棉花黄萎病生防内生芽孢杆菌LH-L3的分离鉴定
陈丽华 ,袁德超 ,吴毅歆 ,3,何鹏飞 ,3,何月秋 ,3*
(1.云南农业大学植物保护学院,昆明650201;2.云南农业大学农学与生物技术学院,昆明650201;3.微生物菌种筛选与应用国家地方联合工程研究中心,昆明650217)
棉花黄萎病生防内生芽孢杆菌LH-L3的分离鉴定
陈丽华1,袁德超2,吴毅歆2,3,何鹏飞1,3,何月秋2,3*
(1.云南农业大学植物保护学院,昆明650201;2.云南农业大学农学与生物技术学院,昆明650201;3.微生物菌种筛选与应用国家地方联合工程研究中心,昆明650217)
【目的】获得能够防治黄萎病菌的棉花内生芽孢杆菌。【方法】将棉株组织研磨液80℃加热后,采用涂板法分离内生菌,将对大丽轮枝菌强致病力菌株Vd084拮抗效果最好的菌株,依据菌体形态、生理生化特征、16S rRNA、gyrB和rpoB基因序列分析进行鉴定,并以盆栽试验确定其对棉花黄萎病的防效。【结果】分离到61株芽孢杆菌类似菌,其中17株能拮抗大丽轮枝菌。复筛得到1株拮抗活性较高、抑菌谱较广的菌株LH-L3。该菌株被鉴定为甲基营养型芽孢杆菌。与无菌水对照相比,用106mL-1的LH-L3菌液浇灌3次的棉花出苗率、株高、根长、地上以及地下部分鲜物质质量分别提高42.85%、10.24%、23.83%、10.05%、97.62%,对棉花黄萎病的防治效果达到85.24%。【结论】菌株LH-L3有较好的促生长和棉花黄萎病防治的效果,具有进一步开发应用潜力。
棉花;大丽轮枝菌;甲基营养型芽孢杆菌;防治效果
棉花(Gossypium hirsutumL.)是世界上主要的纤维作物和油料作物之一[1]。由大丽轮枝菌(Verticillium dahliaeKleb.)引起的黄萎病是棉花生产过程中最具毁灭性的土传和种传病害之一[2],一般造成减产20%~60%[3-4]。目前,棉花黄萎病的防治主要采用轮作倒茬、选育抗病品种、化学防治等传统手段[5],但这些方法均有一定的限制和不足之处,操作性、适应性差或者效果不理想。棉花黄萎病的生物防治因其安全性成为研究热点。
一般认为,植物土传病害的生物防治可以通过调控植物根围微生物种群的方式实现抑菌,如通过向植物根际施用生防菌的方式来增加土壤中的抑菌微生物[6]。芽孢杆菌由于所产生的芽孢对大多数不良环境具有耐受性,而更易于实现大规模培养和生产,且其可以产生多种抗菌物质来抑制植物病原菌。因此,在生物农药领域,芽孢杆菌占有重要地位,备受各国研究者的青睐[7]。本研究旨在从棉株上分离得到对黄萎病有良好拮抗作用的内生芽孢杆菌,为棉花黄萎病的生物防治提供微生物资源,并为研制微生物农药奠定基础。
1 材料与方法
1.1 供试材料
冀棉11棉种及大丽轮枝菌强致病力菌株Vd084由中国农业科学院棉花研究所李志芳博士惠赠,甜瓜果斑病菌由中国农业科学院植保所赵廷昌研究员惠赠,其余所用病原菌均为本实验室分离保存。
1.2 棉花内生菌的分离与大丽轮枝菌的培养
菌株分离:在同一健康棉株上用无菌剪刀分别取叶、茎、根各 5 g,花朵 2 g,用 75%(体积分数,下同)酒精表面消毒10 min,灭菌水漂洗3次后,于灭菌研钵中充分研磨,然后加灭菌水稀释10倍,把所有液体以及残渣转入无菌三角瓶中,并将其置于80℃恒温水浴锅中加热10 min[8],取100 μL 涂布于 LB(Luria-Bertani)培养基,然后置于37℃恒温培养箱中培养48 h后,根据菌落形态、颜色、大小、凸起情况等特征,挑选芽孢杆菌类似菌进行分类编号。
大丽轮枝菌菌株的培养:本研究采用玉米粒产孢法,将在马铃薯葡萄糖琼脂培养基(Potato-dextrose-agar media,PDA)上活化好的大丽轮枝菌菌丝块(含培养基0.2~0.3 g)接种到500 mL无菌三角瓶中煮熟并灭菌的玉米粒上,每天摇动1次玉米粒使其分散开,大约7 d后菌丝即可长满整瓶,待用。
1.3 拮抗内生芽孢杆菌的筛选
以大丽轮枝菌为指示菌,用平板涂布法制备带菌固体培养基(带菌平板)。取出5粒上述培养菌株的玉米粒加入5 mL无菌水,用玻璃棒轻轻搅动玉米粒表面,使孢子和菌丝充分掉落水中制成悬液,吸取200 μL均匀涂布于PDA固体培养基表面,即为带菌平板。
初筛:将分离到的芽孢杆菌依次接种到带菌平板,于28℃恒温培养箱培养4 d后,检查抑菌结果,每个平板接种4个菌株,每个菌株重复3次。将对大丽轮枝菌具有拮抗作用的菌株反复筛选,直至筛选到拮抗作用稳定的拮抗菌株。
复筛:将初筛得到的拮抗细菌接种于50 mL LB液体培养基中,在37℃、180 r·min-1摇床上培养 48 h,经 104r·min-1离心 5 min 去除培养液菌体,取上清液经0.22 μm细菌过滤器过滤,得到无菌发酵滤液。带菌平板的制备:先在灭菌培养皿中倒入薄薄1层10 g·L-1水琼脂培养基,凝固后,每皿等间距地放置2个牛津杯,倒入孢子含量约为105mL-1的大丽轮枝菌马铃薯蔗糖琼脂培养基(Potato-saccharose-agar media,PSA),待培养基凝固后取出牛津杯,制得带孔的含菌平板。然后,一个孔加入无菌发酵滤液75 μL,另一个孔加入无菌水75 μL作空白对照:均于4℃冰箱静置12 h后,再放入25℃培养箱培养3 d,测量并记录抑菌圈直径;3次重复。
1.4 拮抗细菌抑菌谱的测定
将分离到的抑菌效果最好的1株拮抗菌LH-L3与本实验室保藏的12种病原真菌以及3种病原细菌进行抑菌试验,初步确定其抑菌谱。
对病原真菌的抑制作用测定:采用对峙培养法[9]。 将烟草赤星病菌(Alternaria alternate)、茶树轮斑病菌 (Pestalotiopsis theae)、玉米茎腐病菌(Fusarium graminearum)、玉米弯孢霉叶斑病菌(Curvularia lunata)、 稻瘟病菌 (Magnaporthe oryzae)、蚕豆基腐病菌(F.avenaceum)等 14 个菌种于PDA固体培养基上活化,7 d后在菌落边缘区域用灭菌打孔器制成直径5 mm菌饼,接种在直径为90 mm的PDA固体培养基中央,再按十字交叉位置在距离菌饼20 mm处接种LH-L3,以不接种细菌的PDA固体培养基为对照。将培养皿倒置于25℃下培养4~7 d,待对照菌落直径达9 cm后,测量抑菌带宽度(指2个接菌点连线上的无菌区宽度),用十字交叉法测定处理的病原真菌菌落直径,计算菌落生长抑制率。试验重复3次。
采用滤纸片法对细菌性病原菌的抑制作用进行测定。将保存的柑橘溃疡病菌、白菜软腐病菌、甜瓜果斑病菌于LB固体培养基上划线活化,37℃培养48 h后,挑取单菌落于LB液体培养基中 160 r·min-1、37 ℃振荡培养 2 d。吸取菌液以1∶30体积比加入到冷却至45℃左右的LB固体培养基中混匀,制成带菌平板。在无菌环境中,将直径3 mm的滤纸圆片用含量约为 107mL-1的LH-L3菌液浸湿,在无菌条件下吹干,制成拮抗细菌滤纸片。在距离带菌平板中央2 cm处,按十字形设置4个接种点,其中3个放上拮抗菌滤纸片,另1个接种点放上无菌滤纸片为空白对照,设置3个重复,将其放入37℃培养箱中培养,2~3 d后观察并记录抑菌圈直径,计算抑菌率[10]。
1.5 菌株的鉴定
1.5.1 生理生化测定。参照《常见细菌系统鉴定手册》[11]测定。
1.5.2 分子鉴定。用改良的苯酚/氯仿法[12]提取菌株的基因组DNA。用16S rRNA基因的通用引物 P0(5'-GAGAGTTTGATCCTGGCTCAG-3')和P6(5'-CTACGGCTACCTTGTTACGA-3')[13]、gyrB基因扩增引物:UP-1(5'-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3')和 UP-2r(5'-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTAT-3')[14],以及本实验室自行设计的芽孢杆菌rpoB基因扩增引物rpoB-F和rpoB-R2进行PCR (Polymerase chain reaction)扩增。 PCR 反应体系(总体积 30.0 μL):ddH2O 20.7 μL,10×EasyTaqBuffer(Mg2+) 3.0 μL,dNTPs(2.5 mmol·L-1) 2.4 μL,引物(10 μmol·L-1)各 1.5 μL,TaqDNA 聚合酶 (5 U·μL-1)0.3 μL,DNA模板0.6 μL。PCR扩增程序:94℃预变性4.5 min;94 ℃变性 40 s;52 ℃退火 40 s;72 ℃延伸1.5 min,共35个循环;72℃保温10 min。扩增产物中加入花青素,于10 g·L-1琼脂糖凝胶电泳(90 V,40 min)检测,送上海华大生物技术有限公司测序。将测序结果输入NCBI数据库,用BLAST比对,检索同源性较高的菌株,标准菌株序列从LPSN数据库中下载,用MEGA5.0进行Clustal W比对后构建系统发育树。
1.6 菌株LH-L3对棉花的促生长情况测定
试验于2016年3月在云南农业大学温室进行。将活化的LH-L3菌株活化后,挑取单菌落于LB液体培养基中,置于37℃摇床,180 r·min-1摇瓶发酵培养3 d,用稀释涂板法测定菌液含菌量后,按梯度用无菌水将菌液稀释至105、106和107mL-1。棉种经75%酒精消毒后,播种于直径为14 cm、高度为20 cm的圆形花盆中,然后用稀释好的菌液250 mL浇灌土壤,每处理3盆,每盆10粒棉种。此后每隔7 d浇1次菌,总共浇菌3次,并用LB液体培养基作对照。播种后第38天,将整盆植株倒出,用水轻轻冲去泥土,带回实验室统计农艺性状。
1.7 菌株LH-L3对棉花黄萎病的室内防治效果测定
从1.2中所述玉米粒上水洗孢子,并用血球计数板计算悬浮液中大丽轮枝菌孢子浓度,然后将其浇在灭菌土上,充分混匀,制得大丽轮枝菌孢子含量约为105g-1的带菌土。LH-L3菌液处理采用上一步试验得到的最佳施用浓度菌液,菌液处理方法和棉花播种方法同1.6,每处理6盆,每盆播10粒棉种。待LB液体培养基(空白对照)发病第10天时统计发病情况,共调查对照棉株38株,处理棉株54株,按5级分类标准计算病情指数和防治效果[15]。
1.8 数据分析
采用DPS 7.5软件对所测数据统计分析,用平均值和标准误表示测定结果,并做Duncan's多重比较,采用MS Excel 2010制图。
2 结果与分析
2.1 棉花内生芽孢杆菌的分离
经过80℃水浴加热分离芽孢杆菌的方法,根据菌落形态、颜色、透明度的不同对所分菌株进行编号,共分离到61株内生芽孢杆菌,其中从叶部分离到23株(编号LH-L1至LH-L23)、茎部分离到10株(编号LH-S1至LH-S10)、花部分离
到 22株(编号LH-F1至 LH-F22)、根部分离到 6株(编号LH-R1至LH-R6)。
2.2 拮抗内生芽孢杆菌的筛选
2.2.1拮抗菌的初筛。抑菌试验结果表明,61株内生芽孢杆菌中有17株能拮抗大丽轮枝菌,占总数的 27.87%(表 1)。 其中 LH-L3、LH-F11和LH-R2抑菌效果较强,抑菌圈直径均大于20 mm;因此,用这3个菌株进行下一步复筛试验。
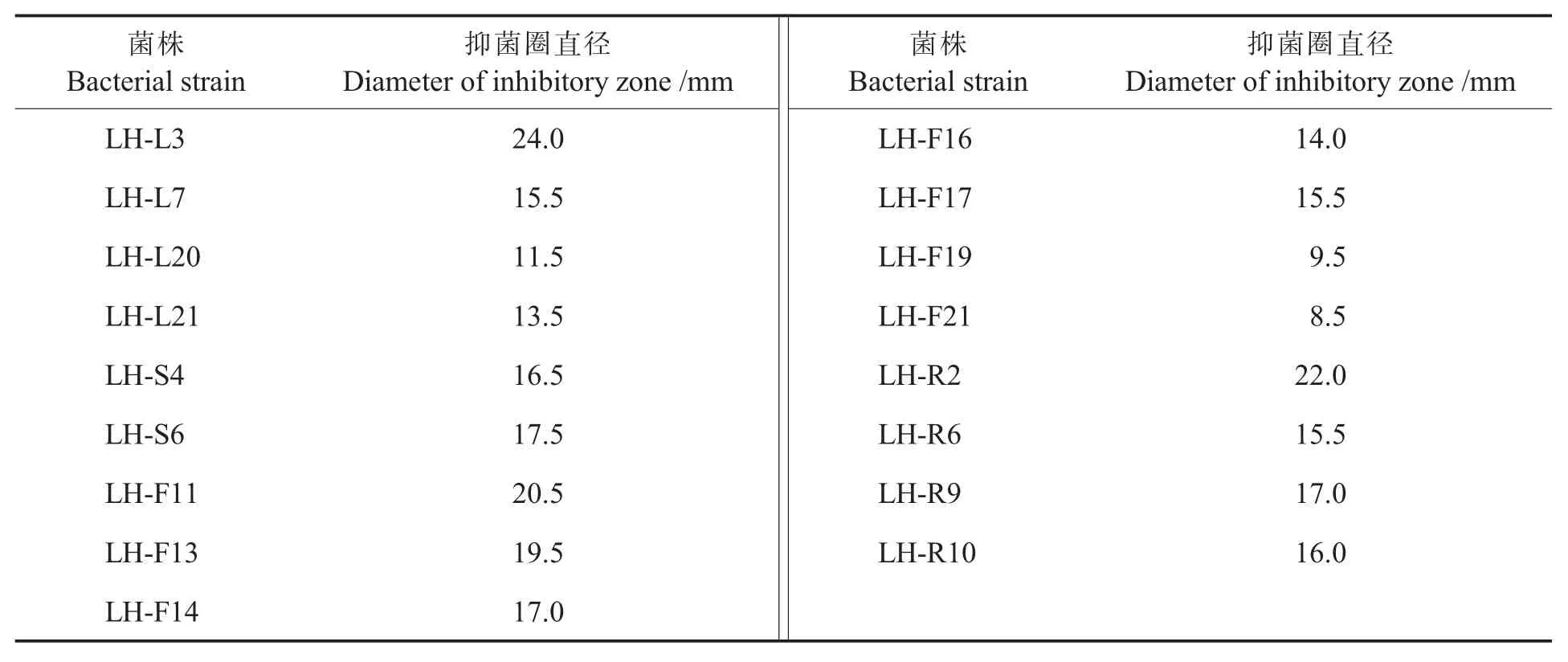
表1 17株内生菌对大丽轮枝菌的抑制效果Table 1 Antagonistic effect of 17 endophytic strains againstVerticillium dahliae
2.2.2拮抗菌的复筛。菌株LH-L3、LH-F11和LH-R2的发酵滤液对大丽轮枝菌有一定抑制作用。其中菌株LH-L3发酵滤液抑菌效果最好,滤液扩散后周围大丽轮枝菌不能生长或分布稀疏,形成直径为25 mm的抑菌圈(图1),确定LH-L3为目标菌株。

图1 3个菌株发酵滤液对棉花黄萎病的抑制效果Fig.1 Antagonistic effect of the bacterium-free fermentation filtration of 3 strains againstVerticillium dahliae
2.3 菌株LH-L3抑菌谱的测定
菌株LH-L3对14种供试病原菌的抑菌结果表明,它对玉米纹枯病菌没有抑制作用,对香蕉枯萎病、柑橘溃疡病、白菜软腐病、甜瓜果斑病病原菌的抑制率低于50%,对其他9种病菌的抑制率均在55%~75%(表2),表明菌株LH-L3具有较广的抑菌谱。
2.4 菌株LH-L3的鉴定
2.4.1形态特征。菌株LH-L3在LB平板上培养24 h后,出现不透明白色圆形菌落,大部分边缘光滑整齐,表面有皱褶,中间有火山状突起(图2-A)。菌体呈短杆状(图2-B),革兰氏染色阳性,芽孢椭圆形(图2-C)。
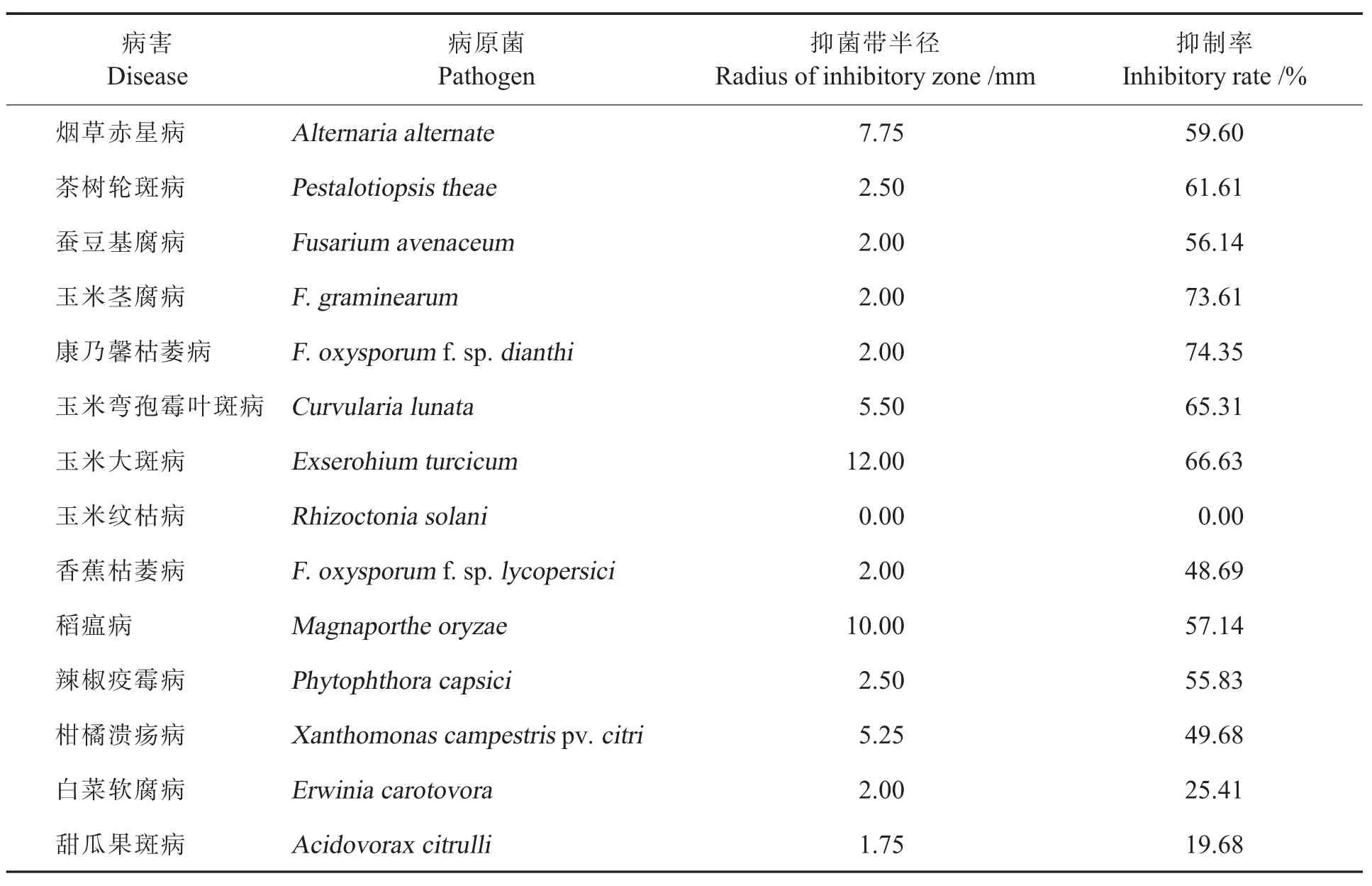
表2 菌株LH-L3对14种植物病原菌的抑制率Table 2 Inhibitory rate of bacterial strain LH-L3 against 14 plant pathogens
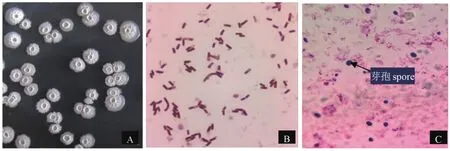
图2 菌落和菌体形态Fig.2 Colony and cell morphology of bacterium strain LH-L3
2.4.2生理生化特征。菌株LH-L3能利用丙二酸、柠檬酸盐,水解淀粉,不能分解蛋白胨产生吲哚,不能水解精氨酸,能产生硫化氢和苯丙氨酸脱氢酶(表3),初步鉴定该菌株属于芽孢杆菌属。
2.4.3分子鉴定。依据测序结果,菌株LH-L3的16S rRNA、gyrB、rpoB基因序列扩增片段长度分别为 1421,1187和 1206 bp。所得序列于 Gen-Bank数据库中进行同源性搜索,该菌株的16S rRNA基因序列与编号为CBMB205的甲基营养型芽孢杆菌Bacillus methylotrophicus(登录号为EU 194897)的相似度最高,达99%,且菌株CBMB205恰好也为B.methylotrophicus的模式菌株;另外,基于16S rRNA基因序列,构建了其与相近的各芽孢杆菌模式菌株的进化树,可以看出,该菌株与B.methylotrophicus分布在同一支上(图3-A)。但该菌株的gyrB和rpoB基因序列与B.amyloliquefaciens和B.methylotrophicus相似度均达99%(图3-B,C)。结合该菌株的生理生化特征和Madhaiyan等[16]的研究结果,将其鉴定为甲基营养型芽孢杆菌(B.methylotrophicus)。

表3 菌株LH-L3的生理生化特征Table 3 Physiological and biochemical characteristics of strain LH-L3
2.5 LH-L3菌液对苗期棉花生长情况的影响
浇灌不同浓度LH-L3菌液后,棉苗总体生长情况均优于对照(表4)。其中106mL-1LH-L3菌液浇灌处理较其他2个浓度处理促进棉苗生长效果更好,该处理棉花出苗率、株高、根长、地上部分鲜物质质量以及地下部分鲜物质质量较LB液体培养基处理 (对照)分别提高42.85%、10.24%、23.83%、10.05%、97.62%(表 4), 且除地上部分鲜物质质量外,其他性状均显著高于对照(P<0.05)。 因此,浇灌菌液最佳浓度为 106mL-1。
2.6 菌株LH-L3对棉花黄萎病的室内防治效果
对照棉株出苗第50天时开始显现黄萎病症状,但LH-L3菌液处理后,于出苗第58天才有少部分叶片出现症状,发病时间明显推迟。从图4可看出,在对照棉株发病第10天时大部分发病叶片已掉落,但LH-L3菌液处理的棉株生长健壮,发病率比对照低71.63%,防治效果达到85.24%(表 5)。
3 讨论
3.1 棉花黄萎病拮抗内生菌的研究进展
棉花黄萎病往往在发病中后期才表现出症状,做好棉花黄萎病的预防工作至关重要。然而,大丽轮枝菌的微菌核在土壤中存活期长,轮作难以减少土壤中微菌核数量;其致病力变异大,抗性品种不易获得,或者获得后抗性容易丧失。一些抗性较强品种的产量和品质不及常规品种,生产上难以推广[17-18]。化学农药在一定程度上减轻棉花黄萎病危害的同时,也带来了环境问题。有益微生物介导的生物防治,能改善作物生长和产量,同时有利于产品和自然环境的安全[19]。陈英化等[20]从棉花健株茎内分离筛选到1株解淀粉芽孢杆菌,对大丽轮枝菌具有强烈抑制作用,且定殖能力强。李全胜等[4]从生长健康的棉花根际土壤中筛选出1株枯草芽孢杆菌S12,它对大丽轮枝菌抑菌率为56%,其发酵液对病原菌孢子萌发抑制率为95.93%;该菌株还能合成蛋白酶,含有抗菌肽合成基因srfAA、spaS、bacA,具有一定的生防潜力。大部分直接从棉株分离的生防菌,可以较好地在植株内定殖。目前,利用芽孢杆菌来防治棉花黄萎病的实例很多,有些已经显示出乐观的应用效果[21]。
3.2 甲基营养型芽孢杆菌的研究
甲基营养型芽孢杆菌 (B.methylotrophicus)是由Madhaiyan等[16]2010年报道的新种,他们发现基于16S rRNA基因序列的系统发育树中,B.methylotrophicusCBMB205T与B.amyloliquefaciens分布在同一支,但各种菌株的生理生化特征存在明显差异,如前者不能水解精氨酸,不能产生脲酶来分解尿素,而后者可以。本研究通过测试菌株LH-L3的生理生化特征,结合16S rRNA、gyrB、rpoB基因序列比对,将菌株鉴定为B.methylotrophicus。

图3 菌株LH-L3的基因序列进化树Fig.3 Phylogenetic trees of the strain LH-L3

表4 LH-L3菌液不同处理下棉株的农艺性状表现Table 4 Agronomic traits on cotton seedlings treated with LH-L3 liquid

图4 对照棉株发病第10天时温室中棉花黄萎病发病情况Fig.4 Incidence of cotton Verticillium wilt at 10 d after incidence of the LB liquid medium treatment in the greenhouse

表5 对照棉株发病第10天时LH-L3菌液对温室内棉花黄萎病的防治效果Table 5 The control effect of strain LH-L3 on cotton Verticillium wilt at 10 d after incidence of the LB liquid medium treatment in the greenhouse
2016年我国农业部药检所首次登记了B.methylotrophicus9912。有报道该类菌株对黄瓜炭疽病菌、黄瓜枯萎病菌、立枯丝核菌、番茄青枯菌、番茄灰霉病菌、烟草黑胫病菌、香蕉枯萎病菌及水稻稻瘟病菌均具有较强的抑制活性[22-25]。本研究从棉花叶片上分离得到1株抑制大丽轮枝菌效果较好的B.methylotrophicusLH-L3;该菌株对大丽轮枝菌的室内拮抗活性及盆栽试验防治效果均较高,还能促进棉苗生长。这是首次报道棉花内生甲基营养型芽孢杆菌对大丽轮枝菌有较好的拮抗效果。
4 结论
从棉株叶片上分离得到1株对棉花大丽轮枝菌有较强抑制作用的甲基营养型芽孢杆菌LH-L3,其抑菌谱较广,对棉花黄萎病的发生有一定的控制效果。
[1]李月,孙杰,陈受宜,等.棉花转录因子GhGT30基因的克隆及转录功能分析[J].作物学报,2013,39(5):806-815.Li Yue,Sun Jie,Chen Shouyi,et al.Cloning and transcription function analysis of cotton transcription factorGhGT30 gene[J].Acta Agronomica Sinica,2013,39(5):806-815.
[2]Angelopoulou D,Naska E,Paplomatas E,et al.Biological control agents(BCAs)of Verticillium wilt:Influence of application rates and delivery method on plant protection,triggering of host defence mechanisms and rhizosphere populations of BCAs[J].Plant Pathology,2014,63(5):1062-1069.
[3]翟枫.解淀粉芽孢杆菌Ba168对棉花黄萎病的防治效果和作用机理研究[D].杨凌:西北农林科技大学,2014.Zhai Feng.Studies on the effect of aBacillus amyloliquefaciensBa168 and mechanism on cotton Verticilium wilt[D].Yangling:North West Agriculture and Forestry University,2014.
[4]李全胜,谢宗铭,张国丽,等.棉花黄萎病拮抗芽孢杆菌S12的筛选鉴定及拮抗机制的分析[J].南京农业大学学报,2015,38(3):402-408.Li Quansheng,Xie Zongming,Zhang Guoli,et al.Screening and identification of antagonistic spore bacterium S12 against cotton Verticillium wilt and preliminary study on its antagonistic mechanisms[J].Journal of Nanjing Agricultural University,2015,38(3):402-408.
[5]梁宏,黄静,赵佳,等.生物防治棉花黄萎病的研究进展[J].生物技术通报,2015,31(5):1-6.Liang Hong,Huang Jing,Zhao Jia,et al.Studies on biocontrol of cotton Verticillium wilt[J].Biotechnology Bulletin,2015,31(5):1-6.
[6]李俊华,蔡和森,尚杰,等.生物有机肥对新疆棉花黄萎病防治的生物效应[J].南京农业大学学报,2010,33(6):50-54.Li Junhua,Cai Hesen,Shang Jie,et al.Effects of controlling to cotton Verticillium wilt with bio-organic fertilizer in Xinjiang[J].Journal of Nanjing Agricultural University,2010,33(6):50-54.
[7]Ji S H,Paul N C,Deng J X,et al.Biocontrol activity ofBacillus amyloliquefaciensCNU114001 against fungal plant diseases[J].Mycobiology,2013,41(4):234-242.
[8]Nishijima T,Toyota K,Mochizuki M.Predominant culturableBacillusspecies in Japanese arable soils and their potential as biocontrol agents[J].Microbes and Environments,2005,20(1):61-68.
[9]方中达.植病研究方法[M].北京:中国农业出版社,1998.Fang Zhongda.Methodology for plant pathology[M].Beijing:China Agriculture Press,1998.
[10]王伟舵.防治水稻细菌性病害生防芽孢杆菌菌株筛选及芽孢杆菌处理后水稻蛋白质组学研究[D].南京:南京农业大学,2012.Wang Weiduo.ScreeningBacillusstrains for biocontrol of rice bacterial diseases and comparative proteomic analysis of rice seedlings in response to inoculation withBacillus[D].Nanjing:Nanjing Agricultural University,2012.
[11]东秀珠,蔡妙英.常见细菌鉴定系统手册[M].北京:科学出版社,2001.Dong Xiuzhu,Cai Miaoying.Common bacteria's manual of determinative bacteriology[M].Beijing:Science Press,2001.
[12]Cheng H R,Jiang N.Extremely rapid extraction of DNA from bacteria and yeasts[J].Biotechnology Letters,2006,28(1):55-59.
[13]Weisburg W G,Barns S M,Pelletier D A,et al.16S ribosomal DNA amplification for phylogenetic study[J].Journal of Bacteriology,1991,173(2):697-703.
[14]Yamamoto S,Harayama S.PCR amplification and direct sequencing ofgyrB genes with universal primers and their application to the detection and taxonomic analysis ofPseudomonas putidastrains[J].Applied and Environmental Microbiology,1995,61(3):1104-1109.
[15]李社增,马平,刘杏忠,等.利用拮抗细菌防治棉花黄萎病[J].华中农业大学学报,2001,20(5):422-425.Li Shezeng,Ma Ping,Liu Xingzhong,et al.Biological control of cotton Verticillium wilt by antagonistic bacteria[J].Journal of Huazhong Agricultural University,2001,20(5):422-425.
[16]Madhaiyan M,Poonguzhali S,Kwon S W,et al.Bacillus methylotrophicussp.Nov.,a methanol-utilizing,plant-growth-promoting bacterium isolated from rice rhizosphere soil[J].International Journal of Systematic&Evolutionary Microbiology,2010,60(10):2490-2495.
[17]Papaioannou I A,Dimopoulou C D,Typas M A.Structural and phylogenetic analysis of the rDNA intergenic spacer region ofVerticillium dahliae[J].FEMS Microbiology Letters,2013,347(1):23-32.
[18]Hadwiger L A,Druffel K,Humann J L,et al.Nuclease released byVerticillium dahliaeis a signal for non-host resistance[J].Plant Science,2013,20(1):98-107.
[19]Avis T J,Gravel V,Antoun H,et al.Multifaceted beneficial effects of rhizosphere microorganisms on plant health and productivity[J].Soil Biology and Biochemistry,2008,40(7):1733-1740.
[20]陈英化,李爱霞,冯丽娜,等.棉花黄萎病内生拮抗细菌L-4-2的鉴定及定殖[J].西北农业学报,2012,21(2):68-71.Chen Yinghua,Li Aixia,Feng Lina,et al.Identification and colonization of an antagonistic endophytic bacterium L-4-2 against cotton Verticillium wilt[J].Acta Agriculturae Boreali-Occidentalis Sinica,2012,21(2):68-71.
[21]郎娇娇.微生物有机肥防治土传棉花黄萎病的效果及对根际微生物影响[D].南京:南京农业大学,2011.Lang Jiaojiao.Control of Verticillium wilt disease of cotton plants with the application of a bio-organic fertilizer its microbiologecal mechanisminrhizosphere[D].Nanjing:NanjingAgricultural University,2011.
[22]冯云利,奚家勤,马莉,等.烤烟品种NC297内生细菌中拮抗烟草黑胫病的生防菌筛选及种群组成分析[J].云南大学学报(自然科学版),2011,33(4):488-496.Feng Yunli,Xi Jiaqin,Ma Li,et al.Isolation and phylogenetic analysis of the antagonistic endophytic bacteria againstPhytophthora parasiticavar.nicotianaefrom tobacco variety NC297[J].Journal of Yunnan University(Natural Sciences),2011,33(4):488-496.
[23]黄霄,陈波,周登博,等.菌株BM-24的分离鉴定及对香蕉枯萎病菌的抑菌活性[J].植物保护学报,2013,40(2):121-127.Huang Xiao,Chen Bo,Zhou Dengbo,et al.Isolation identification of BM-24 strains and its antifungal activity of antagonistic bacteria againstFusarium oxysporumf.sp.cubense[J].Acta Phytophylacica Sinica,2013,40(2):121-127.
[24]Shan H Y,Zhao M M,Chen D X,et al.Biocontrol of rice blast by the phenaminomethylacetic acid producer ofBacillus methy lotrophicusstrain BC79[J].Crop Protection,2013,44(2):29-37.
[25]吕倩,胡江春,王楠,等.南海深海甲基型芽孢杆菌SHB114抗真菌脂肽活性产物的研究[J].中国生物防治学报,2014,30(1):113-120.Lu Qian,Hu Jiangchun,Wang Nan,et al.Anti-fungal lipopeptides produced byBacillus methylotrophicusSHB114 isolated from South China Sea[J].Chinese Journal of Biological Control,2014,30(1):113-120. ●
Isolation and Characterization of EndophyticBacillus methylotrophicusLH-L3 Antagonist of Cotton Verticillium Wilt
Chen Lihua1,Yuan Dechao2,Wu Yixin2,3,He Pengfei1,3,He Yueqiu2,3*
(1.Faculty of Plant Protection,Yunnan Agricultural University,Kunming650201,China;2.Faculty of Agronomy and Biotechnology,Yunnan Agricultural University,Kunming650201,China;3.National and Local Joint Engineering Research Center for Screening and Application of Microbial Strains,Kunming650217,China)
[Objective]The aim of this study is to obtain endophyticBacilluswith control effect on cotton Verticillium wilt.[Method]The cotton tissue grinding liquid was heated at 80℃,and spread onto the Luria-Bertani ager medium.The strains with better inhibitory effects onVerticillium dahliaeVd084,a strain with strong pathogenicity,was identified by the morphology,physiological and biochemical traits as well as 16S rRNA,gyrB andrpoB sequences,and its control effect on cotton Verticillium wilt was determined by pot experiments.[Result]61 similarBacillusstrains were isolated from cotton plants.Among them,17 strains could inhibitVerticillium dahliaeVd084.A strain named LH-L3 with a relatively higher antagonistic activity and a broad inhibition spectrum was obtained in the second screening.LH-L3 was classified intoBacillus methylotrophicus.Compared with the control,the emergence rate,plant height,root length,fresh weight of aerial part and underground part of cotton with 106mL-1LH-L3 suspension drenching for 3 times increased by 42.85%,10.24%,23.83%,10.05%and 97.62%,respectively.And control effect on Verticillium wilt was 85.24%.[Conclusion]LH-L3 had good growth promotion and Verticillium wilt control effects and showed good potential for biological control.
cotton;Verticillium dahliae;Bacillus methylotrophicus;control effect
S435.621 文献标志码:A
1002-7807(2017)06-0550-10 DOI:10.11963/1002-7807.clhhyq.20170605
2017-03-02
陈丽华(1992―),女,硕士研究生,951245313@qq.com。*通信作者:ynfh2007@163.com
云南科技支撑计划(2014BB018)

