长链非编码RNA在精神分裂症的变化与阳性、阴性症状的研究
何明骏 姚高峰 张理义 孔令明 牛威 陈升东 仲爱芳
精神分裂症(schizophrenia,SZ)是一组病因未明的精神病,常伴有感知、思维、情感、行为等多方面的障碍和精神活动不协调[1]。目前全球精神分裂症患病率呈上升趋势[2]。大多研究认为精神分裂症基于基因和环境因素相互作用的结果[3],所以研究者从不同角度展开了精神分裂症的致病因素探索,如依据神经影像学、基因组学、蛋白组学等技术对精神分裂症病因学展开探究[3-6]。有研究[7-10]证实了遗传因素在精神分裂症发病过程中的作用,但确切的分子遗传机制尚不清楚,病因尚未明了[11]。2002年Okazaki等[12]首次发现长链非编码RNA(long non-coding RNA,lncRNA),这是一类长度超过200nt的RNA分子,广泛存在于动物,植物,酵母菌,甚至原核生物和病毒中[13-15],通过结合启动子等方式来调控基因转录[16,17],并与MicroRNA相互作用发挥生物学功能[18]。故其在精神分裂症中是否具备调控作用,值得进一步探究。据报道[19]遗传因素在精神分裂症发生过程中占重要作用,高达70%~85%。迄今尚未见lncRNA与精神分裂症,尤其与精神分裂症阳性、阴性症状量表关系的研究。
为此,我们采用lncRNA芯片技术在精神分裂症患者中筛选出有差异表达的lncRNA,对其中有差异表达的lncRNA采用聚合酶链式反应(polymerase chain reaction,PCR)进行验证,并使用阳性与阴性症状量表(positive and negative symptom scale, PANSS)对临床症状进行评估与分析。现报道如下。
资料和方法
一、 临床资料
本研究获得中国人民解放军第二军医大学临床医院第102医院医学伦理委员会批准,所、有受试者或受试家属(监护人)均签署知情同意书。
1.病例组:2012年8月至2014年6月于解放军第102医院门诊以及精神科病房连续收治的患者。入组标准:①符合美国精神疾病诊断和统计手册第4版精神分裂症诊断标准;②首发患者或入组前3个月未服抗精神病药物。 排除标准:①患有其他精神疾病;②患有脑外伤等躯体或神经系统疾病;③有酗酒或药物滥用史;④入组前1个月内有输血史;⑤入组前3个月内使用过无抽搐电休克治疗者。共入组96例患者,其中男性46例,女性50例,年龄16~63岁,平均年龄(30.49±5.38)岁。
2.对照组:来自解放军第102医院工作人员、健康体检人员。纳入标准:①无精神疾病家族史;②近1个月内无重大创伤事件;③近1月内无输血史。共入组44例,其中男性21例,女性23例,年龄16~64岁,平均年龄(29.61±7.35)岁。
二、方法
1.研究工具
精神分裂症PANSS:评定采用30个基本条目,组成3个分量表:阳性、阴性和一般精神病理量表。每个条目均为7级评分,从1到7,按精神病理水平递增排列。本研究中使用PANSS量表的中文版本进行评估,该版本经信效度检验分析,达到心理测量学标准[20]。
量表评估工作由3名精神科主治医师或医师专职进行,评定前,3名医师进行统一培训,统一指导语。量表由患者自行填写后当场收回。
2.主要试剂和耗材
LowInput Quick-Amp Labeling Kit,one-color(24*)(Agilent,货号:5190-2305);Gene Expression Wash Pack(Agilent,5188-5327);Gene Expression Hybridization Kit(5188-4242);RNA Spike In Kit,one-color(5188-5327);荧光定量PCR引物:Custom Plus TQMN RNA Assays (美国ABI公司);荧光定量PCR试剂:TaqMan通用混合试剂盒Ⅱ(美国ABI公司,货号:4440047);反转录试剂盒:QuantiTect Rev. Transcription Kit (QIAGEN,货号:205311)。
3.主要仪器
扫描仪(Affymetrix,Scanner 3000);杂交炉(Affymetrix,Hybridization Oven 640);洗涤工作站(Affymetrix,Fluidics Station 450);2100(Agilent,G2939A);2100振荡器(Agilent,9600);NanoDrop(Thermo,2000);PCR仪(ABI,9700);离心机(eppendorf,5418);浓缩仪(eppendorf,5301);离心机(其林贝尔,LX-200);离心机-1(其林贝尔,LX-300);振荡器-1(其林贝尔,GL-88B);磁力搅拌器(其林贝尔,GL-3250B);金属浴-2(博日,HB-100);金属浴-3(博日,CHB-100);电热恒温培养箱(精宏实验设备,XMTD-8222);冰箱(荣事达,BCD-265F);ABI9700型PCR仪(美国ABI公司);天美CT14RD型台式高速冷冻离心机(上海天美生化仪器设备工程有限公司);NanoDrop1000超微量紫外分光光度计(附电脑1套)(美国Thermo公司);ABI 7900HT Fast Read-Time PCR System(附电脑1套)(美国ABI公司);WH-2微型漩涡混合仪(上海沪西分析仪器厂有限公司);JS-400A恒温金属浴(上海培清科技有限公司);DK-8D数显恒温水浴锅(金坛市医疗仪器厂);SW-CJ-IFD型单人单面净化工作台(苏净净化设备有限公司);-81℃超低温冰箱(日本三洋公司)。
4.基因芯片筛查、总RNA抽提与荧光定量PCR
基因芯片筛查:用Agilent Human lncRNA芯片,对SZ患者5例,正常对照5人,共10个样本检测和分析。样品总RNA利用NanoDrop ND-2000 (Thermo Scientific)定量并经Agilent Bioanalyzer 2100 (Agilent Technologies)检测RNA完整性。RNA质检合格后,样本的标记、芯片的杂交以及洗脱参照芯片标准流程。首先,总RNA反转录成双链cDNA,再进一步合成用Cyanine-3-CTP(Cy3)标记的cRNA。标记好的cRNA和芯片杂交,洗脱后利用Agilent Scanner G2505C(Agilent Technologies)扫描得到原始图像。
数据分析:采用Feature Extraction 软件 (version10.7.1.1, Agilent Technologies)处理原始图像提取原始数据。接着利用Genespring软件(version 12.5; Agilent Technologies)进行quantile标准化和后续处理。标准化后的数据进行过滤,用于比较的每组样本中至少有一组100%标记为“P”的探针留下进行后续分析。利用t检验的P值和倍数变化值进行差异基因和差异lncRNA筛选,筛选标准为上调或者下调倍数变化值≥2.0且P<0.05。
总RNA抽提与荧光定量PCR:对芯片筛查结果中的10种差异表达的lncRNA进行后续的PCR验证。所有被试使用EDTA抗凝管采肘静脉血5 ml,采血后轻轻摇动抗凝管使抗凝剂与血液混匀,所有血样在采血后2 h内进行RNA提取。先将Ficoll-Paque PLUS液室温(15~20℃)放置,所有离心过程也应在室温完成。取2 ml 乙二胺四乙酸抗凝血与等体积平衡液在15 ml离心管中用移液管(或移液器)充分混匀(总体积4 ml)。用针管抽取3 ml Ficoll Paque PLUS溶液到新的15 ml离心管中,轻轻用移液管(或移液器)沿管壁缓慢滴加准备好的样品(4 ml)于分层液面上,注意保持清楚的液面。室温(18~20℃)以400×g离心30~40 min。用新移液管(或移液器)吸取最上层的血浆与血小板。将单核淋巴细胞置于冻存管中,-80℃保存备用。由实验员每天定时记录冰箱温度。TRIzol(Invitrogen®, USA )法提取出血液单核淋巴细胞中的总RNA(包括lncRNA),具体操作按照试剂盒说明书进行。按照RNA逆转录试剂盒(TaqMan RNA反转录试剂盒,美国ABI公司)说明书进行逆转录反应。反应总体积为15 μl(总RNA5 μl,TaqMan MicroRNA Assay 3 μl, 核酸酶free水4.16 ul,RNase抑制剂0.19 μl,缓冲液1.5 μl,Multiscribe逆转录酶1 μl和dNTP 0.15 μl),在不同温度下(16℃,42℃,85℃,4℃)进行不同时长(30mins,30mins,5mins,10 mins)反应。实时荧光定量PCR按照TaqMan试剂盒(TaqMan通用混合试剂盒II,美国ABI公司)说明书进行。PCR扩增体系总体积为10 μl,反应共40个循环。PCR反应Ct值通过7900实时荧光定量PCR仪(美国ABI公司)测定,每个反应重复两次。 使用SDS 2.4和DataAssist v3.0软件进行数据读取和分析,选择β-Actin为内参进行数据标准化。
三、统计学处理
全部数据使用Excel 2010建立数据库文件,以SPSS v17.0软件进行统计分析。以lncRNA与内参β-Actin之间阈值环(threshold cycle, Ct)之差(ΔCt)表示lncRNA的相对表达水平。以独立样本t检验分析病例组与对照组10种lncRNA是否有差异;lncRNA表达量与PANSS的关系用Pearson相关分析。所有统计分析均为双侧显著性检验,以P<0.05为差异有统计学意义。
结 果
一、精神分裂症lncRNA芯片筛查结果
基因芯片结果显示,125种非编码RNA的表达在精神分裂症患者和正常人之间存在差异。表1列出了本研究中用于PCR验证的10种LncRNA的芯片筛查结果,其中5种表达上调,5种下调。
二、病例组和对照组lncRNA比较
病例组外周血单核细胞中4种lncRNA(PR1、PR4、PR6和PR7)表达水平显著上调,差异有统计学意义(z=-2.460~-2.038,P<0.05),见表2。
三、病例组lncRNA与PANSS量表分的相关分析
精神分裂症中有差异表达的lncRNA与精神分裂症阳性、阴性症状量表分的相关分析显示,有差异表达的PR1~PR10均与精神分裂症阳性症状量表分显著正相关(r=0.231~0.276,P均<0.05),见表3。
四、病例组lncRNA与PANSS量表各症状群的相关分析
表4中精神分裂症中有差异表达的lncRNA与精神分裂症各因子分的相关分析提示,有差异表达的PR1~PR10均与激活性显著正相关(r=0.243~0.352,P均<0.05);PR2、PR5、PR8、PR9及PR10与偏执显著正相关(r=0.201~0.223,P<0.05);PR1~PR10均与攻击性显著正相关(r=0.207~0.259,P<0.05)
五、病例组lncRNA高表达组和低表达组阳性、阴性症状的比较
计算出研究对象NONHSAT089447、NONHSAT021545和NONHSAT041499表达水平的四分位数,将表达水平低于或等于第一四分位数(QL=P25)者归于各自的低表达组,高于或等于第三四分位数(QU=P75)者归于各自高表达组,对高表达与低表达组的阳性、阴性症状进行比较。结果发现,NONHSAT021545、NONHSAT041499高表达组的激活性和攻击性得分显著低于低表达组(P均<0.05),其他认知因子在lncRNA高表达组和低表达组差异无统计学意义(P>0.05),见表5。
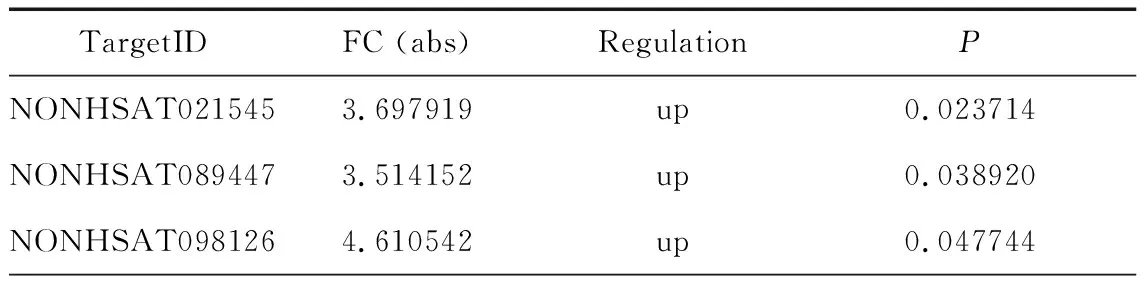
表1 芯片中筛查中差异表达的10种lncRNA
注:lncRNA为长链非编码RNA
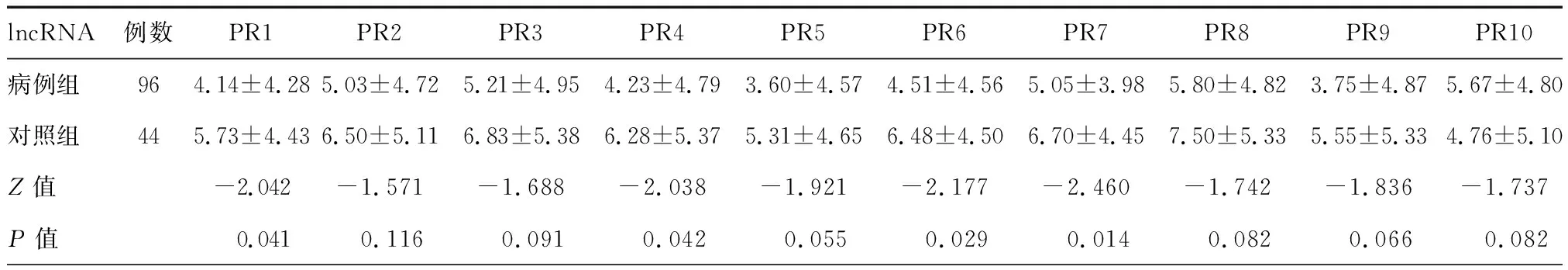
表2 病例组与对照组lncRNA比较(ΔCt±SD)
注:PR1=ENST00000394742,PR2=TCONS_l2_00025502,PR3=NONHSAT098126,PR4=NONHSAT089447,PR5=ENST00000563823,PR6=NONHSAT021545,PR7=NONHSAT041499,PR8=ENST00000521622,PR9=TCONS_l2_00021339,PR10=NONHSAT104778,lncRNA为长链非编码RNA
表3病例组lncRNA与PANSS量表分的相关分析(n=96)

lncRNA阳性量表阴性量表一般病理量表复合量表ENST000003947420.244a-0.004-0.006 0.000TCONS_l2_000255020.276b-0.019-0.023 0.014NONHSAT0981260.252a 0.012-0.026-0.006NONHSAT0894470.258a-0.009-0.018 0.030ENST000005638230.257a 0.011-0.007 0.030NONHSAT0215450.249a-0.025-0.027 0.008NONHSAT0414990.231a 0.002 0.011-0.041ENST000005216220.247a 0.007 0.020 0.028TCONS_l2_000213390.260a 0.009 0.002 0.055NONHSAT1047780.247a-0.007-0.006 0.021
注:aP<0.05,bP<0.01;lncRNA为长链非编码RNA,PANSS为阳性与阴性症状量表
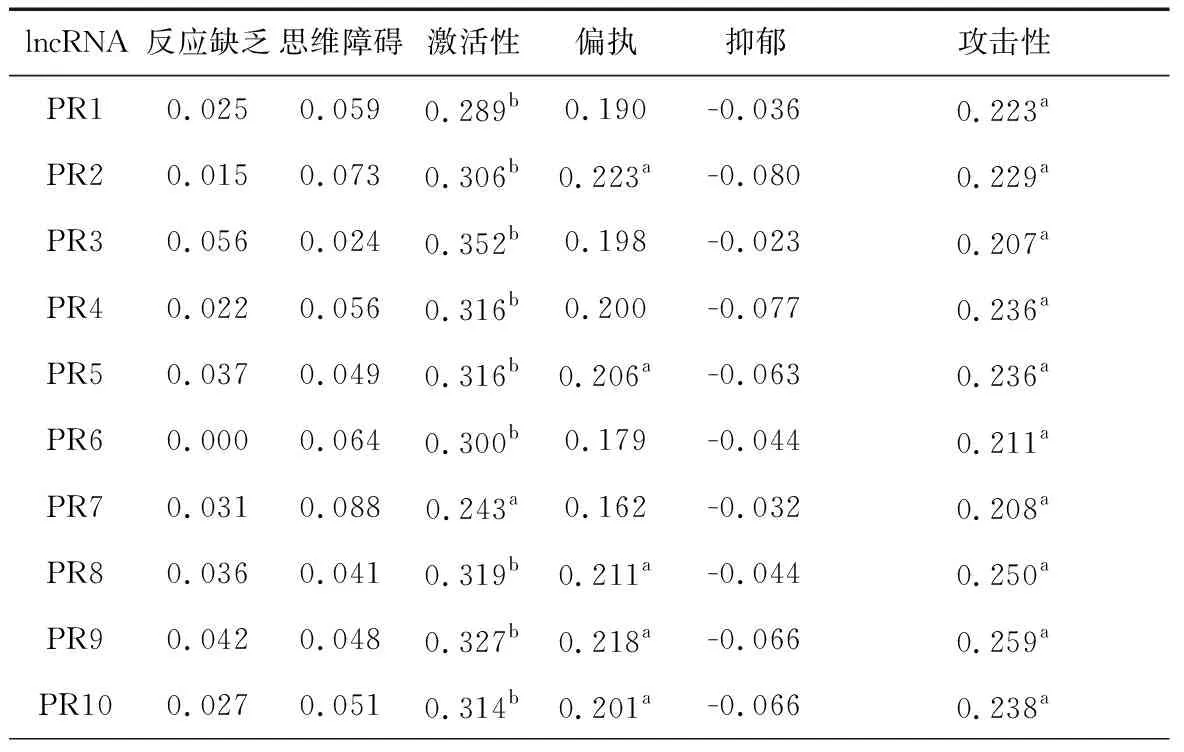
表4 病例组lncRNA与PANSS量表各症状群的相关分析(n=96)
注:aP<0.05,bP<0.01;PR1=ENST00000394742, PR2=TCONS_l2_00025502, PR3=NONHSAT098126, PR4=NONHSAT089447, PR5=ENST00000563823, PR6=NONHSAT021545, PR7=NONHSAT041499, PR8=ENST00000521622, PR9=TCONS_l2_00021339, PR10=NONHSAT104778,lncRNA为长链非编码RNA,PANSS为阳性与阴性症状量表
讨 论
精神分裂症的病因不明,目前诊断精神分裂症仍以精神症状的判定为主要依据。由于判定标准的主观性太大,难免会造成精神分裂症的误诊或漏诊。寻求客观的生物学诊断标记一直是精神分裂症诊断的研究重点和难点。近年来对潜在治疗靶点进行研究为精神疾病的治疗提供了广阔的空间[21,22],其中有一些RNA已被证实与精神分裂症有关,例如Gomafu/MIAT/Rncr2(一种lncRNA)参与精神分裂症相关基因的细胞特异化、干细胞分化、选择性剪接和神经系统功能,其异常表达模式可能会导致某些神经发育异常[23,24]。单纯使用生物信息学的方法寻找lncRNA的靶基因,虽其预测特异性和敏感度较高,但预测结果的一致性往往较低,假阳性率也较高[25]。本研究通过生物信息学结合生物实验验证的方法,利用荧光定量 PCR 检测过表达或干扰 lncRNA 后细胞中其靶基因RNA水平的变化, 从而确定 lncRNA与靶基因的相互作用关系。
基因芯片筛查结果表明lncRNA在精神分裂症患者中存在明显的差异表达,125种非编码RNA在精神分裂症患者与正常人之间存在差异,对其中的10种lncRNA进行PCR验证后发现,其中3种表达上调。这提示精神分裂症可能涉及到lncRNA的异常表达。某些lncRNA定位于与精神疾病相关的染色体区域[26],如Gomafu/MIAT/Rncr2[27,28]以细胞特异化、干细胞分化、选择性剪接等方式参与精神分裂症相关基因的表达,若异常表达,其可能会通过神经发育异常最终诱发精神分裂症。而本研究说明在精神分裂症患者中有异常表达的lncRNA,其在生理功能上可能存在一定的联系,可能由于lncRNA可以影响到神经元可塑性,例如Malat1与突触形成相关,其在中枢神经系统的发育和成熟中起到了重要作用,lncRNA的过度表达可能影响了神经系统的正常发育过程,并通过CNS与环境的交互作用,诱发精神分裂症。目前如此lncRNA相关的疾病和功能方面的研究尚未见报道,故是否确定其与精神分裂症有关,有待进一步验证。

表5 病例组lncRNA高表达组和低表达组阳性、阴性症状的比较
注:lncRNA为长链非编码RNA
本结果显示精神分裂症中有差异表达的10种lncRNA均与精神分裂症阳性症状量表分呈正相关关系。精神分裂症的发生和发展与神经系统的发育障碍及损伤有明显的关联。神经系统功能的行使主要依靠神经通路,神经通路是神经系统功能的体现,而完整的神经通路不仅仅需要神经元细胞,更需要依赖传递过程中产生的一系列复杂动态变化的介质和信使。在对神经系统的基因研究中发现,非编码RNA在特定的时间和空间进行正确的表达则对神经系统生长发育可起到重要的作用,LncRNA作为非编码RNA的重要组成部分参与了神经元分化、脑发育、突触可塑性。2014年首见报道精神分裂症的靶基因相关结合位点[29],所以有关位点的功能尚不明确,看来其可能对精神分裂症的阳性症状起调控作用。但与阴性症状量表分相关性不显著,这可能是由于阴性症状为精神分裂症状谱系的临床特征,有更多的指向性,并非特异性症状,如分裂样人格障碍、偏执型人格障碍等[30]。
PANSS按症状群分可分为:反应缺乏:由N1,N2,G7,G10组成;思维障碍:由P2,P3,P5,G9组成;激活性:由P4,G4,G5组成;偏执:由P6,P7,G8组成;抑郁:由G1,G2,G3,G6组成;攻击性:由P4,P7,G6,S1,S2,S3组成(P为阳性症状量表因子,N为阴性症状量表因子,G为一般病理量表因子,S为复合量表因子)。表4表明,有差异表达的10种lncRNA均与激活性关系密切; TCONS_l2_00025502、ENST00000563823、ENST00000521622、TCONS_l2_00021339及NONHSAT104778与偏执有显著关联;这10种lncRNA均与攻击性有关。从以上可推导出这几种lncRNA对精神分裂症症状群相关,并认为lncRNA对精神分裂症的各种症状起调控作用。目前对lncRNA表达水平与PANSS各症状群的关系尚缺乏充分认识,但本研究的结果似可表明lncRNA广泛参与精神分裂症发生及发展的病理调节过程,未来研究可进一步就lncRNA对症状的特异性和敏感性展开深入探讨,从而为精神分裂症的诊断和个体化治疗提供参考。
综上所述,依据目前的研究,lncRNA与基因调节和神经系统发育和修复过程作用显著,精神分裂症可能与lncRNA的异常表达有关,某些异常表达的lncRNA与特定的阳性、阴性症状特征关系密切,似可作为精神分裂症的一种生物学诊断指标。

