过表达THEM4对高糖诱导的人肾小管上皮细胞胶原分泌的影响
陈 宁,郝 军,朱桂云,安晓颖,康丽菲,李晓霞,杨永辉
(1. 河北省胸科医院病理科,河北 石家庄 050041;2. 河北医科大学病理学教研室,河北 石家庄 050017)
目前普遍认为肾小管间质纤维化是糖尿病肾病发展为终末期肾功能衰竭(end-stage renal disease, ESRD)的病理基础,而肾小管上皮细胞向间质细胞转分化(epithelial to mesenchymal transition, EMT)以及导致的细胞外基质(extracellular matrix, ECM)的过度积聚是肾小管间质纤维化发生的前提[1]。新近研究揭示PI3K/Akt信号通路的异常激活与糖尿病肾病ECM沉积相关[2]。而硫酯酶超家族成员4(thioesterase superfamily member 4, THEM4)作为Akt的内源性负向调控因子[3]是否参与了糖尿病肾病ECM沉积的发生,目前尚未见报道。因此,本研究通过构建THEM4过表达质粒并转染至人肾小管上皮细胞(human renal proximal tubular epithelial cell, HKC)内,观察高糖刺激下PI3K/Akt/THEM4的表达与胶原分泌的关系(胶原是ECM的主要组成成分),以及过表达THEM4能否起到干预作用,为糖尿病肾病ECM沉积的防治提供新的思路。
1 材料
1.1细胞株人肾小管上皮细胞株HKC来自河北医科大学病理学实验室冻存。
1.2试剂pYr-ads-4-THEM4 vector、pYr-adshuttle-4 empty vector均购自长沙赢润生物有限公司;人Collagen Ⅰ ELISA试剂盒、人Collagen Ⅲ ELISA试剂盒均购自BlueGene Biotech;TRITC-羊抗兔IgG、兔抗THEM4单克隆抗体(14692-1-AP)、兔抗β-actin单克隆抗体(20536-1-AP)、兔抗α-SMA单克隆抗体(14295-1-AP),均购自美国Protein Tech公司;兔抗phospho-Akt (Ser 473)单克隆抗体(#4060)、兔抗Akt单克隆抗体,均购自美国Cell Signaling公司;兔抗TGF-β1单克隆抗体(#AP12348a) 购自ABGENT。
1.3仪器荧光显微镜、相差倒置显微镜(日本Olympus公司);CO2培养箱(日本SANYO);高速低温离心机(德国Eppendorf公司)。
2 方法
2.1HKC细胞实验分组用含10%胎牛血清的DMEM培养基常规培养人肾小管上皮细胞,采用Lipofectamine 2000分别转染pYr-ads-4-THEM4表达质粒及pYr-adshuttle-4空质粒,转染后的细胞进行G418(800 mg·L-1)抗性筛选,将筛选出的阳性克隆细胞进行传代培养。经同步化后,将细胞随机分为正常对照组(5.5 mmol·L-1,Control)、高糖组(30 mmol·L-1, HG)、高糖+pYr-ads-4-THEM4质粒转染组(HG+THEM4)、高糖+pYr-adshuttle-4空质粒对照组(HG+V)。后3组经高糖刺激48 h后终止培养,收集细胞进行免疫荧光化学染色和细胞总蛋白提取。
2.2免疫荧光细胞化学检测采用6孔板细胞爬片,培养终止后,细胞用0.01 mol·L-1PBS冲洗数次,4%多聚甲醛固定30 min;0.5% Triton X-100 37℃打孔10 min,PBS冲洗,5 min×3次;正常山羊血清封闭,37℃孵育1 h;弃封闭液,滴加1 ∶200稀释的THEM4一抗,4℃过夜;PBS冲洗,5 min×3次;滴加TRITC-羊抗兔IgG,37℃孵育1 h;PBS冲洗,5 min×3次;滴加 DAPI(1:100配制),37℃孵育10 min;PBS冲洗,5 min×3次;荧光显微镜下观察并摄取图像。
2.3Westernblot检测蛋白表达收集各组细胞并加入冰冷的裂解液(50 mmol·L-1Tris-HCl pH 7.4、150 mmol·L-1NaCl、1 mmol·L-1EDTA、aprotinin 2 mg·L-1、PMSF 100 mg·L-1)200 μL,提取总蛋白。采用考马斯亮蓝法测定蛋白浓度,分装后-80℃保存。每个样品取50 μg总蛋白,经SDS-PAGE凝胶电泳后,电转移至PVDF膜;5% BSA 37℃封闭1 h,一抗[THEM4、Akt、phospho-Akt(Ser 473)、α-SMA、TGF-β1、β-actin,1 ∶1 000稀释] 4℃过夜。TBST洗膜后,加辣根过氧化物酶标记的羊抗兔IgG(1 ∶5 000稀释),室温孵育2 h;TBST洗膜,滴加ECL增强化学发光试剂,Odyssey FC成像系统显影。用美国UVP公司LabWorks 4.5软件对条带进行定量分析,读取积分光密度值(IOD),目的蛋白条带的IOD值除以内参条带的IOD值作为最终结果进行统计分析。
2.4ELISA法检测细胞上清液中ColⅠ、ColⅢ的含量先后加入稀释后的标准品50 μL、待测样品50 μL于反应孔内,立即加入50 μL生物素标记的一抗,轻轻振荡混匀,37℃孵育45 min。甩去孔内液体,震荡洗涤4次,每次30 s。每孔加入100 μL辣根酶标记的二抗,轻轻振荡混匀,37℃孵育30 min。甩去孔内液体,震荡洗涤4次,每次30 s。每孔加入底物A、B各50 μL,轻轻振荡混匀,37℃孵育5 min,避免光照。取出酶标板,迅速加入50 μL终止液,立即测定结果。在450nm波长处测定各孔的OD值。以标准品的吸光度OD值为纵坐标,相应标准品浓度为横坐标,做出标准曲线,样品含量根据其OD值,由标准曲线换算出相应浓度。
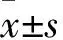
3 结果
3.1pYr-ads-4-THEM4表达质粒抑制高糖刺激下人肾小管上皮细胞内phospho-Akt蛋白的活化质粒转染后,Western blot法检测THEM4蛋白的表达,Fig 1结果显示,pYr-ads-4-THEM4质粒转染成功逆转了高糖刺激下人肾小管上皮细胞内THEM4的低表达,与pYr-adshuttle-4 空质粒组相比,THEM4的表达上调了1.98倍。同时,Fig 2免疫荧光结果显示,THEM4质粒转染组与高糖组及pYr-adshuttle-4 空质粒组相比,THEM4表达明显增加,主要定位于人肾小管上皮细胞的胞质。与THEM4的表达恰好相反,高糖可诱导人肾小管上皮细胞phospho-Akt (Ser 473)的活化,而经pYr-ads-4-THEM4质粒转染后,phospho-Akt (Ser 473)的表达明显降低,与空质粒转染组相比下调了35.11%,而总Akt的表达在各组间未见明显差异 (Fig 1)。
3.2pYr-ads-4-THEM4表达质粒抑制高糖刺激下人肾小管上皮细胞α-SMA及TGF-β1蛋白的表达Western blot法进一步检测了质粒转染并给予高糖刺激后,人肾小管上皮细胞内α-SMA及TGF-β1的表达情况。Fig 3结果显示,高糖刺激时人肾小管上皮细胞内α-SMA、TGF-β1的表达明显增强,而经THEM4表达质粒转染后,二者的表达均被明显抑制,与空质粒对照组相比,二者分别下调了51.59%、76.53%。
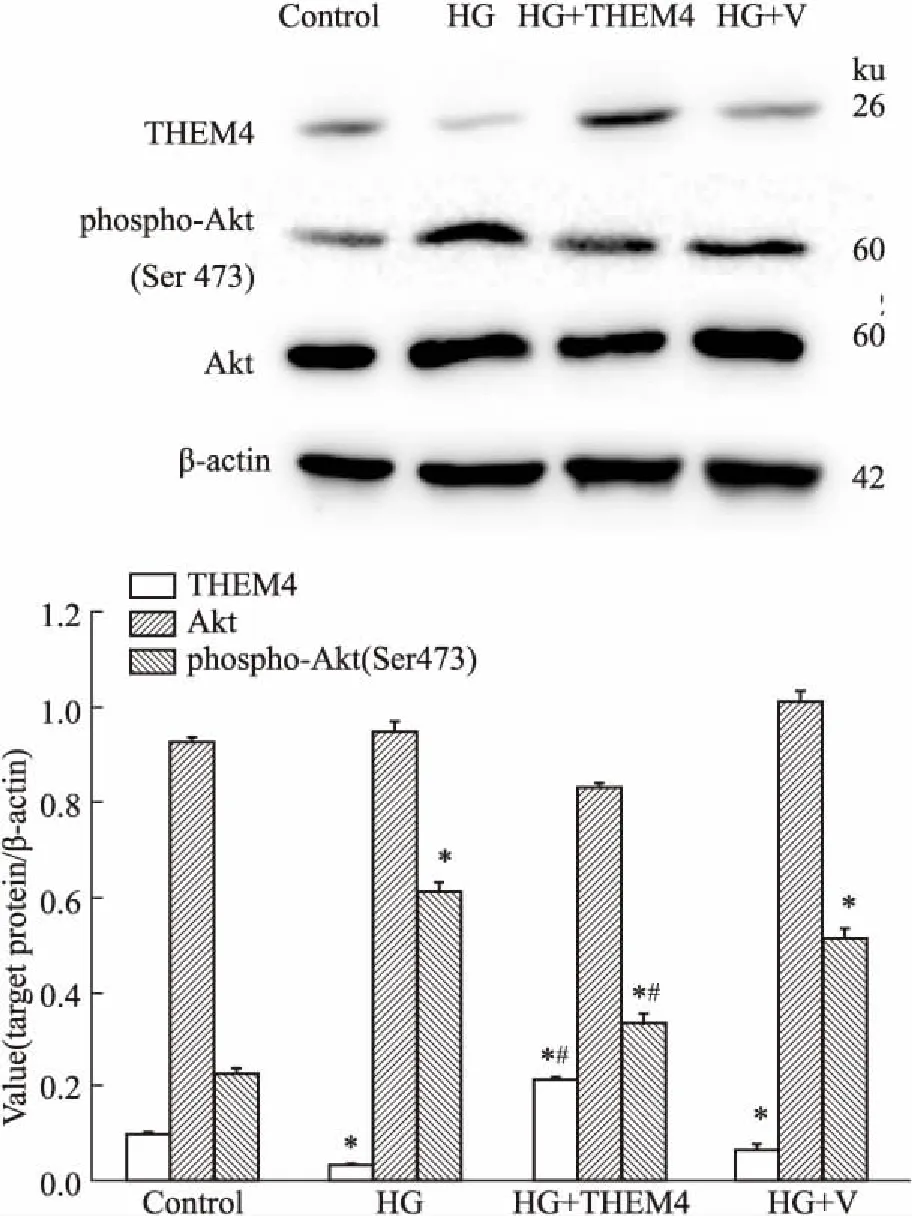
Fig 1 THEM4, phospho-Akt (Ser 473) and Akt in HKC cells by Western blot
*P<0.05vscontrol group;#P<0.05vsHG+V group

Fig 2 Immunofluorescence staining for THEM4 protein (indicated in red) with DAPI counterstaining in HKC cells
White arrows show positive signal. Scale bar: 50 μm. A: Control group; B: HG group; C: HG+THEM4 group; D: HG+V group

Fig 3 Expression of α-SMA and TGF-β1 protein in HKC cells by Western blot
*P<0.05vscontrol group;#P<0.05vsHG+V group
3.3pYr-ads-4-THEM4表达质粒抑制高糖刺激下人肾小管上皮细胞ColⅠ、ColⅢ的分泌ELISA法检测了各组细胞上清液中ColⅠ、ColⅢ的分泌情况。如Fig 4所示,高糖刺激后48 h,ColⅠ、ColⅢ的分泌较正常对照组明显增加(P<0.05),而经pYr-ads-4- THEM4质粒转染后,ColⅠ、ColⅢ的分泌较空质粒对照组分别下调了32.31%、51.83%。
4 讨论
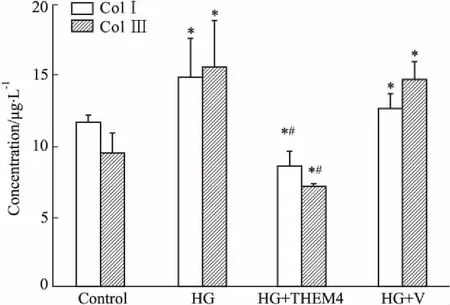
Fig 4 Secretion of Co lⅠ and Col Ⅲ in HKC cells by ELISA
*P<0.05vscontrol group;#P<0.05vsHG+V group
新近研究报道,高糖可诱导PI3K/Akt/mTORC1通路的活化,上调人肾小管上皮细胞骨桥蛋白(osteopontin,OPN) 的表达,而应用LY294002(PI3K特异性抑制剂)以及雷帕霉素(mTORC1特异性抑制剂)后,OPN表达明显降低。可见,通过抑制PI3K/Akt信号通路的激活将为糖尿病肾病的防治提供新的干预靶点[4]。另外,有学者发现,高糖可诱导人肾小管上皮细胞内胆固醇蓄积,进而引起细胞脂质代谢异常[5]。那么,PI3K/Akt/THEM4通路是否参与高糖诱导人肾小管上皮细胞ECM的分泌呢?因此,本研究通过编码THEM4的表达质粒pYr-ads-4-THEM4并转染至人肾小管上皮细胞内,观察过表达THEM4对高糖诱导的人肾小管上皮细胞胶原分泌的影响。
THEM4又称C末端调节蛋白,在多种组织及细胞中被揭示,可抑制Akt的磷酸化活性,是Akt的一种内源性抑制因子[3]。近年来,对THEM4基因学的研究越来越多[6-7],有学者发现THEM4是一种与人体代谢相关的基因之一,可能与慢性肾脏疾病、糖尿病以及心血管疾病的发生相关[8]。Mondal等[9]发现THEM4基因可能是位于1号染色体长臂21-24区的一种易感基因,通过调节体内糖平衡状态而增加2型糖尿病的易感性。Shin等[10]发现,在H-ras12V肝癌小鼠模型中,THEM4通过抑制Akt1磷酸化,抑制肿瘤细胞的增殖和血管生成,具有一定的抗肿瘤效应。新近研究报道,维生素D具有上调THEM4的功能,进而通过抑制巨噬细胞Akt/NF-κB信号通路介导的COX-2释放,在一些炎症性疾病甚至肿瘤的治疗中具有辅助效果[11]。
本研究结果证实了高糖介导的人肾小管上皮细胞THEM4的低表达及phospho-Akt(Ser 473)的活化是引起α-SMA、TGF-β1表达上调,进而导致胶原分泌的重要发病机制。而THEM4作为Akt的内源性抑制因子,过表达THEM4通过抑制phospho-Akt(Ser 473)的活化,下调α-SMA以及TGF-β1表达,从而减少高糖刺激的人肾小管上皮细胞胶原分泌。可见,PI3K/Akt/THEM4信号通路是糖尿病肾脏ECM沉积的重要通路,而通过应用Akt的内源性抑制剂THEM4后能够抑制高糖诱导的胶原分泌,减轻ECM积聚。
我们下一步的研究将在体外实验的基础上,通过尾静脉注射将THEM4表达质粒转染至糖尿病小鼠体内,进一步观察THEM4在糖尿病小鼠体内的表达及影响,从整体水平上探讨糖尿病肾病ECM沉积的发生机制,为其防治提供理论依据。
(致谢:本实验于河北医科大学病理学实验室完成,感谢实验室全体老师的帮助。)
[1] Wight T N, Potter-Perigo S. The extracellular matrix: an active or passive player in fibrosis[J]?AmJPhysiolGastrointestLiverPhysiol, 2011,301(6):G950-5.
[2] Zhu L, Zhao S, Liu S, et al. PTEN regulates renal extracellular matrix deposit via increased CTGF in diabetes mellitus[J].JCellBiochem, 2016,117(5) : 1187-98.
[3] Zhao H, Lim K, Choudry A, et al. Correlation of structure and function in the human hotdog-fold enzyme hTHEM4[J].Biochemistry, 2012,51(33) : 6490-2.
[4] 杜春阳,史永红,朱 艳,等. 高糖对肾小管细胞胆固醇转运的影响及花青素的干预研究[J]. 中国药理学通报, 2016,32(1): 114-8.
[4] Du C Y, Shi Y H, Zhu Y, et al. Effect of high glucose on cholesterol efflux in renal tubular cell and intervention of anthocyanins [J].ChinPharmacolBull, 2016, 32(1) : 114-8.
[5] 王凤梅,蒋克国,张桂霞,等. 高糖激活 PI3K /AKT /m TORC1通路诱导人肾小管上皮细胞骨桥蛋白的表达[J]. 中国药理学通报, 2014,30(8) : 1156-60.
[5] Wang F M, Jiang K G, Zhang G X, et al. High glucose induces expression of osteopontin through activation of PI3K/AKT/m TORC1 pathway in human renal tubular epithelial cells[J].ChinPharmacolBull, 2014,30(8):1156-60.
[6] Bhinder B, Shum D, Li M, et al. Discovery of a dicer-independent, cell-type dependent alternate targeting sequence generator: implications in gene silencing & pooled RNAi screens[J].PLoSOne, 2014,9(7):e100676.
[7] Lai F N, Zhai H L, Cheng M, et al. Whole-genome scanning for the litter size trait associated genes and SNPs under selection in dairy goat (Capra hircus)[J].SciRep, 2016,6: 38096.
[8] Yu B, Zheng Y, Alexander D, et al. Genetic determinants influencing human serum metabolome among African Americans[J].PLoSGenet, 2014,10(3): e1004212.
[9] Mondal A K, Sharma N K, Elbein S C, et al. Allelic expression imbalance screening of genes in chromosome 1q21-24 region to identify functional variants for type 2 diabetes susceptibility[J].PhysiolGenomics, 2013,45(13) : 509-20.
[10] Shin J Y, Chung Y S, Kang B, et al. Co-delivery of LETM1 and CTMP synergistically inhibits tumor growth in H-ras12V liver cancer model mice[J].CancerGeneTher, 2013,20(3) : 186-94.
[11] Wang Q S,He Y H,Shen Y J,et al. Vitamin D inhibits COX-2 expression and inflammatory response by targeting thioesterase superfamily member[J].JBiolChem,2014,289(17) : 11681-94.

