金堂黑山羊FSH信号调节对卵巢基因表达谱影响的研究
曹 冶,赵素君,谢 晶,王秋实,廖党金
(1.四川省畜牧科学研究院,四川 成都 610066;2. 动物遗传育种四川省重点实验室,四川 成都 610066)
金堂黑山羊FSH信号调节对卵巢基因表达谱影响的研究
曹 冶1,2,赵素君1,2,谢 晶1, 2,王秋实1,2,廖党金1,2
(1.四川省畜牧科学研究院,四川 成都 610066;2. 动物遗传育种四川省重点实验室,四川 成都 610066)
【目的】本研究旨在搞清楚金堂黑山羊FSH信号调节机制的作用模式。【方法】将10只生殖周期相同的健康空怀的金堂黑山羊成年母羊随机分成2组,一组为对照组,一组为试验组。在发情后的第2天对试验组金堂黑山羊进行FSH肌肉注射100IU,并在注射24 h后,摘取金堂黑山羊的卵巢;对照组发情后的第3天摘取卵巢。分别提取它们的总RNA,进行表达谱测序。【结果】经测序分析:对照组和试验组分别得到有效序列30 906 038和27 763 272条; 经统计分析后,得到归一化序列30 216 946和27 124 882条,与山羊基因组的符合率分别达85.30 %和86.13 %。比对后发现239个基因出现显著性差异表达,其中139个基因上调了表达,100个基因下调了表达。GO功能分类发现在86个生物学过程、细胞组分、分子功能出现了显著性差异。KEGG功能分类发现有6个调节途径发生了显著性改变。【结论】FSH信号强度变化作用在卵巢上主要通过调节卵巢激素分泌、调节卵巢上FSH信号传导通路、调节脂代谢来响应,从而调节了动物的繁殖性能。
金堂黑山羊;FSH信号;卵巢;基因表达谱
【研究意义】金堂黑山羊属我国优良的地方黑山羊品种,其繁殖力显著高于其他一些山羊品种,据报道金堂黑山羊的产羔数达2.40,大大高于世界上其它优秀山羊品种[1]。【前人研究进展】在前期研究中,发现它的繁殖器官中有两条FSH受体基因(FSHR)同时表达,通过形成异源二聚体显著增加了FSH信号强度,促进了排卵,从而表现出高繁殖力。基于以上研究,可以发现动物高繁殖力的主要控制因素在于FSH信号通路。然而,由于FSH是由脑垂体分泌的激素,经血液循环进入靶器官,进行生殖调节,在这个过程中,该信号通路会受到较多的条件因素(如FSH剂量、FSH受体表达、FSH与受体结合以及结合后下游因子作用等)影响。这就使得FSH信号作用在卵巢进行排卵时出现差异,进而使得家畜在每一胎产仔时,产仔数量却存在差异。这说明动物机体对FSH信号通路的调节存在着一定的调节机制,可能是受研究手段的限制,到目前为止尚未见这方面的详细报道。【本研究切入点】只有完全搞清楚这个调节机制的作用模式,才能有效利用山羊中影响产羔数的主效基因和有效的分子标记,进行山羊高产仔数的分子育种选择,在分子水平研究金堂黑山羊FSH信号通路的调节机制,对于优良地方品种的高效选育和改良具有十分重要意义。【拟解决的关键问题】因此,通过改变金堂黑山羊的FSH信号强度,来测定卵巢基因表达谱的变化,为彻底搞清楚FSH信号的调节机制打下坚实基础。
1 材料与方法
1.1 实验动物
在金堂黑山羊原种场随机选取年龄在3~5岁,体重30~40 kg,营养良好,前3胎产仔数在2个以上的,生殖周期相同的健康空怀的金堂黑山羊成年母羊10只作为试验用羊,供试羊在栏内散放饲养,自由采食、饮水。实验前,观察发情情况,连续观察30 d。
1.2 主要试剂
Trizol为Invetrogen公司(美国)产品;FSH购自于宁波激素一厂;化学试剂除注明外,均为国产分析纯。
1.3 FSH处理
将10只试验用羊随机分成2组,每组5只羊。一组为对照组,不进行FSH注射。另一组为试验组。在发情后的第2天对试验组金堂黑山羊进行FSH肌肉注射,注射剂量为100 IU,并在注射24 h后,摘取金堂黑山羊的卵巢。同时在对照组发情后的第3天摘取卵巢。卵巢液氮速冻后在-80 ℃条件下保存,用于基因表达谱分析。
1.4 总 RNA 提取
用Trizol试剂提取卵巢总RNA。提取步骤按照操作说明进行。将提取的卵巢总RNA送上海美吉生物有限公司进行表达谱测序分析。将得到的数据进行质控分析,包括A/T/G/C碱基含量分布统计、碱基质量分布分析、饱和度分析、冗余序列分析以及基因覆盖度分析,从而确定表达谱测序分析的质量。
1.5 GO(Gene Ontology)功能分类和KEGG PATHWAY代谢途径分析
将测得的基因表达谱用软件Goatools (https://github.com/tanghaibao/GOatools) 进行GO功能富集分析,使用Fisher精确检验。为控制计算的假阳性率,使用多重检验方法(Bonferroni)对P值进行了校正,通常情况下,当经过校正的P值(P_fdr)≤0.05时,认为此GO功能存在显著富集情况[2]。将测得的基因表达谱用KOBAS(http://kobas.cbi.pku.edu.cn/home.do) 进行KEGG PATHWAY 富集分析,使用Fisher 精确检验进行计算。为控制计算假阳性率,采用BH(FDR) 方法进行多重检验,经过校正的P值(CorrectedP-Value)以0.05 为阈值,满足此条件的KEGG 通路定义为在差异表达基因中显著富集的KEGG 通路[3]。
2 结果与分析
2.1 基因表达
本研究采用RNA-seq技术对两组经不同FSH处理的金堂黑山羊卵巢样品进行表达谱测序。
分别得到有效序列30906038和27763272条。将这些数据进行A/T/G/C碱基含量分布统计,发现该文库碱基分布均匀,模糊碱基N %在合理范围之内。同时,进行碱基质量分布统计,得出一个综合的值,即质量值(Q),用来评估测序的质量好坏,结果见表1,发现所获得测序数据达到后续分析要求。碱基错误率分布统计分析发现数据的碱基错误率均可以达到低于0.1 %。经统计分析后,得到归一化序列30216946和27124882条。

表1 测序数据统计

表2 与参考基因组比对
将质控后得到的高质量测序序列使用(http://tophat.cbcb.umd.edu/)与指定的参考基因组比对,参考基因组来自于http://www.ncbi.nlm.nih.gov/genome/genomes/10731。如表2所示,发现符合率分别达85.30 %和86.13 %。
分析显示饱和度总体质量较高,该测序量能够覆盖绝大多数的表达基因。冗余序列分析显示此样本冗余序列含量正常。基因覆盖度分析显示结果不具有偏向性,结果较均一。
2.2 表达差异分析
将这些序列进行比对后发现239个基因出现显著性差异表达,有139个基因上调了表达,100个基因下调了表达。其中,gene17948(muscle, skeletal, receptor tyrosine kinase)上调表达最高,提高了127倍; gene43088(Glutathione S-transferase A2 (EC 2.5.1.18)(Glutathione S-transferase alpha-2)(GST class-alph [...])下调表达最多,下调了144倍。
2.3 差异表达基因的GO功能分类
对这些差异表达基因进行了GO功能分类,发现在86个生物学过程、细胞组分、分子功能出现了显著性差异(表3)。其中细胞组分GO功能显著差异11个[极显著差异7个(P≤0.01),差异显著4个(P≤0.05)],分子功能GO功能显著差异11个[极显著差异8个(P≤0.01),差异显著3个(P≤0.05)],生物学过程GO功能显著差异64个[极显著差异45个(P≤0.01),差异显著19个(P≤0.05)]。在生物学过程GO功能中,涉及类固醇激素合成代谢的过程有11个极显著差异;涉及脂肪合成代谢的过程有10个,其中极显著差异7个(P≤0.01),显著差异3个(P≤0.05);涉及小分子合成代谢的过程有3个极显著差异(P≤0.01);涉及物质转运过程6个显著差异(P≤0.05)。

表3 金堂黑山羊卵巢差异表达基因的GO功能分类
续表3 Continued table 3

描述Description在差异基因中的比例Ratiointhedifferentiallyexpressedgenes在背景基因中的比例Ratiointhebackgroundgenes校正后P值CorrectedPvalue类型Type铁离子结合Ironionbinding8/239258/575260.0344molecular_function阳离子结合Cationbinding34/2393705/575260.0356molecular_function胞外区Extracellularregion18/239568/575261.04E-07cellular_component膜组成部分Integralcomponentofmembrane52/2394239/575261.36E-07cellular_component膜碎片Membranepart64/2395555/575263.30E-07cellular_component细胞成分Cellular_component137/23916224/575264.56E-07cellular_component细胞碎片Cellpart92/23913283/575260.000284cellular_component细胞质碎片Cytoplasmicpart48/2395427/575260.00138cellular_component细胞内碎片Intracellularpart74/23910582/575260.00785cellular_component质膜碎片Plasmamembranepart18/2391231/575260.0118cellular_component膜区域Membraneregion12/239588/575260.019cellular_component细胞膜的组成部分Integralcomponentofplasmamembrane8/239238/575260.0192cellular_component内质网碎片Endoplasmicreticulumpart10/239443/575260.0467cellular_component胆固醇代谢过程Cholesterolmetabolicprocess11/23958/575266.88E-09biological_process胆固醇生物合成过程Cholesterolbiosyntheticprocess9/23922/575267.70E-09biological_process甾醇代谢过程Sterolmetabolicprocess11/23963/575261.50E-08biological_process甾醇生物合成过程Sterolbiosyntheticprocess9/23926/575262.93E-08biological_process醇生物合成过程Alcoholbiosyntheticprocess9/23971/575264.59E-08biological_process脂代谢过程Lipidmetabolicprocess26/239779/575264.82E-08biological_process醇代谢过程Alcoholmetabolicprocess13/239193/575269.89E-08biological_process类固醇生物合成过程Steroidbiosyntheticprocess12/23978/575261.10E-07biological_process有机羟基化合物代谢过程Organichydroxycompoundmetabolicprocess13/239246/575261.15E-07biological_process氧化还原过程Oxidation-reductionprocess23/2391009/575261.43E-07biological_process脂生物合成过程Lipidbiosyntheticprocess20/239313/575261.87E-07biological_process类固醇代谢过程Steroidmetabolicprocess14/239159/575262.07E-07biological_process单生物合成过程Single-organismbiosyntheticprocess23/239937/575262.19E-07biological_process单生物代谢过程Sngle-organismmetabolicprocess55/2394319/575262.58E-07biological_process单生物过程Single-organismprocess104/2399240/575263.12E-07biological_process
续表3 Continued table 3
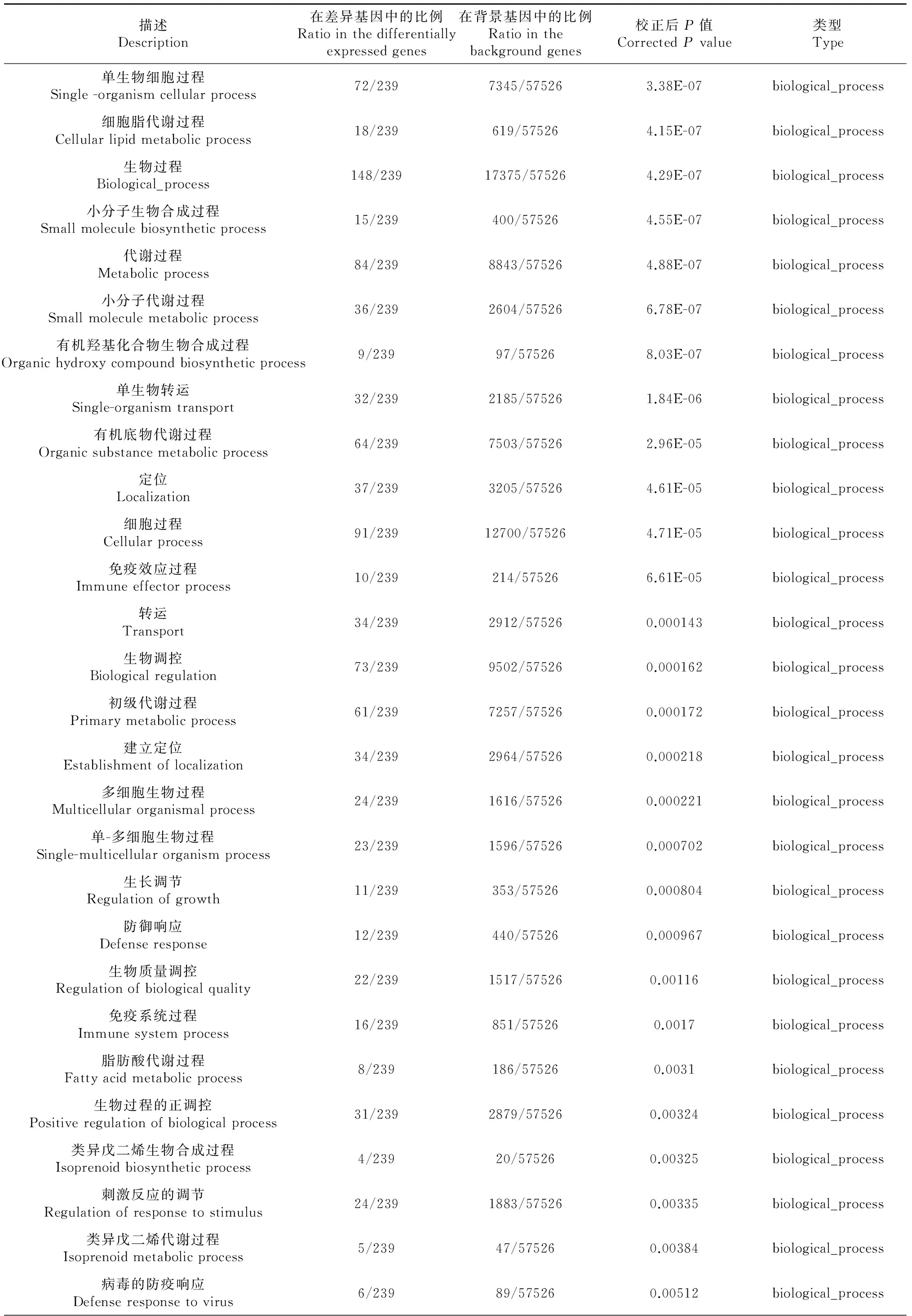
描述Description在差异基因中的比例Ratiointhedifferentiallyexpressedgenes在背景基因中的比例Ratiointhebackgroundgenes校正后P值CorrectedPvalue类型Type单生物细胞过程Single-organismcellularprocess72/2397345/575263.38E-07biological_process细胞脂代谢过程Cellularlipidmetabolicprocess18/239619/575264.15E-07biological_process生物过程Biological_process148/23917375/575264.29E-07biological_process小分子生物合成过程Smallmoleculebiosyntheticprocess15/239400/575264.55E-07biological_process代谢过程Metabolicprocess84/2398843/575264.88E-07biological_process小分子代谢过程Smallmoleculemetabolicprocess36/2392604/575266.78E-07biological_process有机羟基化合物生物合成过程Organichydroxycompoundbiosyntheticprocess9/23997/575268.03E-07biological_process单生物转运Single-organismtransport32/2392185/575261.84E-06biological_process有机底物代谢过程Organicsubstancemetabolicprocess64/2397503/575262.96E-05biological_process定位Localization37/2393205/575264.61E-05biological_process细胞过程Cellularprocess91/23912700/575264.71E-05biological_process免疫效应过程Immuneeffectorprocess10/239214/575266.61E-05biological_process转运Transport34/2392912/575260.000143biological_process生物调控Biologicalregulation73/2399502/575260.000162biological_process初级代谢过程Primarymetabolicprocess61/2397257/575260.000172biological_process建立定位Establishmentoflocalization34/2392964/575260.000218biological_process多细胞生物过程Multicellularorganismalprocess24/2391616/575260.000221biological_process单-多细胞生物过程Single-multicellularorganismprocess23/2391596/575260.000702biological_process生长调节Regulationofgrowth11/239353/575260.000804biological_process防御响应Defenseresponse12/239440/575260.000967biological_process生物质量调控Regulationofbiologicalquality22/2391517/575260.00116biological_process免疫系统过程Immunesystemprocess16/239851/575260.0017biological_process脂肪酸代谢过程Fattyacidmetabolicprocess8/239186/575260.0031biological_process生物过程的正调控Positiveregulationofbiologicalprocess31/2392879/575260.00324biological_process类异戊二烯生物合成过程Isoprenoidbiosyntheticprocess4/23920/575260.00325biological_process刺激反应的调节Regulationofresponsetostimulus24/2391883/575260.00335biological_process类异戊二烯代谢过程Isoprenoidmetabolicprocess5/23947/575260.00384biological_process病毒的防疫响应Defenseresponsetovirus6/23989/575260.00512biological_process
续表3 Continued table 3

描述Description在差异基因中的比例Ratiointhedifferentiallyexpressedgenes在背景基因中的比例Ratiointhebackgroundgenes校正后P值CorrectedPvalue类型Type多细胞生物过程的调控Regulationofmulticellularorganismalprocess19/2391313/575260.00745biological_process一元羧酸代谢过程Monocarboxylicacidmetabolicprocess10/239370/575260.00984biological_process有机酸转运Organicacidtransport7/239156/575260.011biological_process羧酸转运Carboxylicacidtransport7/239156/575260.011biological_process免疫响应Immuneresponse10/239377/575260.0116biological_process有机阴离子转运Organicaniontransport8/239224/575260.0123biological_process阴离子转运Aniontransport9/239309/575260.0165biological_process阳离子转运Iontransport16/2391028/575260.0187biological_process单体发育过程Single-organismdevelopmentalprocess27/2392532/575260.0197biological_process萜类化合物生物合成过程Terpenoidbiosyntheticprocess3/23910/575260.0202biological_process发育过程Developmentalprocess28/2392690/575260.0206biological_process对外刺激反应Responsetoexternalstimulus13/239703/575260.0228biological_process萜类化合物代谢过程Terpenoidmetabolicprocess4/23932/575260.0232biological_process有机环状化合物生物合成过程Organiccycliccompoundbiosyntheticprocess14/239818/575260.0246biological_process生物过程调控Regulationofbiologicalprocess65/2399180/575260.0278biological_process化学平衡Chemicalhomeostasis10/239423/575260.0315biological_process跨膜转运Transmembranetransport15/239954/575260.0322biological_process对其它有机体的防疫响应Defenseresponsetootherorganism7/239184/575260.0322biological_process细胞生长调控Regulationofcellgrowth7/239185/575260.0334biological_process脂生物合成调控Regulationoflipidbiosyntheticprocess5/23973/575260.0345biological_process脂转运Lipidtransport6/239132/575260.0497biological_process
2.4 差异表达基因的KEGG功能分类
对这些差异表达基因进行KEGG功能分类,发现有6个调节途径发生了显著性改变(表4)。其中,有3个途径发生了极显著改变,分别是Steroid biosynthesis,Terpenoid backbone biosynthesis和Ovarian steroidogenesis。
3 讨 论
金堂黑山羊是一个优秀的地方山羊品种,具有生长发育快,体格大,特别是其繁殖力明显高于其它山羊品种。山羊是季节性发情动物,分别于春季和秋季发情。只有在发情期,山羊才会启动卵泡发育。已有研究表明,山羊发情后在一个发情期后出现3~4个卵泡波,第1个FSH卵泡波峰值出现在发情后的第1~5天。张超等[4]研究了不同繁殖力山羊血浆中FSH的分泌规律,发现大足黑山羊在1个发情周期出现3个卵泡波,第1个卵泡波FSH峰值出现在第2天,为8.422 IU/L,而莎能奶山羊在1个发情期有4个卵泡波,第1个卵泡波FSH峰值出现在第1天,为6.227 IU/L。葛世豪等[5]研究了济宁青山羊的FSH分泌规律,发现济宁青山羊在1个发情有4个卵泡波,第1个卵泡波FSH峰值出现在第2

表4 金堂黑山羊卵巢差异表达基因的KEGG功能分类
天,为3.63 IU/L。侯衍猛等[6]研究了莱芜黑山羊的FSH分泌规律,发现莱芜黑山羊在1个发情有4个卵泡波,第1个卵泡波FSH峰值出现在第5天,为0.70 IU/L。综上,可以确定,山羊在发情后第1~5天,将出现第一个卵泡波FSH峰,峰值为0.7~8.4 IU/L。所以本次研究中,在发情后的第2天对试验组金堂黑山羊进行FSH注射,提高金堂黑山羊的FSH信号强度。按照宁波激素一厂的产品说明,山羊超数排卵为间隔12 h连续4 d肌注FSH,总量为200~250 IU,平均每次注射60~80 IU。为此选择一次注射,注射剂量为100 IU,并在注射24 h后,摘取金堂黑山羊的卵巢,检测FSH信号不同强度调节后,卵巢表达谱出现的差异。
FSH是调控动物发育、生长、成熟以及生殖相关的重要垂体激素,是动物下丘脑-垂体-性腺轴中的重要激素,下丘脑GnRH脉冲式释放,刺激垂体分泌FSH、LH分泌,FSH、LH作用于雌性动物卵巢,刺激其分泌性激素。研究表明,动物卵细胞的发育依赖于FSH和LH的刺激,其中,FSH在原始卵母细胞的征集、类固醇激素的产生、LH受体的表达调节中起着至关重要的作用。在本次研究中,发现随着FSH信号强度的增加,使金堂黑山羊的卵巢激素合成、分泌以及信号传导的相关酶的表达量显著增加,这就意味着,FSH信号传导对卵巢性激素的释放有极其显著的正向调节作用[7],这与以上的结论完全吻合。
在本次研究中,发现FSH信号强度变化也显著影响卵巢的脂代谢生物学过程。Mruk DD 等[8]发现,在精子生成的过程中,支持细胞对于精子的发生起着严格的限制性作用,不仅仅是提供能量和结构性支持,还提供精子细胞的发育和移动,还控制着成熟精子的释放。在本次研究中发现的脂代谢生物学过程显著变化也与以上结果类似,卵子成熟也包含着原始卵泡征集、发育、优势化、排卵等重要生物学过程,在这个过程中,需要大量能量来供给这些生物学过程的进行,所以卵巢的脂代谢过程随着FSH信号的增强显著增加。
在本次研究中,发现FSH信号强度变化也显著影响卵巢的配体受体反应。FSH的生理功能是通过分布于性腺的特异性FSH受体(follicle-stimulating hormone receptor, FSHR) 所介导。支持细胞和颗粒细胞分别是FSH作用于睾丸和卵巢的靶细胞。FSH与位于靶细胞膜上的促卵泡素受体(FSHR)结合,经过受体(FSHR)介导信息传递到靶细胞内,它们主要利用胞内第二信使cAMP作为信号,利用PKA途径进行信号传导[9-11]。为响应FSH信号强度,那么金堂黑山羊也通过加强卵巢的配体受体反应来提高信号强度,这与观察到的现象是一致的。
4 结 论
综上所述,FSH信号强度变化作用在卵巢上主要通过调节卵巢激素来调节排卵时卵巢的内环境,通过调节卵巢上FSH信号传导通路来响应FSH信号强度的变化,通过调节脂代谢来做好卵巢排卵前的能量准备,从而达到响应FSH信号强度变化,改变动物的排卵数,从而调节了动物的繁殖性能。
[1]李 键. 肉山羊安全生产技术[M]. 北京:中国农业出版社,2005.
[2]Tang H, Wang X, Bowers J E, et al. Unraveling ancient hexaploidy through multiply-aligned angiosperm gene maps[J]. Genome Res, 2008, 18: 1944-1954.
[3]Xie C, Mao X, Huang J, et al. KOBAS 2.0: a web server for annotation and identification of enriched pathways and diseases[J]. Nucleic Acids Res 2011, 39: 316-322.
[4]张 超,罗艳梅,张家骅,等. 不同繁殖力山羊血浆中INHB、ACTA和FSH变化规律的研究[J]. 中国畜牧杂志,2011,47(7):24-27.
[5]葛仕豪,高立坤,侯衍猛,等. 济宁青山羊发情周期内促性腺激素和性激素分泌规律的研究[J]. 西南农业学报,2007,20(6):1348-1352.
[6]侯衍猛,曹洪防,徐云华,等. 莱芜黑山羊发情周期中FSH、LH、E2和P的分泌规律[J].中国兽医学报,2006,26(3):340-343.
[7]张家骅. 家畜生殖内分泌学[M]. 北京:高等教育出版社,2007.
[8]Mruk D D, Cheng C Y. Sertoli-Sertoli and Sertoli-germ cell interactions and their significance in germ cell movement in the seminiferous epithelium during spermatogenesis[J]. Endocr Rev,2004,25: 747-806.
[9]Segaloff D L,Ascoli M. The lutropin/choriogonadotropin receptor 4 years later[J]. Endocrine Reviews,1993,14: 324-342.
[10]Christenson L K, Gunewardena S, Hong X, et al. Research resource: preovulatory LH surge effects on follicular theca and granulosa transcriptomes[J]. Molecular Endocrinology, 2013, 27: 1153-1171.
[11]Li Q, Jimenez-Krassel F, Ireland J J, et al. Gene expression profiling of bovine preovulatory follicles: gonadotropin surge and prostanoid-dependent up-regulation of genes potentially linked to the ovulatory process[J]. Reproduction, 2009, 137: 297-307.
(责任编辑 陈 虹)
EffectofFSHSignalRegulationonGeneExpressionProfilingofOvaryinJintangBlackGoat
CAO Ye1,2,ZHAO Su-jun1,2,XIE Jing1,2,WANG Qiu-shi1,2,LIAO Dang-jin1,2
(1.Sichuan Animal Science Academy, Sichuan Chengdu 610066, China; 2.Animal Breeding and Genetics Key Laboratory of Sichuan Province, Sichuan Chengdu 610066, China)
【Objective】The purpose of this study was to understand the model of FSH signal regulation mechanism in Jintang black goat.【Method】10 healthy adult Jintang black goats in the same reproductive cycle were randomly divided into two groups, one was as the control group, and the other was as the test group. On the second day of the estrus, the test group was injected with FSH 100IU, and the ovaries of Jintang black goats were obtained in 24 hours after injection; On the third days of the estrus, the ovaries of the control group were obtained, their total RNA were extracted, and the expression profiles of their total RNA were sequenced. 【Result】The 30 906 038, 27 763 272 effective bands in the control group and the test group were obtained, respectively; After statistical analysis, the normalized sequences were 30216946, 27124882 bands, and the coincidence rate of goat genome were 85.30 %, 86.13 %,respectively. By comparison, 239 genes were found to be significantly different, of which 139 genes were up-regulated, and 100 genes was down-regulated. GO functional classification reveals that there were significant differences in 86 biological processes, cellular components and molecular functions. KEGG function classification indicated that significant changes were found in 6 regulatory pathways.【Conclusion】FSH signal intensity changes had effect on the ovary, which caused mainly to regulate the secretion of ovarian hormones, the FSH signal transduction pathway and lipid metabolism and finally regulated the animal reproductive performance.
Jintang black goat; FSH signal; Ovary; Gene expression profiling
S826
A
1001-4829(2017)11-2595-08
10.16213/j.cnki.scjas.2017.11.035
2017-05-20
四川省应用基础研究项目“金堂黑山羊FSH信号通路调节机制的研究”(2015JY0008)
曹 冶(1970-),男,博士,研究员,现从事动物分子遗传研究,E-mail:cy3831@163.com。

