麻花艽β-amyrin合成酶基因GsAS2的载体构建及遗传转化
刘艳玲,向凤宁
(1.莱芜职业技术学院信息工程系,山东 莱芜 271100;2.山东大学生命科学院植物细胞工程与种质创新教育部重点实验室,山东 济南 250100)
麻花艽β-amyrin合成酶基因GsAS2的载体构建及遗传转化
刘艳玲1,向凤宁2
(1.莱芜职业技术学院信息工程系,山东 莱芜 271100;2.山东大学生命科学院植物细胞工程与种质创新教育部重点实验室,山东 济南 250100)
【目的】本文拟进行麻花艽β-amyrin合成酶基因GsAS2的载体构建及遗传转化。【方法】 首先利用gateway方法进行GsAS2的RNAi载体(pK7GWIWG-GsAS2)和过表达载体(pK7WG2D-GsAS2)的构建,并利用基因枪转化麻花艽胚性愈伤组织,经卡那霉素(Kan)筛选后,进一步用35S启动子引物进行抗性植株总DNA的PCR检测。【结果】获得GsAS2的RNAi阳性植株5株,过表达植株8株,转化频率分别为2.94 %和4.00 %。对转基因植株进行GsAS2的半定量RT-PCR分析和齐墩果酸的HPLC测定表明:GsAS2的表达在RNAi系中受到较大抑制,其齐墩果酸含量均低于对照(为对照的48.5 %~80.7 %),而在过表达系中GsAS2则超量表达,且齐墩果酸含量均高于对照(为对照的1.67~2.46倍)。【结论】说明GsAS2的表达与下游产物齐墩果酸的含量关系密切。
麻花艽;β-amyrin合成酶基因;载体构建;遗传转化
【研究意义】随着基因工程技术的不断完善,应用分子克隆和遗传转化手段对植物细胞代谢网络进行修饰和改造来积累目标产物已成为研究的热点领域[1-2]。【前人研究进展】目前,通过超量表达代谢途径中的限速酶基因来提高目标产物含量已成为植物代谢工程的主要方法之一[3-5]。Yun等在颠茄中引入编码莨菪碱-6β-羟化酶基因,结果使颠茄中含量很低的东莨菪碱大量积累,并且几乎所有的莨菪碱都转化成了东莨菪碱[6];Shim等在人参中过量表达SQS基因,测得转基因植物中人参皂甙的含量为对照的2.5倍[7]。因此目前较好的方法就是用已获得的有用基因建立起简单的转基因系来研究次生代谢途径中的关键酶基因及与目标产物的关系。麻花艽(GentianastromineaMaxim.)系龙胆科(Gentianaceae)、龙胆属(Gentiana)植物,是我国重要的传统中药材之一,主要有效成分为熊果酸、齐墩果酸、獐牙菜苷等,主治风湿性关节痛、黄胆性肝炎、胆结石等疾病[8-11]。其中齐墩果酸为抗肝炎的有效成分,其合成的前体物是β-amyrin。研究表明,β-amyrin合成酶为氧化角鲨烯环化酶(OSCs)家族的一员,是合成β-amyrin及其下游产物齐墩果酸的关键酶之一[12-13]。【本研究切入点】在前面的研究中,已经克隆获得了β-amyrin合成酶基因GsAS2的全长序列并进行了功能验证[14],本研究中,拟实现GsAS2对麻花艽愈伤组织的转化,从而获得GsAS2 RNAi系和过表达系的再生植株,分析阳性植株中GsAS2的表达量与齐墩果酸含量的关系。【拟解决的关键问题】为齐墩果酸代谢途径的深入研究奠定基础。
1 材料与方法
1.1 载体构建
1.1.1 载体 pDONR为入门载体,pK7GWIWG为RNAi载体,pK7WG2D为过表达载体。
1.1.2 PCR反应引物 P1:5′-AAAAAGCAGGCTTCATTCTTTACGCAGAGCCG-3′;P2:5′-AGAAAGC TGGGTCATCGTGCTGTGACCTTCTAT-3′; P3:5′-AA AAAGCAGGCTCGATGTGGAGGCTGAAGATCG-3′;P4:5′-AGAAAGCTGGGTCCGTCTCTCAAATCTTCAA GATGGCAA-3′。
1.1.3 BP反应 反应体系:二次PCR产物(40~100 fmol) 3.5 μl,pDONRTMvector (150 ng/μl) 0.5 μl,BP ClonaseTMenzyme mixture 1 μl,25 ℃水浴8 h。
1.1.4 LR反应 反应体系:BP产物(40~100 fmol) 3.5 μl,Destination vector (150 ng/μl) 0.5 μl,BP ClonaseTMenzyme mixture 1 μl,25 ℃水浴8 h。
1.2 遗传转化
1.2.1 基因枪转化方法 在转化之前将麻花艽愈伤组织转至含有高渗培养基(MS+0.4 mol/L甘露醇)的培养皿中心2 cm2范围内;基因枪为PDS-1000/He型,气压1100 psi;微弹制作过程参照Becker等[15]方法。轰击的微弹量为2912 μg/g。
1.2.2 再生阳性植株筛选 轰击后16 h 将胚性愈伤组织移至含150 mg/L卡那霉素的IB培养基上进行继代筛选,然后在不含抗生素的IB培养基上分化出绿色再生植株。以CTAB法提取再生植株DNA,PCR扩增35S启动子片段,筛选阳性转基因植株。
1.3 齐墩果酸的HPLC测定
1.3.1 仪器与试剂 LC-10AD型高效液相色谱仪(日本岛津公司),齐墩果酸对照品购自中国药品生物制品检定所。
1.3.2 实验方法 分别取齐墩果酸标准品3、6、9、12、15 μl进样,以峰面积为横坐标,以进样量为纵坐标作图,得到回归方程:y=0.0016x-180.44(R=0.0093)。表明齐墩果酸进样量在200~1000 ng范围内线性关系良好。
2 结果与分析
2.1 RNAi和过表达载体构建
采用gateway方法来构建麻花艽GsAS2基因载体。RNAi载体构建,首先要进行2次PCR反应,第一次以P1、P2为引物,pMD18T-GsAS2质粒为模板进行(图1A);第二次以attB1和attB2为引物、一次PCR产物为模板进行(图1B),然后经过BP反应,转化大肠杆菌DH5α,并通过菌体PCR筛选获得阳性质粒pDONR-GsAS2(图1C),最后进行LR反应,获得pK7G-GsAS2阳性质粒(图1D),通过测序证明GsAS2的RNAi载体构建成功。
对于过表达载体构建,也是首先进行2次PCR反应,第一次以P3、P4为引物、pMD18T-GsAS2质粒为模板进行(图2A),第二次以attB1和attB2为引物、一次PCR产物为模板进行(图2B),然后经过BP反应,转化大肠杆菌DH5α后,通过菌体PCR筛选获得阳性质粒pDONR-GsAS2(图2C),最后进行LR反应,获得pK7W-GsAS2阳性质粒(图2D),通过测序证明GsAS2的过表达载体构建成功。

A.GsAS2基因片段的一次PCR结果图;B. GsAS2基因片段的二次PCR结果图;C. BP反应转化大肠杆菌后pDONR-GsAS2的菌体PCR验证;D. LR反应转化大肠杆菌后pK7G-GsAS2片段的菌体PCR验证A.The first PCR of GsAS2 fragment; B. The second PCR of GsAS2 fragment; C. Thalli PCR verification of pDONR-GsAS2 fragment after BP reaction; D. Thalli PCR verification of pK7G-GsAS2 fragment after LR reaction图1 麻花艽GsAS2 RNAi载体的构建Fig.1 Construction of RNAi vector for G. strominea gene GsAS2

A.GsAS2基因片段的一次PCR结果图;B. GsAS2片段的二次PCR结果图;C.BP反应转化大肠杆菌后pDONR-GsAS2的菌体PCR验证;D. LR反应转化大肠杆菌后pK7W-GsAS2 的菌体PCR验证A.The first PCR of GsAS2 fragment; B. The second PCR of GsAS2 fragment; C. Thalli PCR verification of GsAS2 after BP reaction;D. Thalli PCR verification of GsAS2 fragment after LR reaction图2 麻花艽GsAS2 过表达载体的构建Fig.2 Construction of overexpression vector for G. strominea gene GsAS2
2.2 麻花艽的遗传转化
选取具有胚性的麻花艽愈伤组织作为转基因植物材料,置于培养皿中用于pK7G-GsAS2和pK7W-GsAS2的基因枪转化。基因枪轰击后,先将麻花艽愈伤组织暗培养24 h,然后转接于B1培养基(含有150 mg/L卡那霉素)上,根据其生长情况留下黄绿色部分,剔除黑褐色部分,从而筛选出抗性愈伤组织。而后再转接于IB培养基(不含卡那霉素)进行苗的分化培养,经过多次继代待幼苗长出后,使用25 mg/L的卡那霉素进一步来筛选抗性植株,最终得到RNAi系植株21株、过表达系植株34株(图3,表1)。用35S启动子引物对抗性植株总DNA进行PCR检测,结果表明,pK7G-GsAS2 RNAi系的阳性植株为5株,转化率为2.94 %;pK7W-GsAS2过表达系的阳性植株为8株,转化率为4.00 %(图4,表1)。
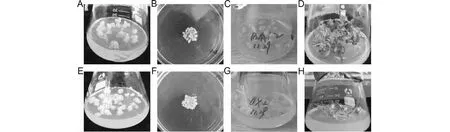
A~D. pK7G-GsAS2遗传转化过程;E-H. pK7W-GsAS2遗传转化过程;A、E. 转化前愈伤组织;B、F. 遗传转化; C、G. 抗性愈伤组织的筛选; D、F. 阳性再生植株A-D. pK7G-GsAS2 genetic transformation;E-H. pK7W-GsAS2 genetic transformation;A,E. The calli before transformation;B,F. Genetic transformation; C,G. Selection of kan-resistant calli; D,F. Positive plants图3 麻花艽愈伤组织的遗传转化Fig.3 The transformation of G.strominea calli
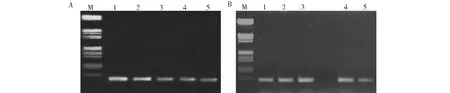
A. pK7G-GsAS2转基因抗性植株的PCR结果(1~5:阳性植株);B. pK7W-GsAS2转基因抗性植株的PCR结果(1~5:阳性植株)A. PCR result from resistant plants of pK7G-GsAS2 transformation (1-5:Positive plants); B. PCR result from resistant plants of pK7W-GsAS2 transformation (1-5:Positive plants)图4 抗性植株的PCR检测Fig.4 PCR result from transformation resistant plants
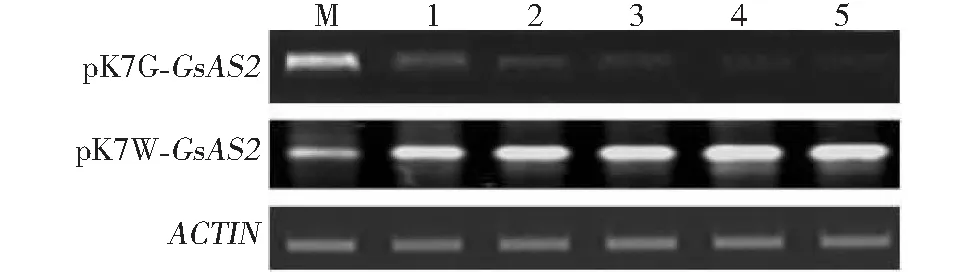
图5 转基因阳性植株GsAS2的半定量RT-PCRFig.5 RT-PCR of GsAS2 for positive plants of pK7G-GsAS2 and pK7W-GsAS2 transformation
2.3 转基因植株的检测
2.3.1 转基因麻花艽GsAS2的RT-PCR分析 分别选取5株pK7G-GsAS2和pK7W-GsAS2的转基因植株,进行麻花艽β-amyrin合成酶基因GsAS2的RT-PCR分析(图5),在RNAi系转基因植株中,GsAS2的表达量均显著低于对照,而在过表达系转基因植株中,其表达量均明显高于对照,说明GsAS2的表达在RNAi系中受到较大抑制,而在过表达系中则超量表达。
2.3.2 转基因植株的齐墩果酸含量分析 对上述选取的10株转基因麻花艽进行齐墩果酸的HPLC分析。如图6所示,RNAi系中的5株转基因麻花艽的齐墩果酸含量均低于对照(为对照的48.5 %~80.7 %),而过表达系中的5株转基因麻花艽的齐墩果酸含量均高于对照(为对照的1.67~2.46倍)。由此可见,可以通过抑制或促进GsAS2的表达来降低或提高齐墩果酸的合成,且抑制和促进的程度与齐墩果酸的含量呈正相关。
3 讨 论
萜类化合物是目前最大的一类植物次级代谢物,近几年,有关萜类的代谢工程研究已经取得了重要进展,从人参[7]、拟南芥[16-17]、豌豆[18]等植物中分离和克隆了许多OSCs基因,但是,有关OSCs基因的研究多局限在通过酵母表达体系来鉴定其生化功能,而在植物体中所参与代谢途径的解析及生物学功能的研究还非常少[19-20]。本实验对OSCs基因家族成员β-amyrin合成酶基因GsAS2进行了植物表达载体的构建,获得了GsAS2的RNAi系和过表达系,并通过转化麻花艽胚性愈伤组织,筛选得到了阳性植株,结果发现RNAi系中GsAS2基因表达量明显下降,且其下游产物齐墩果酸含量也很低;而过表达系中,GsAS2基因表达量明显上升,且齐墩果酸含量也大幅升高,二者具有很好的相关性。这为齐墩果酸代谢途径的深入研究打下了良好的基础。

WT:野生型;R:RNAi系;E:过表达系WT: Wild type; R: RNAi lines; E: Over-expression lines图6 转基因阳性植株的齐墩果酸含量分析Fig.6 Oleanolic acid content of transgenic plants
植物次生代谢是一个庞大的网络系统,中间涉及多条代谢途径及参与这些途径的基因和酶。目前我们掌握的信息还非常少,仅局限在鉴定和克隆少数几个基因上,在齐墩果酸合成过程中,除β-amyrin合成酶基因外是否还有其它关键酶基因或旁支途径影响其代谢还不得而知,因此要想全面探明影响齐墩果酸代谢的各种酶、各基因及各途径的相互关系将是一个非常艰巨和长期的任务,需要进一步研究。
4 结 论
本研究通过进行麻花艽β-amyrin合成酶基因GsAS2的载体构建及遗传转化,获得GsAS2的RNAi阳性植株5株,过表达植株8株,转化频率分别为2.94 %和4.00 %。且GsAS2的表达在RNAi系中受到较大抑制,其齐墩果酸含量均低于对照(为对照的48.5 %~80.7 %),而在过表达系中GsAS2则超量表达,齐墩果酸含量均高于对照(为对照的1.67~2.46倍)。说明GsAS2的表达与下游产物齐墩果酸的含量关系非常密切。
[1]王 丽, 史玲玲, 张艳霞, 等. 植物次生代谢物途径及其研究进展[J]. 武汉植物学研究, 2007, 25(5):500-508.
[2]高 亚, 于丽杰. 植物细胞培养技术生产次生代谢产物的研究进展[J]. 牡丹江师范学院学报(自然科学版), 2008,62(1):25-27.
[3]Seo J W, Jeong J H, Shin C G, et al. Overexpression of squalene synthase inEleutherococcussenticosusincreases phytosterol and triterpene accumulation[J]. Phytochemistry,2005,66(8): 869-877.
[4]Banyai W, Kirdmanee C, Mii M, et al. Overexpression of farnesyl farnesyl pyrophosphate synthase (FPS) gene affected artemisinin content and growth ofArtemisiaannuaL.[J]. Plant Cell Tiss Org,2010,103(2):255-265.
[5]Muir S R, Collins G J, Robinson S, et al. Overexpression of petunia chalcone isomerase in tomato results in fruit containing increased levels of flavonols[J]. Nature Biotechnology, 2001, 19(5): 470-474.
[6]Yun D J, Hashimoto T, Yamada Y. Metabolic engineering of medicinal plants: transgenicAtropabelladonnawith an improved alkaloid composition[J]. Proceedings of the National Academy of Sciences, 1992, 89(24): 11799-11803.
[7]Shim J S, Lee O R, Kim Y J, et al. Overexpression ofPgSQS1 increases ginsenoside production and negatively affects ginseng growth rate inPanaxginseng[J]. Journal of Ginseng Research, 2010, 34(2): 98-103.
[8]张西玲, 晋 玲, 刘丽莎. 近10年秦艽、麻花艽研究概况[J]. 中国中医药信息杂志,2000, 10(增): 62-63.
[9]刘艳红. 秦艽中的环烯醚苷类成分[J]. 云南植物研究, 1995,15(1):,85-91.
[10]近藤嘉和. 秦艽的成分研究[J]. 生药学杂志,1996,46(3):42-343.
[11]Ji L J, Ma Y H, Chen G C, et al. Determination and evaluation of two iridoids inGentianastramineaherbs by HPLC[J]. Acta Botanica Boreali-Occidentalia Sinica,2004, 24(2):292-295.
[12]田丽婷, 马 龙, 堵年生. 齐墩果酸的药理作用研究概况. 中国中药杂志,2002,27(12): 884-888.
[13]Haralampidis K, Trojanowska M, Osbourn A E. Biosynthesis of triterpenoid saponins in plants[J]. Adv. Biochem. Eng. Biotechnol,2002,75:31-49.
[14]Liu Y L, Cai Y F, Zhao Z J, et al. Cloning and Functional Analysis of a β-Amyrin Synthase Gene Associated with Oleanolic Acid Biosynthesis inGentianastramineaMAXIM[J]. Biol Pharm Bull, 2009, 32(5):818-824.
[15]Becker D, Brettschneider R, Lorz H. Fertile transgenic wheat from microprojectile bombardment of scutellar tissue[J]. Plant J.,1994,5(2):299-307.
[16]Segura M J, Meyer M M, Matsuda S P.ArabidopsisthalianaLUP1 converts oxidosqualene to multiple triterpene alcohols and a triterpene diol[J]. Org. Lett, 2000, 15(2): 2257-2262.
[17]Husselstein-Muller T, Schaller H, Benveniste P. Molecular cloning and expression in yeast of 2, 3-oxidosqualene triterpenoid cyclases fromArabidopsisthaliana[J]. Plant Mol. Biol., 2001,45(1): 75-82.
[18]Morita M, Shibuya M, Kushiro T. Molecular cloning and functional expression of triterpene synthases from pea (Pisumsativum) new alpha-amyrin-producing enzyme is a multifunctional triterpene synthase[J]. Eur. J. Biochem, 2000,267(12): 3453-3459.
[19]Masataka K, Katsuyuki T, Yamato, et al. Cloning and characterization of a cDNA encoding β-amyrin synthase from petroleum plantEuphorbiatirucalliL.[J]. Phytochemistry, 2005,66(15): 1759-1766.
[20]Maria C, Maria F C, Paola P, et al. Molecular characterization of β-amyrin synthase fromAstersedifoliusL. and triterpenoid saponin analysis[J]. Plant Science,2005,175(3):255-261.
(责任编辑 李 洁)
ConstructionandTransformationofβ-amyrinSynthaseGeneGsAS2VectorinGentianastramineaMaxim.
LIU Yan-ling1, XIANG Feng-ning2
(1.Biotechnology Institute, Laiwu College for Vocational Technology, Shandong Laiwu 271100,China; 2. Key Laboratory of Plant Cell Engineering and Germplasm Innovation, Ministry of Education, School of Life Sciences, Shandong University,Shandong Jinan 250100, China)
【Objective】Construction and transformation of β-amyrin synthase geneGsAS2 vector inGentianastramineaMaxim. was done in this subject. 【Method】Plant RNAi vector (pK7GWIWG-GsAS2) and overexpression vector (pK7WG2D-GsAS2) were constructed using gateway technique and transferred into callus ofG.Stramineaby particle gun. Resistant lines were gained by selecting in the culture medium with 150 mg/L kanamycin. 35S promoter primers were used to amplify a fragment ofGsAS2 from genome of resistant plants. 【Result】 The transformation rate was caculated (GsAS2 RNAi lines 2.94 %,GsAS2 overexpression lines 4.00%). The results of RT-PCR and HPLC analysis for transgenic plants showed that in RNAi lines the expression ofGsAS2 was suppressed and the plants had lower oleanolic acid, whereas in overexpression lines the expression ofGsAS2 was promoted and the plants accumulated more oleanolic acid. 【Conclusion】All this showed there was close relationship between the expression ofGsAS2 and the content of oleanolic acid.
GentianastromineaMaxim.; β-amyrin synthase geneGsAS2; Vector construction; Genetic transformation
Q81
A
1001-4829(2017)11-2444-05
10.16213/j.cnki.scjas.2017.11.009
2016-12-23
莱芜职业技术学院博士科研启动基金(2015bsky01)
刘艳玲(1977-),女,黑龙江北安人,博士研究生,主要研究方向:中药材次生代谢,E-mail:lyling9030@163.com,Tel:13376343556。

