青天葵组织培养球茎诱导的研究
覃剑峰,林 杨,杨美纯,韦璐阳,金 刚,施丽雅,蒙 瑶,罗 清
(1.广西壮族自治区亚热带作物研究所,广西 南宁 530001;2.广西大学 农学院,广西 南宁 530004 ;3.广西药用植物园,广西 南宁 530023)
青天葵组织培养球茎诱导的研究
覃剑峰1,2,林 杨3,杨美纯2,韦璐阳1,金 刚1,施丽雅1,蒙 瑶1,罗 清1
(1.广西壮族自治区亚热带作物研究所,广西 南宁 530001;2.广西大学 农学院,广西 南宁 530004 ;3.广西药用植物园,广西 南宁 530023)
【目的】研究蔗糖、大量元素和激素等浓度因素对青天葵(Nerviliaefordii)组培球茎诱导形成的影响。【方法】以青天葵球茎诱导形成的走茎,并切取生长端长度约为3 cm带节的茎段为试验材料。分别在以MS培养基为基本培养基,含不同蔗糖、KNO3、NH4NO3、KH2PO4、6-BA、NAA和PP333浓度的培养基中培养,统计形成球茎的数量、直径和鲜重等指标。【结果】蔗糖浓度为40~50 g/L时球茎诱导效果较好;MS培养基中的大量元素,当KNO3、NH4NO3、KH2PO4浓度分别为2800~2600、1650~1980和230~272 mg/L时诱导效果较好。在MS培养基中附加终浓度为0.5~2.5 mg/L NAA和0.4~0.6 mg/L PP333时,提高了青天葵组培球茎的形成速度且形成的球茎大小均匀;附加6-BA则不利于球茎诱导。【结论】筛选出的培养基和培养条件可有效提高青天葵球茎诱导效率。
青天葵;组织培养;球茎
【研究意义】青天葵(NerviliaeFordii)又名毛唇芋兰、独脚天葵、珍珠草、假天麻,为兰科芋兰属植物[1-3],多年生宿根小草本。青天葵是长期以来较为紧缺和经济价值较高的中草药[4,5]。野生青天葵一般以球茎作为繁殖方式,自然繁殖系数极低,且由于人们的滥采滥挖,导致青天葵资源匮乏。人工引种野生青天葵已获得成功,但因种球茎的稀缺,一直无法推广种植[6]。通过组织培养的途径不仅能够保存青天葵的种质资源,同时也为人工种植提供种源。在组织培养条件中将其走茎直接诱导形成完整植株较困难,而将球茎直接种植则较易形成完整植株,且球茎不必进行炼苗即可直接用于大田生产,播种简易,从而节省了时间,降低了成本。因此,提高青天葵球茎诱导效率对青天葵规模化生产具有重要意义。【前人研究进展】至今有关青天葵在组培球茎诱导的研究及相关报道不多。研究报道表明,野生青天葵球茎的大小对发芽有较大的影响,小球茎通常发芽率不高,只有25 %。施肥营养方面的研究表明,施用生物有机肥的地上部分,产量等各项测定数据均高于复合肥和农家肥,而施用复合肥的植株地下部分母块茎、子块茎优于生物有机肥和农家肥[7]。在采用青天葵球茎快速繁殖方法研究中,将青天葵球茎接种在H 培养基上繁殖,不仅球茎顶芽萌发伸长,并可使根茎上的潜伏芽也同时萌发,改变了青天葵正常生长的形态模式,由单芽型变为具有4~6 个芽的丛芽型。分别以叶片、叶柄、球茎、根进行诱导,结果显示球茎的诱导效果比较好[11]。【本研究切入点】通过组织培养的方式有利于青天葵种质资源的保存,但目前有关提高青天葵球茎诱导效率报道较少。【拟解决的关键问题】通过对糖、大量元素和激素的浓度等几个有可能影响青天葵组培球茎形成的因素进行较系统的研究,以期掌握青天葵组培球茎的诱导方法,并筛选出有利于青天葵组培球茎形成的培养基和其它培养条件。
1 材料与方法
1.1 供试材料
青天葵球茎诱导形成的走茎,切取生长端长度约为3 cm带节的茎段。KNO3、KH2PO4、NH4NO3、蔗糖和萘乙酸(NAA)为中国医药(集团)上海化学试剂有限公司生产,其有效成分≥98.0 %。PP333(多效唑),15 %不湿性粉剂;6-苄基腺嘌呤(6-BA)为中国医药(集团)上海化学试剂公司生产,有效成分≥98.0 %。凝固剂用合浦琼脂厂生产的琼脂粉(700 目/cm2)。基本培养基为MS。
1.2 试验方法
分别将直径约0.3 cm、长约3 cm、无侧茎、去掉生长端的组培走茎接种到MS培养基中。其中含不同蔗糖浓度(20、30、40、50、60、70和80 g/L),不同KNO3浓度(0、380、760、1140、1520、1900、2280和2660 mg/L),不同NH4NO3浓度(0、330、660、990、1320、1650、1980和2310 mg/L),不同KH2PO4浓度(0、34、68、102、136、170和204 mg/L),不同6-BA浓度 (0、0.1、0.3、0.5、0.7和0.9 mg/L) ,不同NAA和PP333浓度(0、0.5、1.0、1.5、2.0和2.5 mg/L) ,以上处理接种段数均为60段,每瓶接两个茎段,进行球茎诱导。观察球茎开始形成的时间,60 d后统计形成球茎的数量、直径、鲜重。
2 结果与分析
2.1 蔗糖浓度对青天葵组培球茎诱导的影响
从表1可以看出,随着蔗糖浓度的增加,青天葵组培走茎形成球茎的速度明显加快。在糖浓度较低的培养基内,其侧茎的生长时间比在糖浓度较高的培养基内的长,呈球茎形成速度随培养基内糖浓度的增加而加快的趋势。蔗糖浓度对青天葵组培球茎形成的数量也有着较大影响,当糖浓度为20~50 g/L时,球茎数量、直径和鲜重随着糖浓度的增加而呈增加趋势。当糖浓度达到60 g/L时,球茎数量开始减少,走茎开始出现萎蔫现象。当糖浓度达到70 g/L时所接入的茎段开始时同样能够形成球茎,但之后走茎和球茎严重萎蔫,甚至死亡。
2.2 KNO3对青天葵组培球茎诱导的影响
从表2可见,青天葵走茎形成球茎速度随着KNO3浓度的增加呈增加趋势,当KNO3的添加量为2660 mg/L时,接种后第9天时便可观测到侧茎尖端出现乳白色颗粒状球茎,比对照组提前6 d。第一个球茎形成后,侧茎及球茎均随着培养时间的推移而增粗和膨大,且继续形成的球茎。接种60 d后,各处理所诱导出的球茎数量均随着KNO3添加量增大而增加,但球茎的平均直径和平均鲜重均随KNO3增加量的加大而减小,其中,对照处理球茎最大。添加380和760 mg/L KNO3的处理球茎诱导效果较好,两处理诱导球茎数量均显著多于对照处理,且球茎平均直径与对照处理差异不显著,而其他处理所诱导的球茎数量虽多,但球茎质量较差。
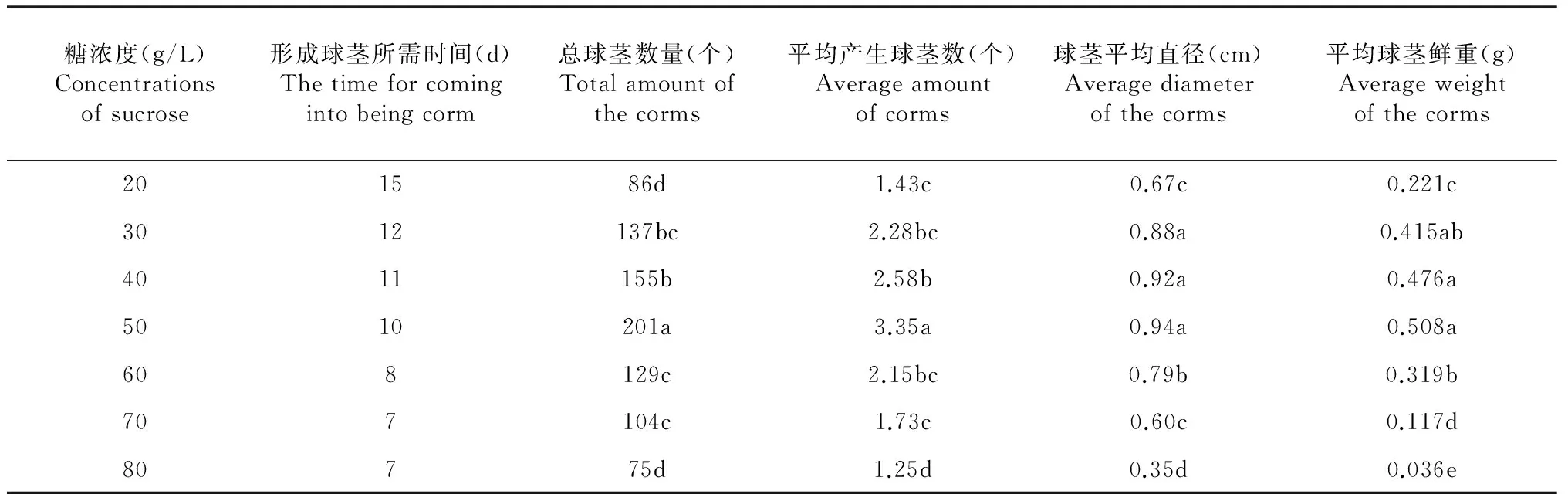
表1 糖浓度对球茎诱导的影响
注:同列数据后不同小写字母表示差异显著(Plt;0.05),下同。
Note:Different lowercase letters in the same column indicate significance of difference atPlt;0.05 level. The same as below.
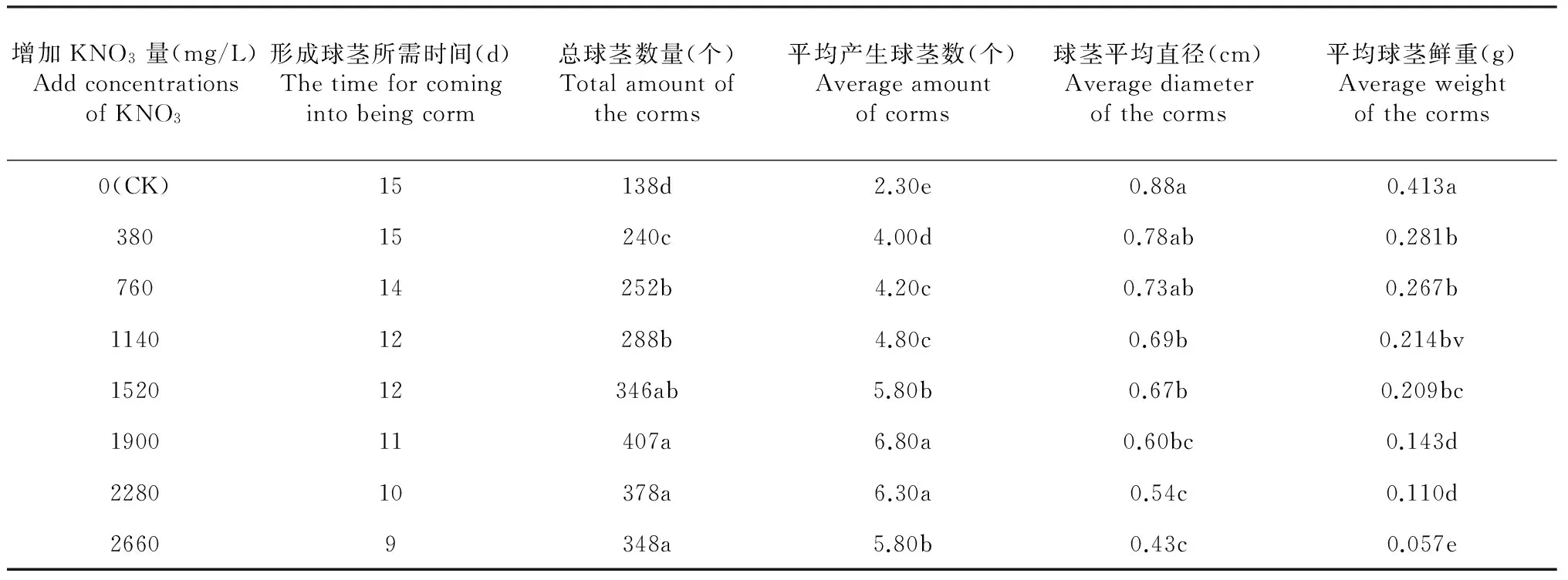
表2 KNO3对青天葵组培球茎诱导的影响(Ⅰ)
2.3 NH4NO3对青天葵组培球茎诱导的影响
增加NH4NO3没有对球茎形成的速度产生明显影响,各处理中开始形成球茎的时间基本一致(表3)。接种60 d后,随NH4NO3添加量的增加,诱导出的球茎数量呈下降趋势,球茎成熟度呈提高趋势,在添加量达1320 ~1980 mg/L时,球茎数量均显著低于低添加量处理,且主茎开始出现萎蔫现象,2310 mg/L时主茎与球茎均呈死亡状态。
随着培养基中NH4NO3的含量的增加,各处理中大部分球茎的平均直径均呈先增加后减少的趋势,原因可能为,原培养基中营养成分不能满足青天葵组培球茎生长的需要,添加NH4NO3后,球茎诱导效果更好,但当NH4NO3增加的量继续加大时,不利于青天葵组培球茎糖分的均衡积累,使大球茎和小球茎的比例不断增加,中等球茎比例逐渐减少。兼顾球茎诱导率和球茎品质来看,NH4NO3的增加量为330 mg/L时诱导效果较好。
2.4 KH2PO4对青天葵组培球茎诱导的影响
增加KH2PO4可提高青天葵球茎的形成速度,但相比对照处理提高并不明显(表5),当KH2PO4添加量到达136 mg/L后不再对球茎形成速度产生影响。接种后60 d,KH2PO4增加量为0~102 mg/L时,球茎数量随KH2PO4添加量增大而缓慢增加;102~204 mg/L时,球茎数量随KH2PO4添加量增大而缓慢减少。随着KH2PO4添加量增加,各处理球茎平均直径呈缓慢增加趋势,当KH2PO4的增加量达到136 mg/L时,球茎平均直径增幅最大,大部分球茎直径在1.00 cm以上,最大为1.25 cm。综合球茎诱导率、大小和品质等方面来看,当KH2PO4的增加量在68~102 mg/L时,诱导效果最好。

表3 NH4NO3对青天葵组培球茎诱导的影响(Ⅰ)
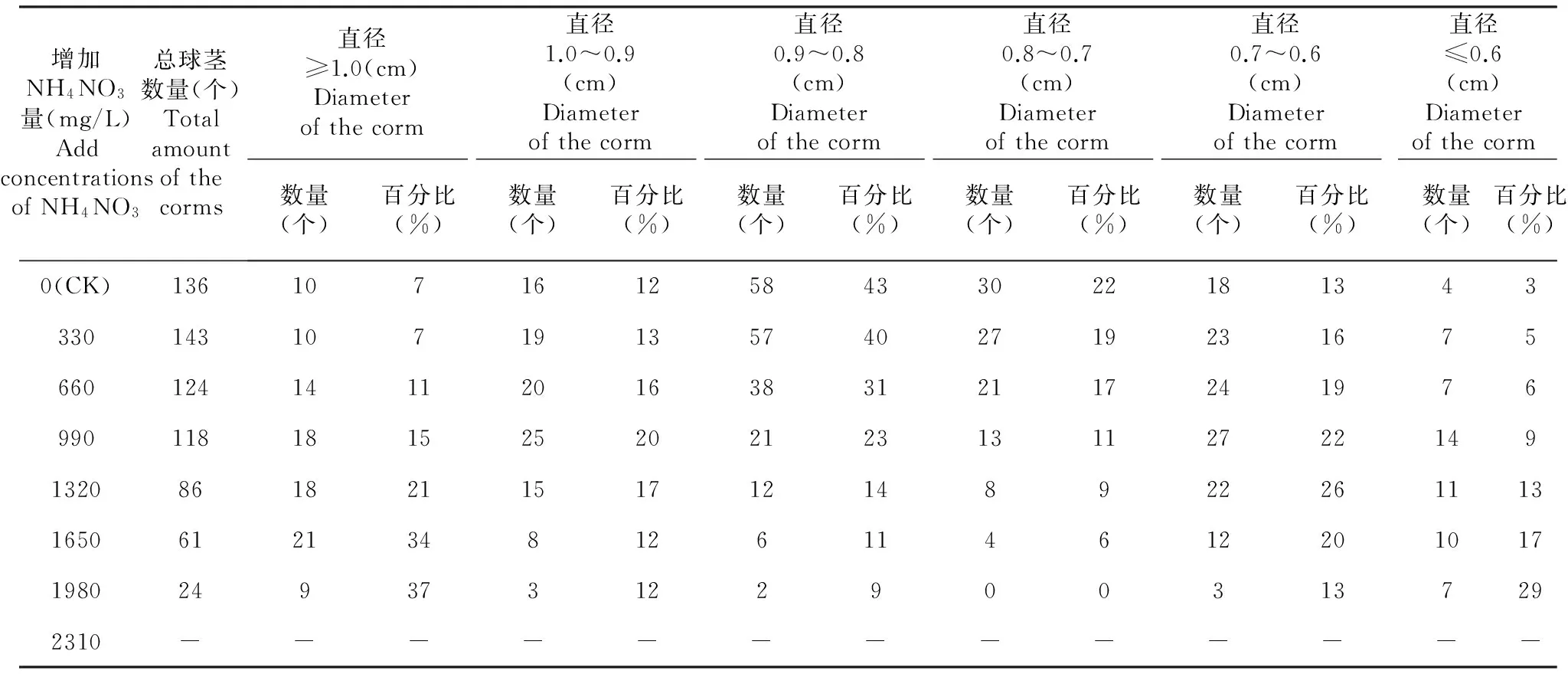
表4 NH4NO3对青天葵组培球茎诱导的影响(Ⅱ)
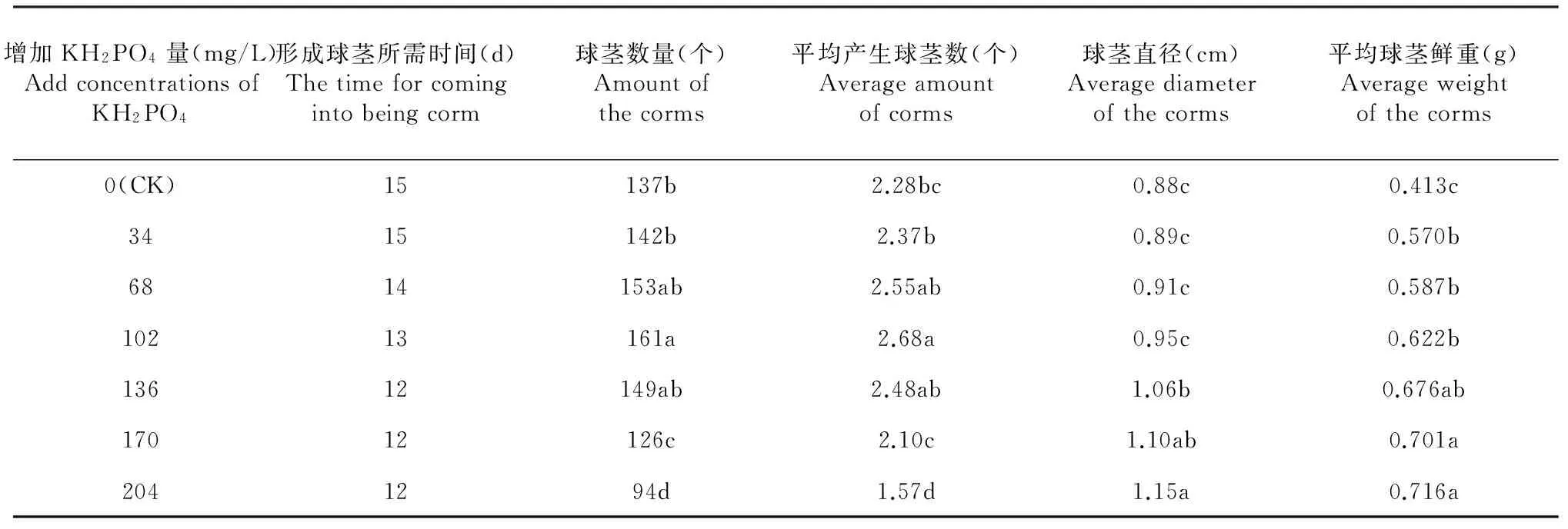
表5 KH2PO4对青天葵组培球茎诱导的影响
2.5 不同PP333浓度对青天葵组培球茎诱导的影响
从表5可见,PP333能够明显加快青天葵组培球茎的形成,PP333浓度达到0.8~1.2 mg/L时,一周内即有约0.1 cm大小的乳白色颗粒状球茎形成,且肉眼基本上观察不到侧茎的生长。当浓度达到0.6 mg/L时,所形成的球茎开始扭曲,随PP333浓度增加,在较早形成的球茎上会长出新的小球茎,且数量不断增加。当PP333浓度达0.8 mg/L及以上时,最初接入的主茎茎段开始出现老化,甚至死亡现象,部分球茎也开始老化。球茎节间随着PP333浓度的增加而明显缩短,导致畸形球茎的产生。综合考虑, PP333浓度为0.4~0.6 mg/L时较好。
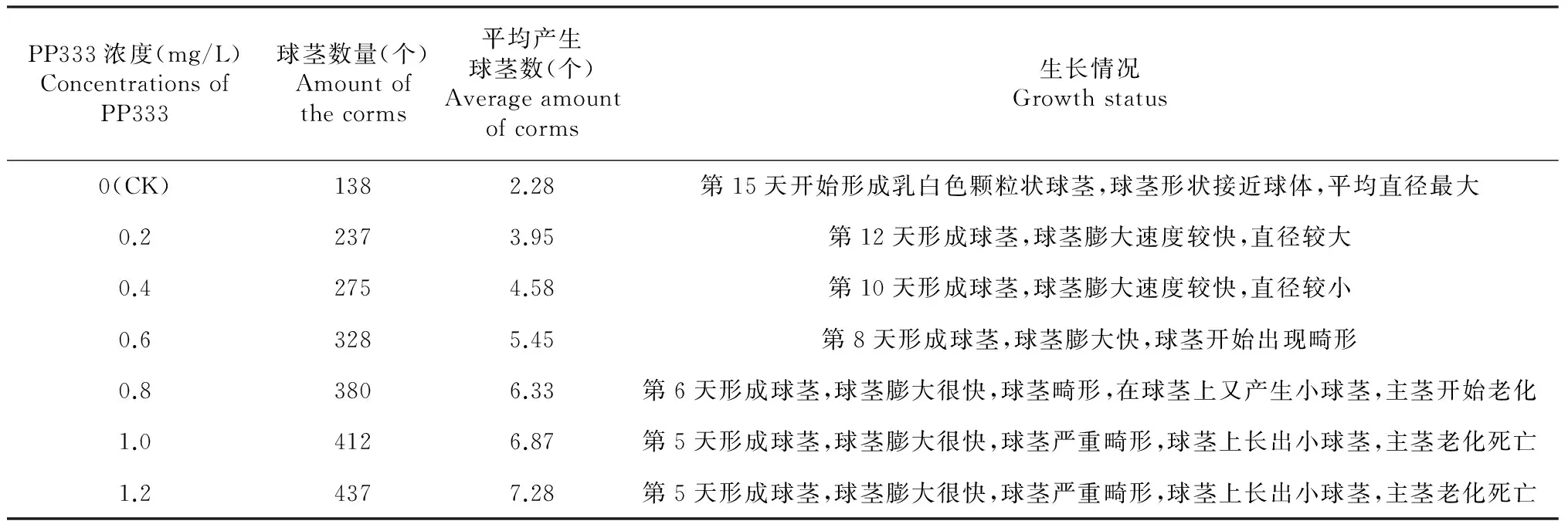
表6 PP333对青天葵组培球茎诱导的影响
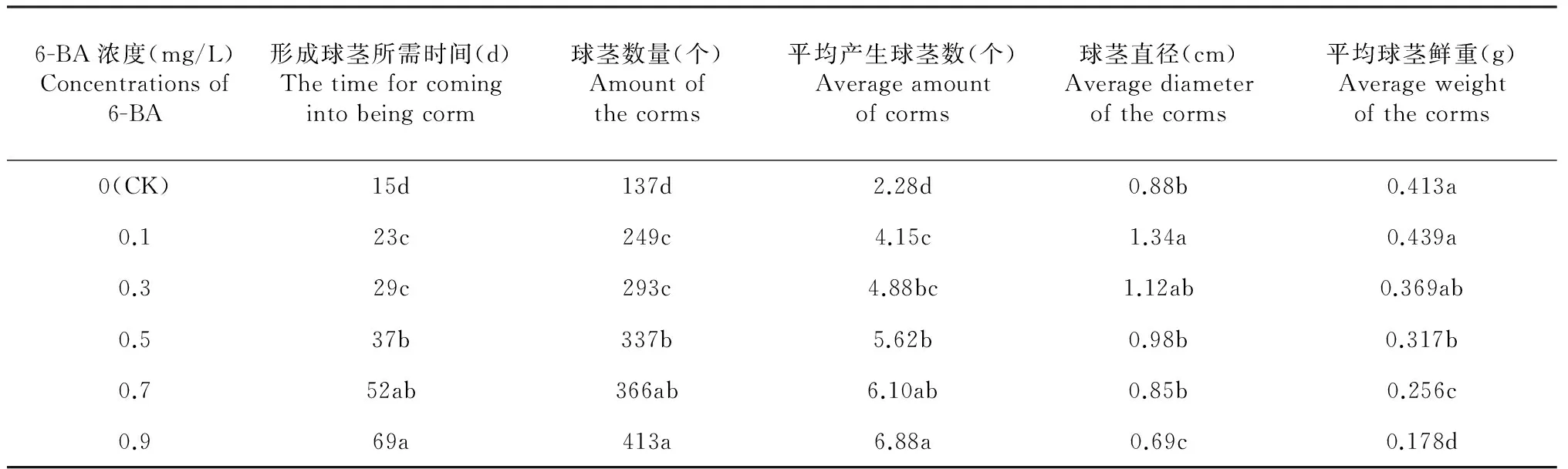
表7 6-BA 对青天葵组培球茎诱导的影响
2.6 6-BA浓度对青天葵组培球茎诱导的影响
从表6可见,6-BA对青天葵球茎的形成有着明显的延缓作用。附加6-BA培养基中球茎形成所需的时间明显大于对照处理。随着6-BA的浓度增加,球茎形成的速度减缓,同时速度减缓的幅度也随之加大。所有添加 6-BA处理的球茎数量均显著高于对照处理,球茎数量随6-BA浓度增大而增多,但增长幅度呈减缓趋势。6-BA的浓度为0.3~0.6 mg/L时,球茎数量呈增加趋势,而球茎直径则相反,原因可能为由于形成球茎数量过多,以及走茎生长量过大,使得球茎生长不能获得足够的营养。
2.7 NAA浓度对青天葵组培球茎诱导的影响
从表7可以看出,青天葵组培球茎的形成速度随着培养基中NAA的浓度加大而加快,但NAA对形成的球茎数量影响不显著,球茎直径则随着附加NAA浓度的增大而出现明显增大的趋势,当NAA浓度达到2.5 mg/L,球茎平均直径达到1.64 cm,其中最大球茎直径达到2.18 cm。虽然球茎的鲜重也随NAA的浓度加大而加大,但增大幅度相对较小。
3 讨 论
青天葵组培球茎的形成本质上是糖分的动态积累过程,故培养基内糖分的含量对球茎的诱导效果有较大影响。本研究结果表明,当培养基内糖浓度为40~50 g/L时,基本能够满足球茎诱导的需求。培养基中部分大量元素的含量以及附加的植物生长物质对青天葵组培球茎的诱导效果具有一定影响。KNO3能够相对均衡的促进球茎糖分的积累,提高了球茎形成的数量。但是,因为受走茎对培养基中营养吸收速率的限制,所以在提高了结球数量的同时,也限制了球茎个体的增大。研究结果表明,培养基中KNO3浓度为2280~2660 mg/L时诱导效果是最好的。NH4NO3有助于促进青天葵组培球茎个体的膨大,但同时也不利于球茎数量的增加,且不能加快球茎的形成的速度。过量的NH4NO3在促进球茎增大的同时也降低了球茎的充实度。在本次研究中发现,当培养基中NH4NO3浓度为1650~1980 mg/L时诱导效果较好。KH2PO4有利于碳水化合物的代谢和运输,从而使球茎在形成过程中较有效地积累糖分,从而使球茎的体积和充实度增加,当培养基中KH2PO4浓度为230~272 mg/L时诱导效果最好。
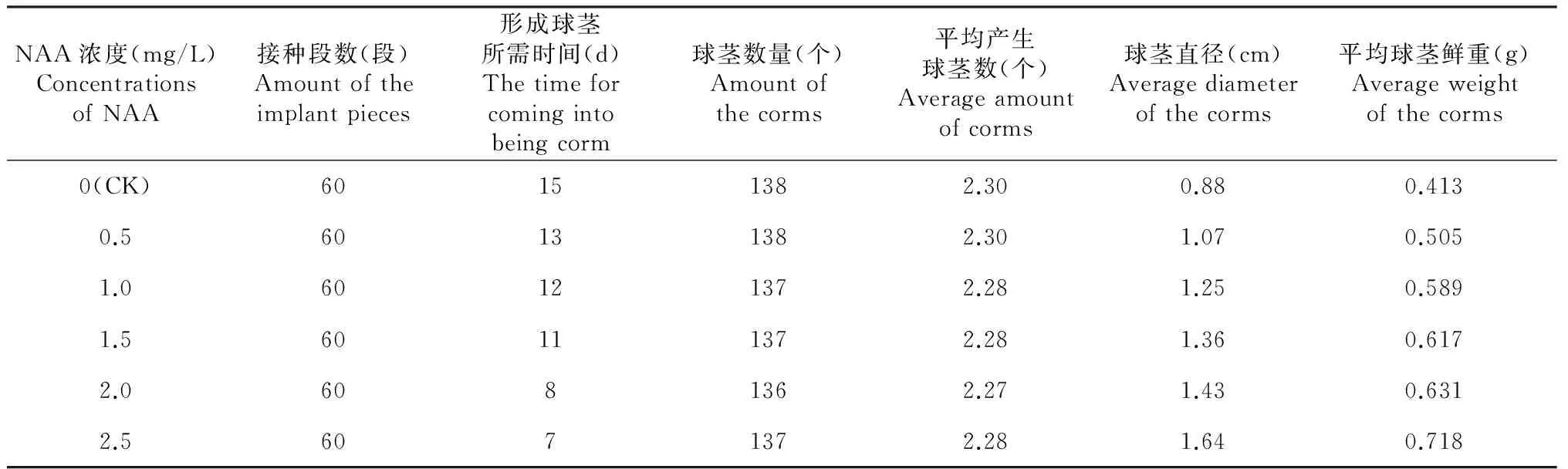
表8 NAA对青天葵组培球茎诱导的影响
MS培养基附加6-BA 的浓度为0.1~0.9 mg/L时,不利于青天葵组培球茎对糖分的积累,但增加了侧茎形成的数量。分析其原因认为,6-BA能促进走茎的细胞分裂,从而减缓了球茎对糖分的积累,最终导致球茎的生长变慢。在今后的试验中可以先利用6-BA诱导出球茎后,再去掉6-BA进行球茎培养,从而既可以提高球茎的数量,也可以保证球茎个体的质量。NAA对青天葵组培球茎的诱导是有一定促进作用的。但是,考虑到球茎的充实度有可能影响青天葵球茎在种植的生长状况,所以在生产上应该适当控制添加NAA的浓度。
对青天葵进行组织培养研究,不仅为人工种植青天葵提供种子资源提高了农民的收入,同时也减少了对野生青天葵的采挖量;运用组织培养的方法,可以生产大量作为种源的球茎。
4 结 论
在青天葵组织培养球茎诱导的过程中,蔗糖浓度为40~50 g/L时、KNO3、NH4NO和KH2PO4浓度分别为2800~2600、1650~1980和230~272 mg/L时诱导效果较好;MS培养基中附加终浓度为0.5~2.5 mg/L NAA和0.4~0.6 mg/L PP333时,可提高青天葵组培球茎的形成速度且形成的球茎大小均匀;附加6-BA则不利于球茎诱导。本研究结果可为青天葵的规模化生产提供技术依据。
[1]倪芝瑜.广西珍贵药材“青天葵”的原植物研究[J].宁波师范学报,1985,3(1):73.
[2]胡廷松.青天葵野生变家种栽培的探讨[J].广西植物,1988,8(3):263.
[3]凌征柱.青天葵组织培养栽培苗与野生引种栽培苗电泳研究[J].种子科技,1999(2):30.
[4]史莜冰,赵不潜,潘俊辉,等.天龙茶治疗急性支气管炎的临床观察[J].现代临医学生物工程学杂志,1997,3(2):126.
[5]缴稳苓.中药对幽门螺杆菌抑制作用的研究[J].天津医药,1997,25(12):740-741.
[6]胡廷松.青天葵的人工栽培技术研究[J].广西植物,1993,13(3):263.
[7]吴庆华,凌征柱,陆永梅.中药青天葵组培球茎栽培的研究[J].时珍国医国药,2001, 10(12):958-959.
[8]Zhou R L,Zhao H L.Protecting eazyme system of herbage and its functions in the cold growing process in alpine and cold region[J].Acta Bot. Boreal Occident Sin, 2002, 22(3):566-573.
[9]邓锡青.毛唇芋兰根茎的诱导与块茎形成[J].植物生理学通讯,1985(6):40.
[10]凌征柱.青天葵诱导多球茎及丛生苗的研究[J].种子,1988,98(5): 35-36.
[11]杜 勤.青天葵组织培养及植株再生的研究[J].中国中药杂志,2005,11(3):812-81.
[12]潘学峰,符式钦,戴卫端.青天葵叶片离体培养及植株再生[J].海南大学学报自然科学版,2001,4(19):358-362.
[13]黄红兵,朱品业,何丽清,等.青天葵的薄层色谱鉴别与总氨基酸含量测定[J].中国野生植物资源,2000,18(2):40-42.
[14]刘纯心.两种青天葵的鉴定研究[J].中药材,1996,12:612.
[15]蓝祖栽.青天葵的采收期对产量的影响[J].广西农业科学,1998(4):177.
[16]邱志楠,潘俊辉.青天葵临床新用[J].广州医学院学报,1995,23(2):96-97.
[17]Mc Cond P L,Fridorichl.The role of oxygen free radicals in biological procedd[J].Biol Chem,1969,244:6049-6055.
[18]Slater T F,Mickle P L.Oxygen Free Radicals and Tissue Damage[J].Excerpta Medica Amsterdam,1979,143.
[19]周迎新.人工栽培与野生雷公藤有效质量比较[J].中国中药杂志,1995,20(3):145.
[20]胡廷松.青天葵中氨基酸成分分析[J].广西植物,1993,13(1):87.
[21]陈俊元.人工栽培与野生雷公藤有效成分比较[J].中草药,1991,22(6):284.
[22]黄 进.人工栽培青天葵的生长研究[J].林业科学研究,1991(4):92.
[23]凌征柱.提高青天葵结果率的研究[J].种子世界,1998(12):19.
[24]凌征柱.青天葵组织培养栽培苗与野生青天葵化学成分对比[J].中医中药杂志,1999(S):30.
[25]Lewis N,Yamamoto E.Lignin:occurrence,biogenesis and biodegradation[J]. Annual Review of Plant Physiology amp; Plant Molecular Biology,1990(4):455-496.
[26]杜 勤.施肥对青天葵生长的影响[J].中药材,2006,29(2):106-107.
[27]Strotmann H,Bickel-Sandkotter S. Structur,function,and regulation of chloroplast ATPase[J]. Annual Review of Plant Biology,1984,35:97-120.
[28]江苏新医学院.中药大辞典(上册)[M].上海:上海人民出版社,1997:1231.
[29]钟济新.广西石灰岩石山植物图谱[M].南宁:广西人民出版社,1982:304.
[30]廖祥儒.抗氧化酶与中国葡萄抗盐性研究[M].杨凌:西北农业大学出版社,1996.
[31]陆善旦.名贵中药材高产栽培技术[M].南宁:广西科学技术出版社,1990.183.
(责任编辑 汪羽宁)
StudyonTissueCultureCormsInducingofNerviliafordii
QIN Jian-feng1,2, LIN Yang3, YANG Mei-chun2, WEI Lu-yang1, JIN Gang1, SHI Li-ya1, MENG Yao1, LUO Qing1
(1.Guangxi Subtropical Crops Research Institute,Guangxi Nanning 530001, China; 2.College of Agriculture, Guangxi University, Guangxi Nanning 530004, China 3.Guangxi Botanical Garden of Medicinal Plants,Guangxi Nanning 530023, China)
【Objective】To explore the influence of concentration factors of sucrose, macroelements and hormones on the induction of tissue cultured corms,the tissue cultured amphitropous stem ofNerviliaefordiiwas selected as explants and studied.【Methods】The amphitropous stem induced byNerviliaefordiicorms were cut at about 3cm of growing end as experimental materials, and cultured in MS medium with different concentration of sucrose, KNO3, NH4NO3, KH2PO4, 6-BA, NAA and PP333 respectively. 【Result】Sucrose at the concentration of 40-50 g/L performed better induction effect. KNO3performed better induction effect at the concentration of 2800-2600 mg/L. NH4NO3had better induction effect at the concentration of 1650-1980 mg/L. KH2PO4performed better induction effect at the concentration of 230-270 mg/L. MS medium supplemented with 0.5-2.5 mg/L NAA and 0.4-0.6 mg/L PP333 accelerated the formation ofNerviliaefordiitissue cultured corms, with no influence on the quantity and uniformity of size. 6-BA was not conductive to the induction of tissue cultured corms. 【Conclusion】The selected medium and culture conditions can increase the induction efficiency ofNerviliaefordiicorms.
Nerviliaefordii; Tissue culture; Corm
S567.23
A
1001-4829(2017)11-2568-06
10.16213/j.cnki.scjas.2017.11.031
2017-06-03
广西科技开发计划项目“珍稀濒危药用资源保护与可持续利用工作站”(桂科AD17129044);广西壮族自治区亚热带作物研究所基本科研业务费专项项目(桂热研201610)
覃剑峰(1979-),壮族,男,广西柳江人,硕士,助理研究员,主要从事植物组织培养及栽培研究工作,E-mail:qinjianfengmail@163.com。

