甜高粱WRKY转录因子基因的克隆与表达分析
徐 磊,胡小文,姚艳丽,邢淑莲,刘 洋
(中国热带农业科学院湛江实验站 广东省旱作节水农业工程技术研究中心,广东 湛江 524013)
甜高粱WRKY转录因子基因的克隆与表达分析
徐 磊,胡小文,姚艳丽,邢淑莲,刘 洋*
(中国热带农业科学院湛江实验站 广东省旱作节水农业工程技术研究中心,广东 湛江 524013)
【目的】克隆甜高粱WRKY基因,分析其序列特征和表达谱,为甜高粱抗旱育种提供基因来源。【方法】以甜高粱品种M81-E幼苗总RNA为模板,利用RT-PCR技术克隆甜高粱WRKY基因,通过生物信息学软件分析其序列特征,采用实时荧光定量PCR检测基因表达情况,获得2条WRKY基因,命名为SbWRKY1(Genebank 登录号:KY231904)和SbWRKY2(Genebank 登录号:KY231905)。【结果】SbWRKY1 cDNA序列全长1086 bp,包括1个1059 bp的开放阅读框,编码352个氨基酸。SbWRKY2 cDNA序列全长750 bp,包括1个717 bp的开放阅读框,编码238个氨基酸。2个基因编码的蛋白均具有WRKY核心序列“WRKYGQK”和“C-X4-5-C-X22-23 -H-X1-H”锌指结构模型。SbWRKY1蛋白分子式为C1628H2619N509O504S16,预测蛋白质分子量为37.89 kDa,等电点(PI)为9.78。SbWRKY2蛋白分子式为C1131H1752N326O344S21,预测蛋白质分子量为26.09 kDa,等电点(PI)为8.43。系统进化树分析表明,SbWRKY1蛋白与高粱、玉米和谷子WRKY蛋白亲缘关系较近,SbWRKY2蛋白与高粱、芒草和玉米WRKY蛋白亲缘关系较近。荧光定量PCR分析表明,随着干旱胁迫时间延长,SbWRKY1和SbWRKY2呈上调表达趋势。【结论】SbWRKY1和SbWRKY2基因可能在甜高粱应对干旱胁迫中发挥一定作用。
甜高粱;转录因子;WRKY;RT-PCR
【研究意义】转录因子(transcription factor)又称反式作用因子,它能激活或抑制相关基因表达,通过这一转录调控过程,植物可以应对各种生物及非生物胁迫[1]。根据转录因子DNA保守结构域的特点,可以将其分成若干个家族,如AP2/EREBP、MADS、bZIP和MYB等[2]。WRKY家族转录因子是植物中一类较大的基因家族,所有WRKY蛋白都包含1~2个保守WRKY结构域,该结构域含有约60个氨基酸序列,N端主要由“WRKYGQK”核心序列组成,C端序列为“C-X4-5-C-X22-23-H-X1-H或C-X7-C-X23-H-X1-C”类型的锌指结构[3-4]。根据WRKY基因分类标准,该类转录因子可分为是I型、II型和III型。I型有个2个WRKY结构域,分别位于N端和C端,其锌指结构类型为C2H2;II型和III型各含有1个保守的WRKY结构域,II型锌指类型为C2H2,III型锌指结构类型则为C2HC[5]。【前人研究进展】在植物中,自1994年从甘薯中克隆第一个WRKY基因以来[6],针对WRKY转录因子已有较多研究报道,在WRKY全基因组鉴定[7]、生物[8]及非生物胁迫[9]表达特征分析和转基因功能验证[10]等方面开展研究。拟南芥中有68 %的AtWRKYs响应SA处理或丁香假单胞菌侵染[11]。棉花GhWRKY3不仅在ABA、SA、MeJA、GAs和ET多种激素处理后上调表达,而且在立枯丝核菌、棉花炭疽病菌和棉花枯萎病菌侵染后增强表达,同时该基因能够被干旱、高盐和冷害胁迫诱导表达[12]。WRKY转录因子具有多种生物学功能,在植物发生长发育、抗病反应、激素诱导和环境胁迫等进程中发挥作用[13]。甜高粱起源于非洲,是粒用高粱的一个变种,生物量大、含糖量高,是优质的饲料作物和能源作物。它具有耐旱、耐盐碱和耐贫瘠等多种特性[14]。而高粱基因组小(750 Mbp),是禾本科作物中抗旱性研究的优良模式植物[15]。【本研究切入点】高粱基因组测序已于2009年完成,但有关高粱WRKY基因的研究鲜有报道,本研究以甜高粱品种M81-E为试材,通过同源克隆获得甜高粱的WRKY基因,并研究基因在干旱胁迫处理条件下的表达模式。【拟解决的关键问题】为甜高粱WRKY基因的功能研究提供参考。
1 材料与方法
1.1 供试材料
甜高粱品种:M81-E,由本实验室保存。试剂:Trans2K Plus DNA Marker、Easy Pure Plant RNA kit、TransScript First-Strand cDNA Synthesis SuperMix、2x EasyTaqPCR SuperMix、pEASY-T1 Cloning Kit、Trans1-T1感受态细胞和TransStart Green qPCR Super Mix均购自北京全式金生物技术有限公司。
1.2 高粱苗期胁迫处理
M81-E种子用5 % NaClO溶液消毒,无菌水冲洗3次,种植于温室,以0.5×Hoagland营养液水培,每3 d更换1次营养液,待生长至3叶1心时,用含20 % PEG6000的营养液进行干旱胁迫处理,分别于0、1和24 h收集全株植物,用锡箔纸包裹后放入液氮冷冻处理20 min,然后迅速放入-80 ℃冰箱保存。
1.3 基因克隆策略
分别以玉米ZmWRKY21蛋白氨基酸序列(NP_001147091.1)和谷子SiWRKY64蛋白氨基酸序列(XP_004978524.1)在Phytozome V11.0网站通过Blast获得高粱基因的cDNA序列和编码蛋白序列。进一步通过SMART(http://smart.embl-heidelberg. de/)在线预测蛋白是否包含WRKY结构域。
1.4 总RNA提取及cDNA合成
按照RNA提取试剂盒的操作步骤进行总RNA提取,提取的总RNA经1.5 %琼脂糖凝胶电泳检测,以检测合格的总RNA为模板,按照cDNA第1链反转录试剂盒操作步骤反转录成cDNA第1链,用于基因克隆试验和qRT-PCR试验。
1.5 引物设计和RT-PCR克隆
为克隆全长cDNA序列,使用Primer 3引物设计工具(http://primer3.ut.ee)在基因的完整阅读框两侧设计巢式引物(表1)。实验步骤、PCR反应体系和PCR反应程序参考徐磊的方法[16]并稍作修改,具体如下:引物C1用于第1轮PCR扩增反应,引物C2用于第2轮PCR反应。以cDNA为模板扩增基因的ORF(Open reading frame,ORF);反应体系(10 μl):cDNA 1 μl,上游引物、下游引物各0.5 μl,2× EasyTaqPCR Super Mix 5 μl,补ddH2O至10 μl;PCR反应程序:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 45 s,72 ℃ 2 min,共34个循环;72 ℃ 10 min,4 ℃保存。PCR产物用1.5 %琼脂糖凝胶电泳检测,目标PCR条带经胶回收、纯化后与PEASY-T1载体连接,然后热击Trans1-T1感受态细胞,恢复培养后涂氨苄平板于37 ℃过夜培养,挑取阳性单克隆摇菌后送上海美吉生物公司测序。
1.6 序列的生物信息学分析
ORF和氨基酸序列分析利用NCBI ORF Finder程序;采用Protparam在线软件分析蛋白理化性质;三级结构预测使用在线SWISS-MODEL数据库;利用NCBI Conserved Domains数据库进行保守结构域分析;多序列比对使用Clustal X 2.1软件[17],然后用MEGA 4.1软件[18-19]采用邻接法构建系统发育树。

表1 基因克隆与表达分析所用引物
1.7 甜高粱WRKY基因的荧光定量表达分析
根据克隆的2条基因cDNA序列设计qPCR引物qSbWRKY1和qSbWRKY2(表1)。内参选择高粱GAPDH基因(XM_002452356)。利用SYBR Green法进行荧光定量表达分析,在ABI 7500实时荧光定量PCR仪上分析[20]。PCR反应体系和PCR扩增程序参考徐磊的方法[16]并稍作修改,具体如下:PCR反应体系(20 μl):cDNA 1 μl,2×TransStart Green qPCR Super Mix 10 μl,上游引物、下游引物各0.5 μl,补ddH2O至20 μl;PCR扩增程序:95 ℃ 2 min;95 ℃ 10 s,60 ℃ 30 s,共35个循环。按照2-ΔΔCT法[21]计算基因在对照组和处理组之间的相对表达值。
2 结果与分析
2.1 甜高粱WRKY基因的克隆与测序
通过Blast比对检索到2个同源性高的高粱基因(Sb01g014180和Sb04g033240 )。Sb01g01418 0CDS全长1059 bp,在CDS两侧设计巢式引物,经RT-PCR扩增、测序(图1),获得1条完整的cDNA序列,该基因cDNA序列全长1086 bp,包含1个1059 bp的开放阅读框,编码352个氨基酸。与高粱

M: Trans2K plus DNA marker; 1: SbWRKY1全长cDNA扩增产物; 2: SbWRKY2全长cDNA扩增产物M: Trans2K plus DNA marker; 1: Full-length cDNA product of SbWRKY1; 2: Full-length cDNA product of SbWRKY2图1 甜高粱SbWRKY1和SbWRKY2基因的PCR扩增产物Fig.1 PCR products of SbWRKY1 and SbWRKY2 genes from sweet sorghum

方框中ATG为起始密码子,*为终止密码子TAG;“WRKYGQK”为WRKY核心序列,“C-X4-5-C-X22-23-H-X1-H”为锌指结构ATG in the box means the initiator codon, * means termination codon TAG; ‘WRKYGQK’ is the core sequence of WRKY, ‘ C-X4-5-C-X22-23-H-X1-H’ is zinc finger structure model图2 甜高粱SbWRKY1cDNA序列及推导的氨基酸序列Fig.2 SbWRKY1 cDNA sequences and deduced amino acid sequences from sweet sorghum
Sb01g014180基因相比,编码区有6个核苷酸突变(269 A-G; 424 T-C; 428 C-T; 458 G-A; 828 T-C; 938 T-C),5个氨基酸发生突变(90 Q-R; 122 S-P; 123 A-V; 153 R-Q; 313 V-A),命名为SbWRKY1(图2)。
Sb04g033240 CDS全长717 bp,经RT-PCR扩增、测序(图1),该基因cDNA全长750 bp,包含1个717 bp的开放阅读框,编码238个氨基酸(图3)。与高粱Sb04g033240基因相比,3个核苷酸发生突变(476 A-T; 486 C-T; 592 T-C),2个氨基酸发生突变(159 Y-F; 198 S-P),命名为SbWRKY2。2个基因编码的蛋白序列均具有典型的WRKY核心序列“WRKYGQK” 和“C-X4-5-C-X22-23-H-X1-H”锌指结构模型。表明克隆的2条基因为WRKY基因(图3)。
2.2 SbWRKY1和SbWRKY2蛋白理化性质和蛋白三级结构预测
蛋白理化性质分析表明:SbWRKY1蛋白分子式为C1628H2619N509O504S16,预测蛋白质分子量为37.89 kDa,等电点(PI)为9.78;包含20种常见氨基酸,含量最高的氨基酸为Ser(12.2 %),最低的是Trp(0.3 %);不稳定指数为49.15,为不稳定蛋白;疏水性 GRAVY值为-0.580,为亲水性蛋白。SbWRKY2蛋白分子式为C1131H1752N326O344S21,预测蛋白质分子量为26.09 kDa,等电点(PI)为8.43;包含20种常见氨基酸,含量最高的为Ser(8.8 %)和Gly(8.8 %),最低的是Ile(0.8 %);不稳定指数为53.87,为不稳定蛋白;疏水性 GRAVY值为-0.455,为亲水性蛋白。预测的蛋白三级结构表明(图4),SbWRKY1基因编码蛋白与数据库2ayd.1.A蛋白匹配,两者序列相似性为57.97 %,GMQE值为0.12,QMEAN4值为-1.86。SbWRKY2基因编码蛋白也与2ayd.1.A蛋白匹配,两者序列相似性为50.67 %,GMQE值为0.19,QMEAN4值为-1.79。
2.3 SbWRKY1和SbWRKY2蛋白保守结构域预测
对2条基因编码蛋白进行蛋白保守结构域预测分析,2个蛋白都包含1个典型的WRKY结构域(图5)。
2.4 SbWRKY1和SbWRKY2基因的表达特征分析
以高粱GAPDH基因作内参,采用荧光定量PCR分析干旱胁迫条件下2条WRKY基因的表达,与 0 h表达量相比,干旱处理1、24 h均上调表达,随着干旱胁迫时间延长,基因相对表达量持续增加(图6)。SbWRKY1和SbWRKY2表达趋势一致。

方框中ATG为起始密码子,*为终止密码子TGA;“WRKYGQK”为WRKY核心序列,C-X4-5-C-X22-23-H-X1-H为锌指结构ATG in the box means the initiator codon, * means termination codon TGA; ‘WRKYGQK’ is the core sequence of WRKY, ‘C-X4-5-C-X22-23-H-X1-H’ is zinc finger structure model图3 甜高粱SbWRKY2cDNA序列及推导的氨基酸序列Fig.3 SbWRKY2 cDNA sequences and deduced amino acid sequences from sweet sorghum
2.5 WRKY蛋白进化树分析
通过NCBI Blast P工具比对分析,下载与SbWRKY1和SbWRKY2蛋白序列相似性高的蛋白序列,SbWRKY1蛋白与高粱(Sorghumbicolor)、玉米(Zeamays)、谷子(Setariaitalica)、节节麦(Aegilopstauschii)、短柄草(Brachypodiumdistachyon)、大麦(Hordeumvulgaresubsp.Vulgare)和小麦(Triticumaestivum)蛋白相似性分别为99 %、90 %、90 %、81 %。83 %、80 %和80 %。SbWRKY2蛋白与高粱、芒草(Miscanthuslutarioriparius)、谷子、玉米、短柄草、短花药野生稻(Oryzabrachyantha)和小麦蛋白相似性分别为99 %、86 %、84 %、82 %、69 %、68
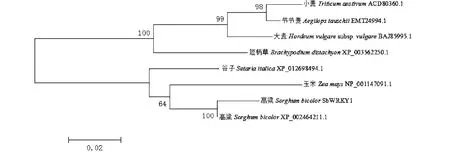
图7 SbWRKY1蛋白与其他WRKY蛋白系统发生树Fig.7 Phylogenetic tree of SbWRKY1 protein and other WRKY proteins
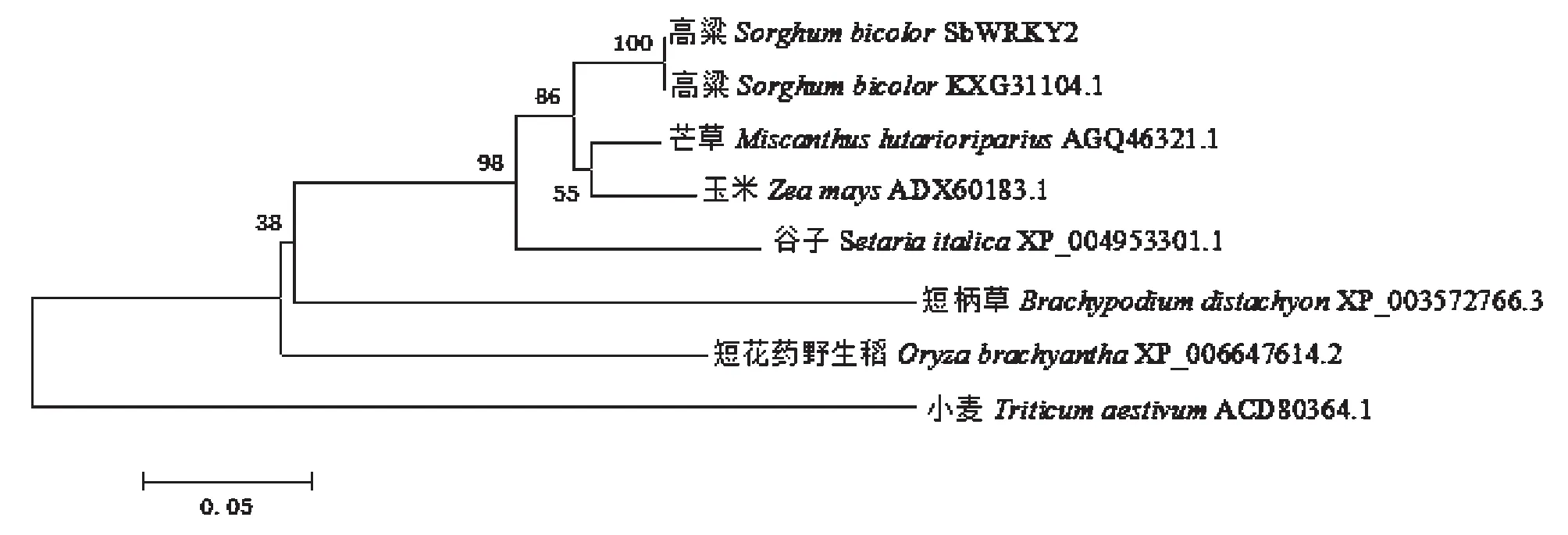
图8 SbWRKY2蛋白与其他WRKY蛋白系统发生树Fig.8 Phylogenetic tree of SbWRKY2 protein and other WRKY proteins
和60 %。利用Mega 4.1软件,采用邻接法构建分子进化树(Bootstrap值设为1000次),由图7可知,甜高粱SbWRKY1蛋白与高粱、玉米和谷子WRKY蛋白聚为一类。 甜高粱SbWRKY2蛋白与高粱、芒草和玉米WRKY蛋白聚为一类。SbWRKY1蛋白和SbWRKY2蛋白均与高粱WRKY蛋白亲缘关系最近(图8)。
3 讨论与结论
本研究基于已知玉米和谷子WRKY蛋白氨基酸序列,通过Blast比对分析,以高粱基因cDNA序列为模板,设计跨编码区的巢式引物,通过RT-PCR验证,在甜高粱中成功克隆到2个WRKY基因。SbWRKY1 cDNA全长1059 bp,编码352个氨基酸。SbWRKY2 cDNA全长750 bp,编码238个氨基酸。蛋白保守结构域预测表明,预测的SbWRKY1和SbWRKY2蛋白均具有WRKY保守结构域。
随着基因组测序与注释工作不断完善,有利于在参考基因组物种中克隆目标基因,目前,高粱基因组注释版本已更新至V3.1。为成功克隆目标基因,本研究设计了特异性较强的巢式引物进行PCR扩增,成功获得2条目标基因。尽管WRKY结构域的核心序列“WRKYGQK”是高度保守的,但水稻有19个WRKY基因编码的核心序列发生变异,类型为:WRKYGEK、WRKYGKK、WRICGQK、WRMCGQK、WKKYGQK、WIKYGQK、WKRYGQK、WSKYEQK和WRKYSEK[22]。本研究克隆的2条WRKY基因均具有保守的“WRKYGQK”7肽序列,没有发生序列变异。前人研究标明,WRKY基因参与干旱、高盐和高温等非生物胁迫调控进程。水稻OsWRKY11基因受干旱和高温胁迫诱导表达,过表达试验证明该基因能够提高转基因植株的耐旱和耐高温抗性[23]。在马铃薯中过表达辣椒CaWRKY1基因,可增强转基因马铃薯植株的耐旱性[24]。羊草LcWRKY5基因受干旱胁迫和盐胁迫诱导表达,进一步通过拟南芥转基因试验证明该基因能够增强植株耐失水胁迫压力[25]。本研究克隆的SbWRKY1和SbWRKY2基因在干旱胁迫条件下呈上调表达特征,这与OsWRKY11和LcWRKY5的表达模式类似,推测这2条基因在应对干旱胁迫中可能发挥一定作用。
[1]Yang Z R, Wang X C, Li X M, et al. Advance on the study of transcription fators in higher plants[J]. Hereditas (Beijing), 2004, 26(3): 403-408.
[2]李 洁. 植物转录因子与基因调控[J]. 生物学通报, 2004, 39(3):9-10.
[3]Eulgem T, Rushton P J, Robatzek S, et al. The WRKY superfamily of plant transcription factors[J]. Trends in Plant Science, 2000, 5(5): 199-206.
[4]Ulker B, Somssich I E. WRKY transcription factors: from DNA binding towards biological function[J]. Current Opinion in Plant Biology, 2004, 7(5): 491-498.
[5]Agarwal P, Reddy M P, Chikara J. WRKY: its structure, evolutionary relationship, DNA-binding selectivity, role in stress tolerance and development of plants[J]. Molecular Biology Reports, 2011, 38(6): 3883-3896.
[6]Ishiguro S, Nakamura K. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizes SP8 sequences in the 5’ upstream regions of genes coding for sporamin and β-amylase from sweet potato[J]. Molecular Genetics and Genomics, 1994, 244(6): 563-571.
[7]江 腾,林勇祥,刘 雪,等. 苜蓿全基因组WRKY转录因子基因的分析[J]. 草业学报, 2011, 20(3): 211-218.
[8]Ryu H S, Han M H, Lee S K, et al. A comprehensive expression analysis of theWRKYgene superfamily in rice plants during defense response[J]. Plant Cell Reports, 2006, 25(8): 836-847.
[9]Ling J, Jiang W J, Zhang Y, et al. Genome-wide analysis ofWRKYgene family inCucumissativus[J]. BMC Genomics, 2011, 12(1): 1-20.
[10]Li J, Wang J, Wang N, et al.GhWRKY44, a WRKY transcription factor of cotton, mediates defense responses to pathogen infection in transgenicNicotianabenthamianas[J]. Plant Cell, Tissue Organ Culture, 2015, 121(1): 127-140.
[11]Dong J X, Chen C H, Chen Z X. Expression profiles of theArabidopsisWRKY gene superfamily during plant defense response[J]. Plant Molecular Biology, 2003, 51(1): 21-37.
[12]Guo R Y, Yu F F, Gao Z, et al.GhWRKY3, a novel cotton (GossypiumhirsutumL.) WRKY gene, is involved in diverse stress responses[J]. Molecular Biology Reports, 2011, 38(1): 49-58.
[13]张 娟. WRKY转录因子功能研究进展[J]. 西北植物学报,2009,29(10):2137-2145.
[14]张苏江,艾买尔江·吾斯曼,薛兴中,等. 南疆玉米和不同糖分甜高粱的青贮品质分析[J]. 草业学报,2014,23(3):232-240.
[15]段有厚,邹剑秋,卢 峰. 高粱抗旱机理及保苗技术[J]. 杂粮作物,2009,29(1):25-27.
[16]徐 磊,姚艳丽,胡小文,等. 甘蔗谷胱甘肽硫转移酶基因SoGST-1a的克隆与表达分析[J]. 中国农学通报,2015,31(26):71-77.
[17]Larkin M A, Blackshields G, Brown N P, et al. Clustal W and Clustal X version 2.0[J]. Bioinformatics, 2007, 23(21): 2947-2948.
[18]Tamura K, Dudley J, Nei M, et al. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599.
[19]王艳芳,赵彦宏,刘林德,等.玉米MIR166基因家族的进化与功能研究[J].南方农业学报,2015,46(8):1345-1349.
[20]王 盛,谢芝勋,谢丽基,等.转基因烟草中外源基因实时荧光定量PCR检测方法的建立[J].南方农业学报,2015,46(5):745-749.
[21]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J]. Methods, 2001, 25(4): 402-408.
[22]Zhang Y J, Wang L J. The WRKY transcription factor superfamily: its origin in eukaryotes and expansion in plants[J]. BMC Evolutionary Biology, 2005, 5(1): 1-12.
[23]Wu X L, Shiroto Y, Kishitani S, et al. Enhanced heat and drought tolerance in transgenic rice seedlings overexpressingOsWRKY11 under the control ofHSP101 promoter[J]. Plant Cell Reports, 2009, 28(1): 21-30.
[24]Moon S J, Han S H, Kim D Y, et al. Ectopic expression ofCaWRKY1, a Pepper transcription factor, enhances drought tolerance in transgenic potato plants[J]. Journal of Plant Biology, 2014, 57(3): 198-207.
[25]Ma T, Li M L, Zhao A G, et al.LcWRKY5: an unknown function gene from sheepgrass improves drought tolerance in transgenicArabidopsis[J]. Plant Cell Reports, 2014, 33(9): 1507-1518.
(责任编辑 陈 虹)
CloningandExpressionAnalysisofWRKYTranscriptionFactorGeneinSweetSorghum
XU Lei, HU Xiao-wen, YAO Yan-li, XING Shu-lian, LIU Yang*
(Guangdong Engineering Technology Research Center for Dryland Water-saving Agriculture, Zhanjiang Experiment Station , Chinese Academy of Tropical Agricultural Sciences, Guangdong Zhanjiang 524013, China)
【Objective】The objective of this study was to cloneWRKYgenes from sweet sorghum and analyzed their sequence characteristics and expression patterns, which would provided the source of gene in sweet sorghum breeding for drought resistance.【Method】Taken seedlings RNA of sweet sorghum cultivar M81-E as tested materials,WRKYgenes from sweet sorghum by RT-PCR were cloned, their characteristics of sequences with bioinformatics softwares and their expression patterns by real-time PCR were analyzed, and twoWRKYgenes from sweet sorghum were cloned, which were namedSbWRKY1 (Genebank accession number: KY231904) andSbWRKY2 (Genebank accession number: KY231905). 【Result】The cDNA full length ofSbWRKY1 was 1086 bp with a 1059 bp open reading frame, which encoded 352 amino acids. The cDNA full length ofSbWRKY2 was 750 bp with a 717 bp open reading frame, which encoded 238 amino acids. The two genes encoding proteins had WRKY core sequence ‘WRKYGQK’ and zinc finger structure model ‘C-X4-5-C-X22-23 -H-X1-H’. The predicted protein molecular formula of SbWRKY1 was C1628H2619N509O504S16, the molecular mass was 37.89 kDa, and the PI was 9.78. The predicted protein molecular formula of SbWRKY2 was C1131H1752N326O344S21, the molecular mass was 26.09 kDa, and the PI was 8.43. Phylogenetic analysis indicated that SbWRKY1 protein was close to WRKY proteins ofSorghumbicolor,ZeamaysandSetariaitalica, and SbWRKY2 protein was close to WRKY proteins ofSorghumbicolor,MiscanthuslutarioripariusandZeamays. Real-time PCR results showed that theSbWRKY1 andSbWRKY2 gene were up-regulated expression with the time of drought stress. 【Conclusion】These results demonstrated thatSbWRKY1 andSbWRKY2 might play a role in response to drought stress in sweet sorghum.
Sweet sorghum; Transcription factor; WRKY; RT-PCR
S514.03;Q943
A
1001-4829(2017)11-2429-07
10.16213/j.cnki.scjas.2017.11.007
2016-11-15
中国热带农业科学院湛江实验站科研启动专项资金项目(zjky201504);中国热带农业科学院基本科研业务费专项资金项目(17CXTD-07)
徐 磊(1984-),男,河南信阳人,硕士,主要从事作物品种改良,E-mail:xulei00100@163.com,Tel:0759-2161106,*为通讯作者:刘 洋,E-mail:lyfull@163.com。

