不同种源马尾松幼苗对低磷胁迫的生理响应
, ,, ,
(贵州大学 a.农业生物工程研究院,山地植物资源保护与种质创新省部共建教育部重点实验室, 山地生态与农业生物工程协同创新中心; b.林学院, 贵阳 550025)
不同种源马尾松幼苗对低磷胁迫的生理响应
乔光a,崔博文a,b,文晓鹏a,丁贵杰b
(贵州大学 a.农业生物工程研究院,山地植物资源保护与种质创新省部共建教育部重点实验室, 山地生态与农业生物工程协同创新中心; b.林学院, 贵阳 550025)
对四川眉山(SM)、贵州孟关(GM)、广西桐棉(GT)、福建龙岩(FL)、福建武平(FW)、江西崇义(JC)及湖南汝城(HR)等7个种源的马尾松幼苗在轻度、中度和重度低磷胁迫下生理生化响应进行了研究。结果表明,在低磷胁迫下,不同种源马尾松幼苗叶绿素(a+b)含量呈下降趋势,其中FW下降幅度最大(65.0%),FL降幅最小(20.5%),而类胡萝卜素含量在低磷胁迫下变化较小;随低磷胁迫程度的增加,整体上马尾松幼苗可溶性糖含量逐渐增加,可溶性蛋白含量逐渐减少,游离脯氨酸含量则变化较复杂。其中,在重度低磷胁迫下,GT可溶性糖含量增加最大,较对照增加了38.9%,GM种源可溶性蛋白含量降幅最大,降低了49.5%,FW种源脯氨酸含量增加最大,为对照处理的3.5倍;MDA含量、POD、SOD及CAT活性等均在低磷胁迫下呈上升趋势,其中,SM种质在不同低磷胁迫间MDA含量无显著差异。除GT、JC及HR外,其余种源马尾松在轻度和中度低磷胁迫下根系活力上升。以上结果表明,马尾松通过降低叶绿素和可溶性蛋白含量以及根系活力,增加MDA、可溶性糖和游离脯氨酸含量,提高POD、SOD、CAT活性来应对低磷胁迫。
马尾松; 低磷胁迫; 生理响应
马尾松(PinusmassonianaLamb.)具有速生、丰产、综合利用程度高等特性,是我国主要工业用材树种之一,业已成为南方造林的先锋树种[1]。南方土壤肥力偏低,土壤中磷多以难溶性闭蓄态形式存在而被固定,有效磷含量极低[2],现有马尾松品种在地力衰退、缺磷少氮的林地上应用难以达到预期效果[3]。作为南方优势用材树种,马尾松在漫长的进化历程中,孕育了丰富的遗传多样性资源[4],使得不同种源种质对施用磷肥反应式样差异较大。因此,筛选马尾松耐低磷种源是解决低磷问题最根本、有效的途径和方法。谢钰容等[5-7]较早从事马尾松种源磷效率研究,分别从磷素吸收动力学参数、根系有机酸分泌物特征,以及对磷肥反应的APase活性与分泌APase活性特征等方面开展工作。周志春等[2]研究了根际对土壤磷活化和有效磷富集能力,筛选出福建武平和广东信宜2种源马尾松为耐低磷种质。秦晓佳等[8]研究了低磷胁迫对3个种源马尾松幼苗形态、生理生化方面的影响,筛选出贵州孟关种源较耐低磷胁迫。本课题组在开展的马尾松耐低磷胁迫分子机理研究中,在前人研究基础上,选取了7个种源的马尾松种质进行低磷胁迫试验,从生长发育方面筛选出较耐低磷种质及低磷耐性评价的生长指标[4],并研究了不同种源马尾松在低磷胁迫下的生理响应,以期为马尾松优良耐低磷种质的培育和筛选提供理论依据,同时为解析马尾松低磷适应性的分子机理奠定基础。
1 材料与方法
1.1 材 料
综合前人研究结果,选择了7个低磷胁迫下表现不同的马尾松种源:四川眉山(SM)、贵州孟关(GM)、广西桐棉(GT)、福建龙岩(FL)、福建武平(FW)、江西崇义(JC)及湖南汝城(HR)。这些种源代表不同地理气候,其中年均温最高为GT(22.1 ℃),最低为GM(15.3 ℃);年降水量JC最高,达1 739.4 mm,GM和GT最低,为1 200 mm;无霜期在270~350 d之间。
1.2 处理方法
分别选取7个种源的饱满种子,清洗干净,经灭菌催芽后,点播于育苗盘中(石英砂为基质,珍珠岩为覆土)。出苗后第35天,选取长势一致的健壮幼苗移栽至装有珍珠岩的塑料花盆中,浇灌营养液使其恢复生长,5 d后开始进行胁迫处理。按照种源与磷浓度2因素完全随机区组设计试验,共设计重度低磷(P 1)、中度低磷(P 2)、轻度低磷(P 3)和中磷(ck)4个P浓度,通过营养液实施胁迫处理。参照秦晓佳等[8]的方法,营养液配方参照Hoagland营养液和阿农微量元素营养液略加修改而成,P由KH2PO4提供,4个处理P浓度分别为0.5,2.0,4.0 mg/L和 10 mg/L(ck),其他元素控制在同一正常供应水平,每3 d浇1次营养液,约15 mL。处理在人工气候箱中进行,光照时间10 h/d,昼夜温度分别为22 ℃和18 ℃,湿度75%,每处理10株苗,重复3次。
1.3 测定方法
胁迫处理60 d后,剪取松针及根系用于生理生化指标的测定。叶绿素采用乙醇提取法测定[9];可溶性糖含量和可溶性蛋白(SP)含量分别采用蒽酮比色法和考马斯亮蓝G-250染料结合法[10];游离辅氨酸(Pro)的测定采用酸性水合茚三酮显色法[11];丙二醛含量的测定采用硫代巴比妥酸(TBA)法[12];超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性的测定分别采用氯化硝基氮兰四唑(NBT)光还原法、愈创木酚氧化比色法和紫外吸收法[10];根系活力测定采用α-萘胺氧化法[13]。
1.4 数据处理方法
试验数据采用Excel 2010和SPSS 20.0统计分析软件进行处理,用t检验分析处理间的差异,用Duncan法分析种源间差异。
2 结果与分析
2.1 低磷胁迫对光合色素的影响
叶绿素是光能吸收、传递和转换的一种最重要的色素,其代谢水平与植物种质及环境条件有关。由表1可以看出,低磷环境下,叶绿素a、叶绿素b及叶绿素(a+b)变化趋势相似,随低磷胁迫的增加,不同程度的表现出下降趋势,在重度低磷胁迫下,FW种源下降幅度最大,与对照处理相比,叶绿素a下降了62.0%,叶绿素b下降了73.6%,叶绿素(a+b)下降了65.0%;FL种源下降幅度最小,与对照处理相比,叶绿素a下降了18.7%,叶绿素b下降了27.2%,叶绿素(a+b)下降了20.5%。各种源类胡萝卜素含量在低磷胁迫下变化较小,在重度低磷胁迫下,仅SM、FW、JC和HR种源的降幅达到显著水平。
表1 低磷胁迫对不同种源马尾松光合色素的影响
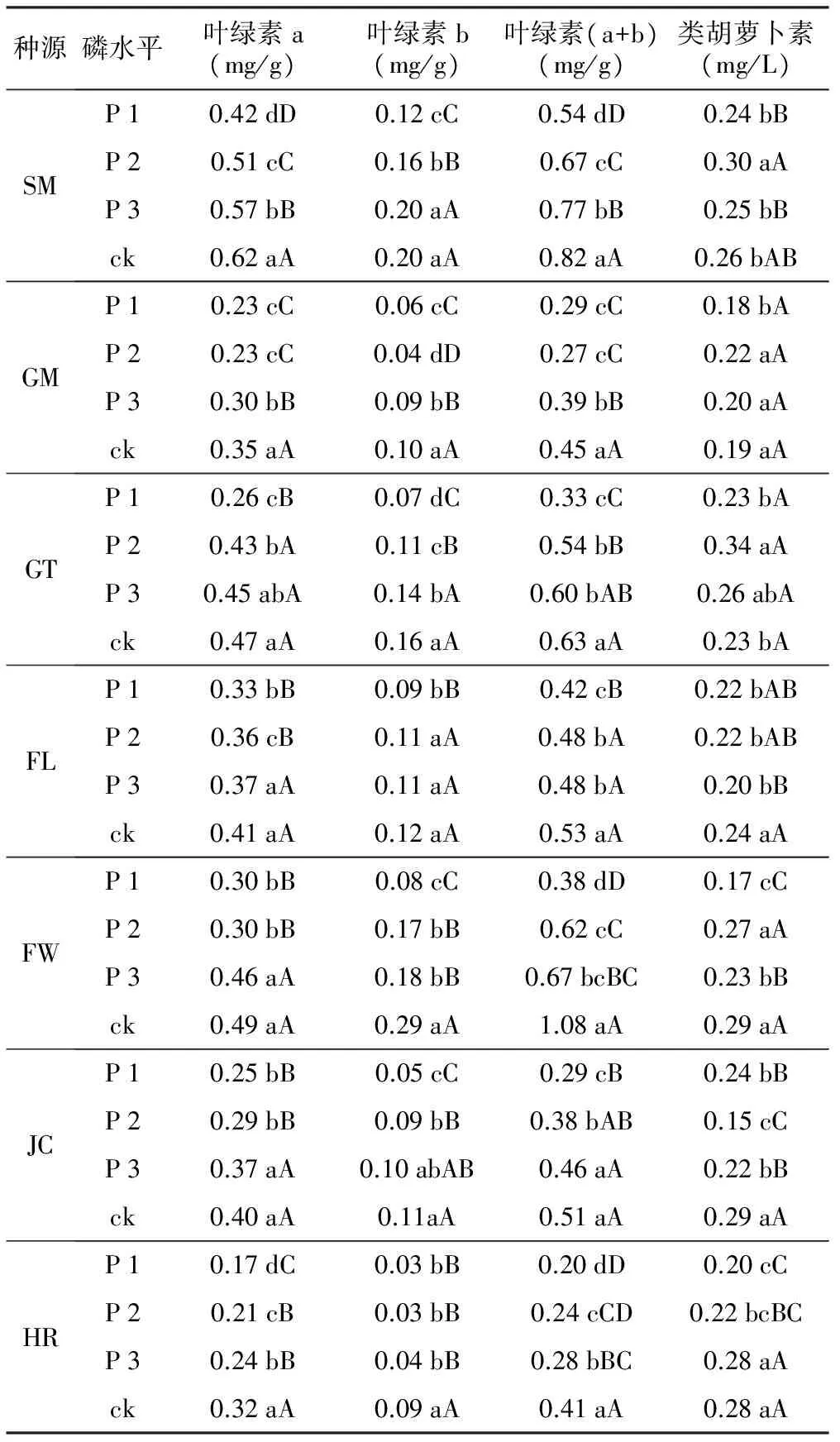
种源磷水平叶绿素a(mg/g)叶绿素b(mg/g)叶绿素(a+b)(mg/g)类胡萝卜素(mg/L)SMP10.42dD0.12cC0.54dD0.24bBP20.51cC0.16bB0.67cC0.30aAP30.57bB0.20aA0.77bB0.25bBck0.62aA0.20aA0.82aA0.26bABGMP10.23cC0.06cC0.29cC0.18bAP20.23cC0.04dD0.27cC0.22aAP30.30bB0.09bB0.39bB0.20aAck0.35aA0.10aA0.45aA0.19aAGTP10.26cB0.07dC0.33cC0.23bAP20.43bA0.11cB0.54bB0.34aAP30.45abA0.14bA0.60bAB0.26abAck0.47aA0.16aA0.63aA0.23bAFLP10.33bB0.09bB0.42cB0.22bABP20.36cB0.11aA0.48bA0.22bABP30.37aA0.11aA0.48bA0.20bBck0.41aA0.12aA0.53aA0.24aAFWP10.30bB0.08cC0.38dD0.17cCP20.30bB0.17bB0.62cC0.27aAP30.46aA0.18bB0.67bcBC0.23bBck0.49aA0.29aA1.08aA0.29aAJCP10.25bB0.05cC0.29cB0.24bBP20.29bB0.09bB0.38bAB0.15cCP30.37aA0.10abAB0.46aA0.22bBck0.40aA0.11aA0.51aA0.29aAHRP10.17dC0.03bB0.20dD0.20cCP20.21cB0.03bB0.24cCD0.22bcBCP30.24bB0.04bB0.28bBC0.28aAck0.32aA0.09aA0.41aA0.28aA
2.2 低磷胁迫对可溶性糖含量的影响
从图1可以看出,不同种源马尾松幼苗在低磷胁迫下可溶性糖积累变化有所差异,GM种源在受到低磷胁迫后可溶性糖含量显著升高,与对照相比,提高范围在21.9%~17.6%之间,低磷处理间无显著差异;GT种源在中度和轻度低磷胁迫下可溶性糖含量并没有显著变化,但在重度低磷胁迫下,其含量显著提高,较对照提高了28.9%;SM、FL和FW种源可溶性糖含量均随低磷胁迫的增加而增加,在重度低磷胁迫下,可溶性糖含量分别较对照提高了26.3%、14.1%和49.9%;HR和JC种源在各低磷胁迫中可溶性糖含量均未发生显著变化。

图1 低磷胁迫下不同种源马尾松幼苗可溶性糖含量
2.3 低磷胁迫对可溶性蛋白含量的影响
不同种源马尾松幼苗可溶性蛋白含量的变化如图2所示。受到低磷胁迫,大部分种源马尾松幼苗可溶性蛋白含量下降,在重度低磷胁迫下,GM种源可溶性蛋白含量降幅最大,较对照降低了49.5%;FL种源马尾松幼苗在受到低磷胁迫后可溶性蛋白含量有所增加,在中度低磷下达到最大;HR种源马尾松幼苗在中度和低度低磷胁迫下可溶性蛋白含量下降,但在重度低磷胁迫下,其含量又有所增加,与对照相比未达显著水平。

图2 低磷胁迫下不同种源马尾松幼苗可溶性蛋白含量
2.4 低磷胁迫对游离脯氨酸含量的影响
由图3可知,低磷胁迫下马尾松幼苗游离脯氨酸含量的变化较复杂,其中FW和HR种源马尾松幼苗游离脯氨酸含量在重度低磷胁迫下达到最大,分别是对照处理的3.5倍和2.1倍;SM种源在中度低磷胁迫下达到最大,是对照处理的1.8倍;GM、FL和JC种源则在轻度低磷胁迫下达到最大,与对照相比分别为1.7倍、2.7倍和1.6倍;GT种源在低磷胁迫下游离脯氨酸含量降低,在中度低磷下降到最低。
2.5 低磷胁迫对丙二醛(MDA)含量的影响
从图4可以看出,不同种源马尾松幼苗在受到低磷胁迫后MDA含量不同程度的增加,尤其在重度低磷胁迫下,MDA含量大幅增加,其中FW种源增加幅度最大,达到对照的2.8倍,HR种源增加幅度最小,是对照的1.6倍,可见,MDA含量积累是马尾松幼苗应答低磷胁迫的主要生理变化。

图3 低磷胁迫下不同种源马尾松幼苗 游离脯氨酸含量的影响
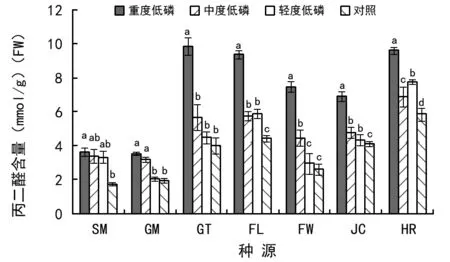
图4 低磷胁迫下不同种源马尾松幼苗丙二醛(MDA)含量
2.6 低磷胁迫对SOD、POD和CAT活性的影响
不同种源马尾松幼苗在低磷胁迫下SOD、POD和CAT活性变化规律较一致,均随低磷胁迫程度的增加而升高(图5)。与对照相比,重度低磷胁迫处理下SOD活性均达到最高,尤其以HR种源增加明显,较正常供磷增加了217.96%,其他6个种源的增幅在50.57%~76.18%之间。不同种源马尾松幼苗POD活性在中度和轻度低磷胁迫下有所增加,但增幅不大;在重度低磷胁迫下,各种源POD活性表现出大幅增加,与对照处理相比,HR种源增幅最大(3.9倍),SM种源增幅最小(1.9倍)。不同程度低磷胁迫下各种源CAT活性略有差异,SM和GM种源在达到中度低磷胁迫后CAT活性才显著提高;中度和低度低磷胁迫下GT和JC种源CAT活性差异较小;重度低磷胁迫下,SM种源CAT活性增幅最大,达对照的1.5倍。
2.7 低磷胁迫对根系活力的影响
由图6 可以看出,缺磷环境下,不同种源马尾松幼苗的根系活力呈现2种变化趋势:GT、JC和HR种源随胁迫程度的增加而显著下降,GT种源下降幅度最大,为对照处理的44.9%;SM、GM、FL和FW种源的根系活力随低磷胁迫程度的增加呈先升后降的趋势,在重度低磷胁迫下,GM、FL和FW种源的根系活力低于对照,但SM种源根系活力仍高于对照。

图5 低磷胁迫下不同种源马尾松幼苗SOD(A)、 POD(B)和CAT(C)活性的影响

图6 低磷胁迫下不同种源马尾松幼苗的根系活力
3 讨论与分析
磷是植物生长发育必需的三大营养元素之一,是生物膜、核酸、蛋白质、磷脂、ATP等重要物质的组成成分,并且以多种方式参与植物体内的物质运输及代谢、信号传导及光合调节等生理过程[14]。研究表明,磷在土壤中移动速度很慢,且只有土壤根系表面的磷才能被植物吸收利用,大部分仍残留于土壤中[15]。植物为了适应磷亏缺的环境,往往会在形态、生理、生化等方面发生一系列的变化。本研究结合前人研究结果,选取对低磷适应能力不同的7个种源的马尾松种质,着重从生理生化的角度探讨马尾松对低磷胁迫的应对机制。
低磷逆境胁迫会影响植物体内多种代谢反应[16],脯氨酸是植物体内氮代谢的中间产物,当植物受到逆境,氮代谢受阻后,体内的脯氨酸含量会积累,严重时影响植株正常生产和发育[17];碳水化合物代谢受阻,会导致糖类积累[18];逆境胁迫可引起植物基因表达变化,使部分蛋白质合成受阻[19]。本研究发现,大部分种源马尾松幼苗在低磷胁迫下均表现出植物可溶性蛋白含量降低,游离脯氨酸和可溶性糖含量提高的现象,其结果与油茶[18]、甜菜[20]、玉米[21]和雷公藤[22]等植物的研究一致,说明马尾松在缺磷时糖类、蛋白质和脂类等物质代谢受阻,三者之间的相互转化平衡受损。
植物在正常代谢中其活性氧的产生和清除处于一个动态平衡的状态,而逆境会导致细胞内活性氧含量上升,植物膜系统遭到破坏。MDA是植物细胞膜脂过氧化的产物之一,其含量的高低在一定程度上反映了膜脂的过氧化水平和膜结构的受害程度[18]。活性氧自由基的积累会刺激植物保护酶(SOD、POD和CAT)系统活性的提高,这些保护酶之间相互协调,且保持稳定平衡态,以此来加快清除自由基。本试验中,低磷胁迫导致马尾松幼苗MDA含量增加,说明细胞膜受到了破坏;同时SOD、POD和CAT活性的增加,说明保护酶系统在受到低磷胁迫后被激活开始发生作用。可见马尾松幼苗中同样存在着自由基含量和保护酶活性的保持动态平衡的低磷生理应答机制[18]。研究还发现,SM种源在3种低磷胁迫时MDA含量变化不显著,原因可能是其保护酶系统作用较大,在受到轻度低磷胁迫时,保护酶系统即开始发挥作用,大量清除自由基,因此在受到中度、甚至重度低磷胁迫时,自由基含量仍较低,使得细胞膜脂过氧化程度较低,MDA含量增加不显著,因此,推测SM种源马尾松为耐低磷种质。
低磷逆境中植物最先感受养分的器官是根系[19],崔博文等研究表明,低磷胁迫下,四川眉山(SM)和福建武平(FW)种源马尾松幼苗表现出根长、根重增加,根冠比加大的特征,为较耐低磷种质[4]。本研究在此试验基础上对马尾松幼苗在低磷逆境下的根系活力进行了测定,发现SM和FW种源在受到中度(P 2)和轻度(P 3)低磷胁迫时,其根系活力较对照升高,且P 2>P 3,当低磷胁迫达到重度时,根系活力才有所下降,其中SM种源根系活力仍高于对照。由此推测,马尾松幼苗根系在一定范围的低磷胁迫下,会促进根系迅速生长,增加根系吸收面积,提高根系活力,以此来提高对土壤磷的吸收能力。
有研究表明,耐低磷研究中磷浓度的选择决定耐低磷筛选的成败,选择压力过大或过小都难以判断种质间差异[23]。为此,本研究设置了重度、中度和轻度低磷3个磷浓度梯度,以减小选择压力对实验结果的影响。植物对低磷的适应机制较复杂,与植物生长发育阶段[22]、低磷胁迫时间长短等均有关系,因此,要想全面准确地研究不同种源马尾松幼苗对低磷胁迫的生理响应,仍需进一步研究。
[1]丁贵杰,吴协保,齐新民,等.马尾松纸浆材林经营模型系统及优化栽培模式研究[J].林业科学,2002,38(5):7-13.
[2]周志春,谢钰容,金国庆,等.马尾松种源对磷肥的遗传反应及根际土壤营养差异[J].林业科学,2003,39(6):62-67.
[3]周志春,谢钰容,金国庆,等.马尾松种源磷效率研究[J].林业科学,2005,41(4):25-30.
[4]崔博文,乔光,范付华,等.基于生长指标筛选耐低磷马尾松幼苗优良种源[J].种子,2017,36(1):63-67.
[5]谢钰容,周志春,金国庆,等.马尾松不同种源P素吸收动力学特征[J].林业科学研究,2003,16(5):548-553.
[6]谢钰容,周志春,金国庆,等.低磷胁迫下马尾松种源根系分泌的主要有机酸研究[J].林业科学研究,2004,17(亚林所所庆专刊):45-49.
[7]谢钰容,周志春,廖国华,等.低磷胁迫下马尾松种源酸性磷酸酶活性差异[J].林业科学,2005,41(3):58-62.
[8]秦晓佳,丁贵杰.低磷胁迫对不同种源马尾松幼苗的影响[J].林业科技,2012,37(3):1-5.
[9]Ni Z,Kim E D,Ha M,et al.Altered circadian rhythms regulate growth vigour in hybrids and allopolyploids.[J].Nature,2009,457(7227):327-331.
[10]张志良.植物生理学实验指导[M].北京:高等教育出版社,1990.
[11]邹琦.植物生理生化实验指导[M].北京:中国农业出版社,1995.
[12]Wen X P,Ban Y,Inoue H,et al.Spermidine levels are implicated in heavy metal tolerance in a spermidine synthase overexpressing transgenic European pear by exerting antioxidant activities.[J].Transgenic Research,2010,19(1):91-103.
[13]Liu J,Wu L,Wei S,et al.Effects of arbuscular mycorrhizal fungi on the growth,nutrient uptake and glycyrrhizin production of licorice (Glycyrrhiza uralensis Fisch)[J].Plant Growth Regulation,2007,52(1):29-39.
[14]林郑和,陈荣冰,郭少平,等.植物对缺磷的生理适应机制研究进展[J].作物杂志,2010(5):5-9.
[15]鲁如坤.中国土壤营养元素概况(氮、磷、钾)[J].土壤学报,1989,26(3):280-286.
[16]杨乾,杨宏羽,刘玉汇,等.马铃薯适应低磷胁迫的生理生化效应[J].分子植物育种,2011,9(2):224-229.
[17]周建朝,林晓坤,王孝纯,等.低磷胁迫对不同基因型甜菜抗性生理特征的效应[J].植物营养与肥料学报,2010,16(6):1 379-1 386.
[18]陈隆升,陈永忠,彭邵锋,等.油茶对低磷胁迫的生理生化效应研究[J].林业科学研究,2010,23(5):782-786.
[19]徐向华,丁贵杰.马尾松适应低磷胁迫的生理生化响应[J].林业科学,2006,42(9):24-28.
[20]李俊,张春雷,秦岭,等.不同磷效率基因型油菜对低磷胁迫的生理响应[J].中国油料作物学报,2010,32(2):222-228.
[21]梁秀兰,林英春,年海,等.低磷胁迫对不同基因型玉米主要生理生化特性的影响[J].作物学报,2005,31(5):667-669.
[22]李键,黄锦湖,洪滔,等.低磷胁迫对雷公藤幼苗叶片生理生化特性的影响[J].植物科学学报,2013,31(3):286-296.
[23]马建华,王玉国,孙毅,等.低磷胁迫对不同品种高粱苗期形态及生理指标的影响[J].植物营养与肥料学报,2013,19(5):1 083-1 091.
Physiological and Biochemical Responses to Low Phosphorus Stress for Different Masson Pine (Pinusmassoniana) Provenances
QIAOGuanga,CUIBowena,b,WENXiaopenga,DINGGuijieb
(a.Key Laboratory of Plant Resource Conservation and Germplasm Innovation in Mountainous Region (Ministry of Education),Institute of Agro-bioengineering,Collabrative Innovation Center for Mountain Ecology & Agro-Bioengineering(CICEAB) Guizhou University; b.College of Forestry,Guizhou University,Guiyang 550025,China)
The physiological and biochemical characteristics in seven different provenances ofPinusmassonianaseedlings under mild,moderate and severe low-phosphorous stress were studied in the current work.Results showed that the content of chlorophyll (a+b) from different provenances decreased under low-phosphorous conditions,with the largest decline of 65% in Fujian Wuping (FW) and lowest of 25% in Fujian Longyan (FL),while slightly changes in the content of carotenoid.With the increase of low-phosphorous stress,the content of soluble sugar increased but the soluble protein decreased gradually inPinusmassonianaseedlings.However,complicated changes were found in the content of free proline,among which,the soluble sugar content of Guangxi Tongmian (GT) increased 38.9% compared to the control,and the content of soluble protein in Guizhou Mengguan (GM) decreased mostly by 49.5%,the content of proline in FW increased as 3.5 times as the control.Furthermore,the content of MDA and activities of POD,SOD as well as CAT increased under low-phosphorus stress,and no significant difference existed in the content of MDA in Sichuan Meishan (SM) as subjected to different low-phosphorous treatments. Besides the Guangxi Tongmian (GT),Jiangxi Chongyi (JC) and Hunan Rucheng (HR),the root activity ofPinusmassonianaseedlings increased under the mild and moderate low-phosphorus stress.Thus,we concluded thatPinusmassonianarespond to low-phosphorus stress by reducing the content of chlorophyll,soluble protein and root activity,increasing the content of MDA,soluble sugar and free proline as well as the activity of POD,SOD,and CAT.
masson pine (Pinusmassoniana); low phosphorus stress;
2017-01-13
贵州省重大专项(20126011-1);“863”计划(2011 AA 10020301)。
乔 光(1981—),男,博士,高级实验师,主要从事森林培育研究;E-mail:13518504594@163.com。
文晓鹏,博士,教授,主要从事林木生物技术与遗传育种研究;E-mail:xpwensc@hotmail.com。
10.16590/j.cnki.1001-4705.2017.08.032
S 791.248
A
1001-4705(2017)08-0032-06
physiological and biochemical responses

