南美白对虾CuZnSOD原核表达及抗体制备
陈晓燕+黄明珠+张妮+刘欢+朱芳芳+熊志伟
摘要:锌铜超氧化物歧化酶(cytoplasmic copper/zinc superoxide dismutase,CuZnSOD)是超氧化物歧化酶家族的一种,超氧化物歧化酶在动植物的抗氧化和免疫功能中扮演着重要的角色。本研究将南美白对虾胞外CuZnSOD基因与pet32a表达载体连接,转化大肠杆菌BL21,IPTG诱导融合表达,经SDS-PAGE分析表明,融合蛋白主要以包涵体形式存在,分子量约为18 ku。利用Ni柱亲和纯化发酵产物,得到较单一的蛋白,制备了多克隆抗体。
关键词:胞外CuZnSOD;原核表达;纯化;组织分布
中图分类号: S917 文献标志码: A 文章编号:1002-1302(2017)20-0193-03
南美白对虾是当今世界水产养殖产量最高的三大蝦类之一。近年来,日益严重的南美白对虾病害,已对某些区域造成了毁灭性的打击,随着我国南美白对虾养殖业的进一步扩大,病原体的变异、新型病原的出现、病害的防控形势不容乐观[1]。南美白对虾病害主要有红体病(又称“桃拉综合症”)、蜕壳综合症、固着类纤毛虫病、白斑病、黑鳃病、弧菌病、亚硫酸盐中毒症、应激性反应[2]。其中弧菌病最为猖獗,近年我国的对虾养殖业特别是华南地区的对虾养殖领域遭受到严重的病害肆虐,发病率及排塘率都在50%以上,个别甚至达到90%。整个疫情中弧菌贯彻始终[3]。
机体在对抗病害、重金属、环境等因素胁迫时,会导致负氧离子等氧化自由基(ROS)的产生[4-5],高浓度的氧化自由基会导致细胞损伤甚至是细胞死亡[6]。高浓度氧化自由基的消除需要依靠包括超氧化物歧化酶(SOD)在内的抗氧化酶系统,SOD能将体内有毒的负氧离子歧化为无毒的氧分子和较低毒性的过氧化氢分子[7]。锌铜超氧化物歧化酶(cytoplasmic copper/zinc superoxide dismutase,CuZnSOD)是目前发现的一类主要细胞外的发挥抗氧化作用的抗氧化酶[8]。南美白对虾CuZnSOD在虾体对抗溶藻弧菌和白斑综合症病毒胁迫是扮演着重要的角色[9]。本研究将南美白对虾胞外CuZnSOD基因与pet32a表达载体连接,转化进入大肠杆菌BL21中并成功表达出融合蛋白。融合蛋白分子量约为 18 ku。利用Ni柱亲和纯化发酵产物,制备了多克隆抗体,以期为将来的南美白对虾胞外CuZnSOD的应用和研究提供理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株和载体 大肠杆菌Escherichia coli DH5α、E.coli BL21菌株,原核表达载体pet32a,均由江西科技学院护理学院生理实验室保存,PMD-18T载体购自TaKeRa公司。
1.1.2 试剂 NC膜为Pall Life Science公司产品,Ni NTA填料,Trizol试剂购自Invitrogen公司;弗氏完全佐剂/弗氏不完全佐剂为Sigma公司产品;反转录试剂盒PrimeScriptTM RT reagent Kit、限制性内切酶、T4 DNA连接酶为TaKaRa公司产品;DNA凝胶回收试剂盒、质粒小提试剂盒为Axygen公司产品;预染低分子量蛋白maker为BIO-RAD公司产品;Tryptone,Yeast Extract,peptone为MD Bioscience公司产品;动物蛋白提取试剂盒为上海生工生物有限公司产品;碱性磷酸酶标记山羊抗兔IgG为北京鼎国生物科技有限公司产品。其余为国产分析纯。
1.2 方法
1.2.1 引物设计与合成 根据GenBank上的南美白对虾CuZnSOD基因序列(ADM64316.1)设计包含酶切位点的特异性引物,SODs: 5′-GCGAATTCATGAAGACGTTGGCAACTCT
GCTGGCTGTG-3′(包含EcoRⅠ酶切位点、起始密码子;SODm-x: 5′-GCTCTAGATTAATGATGATGATGATGATGGA
ACCCT CTCTCAGTGATGGTGCAGCAGGC-3′(包含XbaⅠ酶切位点、终止密码子、6×his标签)扩增CuZnSOD开放性阅读框(ORF)。引物由深圳华大基因合成。
1.2.2 南美白对虾肝胰腺RNA提取和cDNA的合成 取肝胰腺液氮冷冻研磨,按照说明书Trizol法提取RNA,按照反转录试剂盒说明书文献[9]合成cDNA。
1.2.3 扩增目的基因 以cDNA为模板,利用设计的特异性引物进行PCR扩增,程序为:95 ℃ 5 min;95 ℃ 30 s,63 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃ 5 min,12 ℃保存。PCR产物跑1%琼脂糖胶电泳,紫外灯下切胶,采用DNA凝胶回收试剂盒进行回收。
1.2.4 鉴定目的片段 将上述回收的DNA片段与PMD-18T载体连接后,转化大肠杆菌DH5α,转化后涂平板,37 ℃培养过夜,挑阳性克隆进行菌液PCR,送上海生工测序。测序正确的载体命名为PMD-18T-SOD。
1.2.5 表达载体构建 用限制性内切酶EcoRⅠ和XbaⅠ对PMD-18T-SOD和pet32a载体进行双酶切,酶切产物跑1%琼脂糖胶电泳,紫外灯下切胶,采用DNA凝胶回收试剂盒进行回收,回收产物按摩尔比1 ∶ 5混合,按比例加入T4 DNA连接酶,4 ℃过夜,转化DH5α,转化后涂平板,37 ℃培养过夜,挑阳性克隆进行菌液PCR,送上海生工测序。测序正确的载体命名为pet32a-SOD。
1.2.6 融合蛋白诱导 将构建的重组表达质粒转化进入BL21,转化后涂平板,37 ℃培养过夜,挑阳性克隆进行菌液PCR验证。验证正确的菌株接种于含100 mmol/L Amp的LB液体培养基中,180 r/min,37 ℃培养至D600 nm为0.4~0.6,加入IPTG,使之终浓度为1 mmol/L,诱导3 h后开始取样,每隔 1 h 取样1次,通过跑SDS-PAG蛋白胶检测蛋白表达情况。endprint
1.2.7 發酵产物纯化 大量发酵后,收集菌体,磷酸缓冲液重悬,在超声波下破碎30 min;8 000 r/min 4 ℃离心15 min,弃上清;用含4 mol/L尿素的缓冲液重新溶解,12 000 r/min 4 ℃ 离心20 min,留上清,0.4 μm滤膜过滤;依照Ni-NAT操作手册进行蛋白纯化[9],跑SDS-PAG蛋白胶检测蛋白纯化情况。
1.2.8 各组织蛋白检测 重组蛋白溶液(含0.5~1.0 mg重组蛋白)加等体积弗氏完全佐剂,用注射器混匀,多点注射于大白兔腹部及腹股沟,每隔7 d免疫1次,免疫4次后,收集血清[9]。根据动物蛋白提取试剂盒提取南美白对虾眼柄、鳃、肝胰腺、肌肉、肠、血细胞和心脏的总蛋白,提取的总蛋白分别用Bradford法[10]测定浓度,血清与虾各组织20 μg总蛋白按照Towbin法[11]做Western Bolt。
2 结果与分析
2.1 目的片段扩增和表达载体构建
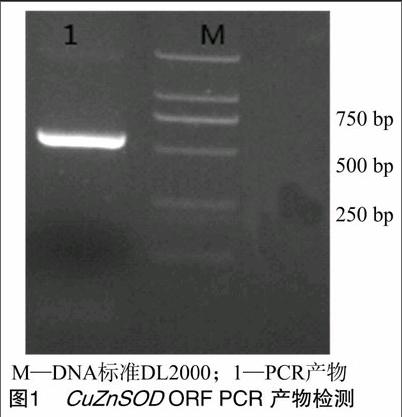
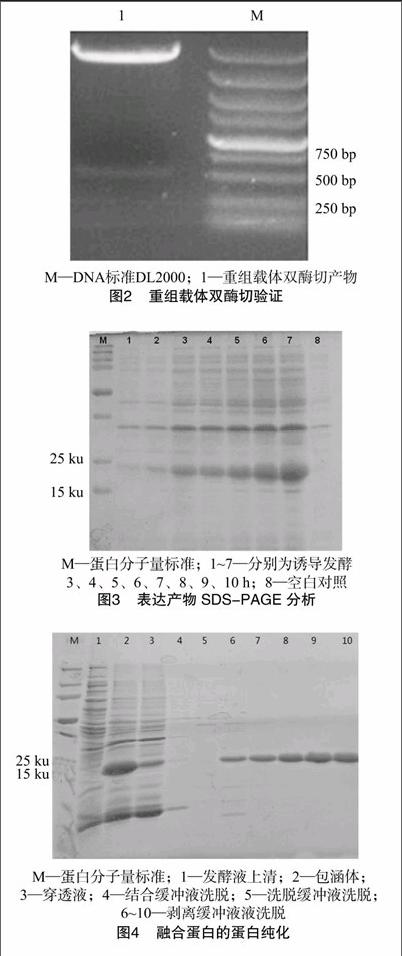
以cDNA为模板扩增目的片段,跑1%琼脂糖凝胶,约 500 bp 处有明显亮带,符合预期大小,经测序证明确为CuZnSOD序列(图1);双酶切连接载体后,转化BL21,扩大培养后,提取质粒,对质粒进行双酶切验证,结果显示有2条亮带,1条为开环pet32a,1条约500 bp大小为目的片段,证实构建表达载体成功(图2)。
2.2 融合蛋白诱导表达及纯化
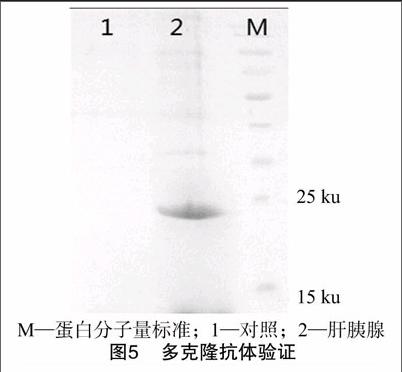
构建好的表达菌株经IPTG诱导表达后,经SDS-PAGE跑胶检测,以加入IPTG之前菌液为空白对照,经IPTG诱导的菌液在18 ku左右有明显条带,与预期大小相符(图3);通过Ni柱纯化后得到较单一条带;由图4可知,发酵液上清没有目的蛋白,目的蛋白以包涵体的形式存在;穿透液中仍有少量目的蛋白没有结合上Ni柱,经结合缓冲液洗掉杂带后,最后通过剥离洗脱液获得较纯的目的蛋白。
2.3 抗体制备及各组织蛋白相对量检测
纯化蛋白免疫新西兰白兔后,取血清,用抗体稀释液与肝胰腺总蛋白进行Western Bolt,结果发现在18 ku左右有明显条带,伴有较多杂带(图5)。
3 讨论
SOD酶活性在水产养殖领域已经被当作动物免疫活性的一项指标[12-15]。目前,对虾中MnSOD有较多研究,胞外CuZnSOD只有在南美白对虾中克隆出基因序列,且CuZnSOD mRNA在血细胞和肠道中表达量最大,在心脏、眼柄和肌肉表达量较少[16]。在虾受到应激时,肌肉颜色变深,在抗氧化防御中起着重要的作用,可能在血液将CuZnSOD蛋白运输至肌肉组织时,发挥抗氧化作用,导致肌肉中mRNA含量低,而蛋白表达量很高。本试验扩增目的片段过程中所用的特异性引物的下游引物SODm-x中直接人为添加6×his 标签和终止密码子,提前终止了表达,这样就能将pet32a载体上自带的分子量较大的GST标签和一些不必要的氨基酸序列连在表达的融合蛋白上,所表达的融合蛋白与源序列更为接近。多克隆抗体具有特异性较低的缺点[17],制备的兔抗南美白对虾胞外CuZnSOD多克隆抗体进行抗体特异性检测时,出现一些杂带,但是目的条带相对较明显,多抗可用于下一步试验。SOD在工业和农业上有大量应用[18],本试验中的南美白对虾胞外CuZnSOD原核表达及产物纯化技术为其在工业及农业的应用打下了坚实的基础。
参考文献:
[1]杨先乐,郑宗林. 南美白对虾病害流行的新动向及其思考[J]. 淡水渔业,2005,35(3):3-6.
[2]何义进. 南美白对虾主要疾病及防控技术[J]. 齐鲁渔业,2004,21(4):40-42.
[3]阮记明,黄建珍,章海鑫,等. 弧菌病,对虾养殖难以回避的话题[J]. 海洋与渔业,2011(4):56-57.
[4]Chanock S J,Benna J,Smith R M,et al. The respiratory burst oxidase[J]. Journal of Biological Chemistry,1994,269:24519-24522.
[5]Muoz M,Cedeo R,Rodríquez J,et al. Measurement of reactive oxygen intermediate production in haemocytes of the penaeid shrimp,Penaeus vannamei[J]. Aquaculture,2000,191:89-107.
[6]Valko M,Leibfritz D,Moncol J,et al. Free radicals and antioxidants in normal physiological functions and human disease[J]. The International Journal of Biochemistry & Cell Biology,2007,39(1):44-84.
[7]Fridovich I. Superoxide radical and superoxide dismutase[J]. Annual Review of Biochemistry,1995,64:97-112.
[8]Nozik-Grayck E,Suliman H B,Piantadosi C A. Extracellular superoxide dismutase[J]. The International Journal of Biochemistry & Cell Biology,2005,37:2466-2471.
[9]Huang M,Liu Y,Xie C,et al. LvDJ-1 plays an important role in resistance against Vibrio alginolyticus in Litopenaeus vannamei[J]. Fish & Shellfish Immunology,2015,44(1):180-186.endprint

