顶空固相微萃取结合气相色谱-三重四极杆质谱法快速测定茶叶中11种酰胺类除草剂残留
李建勋,孙梦园,胡雪艳,吴兴强,常巧英,范春林*
(1.北京工商大学 食品学院,北京 100048;2.中国检验检疫科学研究院,北京 100176;3.河北大学 化学与环境科学学院,河北 保定 071002)
研究简报
顶空固相微萃取结合气相色谱-三重四极杆质谱法快速测定茶叶中11种酰胺类除草剂残留
李建勋1,2,孙梦园2,3,胡雪艳2,吴兴强2,3,常巧英2,范春林2*
(1.北京工商大学 食品学院,北京 100048;2.中国检验检疫科学研究院,北京 100176;3.河北大学 化学与环境科学学院,河北 保定 071002)
利用顶空固相微萃取(HS-SPME)与气相色谱-三重四极杆质谱(GC-MS/MS)联用,建立了快速测定茶叶中11种酰胺类除草剂残留的检测方法。以全发酵红茶为基质,对影响萃取性能的因素(如萃取涂层种类、无机盐种类、水用量、盐用量、萃取温度和萃取时间)进行了优化。在最优条件下,选取绿茶、乌龙茶、红茶和普洱茶4种茶叶基质对方法学进行考察。结果表明,11种酰胺类农药在1~1 000 μg/kg含量范围内线性关系良好,相关系数(r2)为0.992 5~0.999 9,定量下限为1~10 μg/kg。11种农药在红茶、绿茶、乌龙茶和黑茶基质中3个添加水平下的平均回收率分别为70.3%~119.1%、85.2%~118.7%和74.6%~113.3%,相对标准偏差(RSD)均不大于17.4%。该方法操作简单、快速、灵敏度高、重现性好,可满足不同种类茶叶基质中11种酰胺类除草剂农药残留的检测要求。
顶空固相微萃取;气相色谱-三重四极杆质谱法;酰胺类除草剂;茶叶
茶叶以其气味芳香,有益于身心健康的特点,成为全球最受欢迎的饮品之一。茶叶能够改善人体骨骼健康、减少肥胖、预防心脑血管疾病[1],然而在茶叶种植过程中广泛使用各种农药,其中酰胺类除草剂是一类新型高效的触杀型除草剂,具有较高的水溶性和较低的土壤吸附常数,施药后易渗透转移到地表水和浅层地下水中,进而对环境造成污染[2]。乙草胺、丁草胺和异丙甲草胺是目前国内用量最大、最普遍的除草剂[3]。研究发现,酰胺类除草剂能够导致人类淋巴细胞的姐妹染色单体交换[4];长期使用乙草胺对大鼠造成肝肾损伤和抗氧化系统功能障碍,美国环保局将其定为B-2类致癌物质[5-6],认为其可能具有致癌性,但暂无充分证据;丁草胺和异丙甲草胺在细胞体外具有致癌作用,可以加速癌细胞增殖和诱导恶性转变[7]。欧盟国家对茶叶中不同酰胺类除草剂的残留量制定了严格的限量标准,规定茶叶中酰胺类农药的最大残留限量(MRL)为0.05~0.1 mg/kg,我国国标暂未有相应的限量标准。因此,为打破发达国家茶叶贸易技术壁垒,建立简单快速、准确可靠的茶叶中酰胺类除草剂残留的检测方法很有必要。
目前测定酰胺类农药残留量的主要方法有气相色谱-质谱法(GC-MS)[8]、高效液相色谱-质谱法(HPLC-MS)[9]、高效液相色谱-质谱联用法(HPLC-MS/MS)[10]及气相色谱-质谱联用法(GC-MS/MS)[11]等。由于茶叶基质十分复杂,且酰胺类农药在茶叶中的残留量很低,为了能够准确测定,样品的前处理过程尤为关键。茶叶的前处理方法主要有固相萃取(SPE)[12]、加速溶剂萃取(ASE)[13]、固相萃取-分散液液微萃取(SPE-DLLME)[2]等。这些技术需消耗大量的有机溶剂,对环境的污染和操作人员的伤害较大,而且操作过程费时费力,正逐渐被淘汰。固相微萃取(HS-SPME)无需有机溶剂,集萃取、浓缩和进样于一体,自动化程度高,并且具有操作简便、灵活、重现性好和检出限低等特点,已广泛应用于环境、生物和药物分析领域的痕量挥发性有机物检测[14-16]。目前关于利用HS-SPME方法测定茶叶中酰胺类除草剂残留的研究尚未见报道。
本研究将HS-SPME与GC-MS/MS相结合,建立了同时测定茶叶基质中11种酰胺类除草剂残留量的方法。该方法稳定、可靠,灵敏度和自动化程度高,能满足茶叶中酰胺类农药残留量的分析要求。
1 实验部分
1.1 仪器、材料与试剂
Agilent 7890A-7000气相色谱-三重四极杆质谱仪(美国Agilent公司);磁力搅拌器(美国Troemner公司);PL602-L电子天平(瑞士Mettler-Toledo公司);MX-S涡旋搅拌器(美国Scilogex公司);Milli-Q超纯水机(美国Millipore公司);N-EVAP112氮吹浓缩仪(美国Organomation Associates公司)。
二乙烯基苯/碳分子筛/聚二甲基硅氧烷(50/30 μm,DVB/CAR/PDMS)、聚二甲基硅氧烷/二乙烯基苯(65 μm,PDMS/DVB)、碳分子筛/聚二甲基硅氧烷(75 μm,CAR/PDMS)、聚二甲基硅氧烷(100 μm,PDMS) 4种萃取头(美国Supelco公司);SPME萃取手柄(美国Supelco公司);圆柱形磁力搅拌子(6 mm,上海安谱实验科技股份有限公司);茶叶样品均购于北京当地超市。
二丙烯草胺、毒草胺、牧草胺、炔苯酰草胺、乙草胺、溴丁酰草胺、异丙草胺、甲草胺、异丙甲草胺、丁草胺和丙草胺11种标准品(纯度≥95%,德国Dr.Ehrenstorfer公司);氯化钠和无水硫酸钠为分析纯(广东西陇化工股份有限公司);氯化钾为分析纯(美国Sigma公司);氯化镁为分析纯(天津市凯通化学试剂有限公司);甲醇和甲苯为色谱纯(美国Honeywell公司);实验用水为超纯水。
1.2 实验方法
1.2.1色谱-质谱条件色谱柱:Agilent DB-1701(30 m×250 μm×0.25 μm);恒流模式:流速为1.2 mL/min;载气:氦气,99.999%;柱温:初始温度40 ℃保持1 min,以30 ℃/min升至130 ℃,以5 ℃/min升至250 ℃,再以10 ℃/min升至280 ℃,保持5 min;进样口温度:250 ℃;进样方式:不分流进样;溶剂延迟:6 min;EI离子源温度:230 ℃;EI源能量:70 eV;传输线温度:280 ℃;四极杆温度:150 ℃;碰撞气:高纯氮气(99.999%);扫描模式:多重反应监测(MRM)模式。
1.2.2标准溶液的配制单标储备液:分别准确称取约10 mg(精确至0.01 mg)二丙烯草胺、毒草胺、牧草胺、炔苯酰草胺、乙草胺、溴丁酰草胺、异丙草胺、甲草胺、异丙甲草胺、丁草胺和丙草胺标准品于10 mL棕色容量瓶,根据其溶解性,分别用甲醇或甲苯溶解,并用甲醇定容,得到1 mg/mL单标溶液;混标储备液:根据单标储备液浓度计算量取体积,配制成10 mg/L混标溶液。根据相应的添加水平,用甲醇逐级稀释至指定浓度。所有标准溶液均于4 ℃避光保存,待用。
1.2.3HS-SPME操作过程称取1 g茶叶研磨粉末于40 mL顶空萃取瓶,加入1 g NaCl和5 mL超纯水,放置磁力搅拌子,以四氟乙烯瓶盖封口并置于磁力搅拌台,调节磁子转速为500 r/min。90 ℃水浴预平衡5 min,插入装有65 μm PDMS/DVB萃取头的手动进样器,吸附60 min后,取出萃取头插入气相色谱进样口中,250 ℃解析3 min,进行GC-MS/MS分析。
2 结果与讨论
2.1 质谱采集方法的建立
1 mg/L 单标溶液在50~600m/z范围内运行MS1全扫描,根据所得农药的色谱图和质谱图确定保留时间和特征离子,选择质谱图中丰度较高、m/z较大的离子作为特征离子,并作为MRM方法的前级离子。根据所得的前级离子进行子离子扫描,碰撞电压在5~40 eV 之间,每间隔5 eV 进行一次碰撞,比较在不同碰撞能下所得扫描图,选出两个丰度较高的特征产物离子作为MRM方法的子离子。其中丰度高的子离子用于定量分析,另一子离子用于定性分析。11种农药的信息见表1。
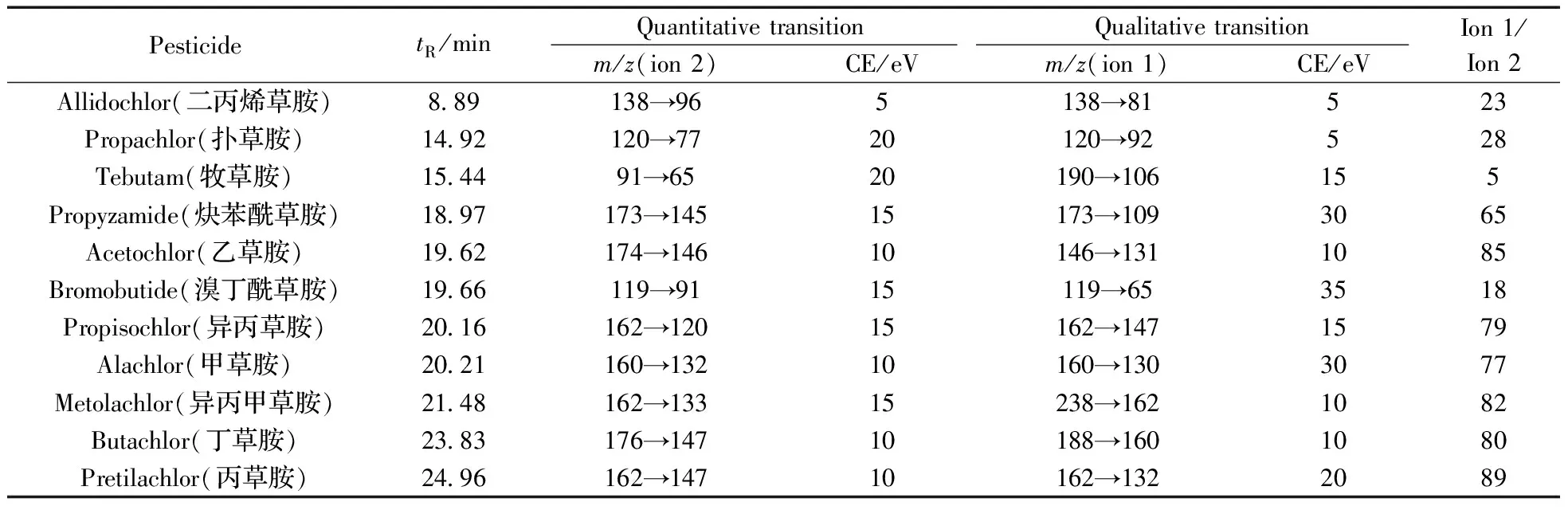
表1 11种酰胺类除草剂的保留时间、定性离子、定量离子、离子丰度比和碰撞能(CE)Table 1 Retention time,qualitative transition(ion 1),quantitative transition(ion 2),ion 1/ion 2 ratio and collision energy(CE) for 11 amide herbicides
2.2 HS-SPME条件优化
选取不含任何农药的红茶作为空白基质,添加11种含量为100 μg/kg的酰胺类除草剂,对影响HS-SPME的重要因素进行优化。
2.2.1SPME萃取涂层的选择选取合适的萃取涂层是HS-SPME优化的重要步骤,涂层的性质能够影响特定极性和挥发性目标分析物的萃取效率[17]。实验选取4种适合痕量挥发性成分分析的商业HS-SPME萃取头,即50/30 μm DVB/CAR/PDMS、65 μm PDMS/DVB、75 μm CAR/PDMS和100 μm PDMS萃取头,对其灵敏度和重复性进行对比。11种酰胺类除草剂的灵敏度通过“积累峰面积标准化值”[18]进行考察,即通过计算每个萃取头萃取的化合物在仪器上的峰面积绝对响应值来综合评价4种萃取头的萃取能力,计算公式如下:
AVK=[AK(100)+AK(75)+AK(65)+AK(50/30)]/4
NAK(X)=AK(X)/AVK
式中,K指任意一种酰胺类化合物;X指100 μm PDMS,75 μm CAR/PDMS,65 μm PDMS/DVB,和50/30 μm DVB/CAR/PDMS 4种萃取头的任意一个;AVK指4种萃取头萃取酰胺类化合物“K”的峰面积平均值;AK(X)指萃取头“X”萃取酰胺类化合物“K”的绝对峰面积;NAK(X)指萃取头“X”萃取酰胺类化合物“K”的峰面积标准化值;CA11(X)指萃取头“X”萃取11种酰胺类化合物的峰面积标准化值。
结果显示,65 μm PDMS/DVB萃取头对11种酰胺类化合物的萃取灵敏度最高,表现为对每一种化合物都有较高的峰面积标准化值,同时,该萃取头对11种酰胺类化合物的积累峰面积标准化值也远高于其他3种萃取头,表现出最高的萃取效率。而其他3种萃取头对11种酰胺类化合物的萃取效率相差不大。
对于重复性的考察,通过每个萃取头做5个平行实验,求化合物峰面积的相对标准偏差(RSD),然后对每个萃取头求11种化合物RSD的平均值和标准偏差。平均值作为萃取头的重复性评价指标,标准偏差作为萃取头萃取不同化合物RSD值的变异性评价指标。实验结果表明,65 μm PDMS/DVB 萃取头的平均值和标准偏差均最小,说明该萃取头萃取酰胺类化合物的重复性最好,其次是50/30 μm DVB/CAR/PDMS萃取头,而75 μm CAR/PDMS萃取头的重复性最差。综上最终选取65 μm PDMS/DVB萃取头进行后续条件优化。
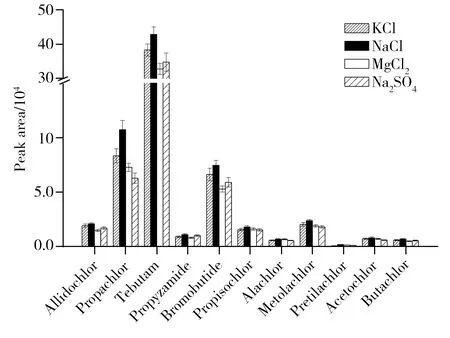
图1 无机盐种类对11种酰胺类除草剂萃取效率的影响Fig.1 Effects of inorganic salt species on extraction efficiency of 11 amide herbicides
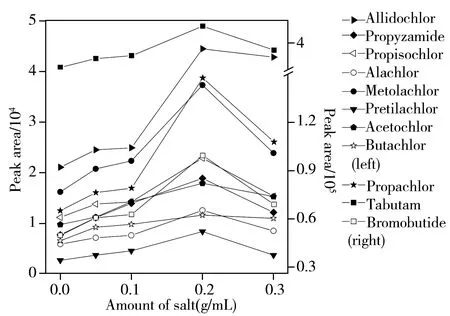
图2 氯化钠用量对11种酰胺类除草剂萃取效率的影响Fig.2 Effects of amount of NaCl on extraction efficiency of 11 amide herbicides
2.2.2无机盐种类的优化无机盐离子的加入可以降低分析物与基质的相互作用,加速分析物从基质向顶空空间的转移,促进萃取头的吸附作用。以65 μm PDMS/DVB萃取头萃取的11种酰胺类除草剂的总峰面积为指标,考察氯化钾、氯化钠、氯化镁和硫酸钠4种无机盐对萃取效率的影响,结果如图1所示。由图1可见,加入氯化钠后65 μm PDMS/DVB萃取头对各酰胺类农药的萃取效率均最高,因此本实验选取加入的无机盐为氯化钠。
2.2.3水用量的优化基质样品中添加适量的水不仅可以促进分析物从基质向顶空空间的转移,同时可加速磁力搅拌器的转动,从而降低平衡时间[19]。本实验在1 g红茶基质中分别加入不同体积(3、4、5、6、7 mL)的超纯水,结果显示,除二丙烯草胺在水添加量为4 mL时萃取头的萃取效率最大外,其他10种酰胺类除草剂均在水添加量为5 mL时萃取效率达到最大值,继续增加超纯水体积时,峰面积呈下降趋势;由于体系中加入过多水后,改变了目标化合物在茶叶基质、顶空空间和萃取纤维头之间的平衡系数,从而降低了萃取效率。由此可见,不同体积水的添加对酰胺类农药的萃取效率有重要影响,本实验选取加入5 mL超纯水。
2.2.4盐用量的优化实验对氯化钠的用量进行了优化,向顶空瓶中加入5 mL超纯水和不同盐水比(0、0.05、0.1、0.2、0.3 g/mL)的氯化钠,考察萃取头对11种农药的萃取效果,结果如图2所示。当加盐量为0.2 g/mL时,萃取头对11种酰胺类除草剂的萃取效率均达到最大值,继续增加盐用量,萃取效率急剧下降。适当加入NaCl可以降低酰胺类除草剂与茶叶基质之间的亲和力,加速其“逸出”基质被萃取头萃取[20];当盐含量过高时,酰胺类除草剂在水中的溶解度减小,但与茶叶基质之间的亲和力增加,不利于目标物的扩散,因此萃取效率降低。本实验选取氯化钠的用量为1 g。
2.2.5萃取温度的优化萃取温度影响分析物的扩散速率,在萃取过程中起重要作用。本实验考察了不同萃取温度(50、60、70、80、90、95 ℃)对11种农药萃取效果的影响,结果显示,萃取温度在50~90 ℃范围变化时,11种酰胺类除草剂的萃取效率逐渐升高当温度超过90 ℃后,萃取效率有所降低。一方面,温度升高,有助于分析物从样品溶液扩散至气相,分析物蒸气压升高,加速了传质过程,提高了萃取效率;另一方面,顶空固相微萃取吸附过程是放热过程,温度过高会降低分配系数,从而降低萃取头的萃取效率。同时,温度过高可能会引起部分农药的降解。因此,本实验选取最佳萃取温度为90 ℃。
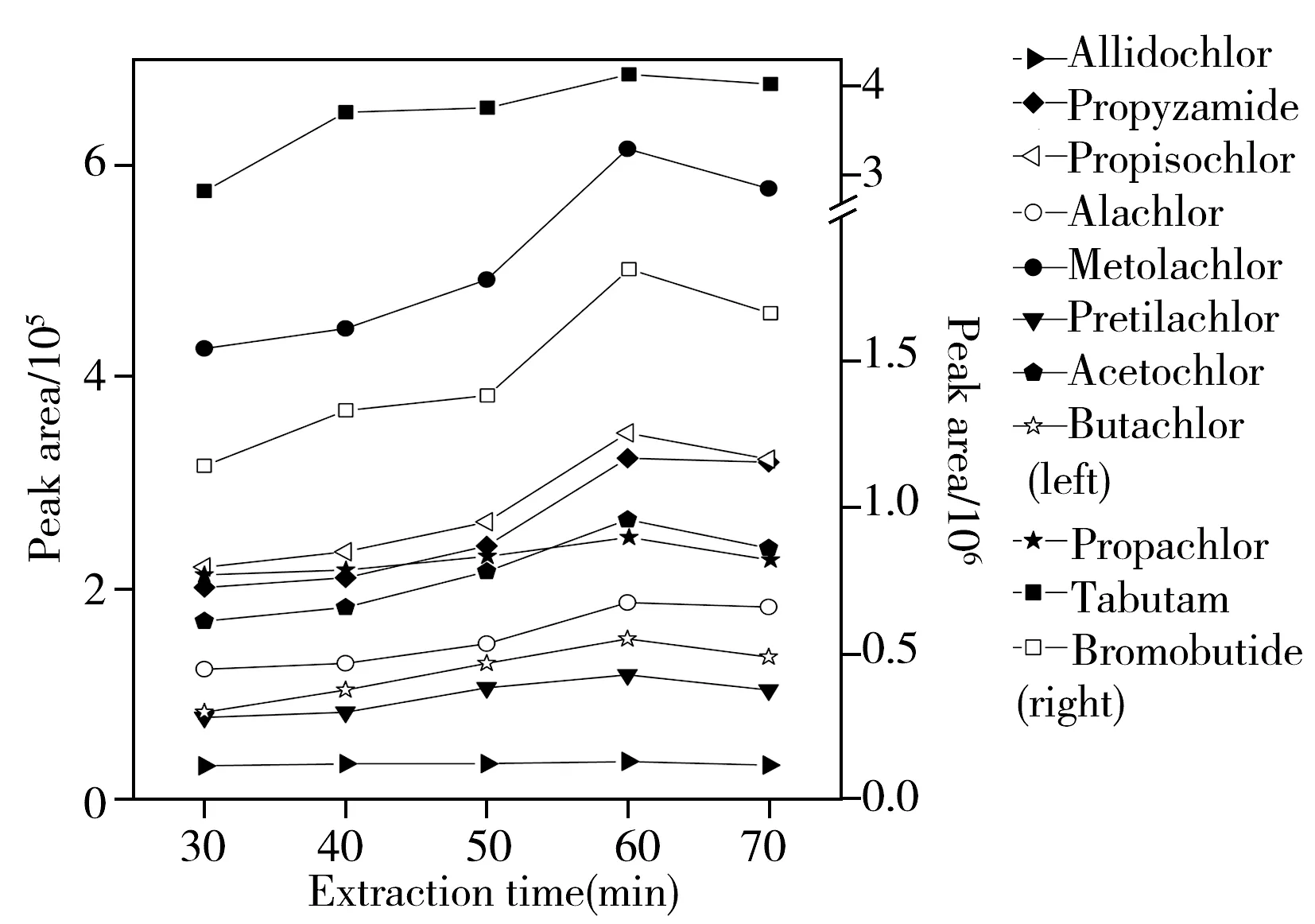
图3 萃取时间对11种酰胺类除草剂萃取效率的影响Fig.3 Effects of extraction time on extraction efficiency of 11 amide herbicides
2.2.6萃取时间的优化萃取头需在顶空空间暴露足够的时间吸附目标物以达到平衡[21]。本实验考察了不同萃取时间(30、40、50、60、70 min)对11种酰胺类农药萃取效果的影响,结果如图3所示。11种酰胺类除草剂的萃取效率随着萃取时间的增加而增大,并在萃取60 min时达到最大值;当萃取时间超过60 min时,萃取效率反而下降。这是因为在未达到萃取平衡时,分析物的萃取量与萃取时间呈正相关,萃取量随着时间的增加而增大;萃取完成后,随着萃取时间的增加,部分水珠凝结在萃取涂层上,降低了萃取头的萃取能力,目标物从萃取涂层反向扩散至顶空空间。因此,本实验选取最佳萃取时间为60 min。
2.3 方法学验证
2.3.1线性范围与定量下限配制一系列不同含量(1、5、10、50、100、500、1 000 μg/kg)的茶叶基质匹配标准溶液,进行HS-SPME/GC-MS/MS分析,考察线性范围。结果如表2所示,11种酰胺类除草剂在4种不同茶叶中的线性范围为1~1 000 μg/kg,相关系数(r2)为0.992 5~0.999 9,方法线性关系良好。以线性范围最低点为定量下限(LOQ),11种农药在4种茶叶中的LOQ为1~10 μg/kg,均低于欧盟规定的茶叶中农药MRL值,具体结果见表2,说明本方法具有很好的灵敏度和准确度。
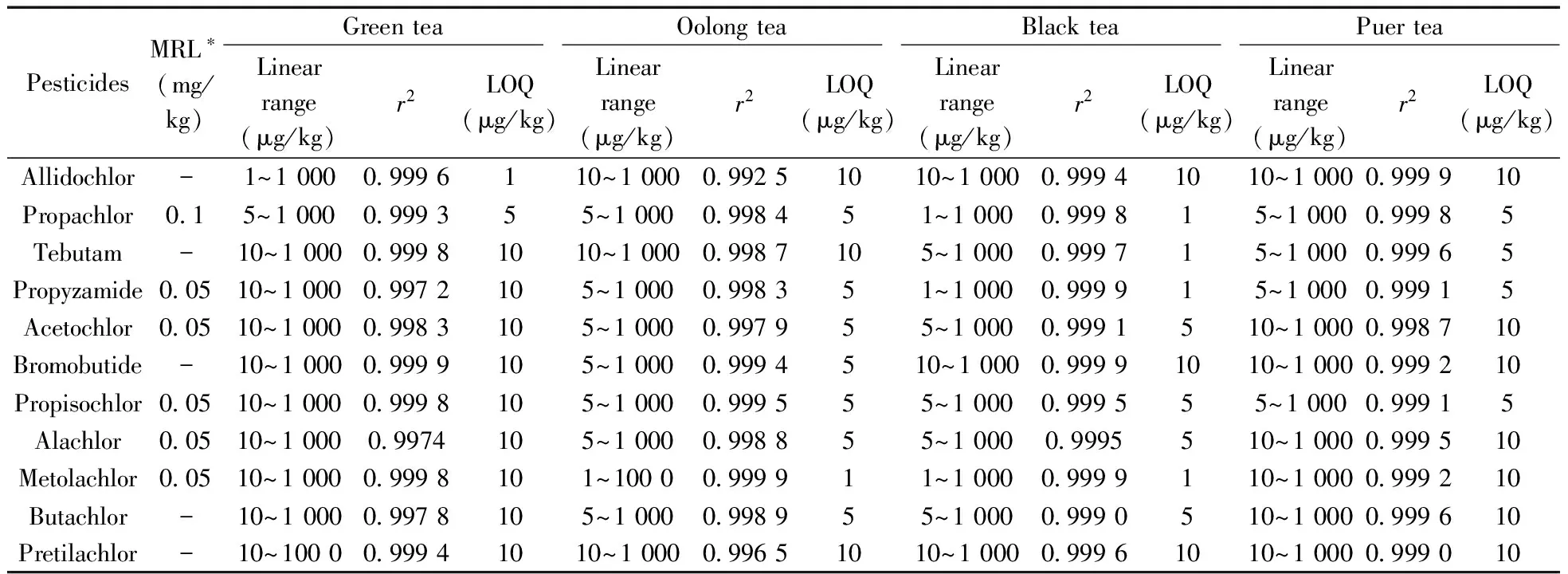
表2 11种酰胺类除草剂的线性范围、线性方程、相关系数(r2)和定量下限(LOQ)Table 2 Linear ranges,linear equations,correlation coefficients(r2) and limits of quantitation(LOQ) for 11 amide herbicides
*MRL:the maximum residue limit for pesticide residues in tea prescribed in European Union(欧盟规定的茶叶中农药最大残留限量标准)
2.3.2回收率与精密度在红茶、绿茶、乌龙茶和黑茶空白样品中做加标回收率试验,添加10、50、100 μg/kg 3个水平,每个水平做5次平行。4种茶叶基质中3个加标水平下的11种酰胺类农药加标回收率及精密度数据见表3。11种酰胺类农药的平均回收率分别为70.3%~119.1%、85.2%~118.7%和74.6%~113.3%,相对标准偏差(RSD)均≤17.4%。该方法的准确度和精确度均令人满意,能够对实际样品中的11种酰胺类除草剂农药进行准确定量。
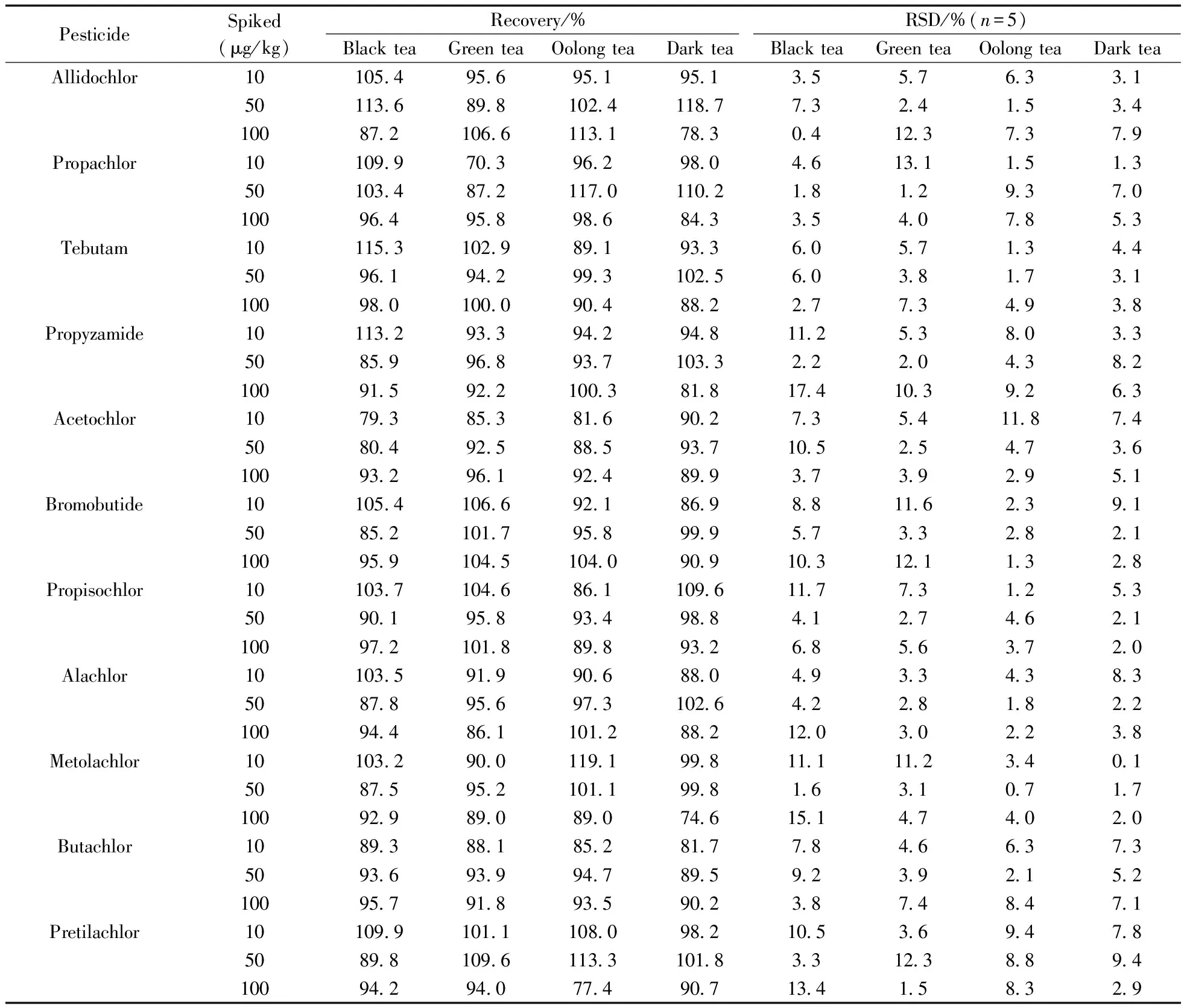
表3 茶叶基质中11种酰胺类除草剂的回收率和相对标准偏差(n=5)Table 3 Recoveries and the relative standard deviations(RSD) of the 11 amide herbicides(n=5)
2.4 与文献方法的比较
将所建立的HS-SPME/GC-MS/MS方法与文献报道[2,8,22-23]方法从样品前处理时间、有机溶剂用量和回收率等方面进行了对比,结果见表4。与其他方法相比,HS-SPME/GC-MS/MS方法具有操作简单、快速、准确和环保等优点,因此可以作为快速分析茶叶基质中11种酰胺类除草剂的有效方法。
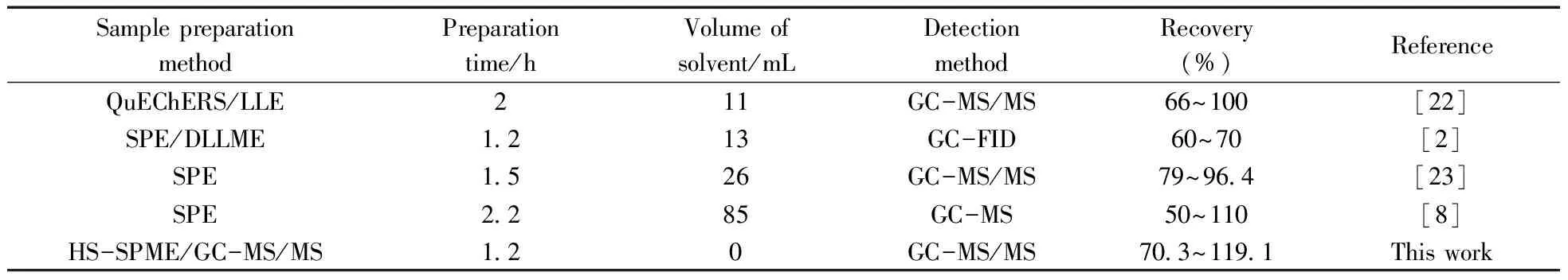
表4 本方法与文献方法对茶叶基质中酰胺类除草剂残留分析结果的比较Table 4 Comparison of this method with other methods from references for determination of amide herbicides in tea
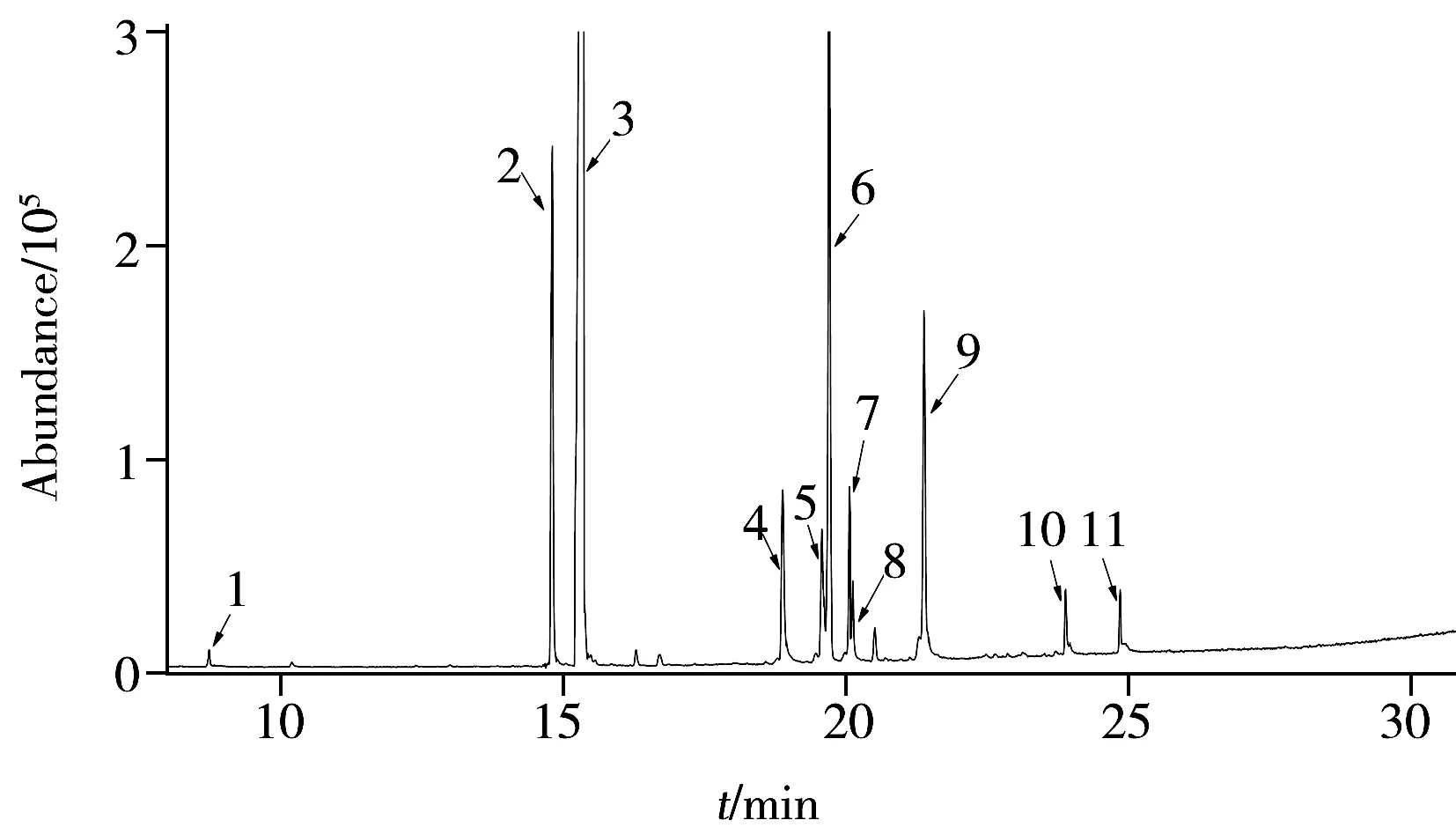
图4 红茶样品中添加11种酰胺类除草剂混标(100 μg/kg)的MRM总离子流图Fig.4 Total ion chromatogram of 11 amide herbicides spiking in black tea(100 μg/kg)1.allidochlor,2.propachlor,3.tebutam,4.propyzamide,5.acetochlor,6.bromobutide,7.propisochlor,8.alachlor,9.metolachlor,10.butachlor,11.pretilachlor
2.5 实际样品测定
随机抽取本地区30例市售茶叶样品,包括10种绿茶、6种乌龙茶、6种红茶和8种普洱茶,利用本方法进行分析测定。结果发现,30例市售茶叶样品中均未检出上述11种酰胺类除草剂。11种酰胺类除草剂混标添加在红茶样品中的MRM总离子流图见图4。
3 结 论
本文建立了茶叶基质中11种酰胺类除草剂农药残留的HS-SPME/GC-MS/MS快速测定方法。虽然茶叶基质较为复杂,但该方法的线性关系良好,在不同茶叶基质中的定量下限、回收率和重复性等指标均满足茶叶中农药残留分析的要求。该方法具有操作简单、准确、环保和自动化程度高的优点,是一种快速、准确的分析方法。
[1] Sun M Y,Shi Z H,Li J X,Wu X Q,Hu X Y,Zhang B L,Fan C L.J.Instrum.Anal.(孙梦园,石志红,李建勋,吴兴强,胡雪艳,张博伦,范春林.分析测试学报),2017,36(5):595-600.
[2] Bai S S,Li Z,Zang X H,Wang C,Wang Z.Chin.J.Anal.Chem.(白莎莎,李芝,臧晓欢,王春,王志.分析化学),2013,41(8):1177-1182.
[3] Zhao R S,Diao C P,Chen Q F,Wang X.J.Sep.Sci.,2009,32(7):1069-1074.
[4] Oosterhuis R,Vukman K,Vagi E,Glavinas H,Jablonkai I,Krajcsi P.Toxicology,2008,248(1):45-51.
[5] Li L X,Wang M Q,Chen S H,Zhao W,Zhao Y,Wang X,Zhang Y.Pestic.Biochem.Phys.,2016,128:82-88.
[6] Xu C,Tu W Q,Deng M,Jin Y X,Lu B,Zhang C N,Lin C M,Wu Y M,Liu W P.Chemosphere,2016,164:618-626.
[7] Xu X Q,Yang H H,Wang L,Han B,Wang X R,Sen-Chun Lee F.Anal.Chim.Acta,2007,591(1):87-96.
[8] Shen W J,Xu J Z,Yang W S,Shen C Y,Zhao Z Y,Ding T,Wu B.Chin.J.Chromatogr.(沈伟健,徐锦忠,杨雯筌,沈崇钰,赵增运,丁涛,吴斌.色谱),2007,25(5):753-757.
[9] Zhao R S,Diao C P,Wang X,Jiang T,Yuan J P.Anal.Bioanal.Chem.,2008,391(8):2915-2921.
[10] Li R,Chu D K,Zhang P J,Gao Y Q,Huang S Y.J.Instrum.Anal.(李蓉,储大可,张朋杰,高永清,黄思允.分析测试学报),2015,34(5):502-511.
[11] Chen H P,Liu X,Wang Q H,Jiang Y.TeaSci.(陈红平,刘新,汪庆华,蒋迎.茶叶科学),2010,31(4):293- 288.
[12] Li J Z,Chu X G,Cai H X,An J,Yang Q.Chin.J.Chromatogr.(李建中,储晓刚,蔡会霞,安娟,杨强.色谱),2006,24(6):585-588.
[13] Qu Z P,Bai X Z,Zhang T,Yang Z G.J.Sep.Sci.,2017,40(5):1142-1149.
[14] Al-Alam J,Fajloun Z,Chbani A,Millet M.Anal.Bioanal.Chem.,2017.DOI 10.1007/s00216-017-0463-y.
[15] Zhang N,Gao J,Huang C H,Liu W,Tong P,Zhang L.Anal.Chim.Acta,2016,934:122-131.
[16] Kennedy J H,Aurand C,Shirey R,Laughlin B C,Wiseman J M.Anal.Chem.,2010,82(17):7502-7508.
[17] Wang C,Du L P,Lu Y,Li T,Li J X,Li W,Xiao D G,Li C W,Xu Y Q.InProceedingsofthe2012InternationalConferenceonAppliedBiotechnology.Springer,Berlin,Heidelberg,2014:435-446.
[18] Tat L,Comuzzo P,Stolfo I,Battistutta F.FoodChem.,2005,93(2):361-369.
[19] Du L P,Li J X,Li W,Li Y F,Li T,Xiao D G.FoodRes.Int.,2014,57:61-70.
[20] Du L P,Wang C,Li J X,Xiao D G,Li C W,Xu Y Q.J.Agric.FoodChem.,2013,61(3):561-568.
[21] Bianchin J N,Nardini G,Merib J,Neves Dias A,Martendal E,Carasek E.FoodChem.,2014,145:1061-1065.
[22] Cajka T,Sandy C,Bachanova V,Drabova L,Kalachova K,Pulkrabova J,Hajslova J.Anal.Chim.Acta,2012,743:51-60.
[23] Hou X,Yi S G,Han M,Yang X F,Lei S R.Chin.J.Anal.Lab.(侯雪,易盛国,韩梅,杨晓凤,雷绍荣.分析试验室),2013,32(3):89-92.
Rapid Determination of 11 Amide Herbicides in Tea by Headspace Solid-phase Microextraction Combined with Gas Chromatography-Triple Quadrupole Mass Spectrometry
LI Jian-xun1,2,SUN Meng-yuan2,3,HU Xue-yan2,WU Xing-qiang2,3,CHANG Qiao-ying2,FAN Chun-lin2*
(1.School of Food and Chemical Engineering,Beijing Technology and Business University,Beijing 100048,China;2.Chinese Academy of Inspection and Quarantine,Beijing 100176,China;3.College of Chemistry and Environmental Science,Hebei University,Baoding 071002,China)
Headspace solid-phase microextraction(HS-SPME) combined with gas chromatography-triple quadrupole mass spectrometry(GC-MS/MS) was used for the rapid determination of 11 amide herbicide residues in tea.Various factors affecting extraction performance such as the types of extraction coatings,the type of inorganic salt,water consumption,salt dosage,extraction temperature and extraction time in HS-SPME were optimized by using the all fermented black tea matrix.Under the optimized conditions,four kinds of teas,i.e.geen tea,oolong tea,black tea and puer tea were selected for methodology validation.The results showed that the calibration curves of 11 amide herbicides were linear in the range of 1-1 000 μg/kg,with correlation coefficients(r2) of 0.992 5-0.999 9,and the limits of quantitation ranged from 1 μg/kg to 10 μg/kg.The average recoveries of the 11 pesticides in black tea,green tea,oolong tea and dark tea at three spiked levels were in the ranges of 70.3%-119.1%,85.2%-118.7%and 74.6%-113.3%,respectively.The relative standard deviations(RSDs) were all not more than 17.4%(n=5).With the advantages of simplicity,rapidness,high sensitivity and good reproducibility,the method could meet the requirements of detection of 11 amide herbicide residues in tea.
headspace solid-phase microextraction(HS-SPME);gas chromatography-triple quadrupole mass spectrometry(GC-MS/MS);amide herbicides;tea
2017-07-19;
2017-08-08
中国检验检疫科学研究院基本科研业务费项目(2017JK025)
*
范春林,研究员,研究方向:食品安全检测,Tel:010-53897910,E-mail:caiqfcl@126.com
10.3969/j.issn.1004-4957.2017.11.008
O657.63;O657.7
A
1004-4957(2017)11-1339-07

