白术两种主要土传病害的分离、鉴定及杀菌剂的室内活性筛选
张佳星, 徐颖菲, 徐艳芳, 戴德江, 刘亚慧, 张传清*
(1. 浙江农林大学, 临安 311300; 2. 浙江省农药检定管理所, 杭州 310020)
白术两种主要土传病害的分离、鉴定及杀菌剂的室内活性筛选
张佳星1, 徐颖菲1, 徐艳芳1, 戴德江2, 刘亚慧1, 张传清1*
(1. 浙江农林大学, 临安 311300; 2. 浙江省农药检定管理所, 杭州 310020)
立枯病和白绢病是白术生产种植中的两种主要土传病害,在苗期和生长期都有发生,危害严重。本研究从浙江省磐安县采集具有典型病症的白术植株,对病原进行了分离、纯化和致病性测定。综合形态学特征及rDNA-ITS序列分析表明,白术上的病害是由立枯丝核菌RhizoctoniasolaniKühn引起的立枯病和由齐整小核菌SclerotiumrolfsiiSacc.引起的白绢病。室内毒力测定结果表明,10种供试杀菌剂对立枯病菌的毒力从大到小为:噻呋酰胺>咯菌腈>戊唑醇>四氟醚唑>吡唑醚菌酯>丙硫菌唑>嘧菌酯>啶酰菌胺>苯醚甲环唑>咪鲜胺;对白绢病菌的室内毒力从大到小为:吡唑醚菌酯>噻呋酰胺>嘧菌酯>戊唑醇>咯菌腈>苯醚甲环唑>丙硫菌唑>啶酰菌胺>四氟醚唑>咪鲜胺,其中噻呋酰胺对两种病菌都具有很高的活性,EC50分别为0.06和0.03 mg/L,可用于两种病害的防治。
白术; 立枯病; 白绢病; 立枯丝核菌; 齐整小核菌
白术AtractylodesmacrocephalaKoidz.,别名浙术、苍术等,属于菊科苍术属多年生草本植物,是“参、术、苓、甘”四大名贵药材之一,也是浙江省主产的道地药材[1]。
近年来,由于白术出口和国内需求量越来越大,其种植面积不断扩大,轮作周期逐渐缩短,导致白术病虫害逐年加重[2]。立枯病(sheath blight)多于植株幼苗期危害其根茎部,导致根茎部产生暗褐色凹陷病斑。发病初期常可见植株在阳光下全株萎蔫,入夜后恢复正常。当病斑环绕茎部一周后,茎部缢缩死亡。病原也可侵染近地面叶片,感病叶片上产生深褐色水渍状大病斑,并快速腐烂死亡。在高温高湿环境中,病部生长出大量的褐色蛛丝状菌丝,并产生大量土粒状褐色菌核。白绢病(southern blight)[3-4]又名白霉病,可侵染100多科210多种植物。该病通常危害成株期植株根部和茎基部,茎部发病后,产生深褐色、不规则的水渍状病斑,向上蔓延导致叶片变黄枯死,向下蔓延导致根部表皮褐变腐烂,最终全株萎蔫枯死,根茎仅剩下纤维组织,很容易从土中被拔出。如环境高温潮湿[5],病情发展更加迅速,病斑处可长出大量绢丝状白色菌丝体,缠绕近地面叶片并向周围土壤蔓延,产生大量油菜籽状的茶褐色菌核。
目前国内外对白术病害的研究主要侧重田间病害调查和药剂防治方面,对病原的研究较少或是为较早期的研究。如,对白术铁叶病病原的研究还停留在20世纪70年代[6];白术根腐病病原是由多种镰刀菌属真菌引起的,对其症状描述也大相径庭[2,7-9];对白术病害命名未有统一的规范,常出现“一病多名,一名多病”现象,这给病害的防治造成了严重的阻碍。因此,本文对白术生产中的两种重要土传病害病原进行分离、鉴定,并进行多种杀菌剂的室内毒力测定,目的在于为病害防治提供科学指导。
1 材料与方法
1.1 病样的采集及病原菌的分离
于浙江省金华市磐安县采集具明显病症的白术样本,用干净的牛皮纸袋密封保存,带回实验室进行病原菌的分离。白术立枯病取病健交界处组织,用75%乙醇浸泡1 min,再用1.5%的次氯酸钠溶液消毒1 min,75%乙醇漂洗1 min,最后用无菌水漂洗4次,用无菌滤纸将水分吸干后切成0.5 cm2小块,置于PDA表面,在25℃恒温培养箱中黑暗培养。待有菌丝长出后,挑取菌落边缘琼脂块到新的平板上进行纯化培养,并于4℃保存备用。白术白绢病直接挑取病株表面油菜籽状的菌核进行灭菌,分离,纯化,保存。
1.2 病原菌致病性测定
白术块根经表面灭菌后埋于湿润的无菌基质中,置于温室中培养,定期浇水,待植株高度达到20 cm,进行致病性试验。从分离获得的病原真菌中选取两株代表菌株进行活化,接于PDA培养基上培养,同时在培养基上放置一根无菌牙签。培养5 d后,将牙签长有菌丝的一端插至白术离地2 cm处的茎基部,以未做处理的无菌牙签作为对照,每个处理重复4次,放于人工气候箱中(28℃,L∥D=12 h∥12 h,相对湿度85%),两种病害进行相同处理。定期观察植株发病情况,并做好记录,对发病植株进行再分离、纯化、保存,与首次分离的病原菌进行比对。
1.3 病原菌的形态学特征观察
将两种病原菌的纯化菌株于25℃恒温培养箱中的PDA培养基上培养,观察菌落形态特征。在显微镜下测量菌丝和菌核大小,并使用Giemsa染料对菌丝细胞进行染色,观察并记录细胞核数量,总结两种病原菌形态特征进行形态学鉴定。
1.4 病原菌的rDNA-ITS 序列扩增及分析
取生长在PDA培养基表面的病原菌菌丝,用真菌基因组DNA快速抽提试剂盒提取基因组DNA。用核糖体内转录间隔区(rDNA-ITS)序列通用引物ITS-1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS-4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增。采用50 μL扩增体系,包括酶2 U、引物0.8 μmol/L、病原菌DNA 1 μL。反应条件为95℃预变性2 min;95℃变性30 s,55℃退火30 s,72℃延伸40 s,35个循环;然后72℃延伸10 min。产物于4℃保存。扩增产物经琼脂糖凝胶电泳后用SanPrep柱式DNA胶回收试剂盒回收目标DNA片段,送往生工生物工程股份有限公司进行测序。利用BLAST软件在GenBank数据库中对测序结果进行比对分析。
1.5 供试杀菌剂
使用的杀菌剂均为原药,包括97.6%戊唑醇(tebuconazole)、96%噻呋酰胺(thifluzamide)、95%咯菌腈(fludioxonil)、95%咪鲜胺(prochloraz)、96%苯醚甲环唑(difenoconazole)、95%啶酰菌胺(boscalid)、96%嘧菌酯(azoxystrobin)、96%丙硫菌唑(prothioconazole)、99%四氟醚唑(tetraconazole)和97%吡唑醚菌酯(pyraclostrobin)。
1.6 杀菌剂对两种病原菌菌丝的室内毒力测定
将上述杀菌剂母液与PDA按照一定的比例混合,其中嘧菌酯和吡唑嘧菌酯两种杀菌剂需要加50 mg/L SHAM,终浓度设置见表1。将4℃保存的菌株活化后,再次转接,至菌落长至9 cm培养皿的三分之二后用5 mm直径打孔器在同一圆周上打取生长状态一致的菌饼,接于不同浓度梯度的PDA培养皿中心,以空白PDA培养皿作为对照,每处理3次重复。将培养皿放于25℃培养箱中进行培养,待空白处理菌落直径大于6 cm后使用十字交叉法测量,记录数据,计算抑制率。公式为:生长抑制率(%)=(对照菌落直径-药剂处理菌落直径)/(对照菌落直径-0.5)×100。数据结果使用SPSS统计软件分析,求得各药剂的毒力回归方程、EC50以及相关系数。
表1杀菌剂的室内毒力测定浓度
Table1Concentrationoffungicidesfortoxicitymeasurement

病害Disease杀菌剂Fungicide浓度/mg·L-1Concentration立枯病Sheathblight噻呋酰胺thifluzamide0.01250.0250.050.10.2咯菌腈fludioxonil0.0250.050.10.20.4戊唑醇tebuconazole0.06250.1250.250.51吡唑醚菌酯pyraclostrobin0.156250.31250.6251.252.5四氟醚唑tetraconazole0.156250.31250.6251.252.5嘧菌酯azoxystrobin0.250.5124啶酰菌胺boscalid0.250.5124苯醚甲环唑difenoconazole0.6251.252.5510丙硫菌唑prothioconazole0.0781250.31251.25520咪鲜胺prochloraz0.31251.2552040白绢病Southernblight吡唑醚菌酯pyraclostrobin0.006250.01250.0250.050.1噻呋酰胺thifluzamide0.01250.0250.050.10.2咯菌腈fludioxonil0.0250.050.10.20.4嘧菌酯azoxystrobin0.031250.06250.1250.250.5戊唑醇tebuconazole0.06250.1250.250.51苯醚甲环唑difenoconazole0.0781250.156250.31250.6251.25啶酰菌胺boscalid0.1250.250.512丙硫菌唑prothioconazole0.156250.31250.6251.252.5四氟醚唑tetraconazole0.156250.31250.6251.252.5咪鲜胺prochloraz2.55102040
2 结果与分析
2.1 病原菌分离及致病性测定
从磐安采集的植株病样中分离得到两种病害病原真菌,以BZLK1、BZLK2和BZBJ1、BZBJ2作为两种病害的代表菌株,进行致病性试验。结果显示:健康白术在接种BZLK1和BZLK2 5 d后,茎基部出现水渍状暗褐色病斑,病斑环茎蔓延。20 d后植株整体表现萎蔫,顶部叶片下垂干枯,近地面叶片出现大面积黑褐色病斑,茎基部缢缩,表皮都为黑褐色病斑,黏附有土粒状深褐色菌核。
白术在接BZBJ1和BZBJ2 5 d后,茎基部伤口开始发病,随着病情发展,茎基部出现水渍状、暗褐色、不规则病斑,近地面叶片黄化萎蔫。20 d后,茎基部和近地面叶片被白色绢丝状菌丝缠绕,植株可从基质中轻易拔起,叶片、茎部和土层中可见大量油菜籽状茶褐色菌核。插有无菌牙签的对照未有病变症状。将病变组织再次进行分离、纯化,得到与BZLK1、BZLK2和BZBJ1、BZBJ2相同的病原真菌。
2.2 病原菌的菌落和形态学特征
立枯病病原菌BZLK1菌丝在PDA上以匍匐状向四周生长,有环状轮纹,生长快,3 d左右可长满9 cm培养基,6 d后菌丝由淡黄色向褐色转变,9 d后转变为深褐色,产生菌核(图1a~b)。在显微镜下观察发现菌丝分支角度较大,且有缢缩,菌丝直径(5.77~ 6.99)μm,用Giemsa染料对菌丝细胞染色后发现胞内有多个细胞核(图1c)。病原菌 BZLK2具有相似的形态特征。
白绢病病原菌BZBJ1 菌丝为白色,向四周以辐射状生长,气生菌丝较多,生长快,3 d左右可长满9 cm PDA培养皿,菌丝直径为(6.40~7.36)μm。5 d后菌丝缠绕,在菌落表面出现大量乳白色细小菌核,9 d后菌核颜色变为茶褐色,表面光滑,不与菌丝相连,呈近球形或椭球形(图1d~f),大小为(1.45~1.76)mm×(1.29~1.61)mm。病原菌 BZBJ2具有相似的形态特征。

图1 病原菌BZLK1和BZBJ1在PDA上的菌落形态Fig.1 Morphological characters of pathogens BZLK1 and BZBJ1 on PDA plate
2.3 病原菌rDNA-ITS序列扩增及分析
以白术立枯病和白绢病两种病害的基因组DNA作为模板,以ITS序列通用引物进行PCR扩增,分别得到700 bp和650 bp长度的DNA片段。测序结果经BLAST软件在GenBank数据库中进行同源性比较,结果显示与立枯丝核菌R.solani和齐整小核菌S.rolfsii的相似率最高,选取相关菌株的ITS序列,使用MEGA 6.06软件邻接法构建系统进化树(图2)。
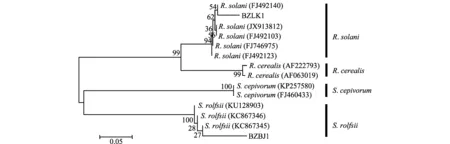
图2 基于两种病原菌及相关真菌ITS序列构建的系统进化树Fig.2 Phylogenetic trees between two pathogens and other fungi based on ITS nucleotide sequences
2.4 杀菌剂的室内毒力
10种杀菌剂对立枯丝核菌的毒力测定结果表明:咪鲜胺对丝核菌的毒力最低,噻呋酰胺和咯菌腈的毒力最高,其毒力为咪鲜胺的222倍;戊唑醇、四氟醚唑、吡唑醚菌酯和丙硫菌唑的毒力为咪鲜胺的13~40倍;其他3种杀菌剂嘧菌酯、啶酰菌胺、苯醚甲环唑相对于咪鲜胺的相对毒力倍数均小于等于10(表2)。
10种杀菌剂对齐整小核菌的毒力测定结果表明:咪鲜胺的毒力最低,吡唑醚菌酯、噻呋酰胺和嘧菌酯毒力较高,其毒力分别为咪鲜胺的582、388和106倍(表3)。戊唑醇、咯菌腈、苯醚甲环唑、丙硫菌唑、啶酰菌胺和四氟醚唑的毒力为咪鲜胺的24~89倍。
表210种杀菌剂对立枯丝核菌的室内毒力
Table2Toxicityof10fungicidesagainstRhizoctoniasolani
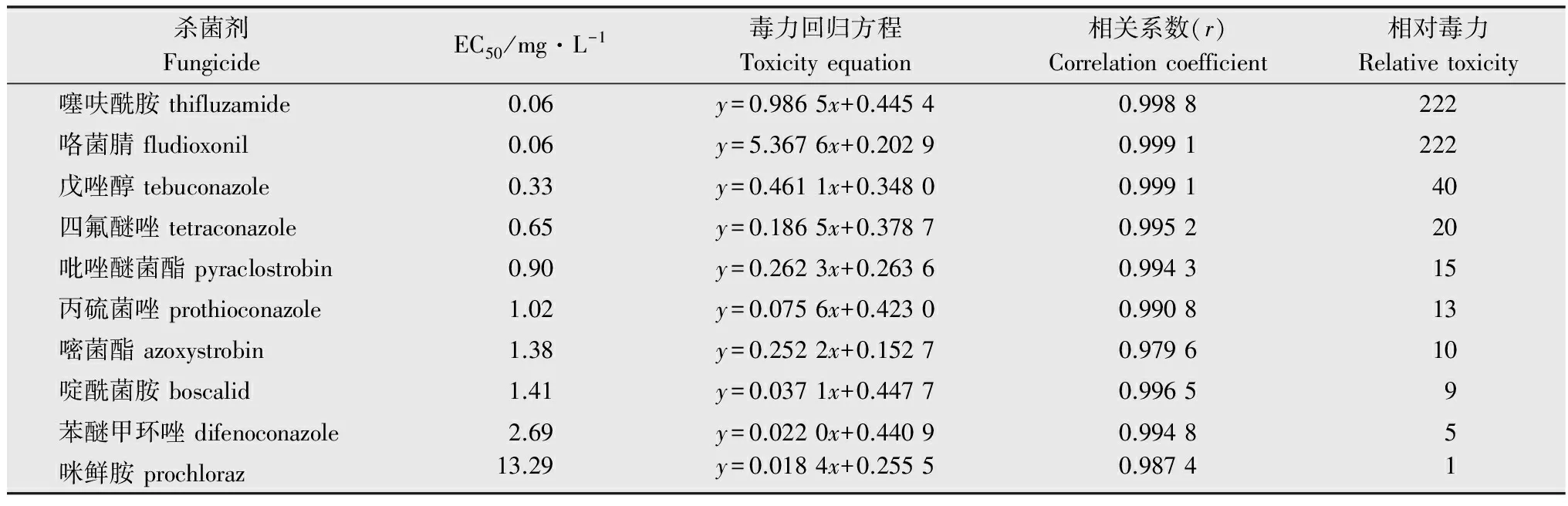
杀菌剂FungicideEC50/mg·L-1毒力回归方程Toxicityequation相关系数(r)Correlationcoefficient相对毒力Relativetoxicity噻呋酰胺thifluzamide0.06y=0.9865x+0.44540.9988222咯菌腈fludioxonil0.06y=5.3676x+0.20290.9991222戊唑醇tebuconazole0.33y=0.4611x+0.34800.999140四氟醚唑tetraconazole0.65y=0.1865x+0.37870.995220吡唑醚菌酯pyraclostrobin0.90y=0.2623x+0.26360.994315丙硫菌唑prothioconazole1.02y=0.0756x+0.42300.990813嘧菌酯azoxystrobin1.38y=0.2522x+0.15270.979610啶酰菌胺boscalid1.41y=0.0371x+0.44770.99659苯醚甲环唑difenoconazole2.69y=0.0220x+0.44090.99485咪鲜胺prochloraz13.29y=0.0184x+0.25550.98741
表310种杀菌剂对齐整小核菌的室内毒力测定
Table3Toxicitytestof10fungicidesagainstSclerotiumrolfsii

杀菌剂FungicideEC50/mg·L-1毒力回归方程Toxicityequation相关系数(r)Correlationcoefficient相对毒力Relativetoxicity吡唑醚菌酯pyraclostrobin0.02y=1.1596x+0.48170.9568582噻呋酰胺thifluzamide0.03y=4.5255x+0.38300.9961388嘧菌酯azoxystrobin0.11y=2.1208x+0.26920.9981106戊唑醇tebuconazole0.13y=0.5998x+0.42320.998989咯菌腈fludioxonil0.13y=3.4289x+0.04140.996689苯醚甲环唑difenoconazole0.26y=0.2924x+0.42450.982645丙硫菌唑prothioconazole0.46y=0.0663x+0.46950.998425啶酰菌胺boscalid0.47y=0.3684x+0.32610.991525四氟醚唑tetraconazole0.48y=0.1816x+0.41370.999924咪鲜胺prochloraz11.63y=0.0329x+0.11740.98751
3 结论与讨论
本研究对从磐安县采集的具有白术立枯病和白绢病典型病症的植株进行病原菌的分离、纯化和致病性研究,并利用病菌形态学特征观察、rDNA-ITS序列分析明确了磐安县白术的两种土传病害是由立枯丝核菌R.solani引起的立枯病和由齐整小核菌S.rolfsii引起的白绢病。两种病害都为典型的土传病害,高温高湿环境更易发生,可造成大面积植株干枯萎蔫和死亡[5,10]。
潘兰兰等[5]及黄力刚[11]报道白术立枯病病原菌为立枯丝核菌R.solani,但未做分离、鉴定和致病性试验。沈立荣等[13]将湖南产区白术纹枯病病原鉴定为齐整小核菌S.rolfsii,病原与本文一致,但病状与本文研究的白术立枯病不同,湖南产区的白术纹枯病发病较晚,常于开花结实期发病,常见云纹状病斑,病斑后期为灰白色,表皮易脱落只留下叶脉,这可能与不同产地气候条件和白术品种的差异有关。李小霞等[3]和胡琼波[14]分别研究了贵州、湖南两地白术白绢病,并将其病原鉴定为齐整小核菌S.rolfsii,其病害病症相似,与本研究结果一致。
随着白术市场的扩大,野生资源的枯竭,大面积密植的人工栽培模式被广泛推广。从野生到人工栽培环境的变化,温湿度提高,空气不流通,连年种植,导致立枯病和白绢病严重发生。张璨[15]报道噻呋酰胺对立枯病病菌的室内毒力较高,高于苯醚甲环唑和咪鲜胺,与本文一致。Grichar[16-17]等的试验表明戊唑醇对白绢病菌防治效果显著,与本文的室内毒力测定结果一致。本研究结果表明吡唑醚菌酯与噻呋酰胺对白绢病的毒力优于戊唑醇,可进行田间试验。此外,噻呋酰胺和吡唑醚菌酯对立枯丝核菌及齐整小核菌的室内毒力都较高,可用于同时防治两种病害,减少药剂的喷洒次数和用量。对噻呋酰胺和吡唑嘧菌酯的田间防治效果将进一步研究。
[1] 施时贵. 磐安白术[J]. 中国地名, 2005(2): 64.
[2] 檀国印, 杨志玲, 袁志林, 等. 白术真菌病害的分离鉴定[J]. 浙江农业学报, 2013(5): 1050-1055.
[3] 李小霞, 肖仲久, 李黛, 等. 白术白绢病病原菌的分子鉴定[J]. 贵州农业科学, 2011(12): 126-128.
[4] 鲁鹏, 肖仲久, 李小霞, 等. 白术白绢病菌的生物学特性及杀菌剂对其室内毒力测定[J]. 贵州农业科学, 2010(8): 90-93.
[5] 潘兰兰, 郑永利, 吕先真. 白术主要病害的发生及综合治理[J]. 浙江农业科学, 2006(3): 315-318.
[6] 俞永信. 白术铁叶病初步研究[J]. 浙江农业科学, 1974(1): 39-42.
[7] 臧少先, 安信伯, 石丽军, 等. 白术根腐病症状类型及病原鉴定[J]. 河北农业大学学报, 2005(3): 73-76.
[8] 张礼维. 贵州白术根腐病病原鉴定及防治研究[D]. 贵阳: 贵州大学, 2015.
[9] 刘凡. 白术根腐病病原鉴定、生物学特性和防治研究[D]. 雅安: 四川农业大学, 2012.
[10] 桑维钧, 练启仙, 宋宝安, 等. 贵州省白术真菌病害种类调查及防治[J]. 贵州农业科学, 2006(3): 40-41.
[11] 黄力刚. 白术主要病害的发生与防治[J]. 现代农业科技, 2005(2): 19-20.
[12] 宋涛. 药用植物白术主要病害的综合防治[J]. 吉林农业, 2015(9): 96.
[13] 沈立荣, 庞阿土, 陈集双. 白术纹枯病研究初报[J]. 植物保护, 1993,19(3): 28-29.
[14] 胡琼波. 白术白绢病发生规律与防治研究[D]. 长沙: 湖南农业大学, 2002.
[15] 张璨. 几种杀菌剂对西藏设施蔬菜立枯病菌的室内毒力测定[C]∥中国植物病理学会. 中国植物病理学会2012年学术年会论文集, 2012: 492.
[16] Grichar W J. Management of stem rot of peanuts (Arachishypogaea) caused bySclerotiumrolfsiiwith fungicides [J]. Crop Protection, 1995, 14(2): 111-115.
[17] 张献强, 黎起秦, 甘启范, 等. 防治茉莉白绢病的药剂筛选研究[J]. 安徽农业科学, 2010(10): 5152-5154.
(责任编辑: 杨明丽)
Isolationandidentificationoftwomainsoil-bornepathogensonAtractylodesmacrocephalaandscreeningoffungicidesinvitro
Zhang Jiaxing1, Xu Yingfei1, Xu Yanfang1, Dai Dejiang2, Liu Yahui1, Zhang Chuanqing1
(1.ZhejiangAgricultureandForestryUniversity,Lin’an311300,China; 2.InstitutefortheControlofAgrochemicalsinZhejiangProvince,Hangzhou310020,China)
The sheath blight and southern blight are two major soil-borne diseases in the cultivation ofAtractylodesmacrocephala, which occur severely during seedling and growing periods. In this study, we collectedAtractylodesplants with typical symptoms from Pan’an County, Zhejiang Province, and determined the pathogens through isolation, purification and pathogenicity tests. Morphology characteristics and rDNA-ITS sequence analysis indicated that the pathogens wereRhizoctoniasolanifor sheath blight disease andSclerotiumrolfsiifor southern blight disease, respectively. Indoor toxicity tests demonstrated that the bioactivity againstR.solaniwere: thifluzamide > fludioxonil > tebuconazole > tetraconazole > pyraclostrobin > prothioconazole > azoxystrobin > boscalid > difenoconazole > prochloraz, and the bioactivity againstS.rolfsiiwere: pyraclostrobin > thifluzamide > azoxystrobin > tebuconazole > fludioxonil > difenoconazole > prothioconazole > boscalid > tetraconazole > prochloraz. Among them, thifluzamide was most effective to both pathogens, with EC50values of 0.06 and 0.03 mg/L, respectively.
Atractylodesmacrocephala; sheath blight; southern blight;Rhizoctoniasolani;Sclerotiumrolfsii
2017-03-22
2017-04-21
浙江省“三农六方”项目;浙江公益技术应用研究计划(2016C32002)
* 通信作者 E-mail: cqzhang@zafu.edu.cn
S 482.2
A
10.3969/j.issn.0529-1542.2017.06.031

