高静压处理对魔芋葡甘聚糖/大豆分离蛋白复合溶胶特性的影响
田学智,龙昌洲,王子宇,张亚宁,张甫生*
1(西南大学 食品科学学院,重庆 ,400715) 2(西南大学 国家级食品科学与工程实验教学示范中心,重庆, 400715)
高静压处理对魔芋葡甘聚糖/大豆分离蛋白复合溶胶特性的影响
田学智1,2,龙昌洲1,2,王子宇1,2,张亚宁1,张甫生1*
1(西南大学 食品科学学院,重庆 ,400715) 2(西南大学 国家级食品科学与工程实验教学示范中心,重庆, 400715)
为考察高静压对多糖-蛋白质复合体系功能特性的影响,以魔芋葡甘聚糖和大豆分离蛋白为原料,研究不同压力、不同时间下高静压处理对两者复合溶胶的乳化活性、乳化稳定性、黏度特性以及微观结构的影响。研究结果表明,在400 MPa压力下经不同的处理时间,复合溶胶的功能性质均有显著性提高,其中乳化活性、乳化稳定性在处理10~15 min时达到最佳,与空白组相比分别提高了5.6%~6.2%和2.5%~2.7%,而黏度则在400 MPa/15 min时达最高值,比空白组提高了145.3%。同时扫描电镜分析得出,适当高静压处理可使多糖和蛋白质复合溶胶体系形成更加均匀致密的三维网络结构,二者间相互作用增强。
高静压(HHP);魔芋葡甘聚糖(KGM);大豆分离蛋白(SPI);乳化特性;黏度特性;微观结构
魔芋葡甘聚糖(konjac glucomannan,KGM) 为天然高分子多糖,为魔芋块根中提取的可溶性纤维[1],具有减肥、排毒、防癌、助消化、降血糖、降血压等多种功效[2];魔芋葡甘聚糖也具有很强的结合水能力,是食品加工中常用的增稠剂、稳定剂、膳食纤维补充剂等[3]。大豆分离蛋白(soybean protein isolated ,SPI)是以大豆粕为原料生产的一种全价蛋白类食品添加剂,蛋白质含量90%以上,氨基酸有近20种,是为数不多的可替代动物蛋白的植物蛋白[4-5]。但其乳化性、胶凝性及溶解性等性质与动物蛋白相比有较大差距[6],限制了其在食品工业中的广泛应用。研究表明,将魔芋葡甘聚糖与大豆蛋白经合适的物理共混,能得到较好乳化特性的复合食品饮料体系[7-8]。
高静压技术(high hydrostatic pressure, HHP)是近年来兴起的一种非热加工技术[9-10],利用高静压技术研究对食品中生物高分子的结构和特性的影响,已经成为当今高静压食品处理技术研究的前沿[11]。高静压处理生物大分子可使其获得较好凝胶性、流变性等品质,如SOLEIMAN等利用 950 MPa、 20 ℃处理 k-卡拉胶 20 min 后发现压力诱导多糖凝胶的黏度下降、亮度增加[12]; MU 等研究在800 MPa,加压 5 min,pH=8.0条件下,可使140 g/L的 β-乳球蛋白生成乳白色凝胶[13]。但这些研究多集中于对单一生物高分子影响的研究,然而食品体系往往是多种生物大分子相互作用的混合体系,对混合体系研究更具有实际意义。多糖和蛋白质作为食品体系其中最主要的高分子,两者复合体系的相互作用在很大程度上决定了食品的品质。但有关高静压对多糖-蛋白质复合体系性质影响的报道较少,对其复合溶胶特性以及微观结构等的研究更不多见。因此,本文以极具代表性和资源丰富的KGM和SPI复合物为研究对象,旨在探索高静压处理对该复合物功能特性以及微观结构的影响,以期为今后有关KGM-SPI复合溶胶产品的改良及其他多糖-蛋白复合体系的实际应用提供理论依据。
1 材料及方法
1.1试验材料及试剂
大豆分离蛋白(食品级),郑州亨多宝化工有限公司;魔芋胶(食品级),上海北连生物科技有限公司;大豆调和油(食品级),南海油脂工业有限公司;十二烷基硫酸钠(分析纯),成都市科龙化工试剂厂。
1.2仪器设备
SL602N高精显电子天平,上海民桥精密科学仪器有限公司; JJ-1精密增力电动搅拌器,金坛市城东新瑞仪器厂;HH-2数显恒温水浴锅,常州奥华仪器有限公司;STA-II高剪切乳化机,上海索祥电机设备制造有限公司; TC-500B真空封口机,上海星贝包装机械有限公司; HHP-M1高静压处理设备,包头科发高压技术有限责任公司;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;DHR-1流变仪,美国TA公司; PB-10精密pH计,德国Sartorius公司; S-3000N扫描电子显微镜,日本日立精密仪器公司;Avanti J-30I真空冷冻干燥机,美国贝克曼有限公司。
1.3实验方法
1.3.1 魔芋葡甘聚糖/大豆分离蛋白复合物制备及高静压处理
KGM-SPI复合溶胶制备参考谢建华等[14]的方法,将0.9%的KGM-SPI(7∶3)混合后溶于100 mL蒸馏水中,在250 mL烧杯中充分搅拌均匀,待KGM溶胀完全后,55 ℃恒温水浴30 min,搅拌均匀,立即冷却到室温,在4 ℃下静置12 h,待测。
高静压处理参考WANG等[6]的方法,将样品放入2层聚乙烯塑料袋中,进行真空热封,后将样品放入高静压处理设备中,将加压腔体密封,设置相应处理参数加压,升压速度为3.4 MPa/s,初始温度为20 ℃。处理参数为:(1)在15 min保压处理时间下,用200、300、400、500、600 MPa压力处理样品;(2)在400 MPa下,分别保压处理5、10、15、20 min。对照为未经高静压处理的样品。
1.3.2 乳化活性及乳化稳定性的测定
参照TANG等[15]采用浊度法来表征共混溶胶的乳化活性和乳化稳定性。按上述方法制备100 mL溶胶,加入40 mL调和大豆油,用高速乳化机在6 000 r/min条件下均质1 min;分别在0 min与10 min后取样,并以0.1% SDS稀释100倍后,在500 nm下测其吸光值,以0.1% SDS溶液为空白。在0 min下测得的吸光值为溶胶的乳化活性(EA),而乳化稳定性(ES)用乳化稳定指数(ESI)来表示,计算公式为
ESI=ΔT/(1-K)
(1)
式中:ΔT为时间差,K为静置10 min测得的吸光值与0 min测得的吸光值的比值[16]。
其中,SDS主要作用是为了防止油滴絮凝在比色皿的侧壁[17]。
1.3.3 黏度特性的测定
黏度特性的测定参考ZHU等人的方法并有所改进[18-19]。按1.3.1制备100 mL溶胶,采用DHR-1流变仪在25 ℃测定,测试夹具为40 mm 平板,间距为1 000 μm,频率1 Hz,剪切速率1~300 s-1。为了保持测量时的热和机械平衡,每个样品测量时间预设为静置5 min,测定前以硅油涂膜样品周围以免测量期间出现蒸发。表观黏度为溶胶测定表观黏度的初始值。
1.3.4 扫描电子显微镜(SEM)观察
参考ZHANG等对溶胶扫描电镜方法并有所改进[20-22]。将溶胶样品于培养皿中涂膜(厚薄均匀),后置于冰箱中预冷冻24 h,再使用真空冷冻干燥样品24 h。将干燥好的样品保存待用。扫描电镜观察前,将样品块用固定胶粘于样品铜台,在真空度133.322×10-3Pa,溅射电压1.1~1.2 kV,镀膜时间2~3 min条件下镀金,放置10 min,再送入电镜观察,选择有代表性的区域拍摄。
1.4数据处理与分析
试验数据均用Origin 8.6与SPSS软件进行处理与分析,每组实验均重复3次,取平均值,试验结果以误差的形式标出。
2 结果与分析
2.1高静压处理对KGM-SPI复合溶胶乳化特性的影响
2.1.1 不同压力对KGM-SPI复合溶胶乳化特性的影响
不同压力处理KGM-SPI复合溶胶的乳化活性及乳化稳定性如图1所示。

图1 不同压力对KGM-SPI复合溶胶乳化活性及乳化稳定性的影响Fig.1 Effect of different pressure on emulsifying and emulsion stability of the KGM-SPI compositesol
从图1可以看出,KGM-SPI复合溶胶的乳化活性和乳化稳定性呈现先升高后降低的趋势。在0~400 MPa压力下,溶胶的乳化活性和乳化稳定性随着压力的升高而增加,并在400 MPa时达到最高;高于400 MPa后,乳化能力有所降低,出现下降的趋势。此结论与沙小梅等对高压处理大豆蛋白-大豆多糖体系的研究结果类似[23]。原因可能是当压力低于400 MPa时,随着压力升高,复合溶胶中的SPI蛋白高级结构逐渐伸展,疏水性氨基酸侧链外露,表面疏水性增加,亲油性提高,同时也提高了KGM-SPI的相互作用和溶解性[24-25],从而使乳化能力得到提高。但当压力超过400 MPa后,随压力逐渐增大,蛋白分子发生变性,进而发生进一步折叠和聚集, 导致复合大分子表面活性降低, 故乳化活性和乳化稳定性又呈下降趋势。
2.1.2 不同处理时间对KGM-SPI复合溶胶乳化特性的影响
不同时间处理KGM-SPI复合溶胶的乳化活性及乳化稳定性的变化趋势如图2所示。
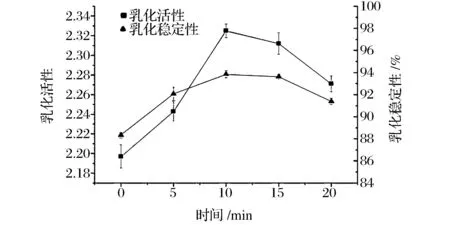
图2 不同处理时间对KGM-SPI复合溶胶乳化活性及乳化稳定性的影响Fig.2 Effect of different pressure holding time on emulsifying and emulsion stability of the KGM-SPI composite sol
由图2可知,在400 MPa下,0~20 min范围内,复合体系的乳化活性及乳化稳定性随压力处理时间呈现先升高后下降趋势。在处理10~15 min时,复合体系的乳化活性及乳化稳定性均达到较好,与对照组相比分别提高了5.6%~6.2%和2.5%~2.7%,这与袁道强等的研究结果基本相符[26]。出现此趋势的原因主要是随着处理时间的延长,蛋白分子得到更充分的伸展,内部氨基酸以及疏水基团、活性巯基的外露导致表面疏水性增加[27],与KGM的相互作用也逐渐增强,表面活性的增加导致了乳化性能的提高。而且与SPI发生相互交联的同时,KGM自身也占据了一定空间,减少了蛋白分子间的相互作用,防止了聚集和沉淀的出现,所以乳化稳定性提高。但在处理20 min以后,过长的处理时间使复合大分子裸露出来的基团被重新包裹,而界面活性逐渐降低[28],因此乳化能力随之下降。
2.2高静压处理对KGM-SPI复合溶胶黏度的影响
2.2.1 不同压力对KGM-SPI复合溶胶黏度的影响
不同压力处理对KGM-SPI复合溶胶黏度的影响如图3所示。从中可知,在0~600 MPa范围内,随着压力增大,复合溶胶的黏度依然呈现先增大后减小的趋势,与之前乳化活性、乳化稳定性的变化规律相同。在压力为400 MPa时,复合溶胶黏度达到最高,且与对照组相比有显著提高。溶胶的黏度主要与溶胶中物质的存在状态有关 ,即伸展状态的分子比无规则卷曲的分子体现出更大的表观黏度[29]。在0~400 MPa压力下,蛋白质的高级结构在一定程度上变性,分子逐渐伸展,在这个过程中KGM可能也起到了促进作用,同时,暴露出来的内部极性基团和疏水基团数量逐渐增加,从而使得两者间的交联作用得到进一步加强,体系的黏度随之增加。但当压力达到400 MPa以上时,过高的压力使溶胶分子转向收缩折叠,KGM-SPI之间有序的键合作用被破坏或重组,分子进一步聚集,水合度减小,溶液流动时受到的阻力大大减小[30],导致最终黏度下降。
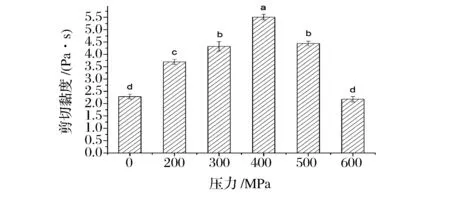
图3 不同压力对KGM-SPI复合溶胶剪切黏度的影响Fig.3 Effect of different pressure on viscosity of the KGM-SPIcomposite sol
2.2.2 不同处理时间对KGM-SPI复合溶胶黏度的影响
不同时间处理对KGM-SPI复合溶胶黏度的影响如图4所示。

图4 不同处理时间对KGM-SPI复合溶胶剪切黏度的影响Fig.4 Effect of different pressure holding time on viscosity of the KGM-SPI composite sol
从图4可知,随着时间的延长,复合溶胶的黏度依然呈先增大后减小的趋势,与之前复合溶胶乳化性、乳化稳定性等的变化基本相同,区别的地方在于,当处理15 min时体系黏度达到最高值,并且与空白对照组相比提高了145.3%。这与HEMAR 等的结果类似,他们发现在中等剪切速率(10~100 s-1)下, 300 MPa和450 MPa高静压处理15 min时观察到脱脂乳-明胶混合物黏度明显增加[31]。原因可能是在高压处理下,体系向体积减少的方向过渡,随着处理时间的延长,逐渐伸展的蛋白分子与KGM形成较好的键合作用,体系由混乱转为有序,不仅溶解度得到提高,结合水的能力也显著增强[32-33],表观黏度明显升高;过长的处理时间则使蛋白分子由伸展状态转向内部收缩,分子间缔合聚集加强,部分亲水区域重新被包裹在内部, 且与KGM之间发生热力学不相容性[34],导致复合物溶解性降低,因此体系黏度最终表现为下降。
2.3高静压处理对KGM-SPI复合溶胶显微结构的影响
2.3.1 不同压力对KGM-SPI复合溶胶显微结构的影响
综合乳化特性与黏度特性的研究结果,经200、400、600 MPa高静压处理后的复合溶胶样品功能性质差异显著,代表性强,故以它们作为研究对象来考察压力对复合体系显微结构的影响。不同压力下KGM-SPI复合溶胶的扫描电镜图如图5所示。

a、b、b、d分别是未处理、200、400以及600 MPa处理后的扫描电镜图片图5 不同压力处理KGM-SPI复合溶胶前后的扫描电镜照片(×200)Fig. 5 Effect of different pressure on SEM of the KGM-SPI composite sol(×200)
从图5可知,未经高静压处理的KGM-SPI复合体系 (图5-a)相互贯穿、交联形成一种三维网状结构,但存在大量的孔洞且连接的结构多数较细,孔洞的出现可能是因为KGM的存在促进了发生有序聚集前SPI蛋白亚基的展开。在200~400 MPa高静压处理后,交联的结构明显变粗(图5-b),孔洞数量与直径也大大减少,并且在400 MPa时形成较为均匀紧密的三维网络(图5-c),这与CAO等的研究结果很相似[35]。说明高静压处理后蛋白分子的结构发生变化,分子逐渐伸展开来,蛋白分子的聚集减少,同时与KGM间的相互作用得到加强,稳定性提高,表观体现于乳化特性以及黏度的升高。当处理压力达到600 MPa时,孔洞数量又明显增加,体系再次转向无序状态(图5-d),说明两者间的相互作用开始减弱,也与前面的研究结果一致。同时有研究结果表明,KGM与 SPI两者间的相互作用以氢键为主,这主要是因为KGM 为非离子型多糖,亲水性极强,而蛋白质与多糖分子链上含有大量的羟基、氨基、羰基等基团,氢键作用极易发生于KGM与 SPI 这样的分子中,且氢键易受高压等因素的影响[36]。
2.3.2 不同处理时间对KGM-SPI复合溶胶显微结构的影响
不同时间处理后KGM-SPI复合溶胶的扫描电镜照片如图6所示。

a、b、c、d分别是高静压400Mpa处理5min、10 min、15 min以及20 min后的扫描电镜图片图6 不同时间处理KGM-SPI复合溶胶的扫描电镜照片(×200)Fig.6 Effect of different pressure holding time on SEM of the KGM-SPI composite sol(×200)
从图6中可看出,处理时间对复合溶胶结构有显著影响,复合体系的三维结构原本混乱无序(图6-a),在400 MPa处理下,5~15 min范围内,逐渐变得均匀紧密,孔洞数量下降,直径减小(图6-b),说明体系内部的相互作用不断增强,稳定性也随之逐步提高,在10 min与15 min时出现较多均匀光滑的连续相 (图6-c),此时体系稳定性高, KGM-SPI复合溶胶的乳化特性与黏度能达到最好,证实了前面的实验结果。随着时间继续延伸,原本均匀紧密的结构逐渐瓦解,体系再度向无序状态过渡,孔洞的数量与直径都呈递增趋势(图6-d),说明在高压下过长处理反而使得复合物之间的相互作用由强转弱,但相比较而言,稳定性仍然高于空白对照组,依然具有明显优势[36],故其乳化特性与黏度依旧均显著优于对照组。
3 结论
高静压处理会对复合溶胶的内部结构产生影响,溶胶功能性质也随之发生改变。适当的高静压处理(本文处理条件为400 MPa),可以使KGM-SPI复合物的功能特性发生显著性改善。然而目前国内外关于高静压等非热加工技术应用于多糖/蛋白复合物改性的研究尚少,今后这方面还需要开展更多的研究,特别是对改性机理的探索,以期使经改性后的多糖/蛋白复合物在膳食纤维乳饮料、多糖类酸奶等食品领域中具有广阔的应用前景。
[1] KHANNA S, TESTER R.Influence of purified konjac glucomannan on the gelatinization and retrogradation properties of maize and potato starches[J]. Food Hydrocolloids, 2006, 20(5): 567-576.
[2] 卢学琴, 康德灿, 黄莉. 魔芋灵芝功能型复合酸奶的研制[J]. 食品科学, 2005, 26(9): 644-648.
[3] MARCANO J, HERNANDO I, FISZMAN S.In vitro measurements of intragastric rheological properties and their relationships with the potential satiating capacity of cheese pies with konjac glucomannan[J]. Food Hydrocolloids, 2015, 51: 16-22.
[4] MORAS B, REY S, VILAREM G,et al. Pressurized water extraction of isoflavones by experimental design from soybean flour and soybean protein isolate[J]. Food Chemistry, 2017, 214: 9-15.
[5] TORREZAN R, THAM W P, BELL A E,et al. Effect of high pressure on functional properties of soy protein[J]. Food Chemistry, 2007, 104(l): 140-147.
[6] WANG X S, TANG C H, LI B S,et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids, 2008, 22(4): 560-567.
[7] 闵维, 杨晓泉. 不同分子量葡聚糖与大豆7S蛋白混合凝胶的流变学性质[J]. 食品科学, 2010, 31(1): 43-47.
[8] 龚加顺, 彭春秀, 幸治梅, 等. 魔芋葡甘聚糖与大豆分离蛋白共混形成凝胶过程中的相互作用力研究[J]. 中国食品学报, 2006, 6(5): 64-68.
[9] CANDO D, MORENO H M, TOVAR C A,et al. Effect of high pressure and/or temperature over gelation of isolated hake myofibrils[J]. Food and Bioprocess Technology, 2014, 7(11): 3 197-3 207.
[10] GARCIA-GONZALEZ L, GEERAERD A H, SPILIMBERGO S, et al. High pressure carbon dioxide inactivation of microorganisms in foods: the past, the present and the future[J]. International Journal of Food Microbiology, 2007, 117(1): 1-28.
[11] 薛路舟, 陈淑花, 夏远景, 等. 超高压处理对生物大分子的影响研究进展[J]. 食品工程, 2009(1): 19-22.
[12] SOLEIMAN A, DICKINSON E.Gelation of iota-carrageenan and micellar casein mixtures under high hydrostatic pressure[J]. Journal of Agricultural and Food Chemistry, 2004, 52(6):1 705-1 714.
[13] KANNO C, MU TH.Gel formation of individual milk whey proteins under hydrostatic pressure[J]. Progress in Biotechnology, 2002, 19(2):453-460.
[14] 谢建华, 谢丙清, 庞杰,等. 魔芋葡甘聚糖与乳清蛋白的相互作用[J]. 食品科学, 2017, 38(5): 98-103.
[15] TANG S, HRTTIARACHCHY N S, HORAX R,et al. Physicochemical properties and functionality of rice bran protein hydrolyzate prepared from heat-stabilized defatted rice bran with the aid of enzymes[J]. Journal of Food Science, 2003, 68(1): 152-157.
[16] 管军军, 裘爱泳, 周瑞宝. 提高大豆分离蛋白乳化性及乳化稳定性的研究[J]. 中国油脂, 2003, 28(11): 37-42.
[17] PUPPO M C, SPERONI F, CHAPLEAU N,et al. Effect of high-pressure treatment on emulsifying properties of soybean proteins [J]. Food Hydrocolloid, 2005, 19(2): 289-296.
[18] ZHU J H, YANG X Q, AHMAD I,et al. Rheological properties of κ-carrageenan and soybean glycinin mixed gels[J]. Food Research International, 2008, 41(3): 219-228.
[19] 冯凌凌, 熊犍. 大豆浓缩蛋白粘度与动态粘弹性研究[J]. 食品与发酵工业, 2007, 33(12):36-39.
[20] ZHANG Y, TAN C, ABBAS S,et al. The effect of soy protein structural modification on emulsion properties and oxidative stability of fish oil microcapsules[J]. Colloids and Surfaces B: Biointerfaces, 2014, 120: 63-70.
[21] HUANG G Q, SUN Y T, XIAO J X,et al. Complex coacervation of soybean protein isolate and chitosan[J]. Food Chemistry, 2012, 135(2): 534-539.
[22] ZHU J, LI L, CHEN L,et al. Study on supramolecular structural changes of ultrasonic treated potato starch granules [J]. Food Hydrocolloids, 2012, 29(1): 116-122.
[23] 沙小梅, 胡姿姿, 涂宗财,等. 高压微射流压力对大豆蛋白-大豆多糖体系功能性质的影响[J]. 农业工程学报, 2016, 32(17):281-286.
[24] LIU C M, ZHONG J Z, LIU W,et al. Relationship between functional properties and aggregation changes of whey protein induced by high pressure microfluidization[J]. Journal of Food Science, 2011, 76(4): E341-E347.
[25] JAMBRAK A R, MASON T J, LELAS V,et al. Effect of ultrasound treatment on solubility and foaming properties of whey protein suspensions[J]. Journal of Food Engineering, 2008, 86(2): 281-287.
[26] 袁道强, 郭书爱. 超高压对大豆分离蛋白乳化性影响[J]. 粮食与油脂, 2009,(12) :23-25.
[27] ZHANG H, LI L, TATSUMI E,et al. High-pressure treatment effects on proteins in soy milk[J]. LWT-Food Science and Technology, 2005, 38(1): 7-14.
[28] 齐军茹, 杨晓泉, 彭志英. 蛋白-多糖复合物的制备及乳化性能的研究[J]. 食品科学, 2003, 19(11):75-78.
[29] FUSTIER P, ACHOURI A, TAHERIAN A R,et al. Protein-protein multilayer oil-in-water emulsions for the microencapsulation of flaxseed oil: Effect of whey and fish gelatin concentration[J]. Journal of Agricultural and Food Chemistry, 2015, 63(42): 9 239-9 250.
[31] HEMAR Y, LIU L H, MEUNIER N,et al. The effect of high hydrostatic pressure on the flow behavior of skim milk-gelatin mixtures [J]. Innovative Food Science amp; Emerging Technologies, 2010, 11(3): 432-440.
[32] CHEN X, CHEN C, ZHOU Y,et al. Effects of high pressure processing on the thermal gelling properties of chicken breast myosin containing κ-carrageenan[J]. Food Hydrocolloids, 2014, 40: 262-272.
[33] IWASAKI T, NOSHIROYAK, SAITOH N,et al. Studies of the effect of hydrostatic pressure pretreatment on thermal gelation of chicken myofibrils and pork meat patty[J]. Food Chemistry, 2006, 95(3): 474-483.
[34] 陈昀, 赵谋明, 孙哲浩. 蛋白质与多糖类交互作用研究进展[J]. 食品科学, 2001, 22(4): 90-93.
[35] CAO Y, XIA T, ZHOU G,et al. The mechanism of high pressure-induced gels of rabbit myosin[J]. Innovative Food Science amp; Emerging Technologies, 2012, 16: 41-46.
[36] HU H, LI-CHAN E C Y, WAN L,et al. The effect of high intensity ultrasonic pre-treatment on the properties of soybean protein isolate gel induced by calcium sulfate[J]. Food Hydrocolloids, 2013, 32(2): 303-311.
Effectofhighhydrostaticpressuretreatmentonthefunctionalpropertiesofkonjacglucomannan/soybeanproteincompositesol
TIAN Xue-zhi1,2, LONG Chang-zhou1,2, WANG Zi-yu1,2, ZHANG Ya-ning1, ZHANG Fu-sheng1*
1(College of Food Science, Southwest University, Chongqing 400715, China) 2(National Food Science and Engineering Experimental Teaching Center,Southwest University,Chongqing 400715,China)
Effect of high hydrostatic pressure on the functional properties of polysaccharide-protein mixture system was studied. Using konjac glucomannan(KGM) and soybean protein isolate(SPI) as raw materials, the emulsifying activity, emulsifying stability, viscosity properties and microstructure of the composite sol were investigated under high hydrostatic pressure . The results showed that the functional properties were significantly improved treated at 400 MPa pressure, the emulsifying activity and emulsifying stability achieved the best at 10-15 min (increased by 5.6%-6.2% and 2.5%-2.7% ), the viscosity also reached the highest value at 15min and increased 145.3% compared with the control group. Moreover, SEM analysis showed that the more uniform and dense three-dimensional network structure of the compound structure was formed after 400 MPa treatment, and the interaction between the polysaccharide and protein was enhanced.
high hydrostatic pressure (HHP); konjac glucomannan (KGM); soybean protein isolate (SPI); emulsifying properties; viscosity properties; microstructure
10.13995/j.cnki.11-1802/ts.014496
本科生(张甫生副教授为通讯作者,E-mail: zfsswu@163.com)。
国家自然科学项目基金(31301599);中国博士后科学基金(2014M551502)
2017-04-10,改回日期:2017-05-12

