产β-葡萄糖苷酶细菌的筛选及转化白藜芦醇的研究
冯薇 胡小妍 马明娜 郭萌 路福平 李玉
(天津科技大学生物工程学院 工业微生物教育部重点实验室,天津 300457)
产β-葡萄糖苷酶细菌的筛选及转化白藜芦醇的研究
冯薇 胡小妍 马明娜 郭萌 路福平 李玉
(天津科技大学生物工程学院 工业微生物教育部重点实验室,天津 300457)
白藜芦醇具有抗癌、抗氧化等八大功效,在医药、化妆品等领域应用广泛。为获得分泌β-葡萄糖苷酶的细菌菌株,并实现其对虎杖苷的有效转化。通过栀子苷平板初筛、虎杖苷摇瓶复筛,筛选得到一株能够分泌β-葡萄糖苷酶,转化虎杖苷生成白藜芦醇的菌株,并利用16S rDNA序列对筛选得到的菌株进行鉴定,鉴定为沙福芽孢杆菌(Bacillus safensis),命名为CGMCC 13129,该菌株在37℃,接种量为7%,底物虎杖苷浓度为0.1%,pH为7,转化8 h的条件下,对底物虎杖苷的转化率可达90%以上,利用HPLC、HPLC-MS、1H-NMR等手段检测转化产物为白藜芦醇,经甲醇萃取一次,纯度高达99.3%。
白藜芦醇;沙福芽孢杆菌;β-葡萄糖苷酶;虎杖苷
白藜芦醇是一种非黄酮类多酚物质,化学名称为芪三酚,分子式为C14H12O3,无色针状结晶,熔点256-258℃,较难溶于水,易溶于甲醇、乙醇等有机溶剂,光、热稳定性差。广泛存在于蓼科、葡萄科等70多种植物中。它具有良好的治疗阿尔茨海默病、清除易形成聚集体的病理性蛋白、保护心血管系统、抗抑郁及神经保护、抑制肿瘤恶性增殖[1-5]等功效。因其可应用于保健品、化妆品、医药等行业而受到人们的关注。
白藜芦醇的生产方式主要包括植物提取法、化学合成法和生物转化法。张景亚等[6]优化超声提取花生衣中白藜芦醇的工艺,使其平均提取率达0.3%。Guiso 等[7]利用3,5-二乙酰氧基苯乙烯与对乙酰氧基碘苯发生Heck 反应,水解得到白藜芦醇,总产率达70%。Solladie 等[8]应用Perkin 反应以对异丙氧基苯乙酸和3,5-二异丙氧基苯甲醛为原料,获得单一顺式构型白藜芦醇,经异构化、脱除保护基得反式白藜芦醇,总收率达55.2%。碳负离子与羰基发生亲核加成反应[9],所得的烃基消除后可以形成双键,合成路线步骤较繁琐,但是该方法利于构型选择。生物转化法中,田天丽等[10]用根霉与中药虎杖共发酵的方法获得产物白藜芦醇;白藜芦醇酶法提取条件温和,提高原料利用率和产物得率,但成本较高。一般采用多种酶复合,应用较多的是糖苷酶和纤维素酶。黄志芳等[11]用纤维素酶将虎杖中的虎杖苷酶解成白藜芦醇,使白藜芦醇得率比醇提法提高近5倍。
植物中游离的白藜芦醇极少,约为0.01%,多结合葡萄糖以苷(虎杖苷)的形式存在;因此从植物中提取白藜芦醇的收率不高。白藜芦醇的光热不稳定性,又限制了化学合成法在白藜芦醇生产中的应用。真菌转化虎杖苷的时间较长,且不便于产物的分离纯化。利用酶法水解,效率稍有提高,但成本也非常高。β-葡萄糖苷酶能够水解结合于末端非还原性的 β-D- 葡萄糖苷键,同时释放出 β-D-葡萄糖和相应的配基[12],虎杖苷可被β-葡萄糖苷酶水解为白藜芦醇。利用能够分泌β-葡萄糖苷酶的菌株转化虎杖苷生成白藜芦醇有效可行,且开发一种转化时间短,反应条件温和,转化率高的生产白藜芦醇的方法尤为重要。
1 材料与方法
1.1 材料
1.1.1 菌种来源 采自湖北省随州市常年种植虎杖的土壤。
1.1.2 主要试剂和仪器 甲醇(色谱纯),乙腈(色谱纯),白藜芦醇标准对照品(98%)、栀子苷(50%)、虎杖苷(50%)均购自南京狄尔格医药公司。PTC-200型PCR基因扩增仪(MJ Research Inc.)、高效液相色谱仪(安捷伦科技有限公司)、色谱柱(Agilent Zorbax SB-C18)、旋转蒸发仪(瑞士buchi)。
1.1.3 培养基 筛选培养基:纯度为50%的栀子苷3 g/L,精氨酸 2 g/L,tryptone 10 g/L,yeast extract 5 g/L,NaCl 10 g/L,琼脂20 g/L;种子培养基:精氨酸2 g/L,tryptone 10 g/L,yeast extract 5 g/L,NaCl 10 g/L;转化培养基:牛肉膏5 g/L,tryptone 10 g/L,NaCl 5 g/L,纯度为50%的虎杖苷1 g/L。
1.2 方法
1.2.1 菌种采集与分离纯化 用生理盐水冲洗虎杖根,浸泡摇匀后,梯度稀释,分别涂布于含有卡那霉素、氨苄青霉素、0.3%的栀子苷的固体培养基上和含有0.3%的栀子苷的LB固体培养基上,栀子苷与β-葡萄糖苷酶反应发生明显的蓝色变化[13],观察菌落生长情况,编号记录。
1.2.2 底物转化及产物的提取与精制 挑取单菌落,接入种子培养基中,培养至对数期后转接入转化培养基中,37℃。220 r/min,摇瓶转化培养。将完成转化的发酵液离心后,弃去上清,向沉淀中加入甲醇,再次离心后取上清,弃去沉淀,利用旋转蒸发仪将甲醇蒸出,得到产物白藜芦醇。
1.2.3 转化产物检测与含量分析 利用HPLCMS检测的方法为:流动相为乙腈∶水∶甲酸=40∶59.94∶0.06;色谱柱:GRACE Vydac 218TPC18;检测波长:306 nm;柱温:35℃。利用1H-NMR(400 MHz)检测参照 Christian S 等[14]的方法,氘代丙酮(C3D6O)溶解产物干燥粉末样品。利用HPLC检测的方法为:流动相为乙腈∶水∶磷酸=40∶59.82∶0.18;色谱柱:Agilent Zorbax SB-C18;检测波长:306 nm;柱温:35℃。配制1 mg/mL白藜芦醇溶液,利用高效液相测定白藜芦醇在进样量分别为0.2、0.4、0.6、0.8、1.0 μL时的峰面积,得到白藜芦醇标准曲线,结果见图1白藜芦醇浓度与峰面积关系标准曲线。
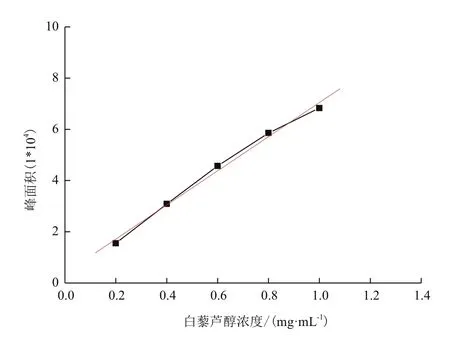
图 1 白藜芦醇浓度与峰面积的关系(Y=0.380 5+6.665 5X,R=0.996 28)
2 结果
2.1 菌株的筛选与鉴定
利用1.2.1中所述的方法,筛选得到一株能够分泌β-葡萄糖苷酶的菌株CGMCC 13129,因β-葡萄糖苷酶可水解固体培养基中的栀子苷,生成生产蓝色络合物京尼平,在菌落周围出现了明显的蓝色,如图2所示,证明该菌株能够分泌β-葡萄糖苷酶。菌株经革兰氏染色呈阳性、短杆状、有芽孢,芽孢中生、不膨胀,属于典型的芽孢杆菌属形态特征,其个体形态如图3所示。

图 2 菌株在初筛平板上的菌落形态
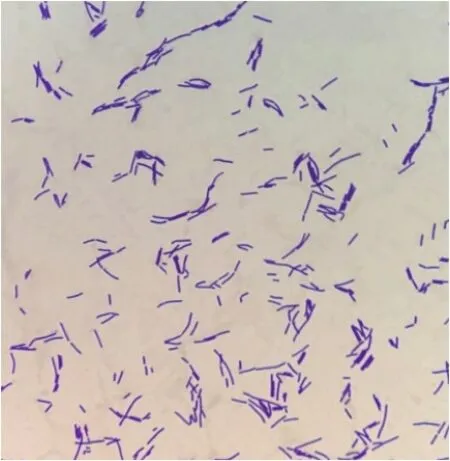
图3 菌株的个体形态(100×10)
通过PCR获得16S rDNA序列,经测序,分析其大小为1 373 bp,利用NCBI数据库进行对比分析,结果表明该菌与芽孢杆菌属的多个沙福芽孢杆菌具有99%以上的同源性。系统进化树如图4所示。综合菌株的16S rDNA序列分析,确认该菌株为沙福芽孢杆菌(Bacillus safensis),保藏编号为CGMCC 13129。
2.2 利用沙福芽孢杆菌转化虎杖苷生产白藜芦醇
利用1.2.2中所述方法,将种子液接入发酵培养基中,接菌前培养基澄清,如图5所示。接菌后进行摇瓶培养,随着菌体大量生产繁殖,培养基变得浑浊;摇瓶培养8 h后,有明显的团状沉淀出现,上清液中菌体浓度明显降低,如图6所示,产物难溶于水在液体培养基中结晶析出,摇瓶底部出现大量白色沉淀。

图 4 菌株的系统进化树

图 5 接种B.safensis菌前的培养液

图 6 接种B.safensis菌后转化8 h的培养液
2.3 底物浓度与转化时间对转化结果的影响分析
利用1.2.2中所述方法对虎杖苷进行转化,分别对底物浓度和转化时间进行优化,由图7可知,当底物虎杖苷浓度为0.1%时转化率较高,为90%左右;当底物虎杖苷浓度为0.2%时,转化率趋近于0%。随着底物虎杖苷浓度增加,转化率迅速降低,底物浓度过高影响菌体生长繁殖,而导致底物几乎不被转化。由图8可知,当转化时间为8 h时,转化率较高,短于或长于8 h,转化率均降低;6 h时因未完全转化导致测得的转化率较低,而转化时间过长,产物白藜芦醇被降解,导致转化率下降,朱屹东[15]也分析了类似的问题,利用沙福芽孢杆菌转化虎杖苷8 h,转化率就能达到90%,可大大缩短转化时间,显著降低白藜芦醇的工业化生产成本。
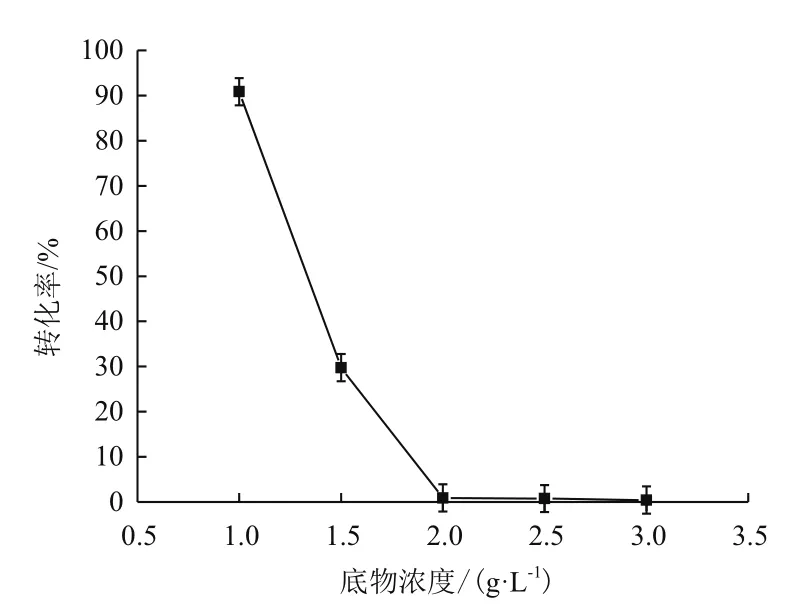
图 7 底物浓度与转化率的关系
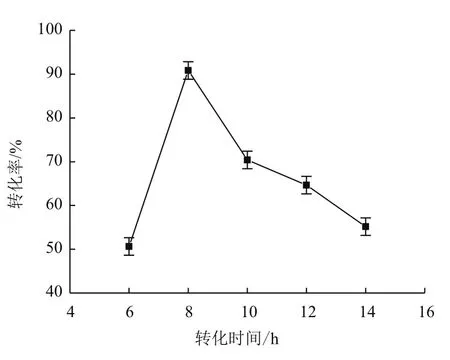
图 8 转化时间与转化率的关系
2.4 产物的分析与检测
2.4.1 利用HPLC检测产物 利用1.2.3中方法检测转化产物,对比图9和图10可知转化产物与白藜芦醇标准品的出峰时间相同,产物经甲醇萃取一次,纯度可高达99.3%。
2.4.2 利用HPLC-MS检测产物的纯度 利用1.2.3中方法对产物纯度进行检测,白藜芦醇分子量为:228.25,分析图11及图12可知转化产物与白藜芦醇标准品分子量相同,确定转化产物为白藜芦醇,且纯度较高。
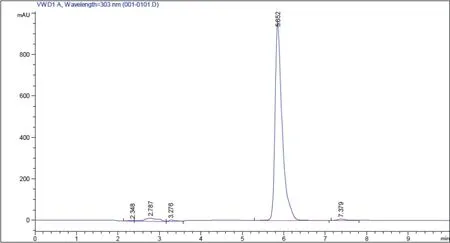
图9 白藜芦醇标准品HPLC图
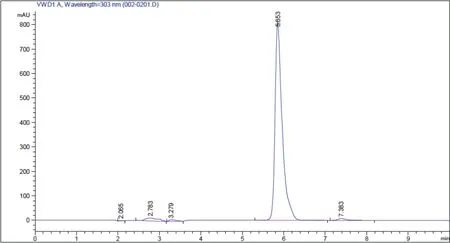
图10 转化产物HPLC图
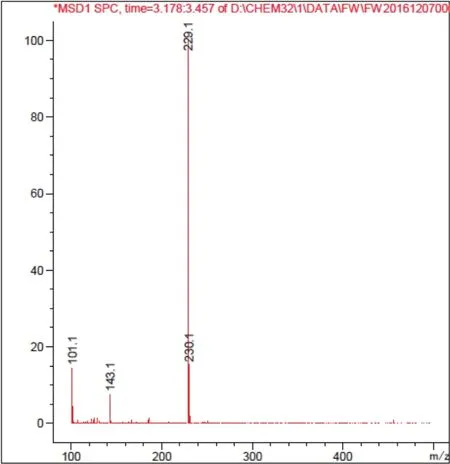
图 11 白藜芦醇标品HPLC-MS图
2.4.31H-NMR检测产物的结构 利用1.2.3中1H-NMR检测方法对产物结构进行检测,分析图13,1H-NMR(400 MHz,C3D6O):δ 7.02(d,J = 16 Hz,1H),6.88(d,J = 16 Hz,1H),可知产物为反式白藜芦醇。
3 讨论
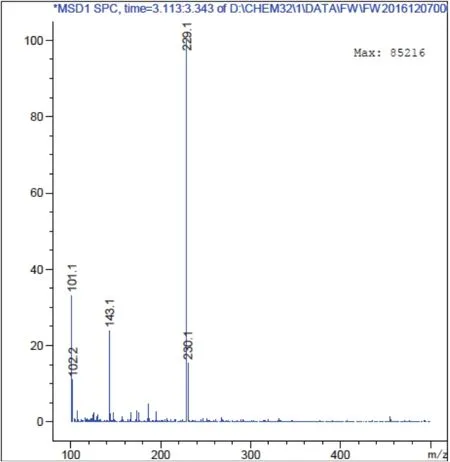
图 12 产物HPLC-MS图
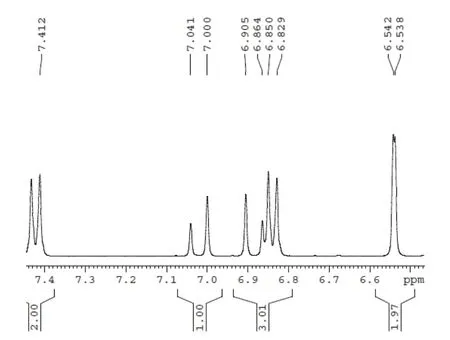
图13 产物1H-NMR图
目前国内利用微生物转化法生产白藜芦醇的研究已较多,但主要集中在利用黑曲霉[16]、根霉菌[17]、酿酒酵母工程菌[18-21]等真菌转化,真菌转化耗时较长,需5-8 d左右,且不利于产物白藜芦醇的分离纯化。而关于细菌转化白藜芦醇的报道较少,国内朱屹东[15]构建了一株强化酪氨酸合成的白藜芦醇生产菌株,以葡萄糖为底物,最终白藜芦醇产量为71.6 mg/L,副产物主要有白藜芦醇二聚体和氧化白藜芦醇;本方法的产量是其方法的4倍且几乎无副产物。国外的研究中,Watts 等[22]以香豆酸作为底物,白藜芦醇产量为100 mg/L;Katsuyarnal 等[23]以香豆酰辅酶A为底物,白藜芦醇产量为171 mg/L Lim和Koffas 等[24]以对香豆酸为底物,白藜芦醇产量达到2.3 g/L。利用沙福芽孢杆菌转化底物虎杖苷生成白藜芦醇,转化率可达到90%以上,仅8 h即可完成一次转化。转化过程中,培养基由澄清变为浑浊,最后又变得较澄清。在显微镜下观察菌体和产物,发现大多数菌体被包含在产物内部,分析该现象出现的原因是产物白藜芦醇在转化过程中,以菌为晶核,因难溶于水而结晶析出。这个现象为后期产物的分离纯化提供了良好的先决条件,使得产物经一步甲醇萃取过程,纯度便可高达99.3%。
沙福芽孢杆菌分离自常年种植虎杖植物的土壤,而虎杖植物中虎杖苷的含量较低,自然条件下,菌株适应低浓度虎杖苷的环境,对底物虎杖苷的耐受能力较弱,高浓度底物虎杖苷对菌体生长繁殖影响较大,当底物虎杖苷浓度增加时,底物转化率显著下降,甚至无转化产物生成。综合考虑研究中出现的问题,对比构建高效的外源基因表达系统、细胞固定化与敲除底物浓度限制因素的基因等3种方法的优势与劣势,后续会考虑对沙福芽孢杆菌全基因组测序,改造其代谢途径,提高其对底物的耐受性,进一步提高底物的转化率。
4 结论
在肉汤培养基中,底物浓度为0.1%,接种量为7%,37℃,220 r/min摇瓶转化8 h,转化率高达90%以上。经甲醇萃取一次,纯度可高达99.3%;通过HPLC、HPLC-MS、1H-NMR检测确定产物为反式白藜芦醇。
[1]Tennen RI, Michishita-Kioi E, Chua KF. Finding a target for resveratrol[J]. Cell, 2012, 148(3):387-389.
[2]董雯, 王蓉. 白藜芦醇诱导细胞自噬在神经退行性疾病进展中的作用[J]. 药学学报, 2016(1):18-22.
[3]Zong Y, Sun L, Liu B, et al. Resveratrol inhibits LPSinduced MAPKs activation via activation of the phosphatidylinositol 3-kinase pathway in murine RAW 264. 7 macrophage cells[J]. PLoS One, 2012, 7(8):e44107.
[4]Ferretta A, Gaballo A, Tanzarella P, et al. Effect of resveratrolon mitochondrial function:Implications in parkin-associated familiar Parkinson’s disease[J]. Biochim Biophys Acta, 2014, 1842(7):902-915.
[5]Li Y, Zhu W, Li J, et al. Resveratrol suppresses the STAT3 signaling pathway and inhibits proliferation of high glucoseexposed HepG2 cells partly through SIRT1[J]. Oncol Rep, 2013, 30(6):2820-2828.
[6]张景亚, 李朋伟, 仝艳, 等. 超声波辅助提取花生衣中的白藜芦醇[J]. 安徽农业科学, 2011, 9(19):11940-11941.
[7]Guiso M, Marra C, Farina A. A new efficient resveratrol synthesis[J]. Tetrahedron Lett, 2002, 43(4):597-598.
[8]Solladie G. A reinvestigation of resveratrol synthesis by Perkins reaction[J]. Tetrahedron, 2003, 59(18):3315-3321.
[9]Alonso E, Ramon DJ, Yus M. Simple synthesis of 5-substituted resorcinols:A revisited family of interesting bioactive molecules[J]. J Org Chem, 1997, 62(2):417-421.
[10]田天丽. 微生物发酵转化虎杖的研究[D]. 成都:四川大学,2007.
[11]黄志芳, 易进海, 刘倩伶, 等. 酶解法提取纯化虎杖提取物中白藜芦醇的工艺研究[J]. 天然产物研究与开发, 2009, 21(5):1061-1064.
[12]任建伟. β-葡萄糖苷酶高产菌株选育及发酵条件优化[D].杭州:浙江大学, 2016.
[13]李大力. 一种产β-葡萄糖苷酶的微生物的筛选方法[P]. 中国专利:105543334A, 2016-05-04.
[14]Jungong CS, Novikov AV. Practical preparation of resveratrol 3-O-β-D-glucuronide[J]. Synthetic Communications, 2012, 42(24):3589-3597.
[15]朱屹东. 代谢工程改造大肠杆菌生产白藜芦醇[D]. 无锡:江南大学, 2016.
[16]许南儿, 罗榴彬, 梅建凤, 等. 生物转化法提高虎杖中白藜芦醇的含量[J]. 药物生物技术, 2012, (05):411-413.
[17]袁润蕾, 徐萌萌, 孙艳娟, 等. 微生物转化虎杖苷粗提物生成白藜芦醇的研究[J]. 时珍国医国药, 2008, (03):712-714.
[18]孙萍, 郭丽琼, 黄佳俊, 等. 酿酒酵母工程菌生物合成白藜芦醇[J]. 中国食品学报, 2016, (03):68-74.
[19]Beekwilder J, Wolswinkel R, Jonker H, et al. Production of resveratrol in recombinatmicroorganisms[J]. Applied and Environmental Microbiology, 2006, 72(8):5670-5672.
[20]Becker JVW, Armstrong GO, Van der Merwe MJ, et al. Metabolic engineering of Saccharomyces cerevisiae for the synthesis of the wine-related antioxidant resveratrol[J]. FEMS Yeast Research,2003, 4(1):79-85.
[21]Zhang YS, Li SZ, Li J, et al. Using unnatural protein fusions to engineer resveratrol biosynthesis in yeast and mammalian cells[J]. Journal of the American Chemical Society, 2006, 128(40):13030-13031.
[22]Watts KT, Lee PC, Schmidt-Dannert C. Biosynthesis of plantspecific stilbene polyketides in metabolically engineered Escherichia coli[J]. BMC Biotechnology, 2006, 6 :12.
[23] Katsuyama Y, Funa N, Miyahisa I, et al. Synthesis of unnatural flavonoids and stilbenes by exploiting the plant biosynthetic pathway in Escherichia coli[J]. Chemistry & Biology, 2007, 14(6):613-321.
[24]Lim CG, Fowler ZL, Hueller T, et al. High-yield resveratrol production in engineered Escherichia coli[J]. Applied and Environmental Microbiology, 2011, 77(10):3451-3460.
The Screening of β-Glycosidase-producing Strain and the Transforming of Resveratrol
FENG Wei HU Xiao-yan MA Ming-na GUO Meng LU Fu-ping LI Yu
(Key Laboratory of Industrial Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457)
Resveratrol has a lot of benefits such as anti-cancer and anti-oxidation,and thus is widely applied in cosmetics,medicine and so on. This study aims to screen bacteria which can secrete β-glycosidase and study it’s ability of transforming polydatin. Through the geniposide plate screening and polydatin shake flask,a strain secreting β-glucosidase and transforming polydatin to resveratrol was acquired. It was identified as Bacillus safensis by 16S rDNA sequence analysis,named as CGMCC 13129. Under these conditions of 37℃,with 7 percent of inoculation,pH7,and conversing for 8 h,the conversion rate of polydatin was up to 90%. HPLC,HPLC-MS and1H-NMR were used to test and identify the product as resveratrol,and the purity of the product was up to 99.3% by one-time methanol extraction.
resveratrol;Bacillus safensis;β-glycosidase enzyme;polydatin
10.13560/j.cnki.biotech.bull.1985.2017-0439
2017-05-27
国家重点研发计划专项项目(2016YFD0400803)
冯薇,女,本科,研究方向:微生物与生化药学;E-mail:fengwei@mail.tust.edu.cn
李玉,女,教授,研究方向:应用微生物与酶工程;E-mail:liyu@tust.edu.cn
(责任编辑 朱琳峰)

