果树赤霉素代谢与信号途径研究进展
王文然 樊秀彩 张文颖 刘崇怀 房经贵 王晨
(1. 南京农业大学园艺学院,南京 210095;2. 农业部果树育种技术重点实验室,郑州 450009)
果树赤霉素代谢与信号途径研究进展
王文然1樊秀彩2张文颖1刘崇怀2房经贵1王晨1
(1. 南京农业大学园艺学院,南京 210095;2. 农业部果树育种技术重点实验室,郑州 450009)
赤霉素作为5大植物激素之一,在果树的花芽分化、花序发育、开花坐果、果实的生长发育及植株的形态建成等方面扮演着重要的角色,但对果树赤霉素的分子生物学研究与其他大田作物相比差距较大。为了在果树生产中能更加合理有效地利用赤霉素调控果树花果发育,研究果树赤霉素的合成及其信号转导途径的分子调控机制十分必要。研究发现GA合成的关键酶KO、GA2ox及GA20ox的表达均与果树矮化呈负相关,而KS的含量则与植株高矮呈正相关,板栗雄性不育现象也与KO、KAO的表达量密切相关。GAMYB基因及LFY基因则在果树的成花诱导和雄蕊发育等生殖生长过程中发挥重要作用。DELLA蛋白在果树的GA信号途径中作为负调控因子可致使矮化植株形成,在果树的细胞周期循环过程、转录调控、花的形成、细胞的信号转导及许多生理过程中,DELLA蛋白泛素化降解均扮演着至关重要的角色。主要从果树赤霉素的合成及赤霉素的信号途径两大方面,着重对果树赤霉素合成过程中的关键酶基因及其定位、果树赤霉素信号途径的重要元件如赤霉素受体GID1、DELLA蛋白等进行了综述,以期为高效利用赤霉素调控果树生长发育提供重要的理论参考。
果树;赤霉素;代谢;信号转导
1934年,Teijiro Yabuta等最先从恶苗病菌的发酵滤液中分离获得有效成分的非结晶体,该成分能促进水稻的徒长,并于1938年正式命名为赤霉素(Gibberellin,GA)[1]。赤霉素是一种四环二萜类化合物,是高等植物的天然产物,在已知的136种天然赤霉素中仅 GA1、GA3、GA4、GA7具有生理活性[1]。GA最显著的生理作用之一是对植株高矮的控制,研究发现植株的高矮与GA的种类及其信号途径密切相关;其次发育中的种子产生大量GA抑制其花芽形成以维持果实正常生长;并且在A环第2位置上含有双键的GAs对恢复果树童年性状十分有效,可应用于生根难的砧木自根苗的繁殖。另外,五大激素中除ABA外,GA在果树萌发过程中影响最大。GA对葡萄等GA敏感的树种作用尤为重要,GA可引起葡萄的单性结实,GA3可促进葡萄果粒增大、果穗长度拉长,果实的单果重相对增大,可提高果实的色素含量、降低果实有机酸的含量,并且可溶性固形物、还原性糖等都有提高,提高葡萄的整体品质[2]。果树中关于GA的研究取得了一定的成果,但与其他大田作物相比研究不够深入,尤其是GA的分子生物学领域。本文从赤霉素的生物合成及赤霉素信号转导途径两方面对果树的研究成果进行综述,以期为果树赤霉素信号的系统研究提供理论依据。
1 赤霉素的合成与代谢
1.1 赤霉素的生物合成
GA在高等植物中合成途径可大致分为3个阶段,第一阶段是在质体中进行的,GA合成前体GGPP(Geranylgeranyl pyrophosphate) 经 CPS(Copalyl pyrophosphate synthase)、KS(Endogen-shell synthase)的催化环化为Ent-kaurene;第二阶段是在内质网中进行的,KO(Endogen - kauri oxidase)和KAO(Endogen - kauri acid oxidase)催化氧化内根-贝壳杉烯,形成了GA的最初产物GA12-醛,并进一步转化为GA12、GA53;第三阶段是在细胞质基质中 GA12、GA53经 GA20ox(GA 20-oxidase)、GA3ox(GA 3-oxidase)、GA2ox(GA 2-oxidase)的一系列氧化作用转变为其他种类的GAs(图1)。
1.2 果树中GA合成的关键酶基因的定位
如上所述,GA的合成是在细胞的不同部位按阶段进行,亚细胞定位分析发现苹果MdKO基因可能在内质网膜上[3],苹果MdGA20ox1基因在细胞核和细胞质膜上,其MdKS蛋白定位于细胞核、细胞质和细胞膜[4]。葡萄VvGA20ox1在细胞核内和细胞膜上表达,而VvKO、VvGA2ox2和VvGA2ox4、VvGA3ox4仅在细胞核内表达[5]。上述研究进一步证实,GA合成的生化反应可以在同一植株的不同组织中合成中间体,再运输到其他组织作为反应底物,最终被转化为有活性的形式。
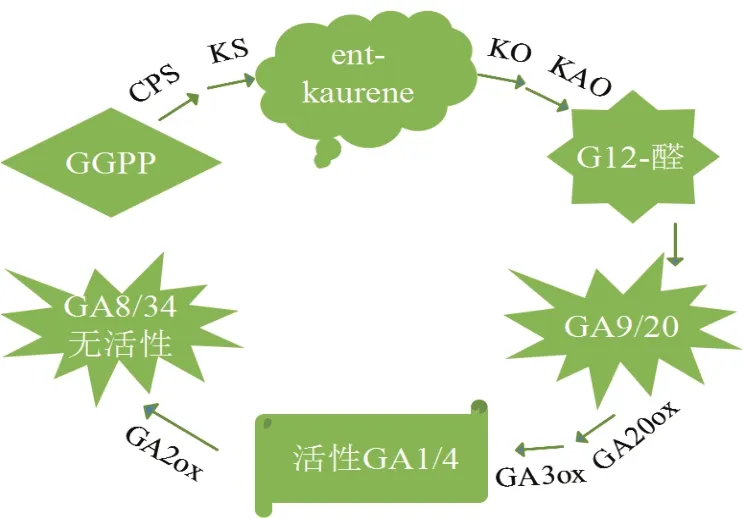
图1 GA生物合成途径示意图
1.3 果树中赤霉素生物合成基因的表达与调控
如图1所示,CPS、KS、KO、KAO、GA20ox、GA3ox及GA2ox 是GA合成过程中的关键酶,这些酶基因的表达受到活性赤霉素的反馈和前馈调节,通过促进或抑制基因的表达影响植株的整体生长发育和形态建成。
1.3.1 果树GA合成第一阶段的酶基因 相对于其他果树,苹果CPS和KS的研究较为深入。MdKS蛋白在细胞质体中参与了赤霉素的合成并具有一定的转录因子的作用[4]。目前针对苹果的柱型性状与赤霉素的关系,田义轲等[6]确定MdCPS基因与苹果的柱型性状无明显相关性,虽然KS基因的突变会引起植株矮化,但是柱型苹果与普通苹果MdKS基因的cDNA序列和氨基酸序列的差异不在其功能位点区域,因此认为苹果的柱型性状与该基因的关键位点碱基发生突变无关[7]。另有研究证实,赤霉素合成关键酶基因呈现的规律性变化与其生长进程是一致的,MdCPS、MdKS、MdKO和MdKAO这几种酶的转录水平均与器官的生长速度有关,生长越旺盛,其转录水平相对越高[8],对‘红阳’猕猴桃的CPS、KS、KO、GA20ox、GA3ox及GA2ox基因的研究得出了相似的结论[9];欧春青对梨的研究也证实,在生长旺盛的部位PcKAO基因表达水平较高[10]。该研究结果为探讨这几种关键酶基因对GA合成的影响规律和利用基因调控来影响果树发育提供了一定的理论依据。
1.3.2 果树GA合成第二阶段的酶基因 果树上草莓、苹果和梨等树种的KO基因也进行了研究。‘丰香’草莓KO基因不完全符合以往发表的P450酶的结构模式,被认为是新的一类P450酶[11],田伟也验证了MdKO属于细胞色素超家族P450系[3]。同时,还证明草莓内KO基因是家族基因,后续研究也表明,草莓中至少有两个不同基因共同编码KO,以响应不同的发育信号[11]。李节法等[12]克隆了梨PpKO基因,该基因在植株发育与形态建成方面起重要作用[13]。果树矮化是由多种原因引起的,GA合成过程中KO的失调表达是重要原因之一,植株的高矮与体内赤霉素的含量呈正相关,M26矮化砧木接穗GA合成的减少,是由于砧木KO的合成能力低[11];矮生梨‘中矮1号’中分离的PcKS的调控作用与PpKO基因相反,与植株的生长势呈负相关[15]。郭献平等[16]推测KO基因的突变是板栗短雄花序性状出现的原因。这些结果表明KO的表达水平与植株的高矮呈负相关,还与板栗短雄花序性状的出现密切相关。
KAO基因在赤霉素途径中与植株的形态建成有一定的关系。亚细胞定位显示,MdKOA1蛋白主要定位于细胞质与细胞质膜,这表明MdKOA1蛋白可能既能合成GA也能维持细胞稳定性[4]。板栗雄性不育的研究表明,板栗芽变短雄花序是赤霉素缺陷型突变体,KAO基因启动子区域碱基突变导致板栗芽变短雄花序中KAO表达量及赤霉素含量低,是板栗短雄花序产生的原因[17],这与李兴亮等[18]的研究结果一致。另有研究报道KAO基因突变也是植株矮化的原因,但通过梨矮化砧木‘中矮1号’与正常品种对比后发现其编码的蛋白序列完全一致,因此‘中矮1号’的矮化现象不是由于PCKAO1基因结构变异造成的[10]。
1.3.3 果树GA合成第三阶段的酶基因 如图1所示,GA2ox可以将有活性的GA1和GA4转化为无活性的GA8和GA34,从而降低GAs的活性。‘红阳’猕猴桃整个发育期GA2ox和DELLA基因的表达水平都较高导致其果实中GA含量低[9]。由于赤霉素的含量在植株的形态建成过程中起十分重要的作用,因此在培育无核品种、果树矮化及短枝形成机制的研究中,对赤霉素合成的关键酶的研究十分必要。VvGA2ox和VvGA3ox家族在葡萄无核品种胚珠败育的关键时期的异常表达影响GA的合成,进而导致葡萄胚珠败育[19-20]。已证实拟南芥中GA2ox过量表达而引起植株矮化[21],矮生梨的研究也证实GA2ox基因的过量表达是‘中矮1号’的矮化原因[21]。辛璐发现短枝型苹果‘苏帅’中与GA3ox4、GA2o8x和GRAS家族同源的基因调控其叶片中内源赤霉素的含量,并在其短枝的形成机制中发挥重要作用[22]。虽然对果树GA合成的关键酶的表达机制尚不清楚,但研究缺铁胁迫对梨的赤霉素信号途径的影响时发现,缺铁胁迫并未影响到GA2ox基因的表达机制[23]。因此,赤霉素信号途径的关键酶GA2ox、GA3ox在果树的矮化及短枝的形成过程中起很重要的作用。
现已先后在拟南芥、马铃薯和水稻中分离克隆出GA20ox基因,果树上也克隆了GA20ox基因如苹果 梨 Pb20ox[24], 板 栗 CmGA20ox1[16]。 宣 利 利 通过对比‘中矮1号’、‘锦香’及‘早酥’3个品种PcGAox1,推断该基因的表达与植株的矮化有直接关系[25],并成功地构建了转GA20ox基因菌株,为其功能验证奠定了基础[26]。赤霉素在果树萌发过程中发挥的生理效应是十分重要的,GA20ox有可能通过影响日本杏的GA信号途径而在其休眠过程发挥重要作用[27]。每个基因在不同组织器官中的表达存在明显的差异,葡萄VvGA2ox2主要在果实中表达,VvGA2ox4主要在叶片和果实中表达,VvKO和VvGA20ox1则在各个组织中均有一定水平的表达[5];番荔枝ASGA20ox在花蕾期I、未成熟的种子、结果枝、嫩茎和雌蕊中表达量相对较高[28];柑橘CuGA20ox1在营养组织比在生殖组织中表达量高,而CuGA20ox2在花蕾中特异表达[29]。GA20ox基因上调或下调表达均会影响植株的形态,短枝型苹果‘龙富短枝’的GA20ox和KO的下调表达使其赤霉素含量与普通品种存在显著差异,最终导致其枝条节间变短[30]。GA20ox的表达水平也是果树矮化重要因素之一。矮生突变体 A1[31]、苹果[32]、转 rol ABC基因枳橙[33]均是由于GA20ox的异常表达影响了GAs的合成出现矮化现象。研究果树矮化机制时,可通过分析关键酶的氨基酸序列来确定是否由于该基因发生突变导致果树矮化的,‘中矮1号’、‘早酥’和‘锦香’3个梨的品种的GA20ox和KO、KS基因的基因功能完全一致[15],因此认为该矮化品种是由于GA信号途径中的关键酶基因的上调或下调表达而导致的。
2 赤霉素的信号转导途径
GID1受体是一种存在于细胞质和细胞核之间的一种可溶性蛋白,GID1蛋白能特异性地结合活性GA,并进一步与DELLA蛋白结合形成复合体。该复合体通过介导DELLA蛋白的降解或抑制DELLA蛋白的活性,解除DELLA蛋白对GA反应系统的抑制作用,进而激活GA反应基因(图2)。

图 2 赤霉素信号转导途径
2.1 赤霉素的受体
赤霉素的生理功能是通过赤霉素的信号转导实现的,GA受体的发现有力地推动了GA信号转导研究的发展。1997年Nakajima等[34]发现GA受体,对拟南芥转录组的研究证明所有GA信号均是通过位于膜上的GID1起作用的。宋杨[30]分离并已初步证明短枝型苹果的赤霉素受体MdGID1基因,发现MdGID1含有两个外显子和一个内含子,上游调控序列具有植物激素、光和温度等顺式作用元件。‘砀山酥梨’的赤霉素受体GID1的4个等位基因相对表达量均会随缺铁程度加重而增加,其相对表达量都与赤霉素含量呈正相关[23]。
2.2 DELLA蛋白
2.2.1 果树中编码DELLA蛋白的基因 目前,果树中已经克隆出很多DELLA基因,如柱型苹果MdGai基因、短枝型苹果DELLA基因,并与湖北海棠和苹果砧木等其他DELLA基因进行了同源性分析并且建立了系统进化树[35]。研究人员对葡萄、樱桃和核桃果树的DELLA基因序列也进行了分析,如克隆并命名甜樱桃 PaGAI基因[36]和核桃 JrGAI基因[37],并对其开放阅读框长度、编码的氨基酸等方面进行分析;转基因植物的表型可作为明确某一基因生理功能的理论依据,转MdRGL1a基因的烟草表现出植株矮化、提早开花的特征,这一结果为明确MdRGL1a基因的生理功能奠定基础[38]。
2.2.2 DELLA蛋白在果树赤霉素信号途径中的作用 拟南芥的研究中证实,编码DELLA的基因可调控花芽发育,降解DELLA蛋白可以促进花芽的萌发,果树也做了相关的研究。梨花芽PpGAI基因对梨花芽休眠解除起到调控作用,且在表达量达到一定程度时促进花芽萌动开花[39]。GA能调控植物茎的伸长,从而决定植物的高度,因此通过改变植物体内GA的浓度或者GA的敏感性都有可能改变植物的高度,获得矮化植株。目前,在拟南芥、玉米和小麦等作物上都已经发现GA合成或信号转导受阻的突变体。果树中,‘平邑甜茶’无融合生殖矮生突变体由于MhGAI2突变,使DELLA不能感知GA信号并与GA结合降解成为阻遏蛋白,而出现矮化突变体[40]。通过上述研究成果可知,DELLA蛋白在果树的GA信号途径中作为负调控因子在其花芽发育及形态建成中发挥着重要作用。
2.3 GAMYB、LFY在植物花发育的作用
GAMYB是受GA诱导的MYB转录因子,GAMYB基因是DELLA蛋白的下游基因,GAMYB蛋白通过结合到GA应答基因的启动子上来诱导下游基因的表达。在GA信号转导过程中,GAMYB在植物成花诱导中具有非常重要的作用,它最早是从大麦的糊粉层中被鉴定出来,后来在拟南芥、水稻等中被分离和鉴定。FaGAMYB可能在草莓成花诱导和雄蕊发育中发挥重要作用[41];MdGAMYB与梨、梅花、草莓、枣和葡萄等的GAMYB蛋白有较高的同源性[42]。此外,由于GAMYB主要调控LFY等成花基因的表达影响开花,可推测MdGAMYB基因表达量的下降和下游成花基因表达量的下调密不可分。
在LFY启动子中,鉴定出1个响应GA的顺式作用元件,是GAMYB的靶基因,GAMYB基因可以通过激活LFY的表达而影响开花[42]。LEAFY(简称LFY)同源基因是一个调控植物花分生组织和花器官形成的特征基因,它是启动开花的枢纽。果树中部分树种已经克隆出LFY基因片段,如脐橙中LEAFY同源基因片段[43];苹果中AFL1、AFL2,但两同源基因在花和营养组织的发育中发挥不同的作用[44];‘糯米糍’荔枝中LcLFY基因在花序原基出现前后表达增强,但在花分化的阶段表达水平明显减弱[45]。综上所述,植物在营养生长向生殖生长转变的过程中需要很多基因的调控和一系列的信号转导,LFY基因在植物花的生长发育中发挥重要的作用。
2.4 赤霉素信号途径中泛素化降解
泛素化调控蛋白质降解在生命活动中具有重要意义,DELLA蛋白的泛素化降解是GA信号转导的关键。目前,果树上对DELLA蛋白泛素化降解也进行了相关的研究,进化分析表明从草莓中分离出的两个SKP1基因,它们与梨、苹果、樱桃互为同源基因[46];柑橘Pt-F-box位于细胞核中,具有核定位功能[47];半矮生型桃F-box基因是调控节间伸长的关键因子[48];香水柠檬LFB1可能还与植株的生长发育、花粉发育以及环境胁迫有一定关系[49]。综上所述,在细胞周期循环过程、转录调控、植物花的形成、细胞的信号转导以及许多生理过程中,蛋白泛素化降解均扮演着至关重要的角色。
3 结语
植物激素在植物生长的各个阶段,以及在生物和非生物胁迫反应过程中都发挥着重要的作用,因而植物激素及其信号途径的研究至关重要。虽然具有重要经济价值的果树苹果和梨上报道了一些GA合成的关键基因,如KO、GA20ox、GA2ox和GA3ox,及GA信号途径的重要元件,但是在实际生产中的应用仍有许多问题需要解决,主要表现在以下几方面:(1)GA如何以极其微量的成分调控果树生长、发育及其对环境适应的机制。(2)如何合理使用GA对果树生长进行有目的调控。(3)GA信号转导途径是一个复杂的过程,包括赤霉素信号的感受,转导以及最终的特定反应等,与其他植物激素之间还存在着交互作用,它们之间形成复杂的网状结构,其相互作用机制还需进一步深入研究。
因此,今后关于果树GA及其信号途径的研究应在更注重分子水平研究的同时,结合实际生产,为GA在农业生产的应用和分子设计育种提供理论指导。
[1]邢超, 陈永胜, 李跃, 等. 赤霉素代谢和信息转导及其对植株表型的影响研究进展[J]. 安徽农业科学, 2015(35):225-226.
[2]何昕孺. 赤霉素对摩尔多瓦葡萄果实生长发育及品质的影响[D]. 银川:宁夏大学, 2013.
[3]田伟, 田义轲, 王彩虹, 等. 苹果内根-贝壳杉烯氧化酶基因的克隆及序列分析[J]. 果树学报, 2011, 28(1):1-7.
[4]姜志昂, 彭建营, 孙建设. 苹果MdKS、MdKOA1基因克隆与表达分析[J]. 植物遗传资源学报, 2014, 15(2):362-368.
[5]王西成, 任国慧, 房经贵, 等. 葡萄赤霉素合成相关基因克隆,亚细胞定位和表达分析[J]. 中国农业科学, 2012, 45(11):2224-2231.
[6]田义轲, 白牡丹, 王彩虹, 等. 苹果MdCPS基因的克隆, 定位及其在柱型/普通型间的表达差异分析[J]. 华北农学报,2014, 29(6):21-27.
[7]邓晓云, 戴洪义, 梁美霞. 苹果内根-贝壳杉烯合成酶基因的克隆及表达分析[J]. 华北农学报, 2013, 28(2):46-51.
[8]刘云龙, 王彩虹, 白牡丹, 等. 影响苹果赤霉素合成的关键酶基因在新梢和幼嫩种子上的表达分析[J]. 果树学报, 2013, 5:732-736.
[9]李文彬. ‘红阳’猕猴桃果实发育转录组及花青素累积机理研究[D]. 北京:中国科学院大学, 2015.
[10]欧春青, 姜淑苓, 王斐, 等. 梨贝壳杉烯酸氧化酶基因PcKAO1的克隆与表达分析[J]. 园艺学报, 2013, 40(5):849-858.
[11]石琰景. 果树GA生物合成基因-贝壳杉烯氧化酶和20-氧化酶的克隆及表达模式的初步研究[D]. 泰安:山东农业大学,2002.
[12]李节法, 田义轲, 王彩虹, 等. 梨贝壳杉烯氧化酶基因PpKO的克隆及生物信息学分析[J]. 园艺学报, 2010, 37(10):1575-1582.
[13]田义轲, 王彩虹, 白牡丹, 等. 基于梨贝壳杉烯氧化酶基因PpKO序列的功能性SNP标记[J]. 园艺学报, 2012, 39(10):1876-1884.
[14]田义轲, 李节法, 王彩虹, 等. 梨茎尖中PpKO基因表达量的实时荧光定量PCR分析[J]. 华北农学报, , 2012, 27(3):62-66.
[15]程飞飞, 欧春青, 姜淑苓, 等. 梨内根-贝壳杉烯合酶基因克隆及表达分析[J]. 沈阳农业大学学报, 2011, 42(6):677-682.
[16]郭献平, 李兴亮, 段续伟, 等. 板栗野生和芽变雄花序赤霉素合成关键酶基因比较分析[J]. 中国农业大学学报, 2012, 17(4):91-95.
[17] 郭献平. 板栗短雄花序芽变与赤霉素相关的分子机理研究[J].乌鲁木齐:新疆农业大学, 2012.
[18]李兴亮, 郭献平, 沈元月, 等. 板栗赤霉素缺陷型短雄花序芽变的初步鉴定及CmGID1基因的表达分析[J]. 园艺学报,2011, 38(7):1251-1258.
[19]刘炳臣. 葡萄胚珠败育相关基因VvABCG20及活性GA代谢关键基因的初步分析[D]. 杨凌:西北农林科技大学, 2016.
[20]Acheampong AK, Zheng C, Halaly T, et al. Abnormal endogenous repression of GA signaling in a seedless table grape cultivar with high berry growth response to GA application[J]. Frontiers in Plant Science, 2017, 8:850.
[21]程飞飞. 矮生梨‘中矮1号’GA2-oxidase基因的克隆与功能分析[D]. 北京:中国农业科学院, 2012.
[22]辛璐. 短枝型苹果‘苏帅’赤霉素相关差异基因的筛选与表达分析[D]. 南京:南京农业大学, 2015.
[23]丁伟. 缺铁胁迫对梨氮代谢及赤霉素信号转导相关基因表达的影响[D]. 合肥:安徽农业大学, 2015.
[24]王满, 金灿, 许雪, 等. 梨极矮化突变体与苹果梨GA20ox基因的克隆及植物表达载体的构建[J]. 北方园艺, 2014(2):89-94.
[25]宣利利, 欧春青, 王斐, 等. 梨矮化砧木中矮1号GA20-氧化酶基因克隆与表达分析[J]. 果树学报, 2011(5):883-887.
[26]宣利利, 欧春青, 王斐, 等. 梨品种中矮1号GA20-氧化酶基因正义和反义表达载体的构建[J]. 中国果树, 2011(3):11-13.
[27]Wen LH, Zhong WJ, Huo XM, et al. Expression analysis of ABA-and GA-related genes during four stages of bud dormancy in Japanese apricot(Prunus mume Sieb. et Zucc)[J]. The Journal of Horticultural Science and Biotechnology, 2016, 91(4):362-369.
[28]刘锴栋, 袁长春, 黎海利, 等. 番荔枝GA20氧化酶基因的克隆与表达分析[J]. 植物生理学报, 2015, 51(10):1697-1705.
[29]Kotoda N, Matsuo S, Honda I, et al. Isolation and functional analysis of two Gibberellin 20-oxidase genes from Satsuma mandarin(Citrus unshiu Marc.)[J]. The Horticulture Journal, 2016, 85(2):128-140.
[30] 宋杨. 富士苹果短枝型性状相关基因的分离及表达[D]. 泰安:山东农业大学, 2012.
[31] 沙广利, 束怀瑞, 郝玉金. 苹果无融合生殖矮化种质创新[D].泰安:山东农业大学, 2007.
[32] 姜志昂, 孙建设, 彭建营, 等. 苹果MdGA20ox1基因的克隆, 亚细胞定位及表达分析[J]. 园艺学报, 2013, 40(12):2373-2381.
[33] 袁飞荣. 转rolABC 基因枳橙砧木的评价[D]. 长沙:湖南农业大学, 2011.
[34]Wang YJ, Deng DX. Molecular basis and evolutionarypattern of GA-GID1-DELLA regulatory module[J]. Molecular Genetics and Genomics, 2014, 289(1):1-9.
[35]宋伟, 李鼎立, 王然, 等. 蔷薇科植物DELLA蛋白的生物信息学分析[J]. 中国农学通报, 2013, 29(19):142-148.
[36]钟翡, 沈欣杰, 刘芳, 等. 甜樱桃DELLA蛋白基因PaGAI的克隆与表达分析[J]. 园艺学报, 2012, 39(1):143-150.
[37]徐丽, 陈新, 张力思, 等. 核桃GAI基因的克隆和序列分析[J].山东农业科学, 2013, 45(7):1-5.
[38]翟晓霏, 张文, 赵旭勉, 等. 苹果MdRGL1a基因对烟草遗传转化研究[J]. 中国农业大学学报, 2011, 16(1):36-41.
[39]刘杭, 杨贺忠, 李亮, 等. 梨休眠DELLA蛋白PpGAI基因的克隆与表达分析[J]. 分子植物育种, 2016(8):1995-2002.
[40] 沙广利, 束怀瑞, 郝玉金. 苹果无融合生殖矮化种质创新[D].泰安:山东农业大学, 2007.
[41]雷恒久, 姚立萍, 王爽, 等. 草莓转录因子基因FaGAMYB的克隆与表达分析[J]. 中国农业大学学报, 2015, 20(5):156-163.
[42]樊胜, 雷超, 辛明志, 等. 苹果赤霉素信号转导因子MdGAMYB的克隆和表达分析[J]. 园艺学报, 2017, 44(5):817- 827.
[43]刘淑芳, 陈力耕, 陈大明, 等. 柑橘LEAFY同源基因片段的克隆及分析[J]. 浙江大学学报:农业与生命科学版, 2001, 27(3):297-300.
[44]曹秋芬, 和田雅人, 孟玉平, 等. 苹果LEAFY同源基因的cDNA克隆与表达分析[J]. 园艺学报, 2003, 30(3):267-271.
[45]李宁, 陈厚彬, 张昭其, 等. 荔枝LEAFY同源基因克隆及表达分析[J]. 华南农业大学学报, 2013, 34(1):57-61.
[46]殷姗姗, 李茂福, 王华, 等. 草莓FaSKP1-1基因的克隆与表达分析[J]. 中国农业大学学报, 2016, 21(12):28-34.
[47]张演义, 王化坤, 宋长年, 等. 枳2个F-box基因cDNA全长的克隆及其亚细胞定位分析[J]. 华北农学报, 2012, 27(5):1-7.
[48]王玉兰, 鲁振华, 王志强, 等. 半矮生型桃F-box基因的克隆和表达特征分析[J]. 果树学报, 2013, 30(4):543-550.
[49]安振宇, 张树伟, 何新华, 等. 柠檬F-box基因的克隆及表达分析[J]. 分子植物育种, 2015(11):2484-2490.
Study Progress on Gibberellin Metabolism and Signaling Transduction Pathway in Fruits Trees
WANG Wen-ran1FAN Xiu-cai2ZHANG Wen-ying1LIU Chong-huai2FANG Jing-gui1WANG Chen1
(1. College of Horticulture,Nanjing Agricultural University,Nanjing 210095 ;2. Key Laboratory of Fruit Tree Breeding,Ministry of Agriculture,Zhengzhou 450009)
Gibberellin,as one of five major plant hormones,plays a key role in flower bud differentiation,inflorescence development,flowering and fruit setting,fruit growth and plant morphogenesis,etc. However,the research on molecular biology of gibberellin in fruit crops compared with field crops differs largely. In order to more effectively and reasonably use gibberellin to regulate fruit and flower development of fruit trees in fruit crops production,it is necessary to study the synthesis of gibberellin and the molecular regulation mechanism of signal transduction pathways. Here,two aspects,the synthesis of gibberellin of fruit crops and gibberellin signaling pathways,are reviewed,focusing on the key enzyme genes in the process of gibberellin synthesis and their localizations,as well as important components of gibberellin signaling pathway such as gibberellin receptor GID1,DELLA protein and so on. The results showed that the expressions of KO,GA2ox and GA20ox in GA synthesis were negatively correlated with the dwarf of fruit trees,while the content of KS was positively correlated with plant height. The male sterility of chestnut was also closely related to the expression of KO and KAO. GAMYB gene and LFY gene play an important role in the reproductive growth of fruit crops,such as flower formation and stamen development. DELLA protein,as a negative regulator in the GA signaling pathway in fruit trees,lead to the formation of dwarf plants,and DELLA protein ubiquitination degradation plays a vital role in the cell cycle,transcription regulation,flower formation,cell signal transduction,and many physiological processes of the fruit crops.This paper aims at providing an important theoretical reference for the modulation of fruit crop growth and development by effectively utilizing gibberellin.
fruit trees;gibberellin;metabolism;signal transduction
10.13560/j.cnki.biotech.bull.1985.2017-0650
2017-08-06
中央高校基本科研业务费自主创新重大专项(KYTZ201602),农业部果树育种技术重点实验室开放课题(NBY-201508-1)
王文然,硕士研究生,研究方向:果树分子生物学;E-mail:826507957@qq.com
王晨,副教授,研究方向:果树分子生物学;E-mail:wangchen@njau.edu.cn
(责任编辑 李楠)

