RNAi技术的最新研究进展
王伟伟 刘妮 陆沁 凌晓霏 陈航,2
(1. 中国林业科学研究院资源昆虫研究所,昆明 650224;2. 国家林业局资源昆虫培育与利用重点实验室,昆明 650224)
RNAi技术的最新研究进展
王伟伟1刘妮1陆沁1凌晓霏1陈航1,2
(1. 中国林业科学研究院资源昆虫研究所,昆明 650224;2. 国家林业局资源昆虫培育与利用重点实验室,昆明 650224)
RNA干扰(RNA interference,RNAi)是真核生物中由双链RNA(double-stranded RNA,dsRNA)诱发同源mRNA降解,使靶基因沉默的现象。目前,RNAi技术作为基因调控的有效工具,具有高度特异性、高效、可传播等特点,被广泛用于病虫害防治、肿瘤及癌症治疗等领域。尤其在医学上的应用,相对于传统的疫苗预防和药物治疗而言,RNAi技术在靶点用药、减少副作用、抑制致病基因表达等方面具有不可比拟的优越性,在癌症等疾病治疗的新方法中发挥越来越重要的作用。主要介绍RNAi的作用机理、导入方法及其在植物改良、生物防治、昆虫抗药性、疾病的预防与治疗中的最新应用进展,并对其应用前景进行综合分析与评价,以期为相关领域的研究者提供参考。
RNAi;dsRNA;shRNA;转基因法;作用机理
RNA干扰(RNA interference,RNAi)是指在真核生物中,由双链RNA(Double-stranded RNA,dsRNA)诱发同源mRNA降解,使靶基因表达沉默的现象[1]。1998年,Fire等[2]用 dsRNA沉默秀丽隐杆线虫中相应的mRNA,阐述了基因沉默现象的本质,并将其特异性基因转录后沉默的这一现象称为 RNA干 扰。2000年,Wianny和 Svoboda等[3-4]先后发现在小鼠的胚胎细胞和卵母细胞中dsRNA能引发RNAi效应。2002年,Brummelkamp等[5]在小鼠体内构建表达载体pSUPER,使用该载体能持续抑制目的基因表达,为RNAi技术在基因治疗方面奠定基础。RNAi为人们了解生命提供了新视角,并为医学发展提供了新工具,2006年Craig Mello 和Andrew Fire由于在RNAi机制研究中所作出的贡献,获得诺贝尔生理及医学奖。本文针对RNAi的作用机理、导入方法及其在植物改良、生物防治、昆虫抗药性、疾病的预防与治疗中的最新应用进展做较为详尽的综述,旨为相关领域的研究者提供参考。
1 RNAi的作用机理及特点
1.1 RNAi的作用机理
RNAi的作用过程分为起始、效应、扩增3个阶段(图1)。(1)起始阶段:加入的dsRNA被Dicer酶切割为21-23 nt大小的siRNA片段;(2)效应阶段:siRNA双链在细胞质中结合一个核酶复合物形成RNA诱导沉默复合体(RNA-induced silencing complex,RISC)。解旋酶将siRNA双链解旋为单链,单链中的引导链(Guide strand)与靶mRNA通过碱基互补配对而结合,在ATP供能的情况下,RISC中核酸内切酶slicer切割靶mRNA,将mRNA切割降解,阻止其翻译,引起靶基因转录后水平的沉默[6];(3)扩增阶段:siRNA与mRNA结合,并作为引物,在RNA聚合酶(RdRp)作用下再次形成dsRNA,然后重复起始阶段和效应阶段,从而进一步放大RNAi的作用,最终将靶mRNA完全降解。
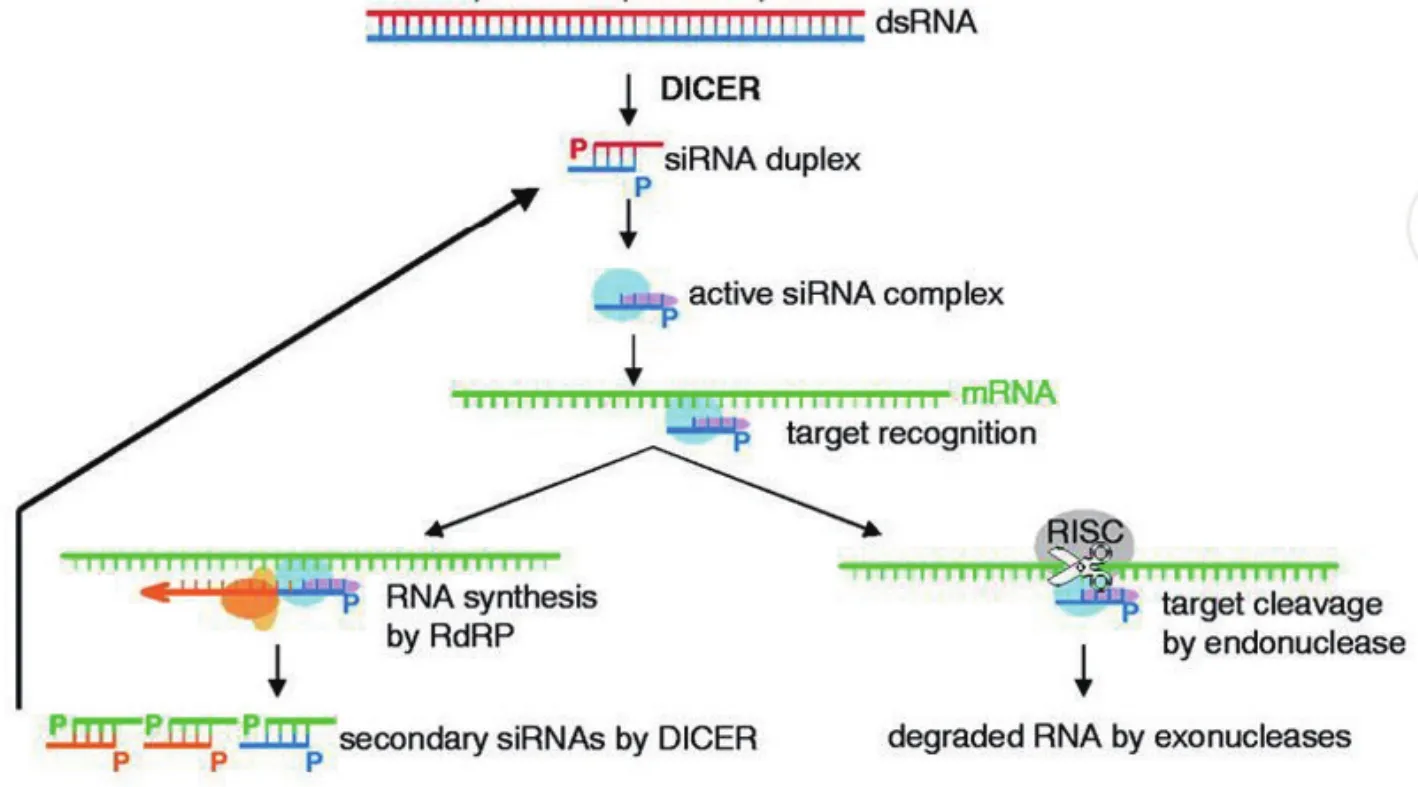
图1 RNAi的作用机理[7]
1.2 RNAi技术的特点
1.2.1 高效性 细胞内的RNAi途径存在级联放大效应,极少量的dsRNA经起始阶段—效应阶段—扩增阶段的循环就能产生强烈的RNAi效应,以维持高效的干扰作用。
1.2.2 特异性 RNAi只特异地降解同源mRNA,而其他mRNA表达则不受影响,从而准确沉默目的基因。
1.2.3 位置效应 Holen 等[8]根据 TF(Tissue factor)不同位置的dsRNA对基因沉默效率的影响,结果表明dsRNA对mRNA的结合部位有碱基偏好性,相对而言,GC含量较低的mRNA被沉默效果较好。
1.2.4 ATP依赖性 RNAi是一个ATP依赖的过程,在没有ATP时发现RNAi现象降低或消失,可能是由于在Dicer和RISC的酶切反应过程中必须要ATP提供能量[9]。
1.2.5 可传播性 可以跨越细胞界限,在不同细胞甚至生物体间长距离传递和维持,使RNAi扩散到整个机体并可传递给子代[10]。
2 RNAi的方法
RNAi有注射、喂食、浸泡、病毒感染、转基因等方法(表1),较常用注射法、喂食法和浸泡法。在RNA干扰研究的初期,注射最初主要应用于线虫[2];随着在果蝇中运用的开展[11],其逐渐成成为有效引入dsRNA的方法之一。目前已在烟草天蛾(Manduca sexta)、棉铃虫(Helicoverpa armigera)等研究对象中建立了注射dsRNA诱导RNAi的体系,此方法通过将dsRNA或siRNA注射到昆虫或其他研究对象的特定部位,迅速到达靶位点,以实现其作用的快速性与高效性。但当研究对象个体过小时,注射难度增大且成活率降低的问题仍无法解决。由于操作带来的局限性,使其很难用于大规模分析。喂食法最早应用于秀丽隐杆线虫,用含有dsRNA的大肠杆菌喂食线虫后,其表现为部分功能缺失或产生突变体的表型[12],喂食法由此成为RNAi中有效引入dsRNA的另一手段。目前主要应用的喂食法有3种:第1种是细菌喂食法,在细菌中表达dsRNA,通过喂食细菌来实现;第2种是直接喂食法,在体外合成dsRNA,并将dsRNA混入食物或溶液中直接喂食。这种喂食法在马铃薯甲虫中得到了成功应用[13],但在果蝇实验中发现该方法并不能使果蝇引起RNAi[14];第3种手段是通过表达dsRNA的转基因植物,将昆虫基因作为靶标,提高植物的抗虫性[15]。研究发现,利用此方法可使马铃薯中的叶绿体产生大量的马铃薯甲虫β-actin基因的dsRNA,从而代替化学杀虫剂,使取食马铃薯叶片的马铃薯甲虫在幼虫时期死亡[16]。喂食诱导RNAi因其操作简单方便,对研究对象危害性小等特点,可大量用于高通量的基因实验。但喂食法均存在作用较慢、效率较低的缺点。近年来,在RNAi实验中,将材料直接浸泡在dsRNA溶液中,因其操作简便,周期短而得到广泛应用,也称其为细胞外RNA干扰[17]。2000年,Clemens等[18]第一次利用果蝇胚胎的S2细胞进行了浸泡实验并取得成功,目前浸泡法在双翅目的黑腹果蝇和鳞翅目的家蚕中成功率比较高。

表1 dsRNA不同转运方式优缺点比较[17,19]
3 RNAi技术的应用
3.1 RNAi技术在农业领域的应用
3.1.1 植物改良中的应用 通过RNAi技术对植物抗逆相关基因挖掘及功能的研究,对于培育具有较强抗逆性的植物新品系至关重要。高梦烛等[20]通过构建RNAi膜蛋白(Putative membrane related protein,PMRP)载体,将PMRP-RNAi载体导入转基因拟南芥;用于分析PMRP对拟南芥抗寒性的影响,结果表明PMRP表达量降低可增强拟南芥的抗寒性,为增强作物抗逆性提供理论依据。NAC蛋白在植物适应环境和抵御逆境胁迫中起重要作用,2017年,Wang等[21]对刚毛柽柳Tamarix hispid的NAC型转录因子ThNAC13在盐和渗透胁迫的反应进行了功能分析,通过RNAi技术沉默ThNAC13发现刚毛柽柳对盐和渗透胁迫的耐受性降低。结果表明,ThNAC13是遗传育种中增强盐和渗透胁迫耐受性的重要基因。利用RNAi筛选与抗逆性相关的基因,从而改良植物使其具有抗寒、抗盐胁迫等抗性,将有利于植株在逆境中生存。
3.1.2 生物防治中的应用 害虫对农业生产造成巨大的损失,是制约农业生产持续稳定发展的重要因素之一,生物防治作为高效且无污染的方法逐渐成为最理想的防治手段。在生物防治领域,RNAi技术有广泛的应用前景,其对害虫控制策略在于选择合适的靶基因。近几年来,随着RNAi技术的发展,对未知基因功能的研究越来越多,在害虫防治中也发现了一些合适的靶基因。2015年,Xu等[22]在对稻飞虱长短翅的研究中发现,以褐飞虱Nilaparvata lugens为模型,褐飞虱两个同源性极高的胰岛素受体InR1和InR2在长、短翅分化中起着决定性作用。当利用RNAi技术沉默InR2使其含量降低时,长翼变形,这对开发新型褐飞虱治理技术具有重要价值,也可为其他害虫的防治提供新的策略。海藻糖-6-磷酸合成酶(TPS)在昆虫发育中起着关键作用,2016年,Tang等[23]对赤拟谷盗Tribolium castaneum中与几丁质相关的5种海藻糖酶基因的功能研究发现,在用RNAi技术沉默这5种基因时,观察到有异常表型出现,赤拟谷盗的死亡率在17%-42%之间,结果表明通过沉默海藻糖酶基因来调节基因表达从而使其蜕皮畸形和产生高的死亡率。2017年,Yang等[24]利用RNAi技术将褐飞虱Nilaparvata lugens体内的海藻糖-6-磷酸合成酶基因TPS1和TPS2敲除,褐飞虱出现异常表型,有30%的昆虫死亡。通过数字基因表达谱(DGE)分析显示,TPS基因的沉默可导致蜕皮畸形,并参与甲壳素代谢基因的调控,他们认为TPS基因在未来是潜在的害虫控制目标。
RNAi技术在病害防治中也有广泛的应用。番木瓜环斑病毒(Papaya ringspot virus,PRSV)是危害番木瓜生产的致命性病原,并制约番木瓜产业的发展。2017年,黄静等[25]为了培育出对海南地区PRSV种群具特异抗性的番木瓜新品种,根据RNAi原理构建抗PRSV表达载体pCAMBIA2300-35S-CPRNAi-OCS,将载体导入番木瓜的愈伤组织中,通过抗病毒试验分析表明,转基因株系474和非转基因株系1280相比对PRSV有较好抗性,但要获得广谱抗PRSV的植株还有待于进一步田间试验。白粉病是限制瓜叶菊生产和推广的主要病害,王丹等[26]构建了Mlo基因的RNAi载体质粒Ptck303-Mlo-RNAi,构建了瓜叶菊‘大花’高频再生体系。并导入到农杆菌中进行瓜叶菊的遗传转化,为培育抗白粉病的瓜叶菊新品系奠定基础。
3.1.3 昆虫抗药性中的应用 随着化学杀虫剂大范围、大剂量重复使用,一些害虫对杀虫剂产生很强抗性,深入探究昆虫抗性机理,有助于抗性的有效治理,RNAi技术为害虫抗药性机理的研究提供了有效途径。2014年,Hu等[27]经过研究发现,昆虫体内细胞色素P450基因家族中CYP321E1在抗药性中起的作用很大,对此,研究人员利用RNAi技术,将dsRNA通过注射输送到小菜蛾Plutella xyllostella体内,从而降低CYP321E1基因的表达,经过24 h观察发现小菜蛾幼虫死亡率增加,这将为解决昆虫对抗药性的难题提供新的思路。2015年,Guo等[28]对小菜蛾Plutella xyllostella抗药性的研究表明,利用RNAi技术沉默ABCG亚家族的ABC转运蛋白基因,能使小菜蛾幼虫对CryiAc毒素的敏感性降低,从而对小菜蛾抗药性有一定的作用。
3.2 RNAi技术在医学中的应用
3.2.1 疾病预防中的应用 肉类安全问题一直受到社会各界的广泛关注,其中牲畜疾病是严重威胁肉类安全的主要因素,因此对动物疾病的预防备受关注。RNAi技术在疾病预防中发挥着重要的作用,如在口蹄疫(FMD)的预防和流感病毒(H1N1)的控制中都有相关研究。2014年,Li等[29]通过siRNA产生对PRRSV特异性表达的转基因(TG)猪,经过TG猪与NTG对照发现,体内siRNA表达使猪血清HP-PRRSV含量显着降低,并且增加了3 d的存活时间,RNAi技术为家畜抵抗病毒感染提供可能性。2016年,Linke等[30]针对禽流感病毒(AIV)的核蛋白(NP)和聚合酶酸性蛋白(PA),利用siRNA细菌载体递送到禽黏膜上皮细胞,结果发现这种新型抗AIV载体能够抑制AIV并将病毒滴度降低10 000倍。siRNA载体技术可作为一种新型的抗病毒方法,用于禽流感、人类流感的抗病毒技术和基于RNAi的载体的其他病毒。
3.2.2 疾病治疗中的应用 在传统的肿瘤和癌症治疗中,多应用化疗法来有效的杀死肿瘤和癌症细胞,但其作用于肿瘤和癌细胞的同时也对正常细胞产生影响,从而导致正常细胞死亡。利用RNAi技术对靶位点局部用药,尽量减少用药给机体带来的副作用,是肿瘤和癌症治疗的重要发展方向。2016年,Wu等[31]利用 RNAi沉默 PIK3CA和PIK3CB基因来抑制人类结肠直肠癌(CRC)组织中的致瘤性,结果表明PIK3CA和PIK3CB可以作为结肠直肠癌的潜在治疗药物靶点,对CRC患者提供个性化治疗方案并能够缓解癌细胞在化疗时的抗性。埃-巴病毒(EBV)引起的胃癌(EBVaGC)作为恶性肿瘤最常见的胃癌(GC)之一,通过传统方法如手术、放射治疗和化学治疗等很难完全清除肿瘤细胞。2017年,Wang等[32]应用慢病毒介导的RNAi抑制EBV阳性胃癌GT38细胞系中的潜伏膜蛋白2A(LMP2A)基因表达发现,细胞的增殖被显著抑制,凋亡率增加。因此,LMP2A将是EBVaGC治疗的潜在靶标,可作为开发抑制肿瘤细胞生长或治疗EBVaGC的新方法。
RNAi技术可抑制致病基因的表达,用于治疗癌症和其他疾病是一种极为有效的策略,但面对大多数疾病,如何将干扰载体高效率、安全的运送到靶位点还是一个挑战。2015年,Weinstein等[33]在对一种侵袭性B细胞淋巴瘤(MCL)的研究中发现其细胞周期蛋白D1过表达,他们设计了涂有抗CD38单克隆抗体的脂质基纳米粒子(LNP),该抗体被人为的使MCL细胞吸收并异种移植到小鼠的骨髓中,利用RNAi技术可使LNP诱导MCL细胞中的基因沉默,细胞周期蛋白D1的表达下降,并能延长带病小鼠的存活时间,从而获得一种新的RNAi递送系统。2015年,Cohen等[34]在对多形性成胶质细胞瘤(GBM)的研究中,利用RNAi技术使透明质酸(HA)移植的脂质纳米颗粒(LNP)直接到GBM位点。在小鼠实验中可使mRNA水平降低80%以上,对于肿瘤的治疗的递药系统提供新的思路。
4 结语
基因测序技术的发展为我们获取大量的基因信息提供了技术保障,RNAi作为一种对基因表达具有特异性的抑制机制,为未知基因功能的研究提供了技术平台,成为研究基因功能的最有利的工具。同时RNAi技术具有简单、快速、重复性好等特性,可成为研究细胞信号传导通路的新策略。此外,RNAi可抵抗病毒入侵、防止突变基因过量增殖等作用,可成为开展基因治疗的新途径。
目前,RNAi技术以快速、可靠、操作简单的特点被广泛应用在植物改良、生物防治、疾病预防和治疗等领域,虽在实验室条件下取得初步成果,但在实际应用中还存在一些问题。如siRNA不仅可与靶基因特异性结合,也可与非靶基因结合使其基因沉默,出现脱靶效应(Off-target effect)[35]。脱靶效应的产生严重影响RNAi应用,已成为RNAi技术从实验到临床转化过程中面临的一个重要问题。然而随着高通量测序和转录组的发展,筛选出合适的靶基因并对特定的靶基因用药将可有效解决脱靶问题。还有如何提高靶基因的沉默效率有待于研究,可将dsRNA进行特定的包装和修饰,让靶基因更好的吸收,从而提高靶基因的沉默效率。
随着对分子生物学研究的不断深入,RNAi技术作为一种新的基因阻断技术,必将从实验阶段走向实际应用,在功能基因研究、基因表达调节机制、植物改良、病害虫防治和医学领域中的基因治疗、耐药物细胞模型的建立和筛选、新药开发等方面将有广泛的发展前景。
[1]何正波, 陈斌, 冯国忠. 昆虫RNAi技术及其应用[J]. 昆虫知识, 2009, 46(4):525-532.
[2]Fire A, Xu SQ, Montgomery MK, et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J]. Nature, 1998, 391(6669):806-811.
[3]Wianny F, Zernicka-Goetz M. Specific interference with gene function by double-stranded RNA in early mouse development[J].Nature Cell Biology, 2000, 2(2):70-75.
[4]Svoboda P, Stein P, Hyashi H, et al. Selective reduction of dormant maternal mRNAs in mouse oocytes by RNA interference[J].Development, 2000, 127, 4147-4156.
[5]Brummelkamp TR, Bernards R, Agami R. A System for stable expression of short interfering RNAs in mammalian cells[J].Science, 2002, 296(5567):550-553.
[6]Martinez J, Patkaniowska A, Urlaub H, et al. Single-stranded antisense siRNAs guide target RNA cleavage in RNAi[J]. Cell,2002, 110:563-574.
[7]Plasterk RH. RNA silencing:the genome’s immune system[J].Immunological Journal, 2004, 296(5571):1263-1265.
[8]Holen T, Amarzguioui M, Wiiger MT, et al. Positional effects of short interfering RNAs targeting the human coagulation trigger Tissue Factor[J]. Nucleic Acids Research, 2002, 30(8):1757-1766.
[9]Zamore PD, Tuschl T, Sharp PA, et al. RNAi:double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals[J]. Cell, 2000, 31:101(1):25-33.
[10]Brantl S. Antisense-RNA regulation and RNA interference[J].Biochim Biophys Acta, 2002, 1575(1-3):15-25.
[11]Kennerdell JR, Carthew RW. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway[J]. Cell, 1998, 95:1017-1026.
[12]Timmons, Fire A. Specific interference by ingested dsRNA[J].Nature, 1998, 395:854.
[13]Kong Y, Liu XP, Wan PJ, et al. The P450 enzyme Shade mediates the hydroxylation of ecdysone to 20-hydroxyecdysone in the Colorado potato beetle, Leptinotarsa decemlineata[J], Insect Mol Biol, 2014, 23:632-643.
[14]Whyard S, Singh AD, Wong S. Ingested double-stranded RNAs can act as species-specific insecticides[J]. Insect Biochem Mol Biol,2009, 39:824-832.
[15]Yu XD, Liu ZC, Huang SL, et al. RNAi-mediated plant protection against aphids[J]. Pest Manag Sci, 2016, 72(6):1090-1098.
[16]Zhang J, Khan SA, Hasse C, et al. Full crop protection from an insect pest by expression of long double-stranded RNAs in plastids[J]. Science, 2015, 347 :991-994.
[17]刘吉升, 朱文辉, 廖文丽, 等. 昆虫RNA干扰中双链RNA的转运方式[J]. 昆虫学报, 2016, 59(6):682-691.
[18] Clemens JC, Worby CA, et al. Use of double-stranded RNA interference in Drosophila cell lines to dissect signal transduction pathways[J]. Proc Natl Acad Sci, USA, 2000, 97 :6499-6503.
[19]杨广, 尤民生, 赵伊英, 等. 昆虫的RNA干扰[J]. 昆虫学报,2009, 52(10):1156-1162.
[20]高梦烛, 赵亚林, 闫青地, 等. 拟南芥PMRP基因在叶绿体淀粉粒积累和抗寒性中的作用[J]. 中国农业科学, 2016, 49(5):832-839.
[21]Wang L, Li Z, Lu M, et al. ThNAC13, a NAC transcription factor from Tamarix hispida, confers salt and osmotic stress tolerance to transgenic tamarix and Arabidopsis[J]. Frontiers in Plant Science, 2017, 8:635.
[22] Xu HJ, Xue J, Lu B, et al. Two insulin receptors determine alternative wing morphs in planthoppers[J]. Nature, 2015, 519(7544):464-467.
[23]Tang B, Wei P, Zhao LN, et al. Knockdown of five trehalase genes using RNA interference regulates the gene expression of the chitin biosynthesis pathway in Tribolium castaneum[J]. BMC Biotechnology, 2016, 16:67.
[24]Yang MM, Zhao LN, Shen QD, et al. Knockdown of two trehalose-6-phosphate synthasesseverely affects chitin metabolism gene expression in the brown planthopper Nilaparvata lugens[J]. Pest Management Science, 2017, 73:206-216.
[25]黄静, 贾瑞宗, 孔华, 等. 基于RNAi抗PRSV番木瓜株系的培育及其分子特征验证[J]. 热带作物学报, 2017(3):513-520.
[26]王丹, 王金刚. 瓜叶菊‘大花’Mlo基因RNAi载体的构建及其遗传转化研究[J]. 河北农业大学学报, 2016(6):88-95.
[27]Hu Z, Lin Q, Chen H, et al. Identification of a novel cytochrome P450gene, CYP321E1 from the diamondback moth, Plutella xylostella(L.)and RNA interference to evaluate its role in chlorantraniliprole resistance[J]. Bulletin of Entomological Research, 2014, 104:716-723.
[28]Guo ZJ, Kang S, Zhu X, et al. The novel ABC transporter ABCH1 is a potential target for RNAi-based insect pest control and resistance management[J]. Scientific Reports, 2015, 5 :13728.
[29]Li L, Li QY, Bao YH, et al. RNAi-based inhibition of porcine reproductive and respiratorysyndrome virus replication in transgenic pigs[J]. Journal of Biotechnology, 2014, 171 :17-24.
[30]Linke LM, Wilusz J, et al. Inhibiting avian influenza virus shedding using a novel RNAi antiviral vector technology:proof of concept in an avian cell model[J]. AMB Expres, 2016, 6(1):16.
[31]Wu SH, Wen FF, Li YY, et al. PIK3CA and PIK3CB silencing by RNAi reverse MDR and inhibit tumorigenic properties in human colorectal carcinoma[J]. Tumor Biol, 2016, 37:8799-8809.
[32]Wang FJ, Chen WC, Liu PF, et al. Lentivirus-mediated RNAi knockdown of LMP2A inhibits the growth of the Epstein-Barrassociated gastric carcinoma cell line GT38 in vitro[J].Experimental and Therapeutic Medicine, 2017, 13:187-193.
[33]Weinsteina S, Toker IA, et al. Harnessing RNAi-based nanomedicines for therapeutic gene silencing in B-cell malignancies[J].Proc Natl Acad Sci USA, 2016, 113(1):E16-22.
[34]Cohen ZR, Ramishetti S, Peshes-Yaloz N, et al. Localized RNAi Therapeutics of Chemoresistant Grade IV Glioma Using Hyaluronan-Grafted Lipid-Based Nanoparticles[J]. American Chemical Society, 2015, 10. 1021.
[35]Rassouli FB, Matin MM. Gene silencing in human embryonic stem cells by RNA interference[J]. Biophys Res Commun, 2009, 390(4):1106-1110.
Latest Research Progress on RNA Interference Technology
WANG Wei-wei1LIU Ni1LU Qin1LING Xiao-fei1CHEN Hang1,2
(1. Research Institute of Resources Insects,Chinese Academy of Forestry,Kunming 650224 ;2. Key Laboratory of Cultivation and Utilization of Resource Insects,State Forestry Administration,Kunming 650224)
RNA interference(RNAi)is a phenomenon in which the target gene is silenced by double-stranded RNA(dsRNA)inducing homologous mRNA degradation in the eukaryotic cells. At present,RNAi technology,as an effective tool for gene regulation,is widely used in pest control,cure of tumor and cancer duo to its high specificity,high efficiency,transmission and other characteristics.Especially in the medical application,compared with the traditional vaccine prevention and drug therapy,RNAi technology has unparalleled advantages of target medication,reducing side effects and inhibiting the expression of virulence genes,thus it plays an increasing significant role in the new treatment methods of cancer and other diseases. The mechanism,introducing methods of RNAi and its latest application in plant improvement,biological control,insect resistance,disease prevention and treatment are synthetically analyzed and evaluated in this paper,for providing the reference for researchers in related fields.
RNAi;dsRNA;shRNA;transgenic method;action mechanism
10.13560/j.cnki.biotech.bull.1985.2017-0455
2017-06-02
国家林业局948 项目(2014-4-66),中央级公益性科研院基本科研业务费专项(CAFYBB2014ZD005)
王伟伟,男,硕士研究生,研究方向:资源昆虫分子生态;E-mail:sk121www@163.com
陈航,男,博士,研究员,研究方向:资源昆虫学;E-mail:stuchen6481@gmail.com
(责任编辑 朱琳峰)

