大黄麻黄方对大鼠血及心肌组织肾素-血管紧张素系统的影响
肖荷妹 于立杰 李凤丹 雷新锋 李炳茂 何新霞 韩卫红 童莉
·论著·
大黄麻黄方对大鼠血及心肌组织肾素-血管紧张素系统的影响
肖荷妹 于立杰 李凤丹 雷新锋 李炳茂 何新霞 韩卫红 童莉
目的观察中药大黄麻黄方治疗前后大鼠血压、血浆及心肌组织肾素(PRA)、血管紧张素Ⅱ(AngⅡ)和血管紧张素转换酶(ACE)的时间生物学特征的变化。方法健康雄性SD大鼠80只,体重250~300 g,随机分为对照组(对照组给予安慰剂,组Ⅰ)、大黄麻黄方治疗组(组Ⅱ)。每组又随机分为4小组。服药前1日,分别于同日内不同时间点(02∶00,08∶00,14∶00,20∶00)用鼠尾血压仪测2组中各小组大鼠收缩压。灌胃4周后,分别于同日24 h内不同时间点(02∶00,08∶00,14∶00,20∶00)用鼠尾血压仪测量2组中每小组的大鼠收缩压并处死,留取血浆、血清、心肌组织。分别采用放免法检测血及心肌组织中PRA、AngⅡ、ACE的水平。结果与对照组比较,治疗组大鼠的收缩压、血PRA、AngⅡ、ACE水平均下降,差异有统计学意义(Plt;0.05),与血浆PRA、AngⅡ、ACE水平比较,心肌组织中PRA、AngⅡ、ACE的水平明显增高,差异有统计学意义(Plt;0.05),2组大鼠的各项指标均存在昼夜节律,治疗组大鼠的血压、PRA、AngⅡ、ACE水平的昼夜节律特征均有明显改变。结论大黄麻黄方可降低血压,同时对于维持血压昼夜节律、改善RAAS系统功能有明显影响,同时发现,血及心肌组织RAAS系统各组分的含量水平不同。
昼夜节律;大黄麻黄方;心肌组织;肾素;血管紧张素;血管紧张素转化酶
高血压是一种常见病,多发病,目前的发病率逐渐上升,随着诊断率的不断提高,我国的高血压患者已达2亿,约1/5的成人患高血压,高血压是我国心脑血管疾病的首要危险因素,同时,我国高血压的控制率远远低于发达国家[1],因此,高血压的防控形势非常严峻,由此导致的心脑血管疾病发病率也大大提高。大多数健康人的血压水平呈现以24 h为周期的规律性波动,被称为昼夜节律或近日节律。血压的昼夜节律是人体正常的生理节律之一,正常情况下,人体血压昼夜节律呈双峰一谷的长柄杓型[2],一般而言,人体血压在日间较高而夜间较低。根据昼夜血压水平的差异可将其分为3种类型:(1)杓型,指夜间血压均值较日间均值降低10%~20%;(2)超杓型或深杓型,至夜间血压降低超过20%;(3)非杓型,即夜间血压下降不足10%。部分患者(特别是老年高血压患者)夜间血压水平高于日间,成为反杓型。此种血压节律一般被视为非杓型血压分布中的一种特殊类型[3]。血压昼夜节律是独立于血压水平之外的心脑血管病预测因素[4],异常血压节律是心脑血管疾病的危险因素[5,6]。研究已证实,血压节律受到年龄、性别、体内多种活性物质、环境等多种因素的影响,其中肾素-血管紧张素-醛固酮系统(RAAS)分泌的各种激素肾素(PRA)、血管紧张素Ⅱ(AngⅡ)、醛固酮(ALD)等是影响血压节律的主要活性物质,且血压节律随着上述活性物质的变化而变化[7]。祖国传统医药博大精深,近年来中医药以其毒副作用小、多靶点发挥疗效等优点用于降低血压、恢复异常血压昼夜节律方面日益受到青睐。早有研究证实,分别由大黄、麻黄、仙鹤草、甘草组成的方剂具有调节血脉、调节血压、改善靶器官损害等作用[8-10]。同时也有报道发现临床上低肾素型高血压患者应用血管紧张素受体阻滞剂(ARB)类药物取得良好降压效果,其原理可能是循环及组织中肾素分布的不同所致[11]。目前,对于循环中RAAS对血压昼夜节律影响的研究较多,而对于组织中RAAS对血压昼夜节律影响的研究相对较少。为此选取雄性健康大鼠为研究对象,观察大黄麻黄方治疗前后血压、血及心肌组织中PRA、AngⅡ和 血管紧张素转换酶(ACE)的变化,及三种物质分布的比较,进一步为探讨中医药物治疗高血压、改善RAAS功能、减轻靶器官损害的影响提供理论基础。
1 材料与方法
1.1 实验动物分组与喂养 SPF级SD大鼠80只,健康雄性,10周龄[购自河北医科大学实验动物中心,动物合格证号:SCXK(冀)2013-1-003],体重250~300 g,常规饲养于衡水市人民医院动物中心,自由进食,室温维持在(22±2)℃,严格控制声、光、喂食及消毒清扫等活动刺激。适应性饲养2周后,随机分为2大组,每组40只,每大组又随机分为4小组,每小组10只。对照组(组Ⅰ)每次给予安慰剂10 ml(清洁饮水),2次/d灌服。大黄麻黄方组(组Ⅱ)组方:大黄6 g,麻黄5 g,仙鹤草15 g,甘草15 g,水煎服,10 ml/次,2次/d。
1.2 方法
1.2.1 仪器与试剂:RBP-1B型光电法鼠尾测定仪,中日友好医院生产;PRA、AngⅡ和 ACE试剂盒购自北京北方生物技术研究所。
1.2.2 血压的测定:所有大鼠灌胃前1 d及灌胃后4周末,采用RBP-1B型光电法鼠尾测定仪于同日内不同时间点,即02∶00,08∶00,14∶00,20∶00,测定大鼠的收缩压,每个时间点分别测量二大组中各一小组大鼠的收缩压。
1.2.3 取材及PRA、AngⅡ和 ACE测定 灌胃4周后,分别于同日24 h内不同时间点(02∶00,08∶00,14∶00,20∶00)处死2组中的各小组大鼠,提取血浆及血清及心肌组织。10%水合氯醛(0.5 ml/100 g)腹腔注射,待动物麻醉后迅速开胸,暴露心脏,10 ml注射器抽取心室内血液。取血1 ml置入盛有0.3 mol/L依地酸二钠10 μl、0.32 mol/L二琉基丙醇5 μl、0.34 mol/L 8-羟基喹啉硫酸盐10 μl的EP管中,3 000 r/min低温离心10 min,留取血浆,-20℃冰箱保存备用。留取心肌组织,匀浆后低温离心,3 000 r/min,留取上清液,-20℃冰箱保存备用。采用放免法分别测定血及心肌组织中PRA、AngⅡ和 ACE含量。
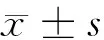
2 结果
2.1 2组大鼠治疗前后血压比较 大黄麻黄方组大鼠在治疗4周后血压较治疗前下降,差异有统计学意义(Plt;0.05),对照组大鼠在灌胃4周后血压无明显变化,差异无统计学意义(Pgt;0.05)。见表1。
2.2 2组大鼠治疗前后血压的时间生物学特征比较 用余弦拟合法分析发现,2组大鼠治疗前后血压均有明显的昼夜节律特征。与对照组相比,大黄麻黄方组大鼠在治疗4周后血压的中值及振幅较治疗前明显下降,峰值相位较治疗前明显位移,峰值时间较治疗前提前(Plt;0.05)。见表2。
2.3 2组大鼠治疗前后血及心肌组织中PRA、AngⅡ和 ACE含量比较 与对照组比较,大黄麻黄方组大鼠血中PRA、AngⅡ、ACE水平明显下降,差异有统计学意义(Plt;0.05),对照组大鼠心肌组织中PRA、AngⅡ、ACE水平较血浆中PRA、AngⅡ、ACE升高,差异有统计学意义(Plt;0.05)。见表1、3。
2.4 2组大鼠治疗前后血及心肌组织中PRA、AngⅡ和 ACE含量生物学特征比较 用余弦拟合法分析大黄麻黄方组大鼠血中PRA、AngⅡ、ACE的中值(M)、振幅(A)、峰值相位(Φ)及峰值时间(T),以及对照组血及心肌组织中PRA、AngⅡ、ACE的中值(M)、振幅(A)、峰值相位(Φ)及峰值时间(T),比较发现,与对照组比较,大黄麻黄方组大鼠血中PRA、AngⅡ、ACE的中值(M)、振幅(A)明显下降,与血压中值及振幅的变化一致,峰值相位发生位移,峰值时间明显提前(Plt;0.05)。见表2。
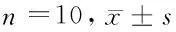

组别02∶0008∶0014∶0020∶00组Ⅰ 收缩压175.71±7.32131.41±13.64120.62±11.73121.31±10.57 PRA(mg·L-1·h-1)1.00±0.071.18±0.101.48±0.151.02±0.33 ACE(mmol·L-1·min-1)1.58±0.761.89±1.061.46±0.371.19±0.43 AngⅡ(pg/L)106.41±2.17149.50±2.32141.20±2.17164.61±2.32组Ⅱ 收缩压167.13±14.0*121.30±9.91*113.12±12.90*120.82±12.54* PRA(mg·L-1·h-1)0.97±0.06*1.00±0.11*1.02±0.19*0.74±0.52* ACE(mmol·L-1·min-1)1.60±0.73*1.90±0.56*1.25±0.39*1.03±0.62* AngⅡ(pg/L)106.21±2.45*147.02±2.29*178.80±2.29*297.31±2.21*
注:与组Ⅰ比较,*Plt;0.05
3 讨论
血压昼夜节律的改变主要受三方面因素的调节:脑力及体力活动变化的控制,交感迷走神经平衡昼夜节律性变化的影响,人体内体液激素分泌节律的影响[7]。李朋朋等[12]对健康大学生非杓型血压昼夜节律的分析发现,健康人群血压昼夜节律的改变主要与学习压力大、精神紧张、生活起居失常等有关。女性绝经后雌激素水平下降也是导致血压昼夜节律异常及内
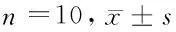
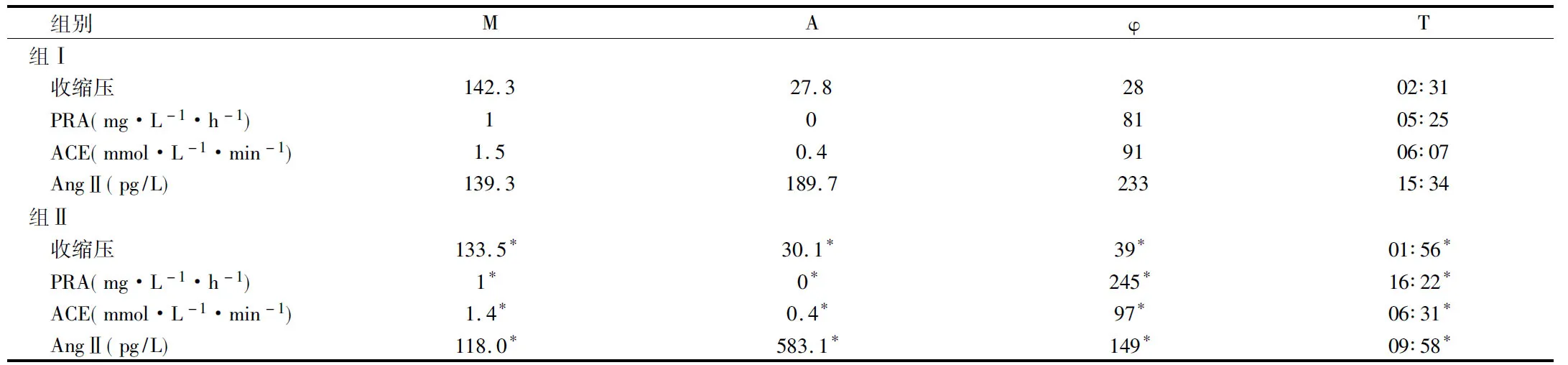
组别MAφT组Ⅰ 收缩压142.327.82802∶31 PRA(mg·L-1·h-1)108105∶25 ACE(mmol·L-1·min-1)1.50.49106∶07 AngⅡ(pg/L)139.3189.723315∶34组Ⅱ 收缩压133.5*30.1*39*01∶56* PRA(mg·L-1·h-1)1*0*245*16∶22* ACE(mmol·L-1·min-1)1.4*0.4*97*06∶31* AngⅡ(pg/L)118.0*583.1*149*09∶58*
注:与组Ⅰ比较,*Plt;0.05
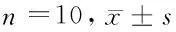
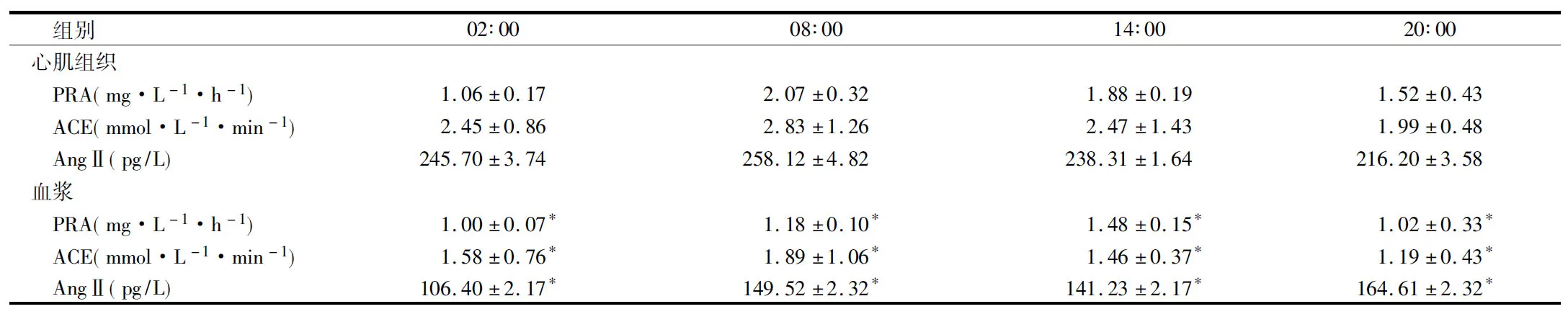
组别02∶0008∶0014∶0020∶00心肌组织 PRA(mg·L-1·h-1)1.06±0.172.07±0.321.88±0.191.52±0.43 ACE(mmol·L-1·min-1)2.45±0.862.83±1.262.47±1.431.99±0.48 AngⅡ(pg/L)245.70±3.74258.12±4.82238.31±1.64216.20±3.58血浆 PRA(mg·L-1·h-1)1.00±0.07*1.18±0.10*1.48±0.15*1.02±0.33* ACE(mmol·L-1·min-1)1.58±0.76*1.89±1.06*1.46±0.37*1.19±0.43* AngⅡ(pg/L)106.40±2.17*149.52±2.32*141.23±2.17*164.61±2.32*
注:与心肌组织比较,*Plt;0.05
皮功能紊乱的危险因素[13]。而血管内皮系统及RAAS是参与血压节律调节的主要机制。研究表明, RAAS各组分的水平及其活性均表现出昼夜节律现象,这些物质的昼夜节律与其相应的mRNA表达量密切相关,而且RAAS的各成分的mRNA表达也都存在昼夜节律[14]。经典的RAAS激素级联反应开始于肾素产生,肾素是由肾小球入球动脉的球旁细胞合成和分泌的一种天冬氨酰蛋白酶,通过将血管紧张素原转换成AngⅠ调节RAAS激素级联反应的初始和作为反应初始的限速步骤。AngⅠ经ACE进一步活化形成具有生物活性的AngⅡ,AngⅡ作用于肾上腺皮质,并导致醛固酮释放[15]。当多种基因因素、肥胖、盐摄入量、压力等环境因素影响RAAS时,RAAS便被过度激活,RAAS活化导致过量AngⅡ产生,从而引起血管收缩、水钠潴留,进一步发生高血压。原发性高血压与AT1R等RAAS基因突变有关。另外,广泛研究表明AT1R血管紧张素原基因M135T和ACE基因I/D与原发性高血压有关。AT1R基因在血管收缩、平滑肌细胞生长和细胞肥大等心血管疾病方面起重要作用[16]。高血压患者大多存在血压节律的异常,研究已证实,与RAAS的变化有明确关系,而且随着高血压危险等级的不同,RAAS各组分的水平也不同,血压节律也随之变化,对靶器官损伤的程度也不同。由于遗传背景不同,原发性高血压患者的血浆PRA可以很高,正常或偏低。由此可以将原发性高血压分为高PRA型、正常PRA型、低PRA型高血压。而“PRA”高血压更常见于老年人、糖尿病患者及慢性肾病患者[14]。高PRA型高血压患者常常存在高肾素活性,同时存在交感肾上腺素系统和RAAS的激活。因此,降低原发性高血压患者血浆PRA及AngⅡ水平可能是治疗高血压病的关键。梁晓慧等[7]纳入242例原发性高血压患者,根据其动态血压监测结果分为杓型组和非杓型组,所有高血压患者均采用放射免疫方法测定卧立位血浆PRA、AngⅡ、ALD的水平;并做超声心动图检查及肾功能的测定,了解靶器官损害的情况。结果发现,2组间24 h SBP、DBP、dSBP、dDBP差异无统计学意义(Pgt;0.05),非杓型组nSBP、nDBP、24 h HR高于杓型组,差异有统计学意义(Plt;0.05)。非杓型组卧位AngⅡ水平高于杓型组,差异有统计学意义(Plt;0.05)。2组间血钾、血钠水平差异无统计学意义(Pgt;0.05)。非杓型组左心室舒张末期内径、左心室质量指数、肌酐水平均高于杓型组,差异有统计学意义(Plt;0.05)。由此可见,PRA在调节血压昼夜节律中起到重要作用,血压呈非杓型分布的高血压患者心肾等靶器官损害的程度较杓型高血压患者严重。欧洲老年收缩期高血压试验的一项亚组对患者血压的昼夜节律特征与发生心血管事件的危险性进行了研究,结果表明,在安慰剂组,夜间收缩压水平较日间血压更能准确预测心脏终点事件的发生,夜间与日间收缩压比值越高,发生心血管事件的危险性就越大,且这种相关关系独立于血压的平均水平之外[2]。高血压患者心血管系统危险水平不仅与血压升高的幅度有关,还可能与血压的昼夜节律有密切关系[3]。2010年修订版中国高血压防治指南将夜间血压平均值gt;120/70 mm Hg 定义为夜间高血压[1]。研究发现,无论白天血压正常人群还是白天高血压人群,均有较高夜间高血压发生率,且夜间高血压常与非杓型血压并存,国人单纯夜间高血压(22时至次日4时平均血压≥120/70 mm Hg,白天血压正常)患病率为10.9%[17]。一般认为,睡眠时交感神经活性升高及迷走神经兴奋性降低,PRA系统活性增加,RAAS各组分的血浆水平及其活性昼夜节律紊乱,从而影响正常血压昼夜节律。临床上,应用RAAS阻断剂可以治疗高血压,改善患者血压异常节律,也可以证实RAAS对血压的调节。研究还发现,不同时间给予降压药物对患者的血压节律影响不同[18]。栾家杰等[19]发现,昼夜不同时间给药,缬沙坦/氨氯地平复方制剂对非杓型高血压患者的降压作用差异无统计学意义(Pgt;0.05),但对血压的昼夜节律有显著影响。休息时给药,可使高血压患者非杓型血压节律明显改善。本研究也发现,给予大黄麻黄方治疗后大鼠的收缩压较对照组下降,血压的昼夜节律特征也有改变,相应的PRA、AngⅡ、ACE也较对照组下降,上述各指标的昼夜节律特征有不同程度改变,但也发现,血及心肌组织中各物质水平不同,心肌组织中相对较高。大黄麻黄方对组织及血中各物质的影响可能不同,可能与血及组织中含量不同有关,含有待进一步研究证实。
以整体观念和辨证论治是中医的核心思想,来越来越受到人们的重视,近年中医药在高血压病的防治研究方面取得了一定的进展,其作用机制主要涉及到阻断RAAS、抑制交感神经活动、改善血管内皮功能、改善心血管重构、预防靶器官损害、改善胰岛素抵抗等方面。中医药在调节机体整体平衡、控制血压水平稳定等方面体现出独特的优势,其防治高血压病作用的多效性、增效减副性、多靶点性、前瞻性、稳定持久性均体现出了中医药特色[20]。中医本没有“高血压”一词,高血压病属中医的“眩晕” 、“头痛”、“中风”范畴,中医研究证明,高血压的中医证型主要有肝火亢盛、阴虚阳亢、痰湿壅盛、阴阳两虚4证。有研究发现,老年高血压患者24 h血压水平和血压昼夜节律在中医辨证分型各组分布存在差异,通过辨证分型可以判断靶器官损害及预后[21]。非杓型高血压患者更易出现痰湿壅盛型,痰湿主要与肝脾有关,肝主疏泄,脾主运化,实证者情志不遂,则肝失调达,疏泄失司,则气血阻滞,经络不通,气血及津液运行不畅,化生痰湿,或肝郁乘脾,脾主运化功能失调,痰浊内生。虚症者,饮食不节或脾胃虚弱,脾失健运,痰湿内生[22]。本研究采用以大黄为主药的大黄麻黄方观察在降压及改善血压昼夜节律方面的作用。大黄麻黄方可以降低血压,同时降低血浆及心肌组织中PRA、AngⅡ的水平,降低ACE的活性,且各指标曲线提示曲线各值变化明显,表明大黄麻黄方能够起到降低血压、PRA、AngⅡ和 ACE水平,维持血压、RAAS正常的生物节律作用。方中大黄主要功效为泻下通便,清热解毒,活血化瘀等。麻黄在传统中医中被认为“肺经专药”, 具有发汗、解痉平喘、止咳、祛痰等作用,可与多种其他药物配伍。甘草温中和胃,调和药性,可起缓急之功。仙鹤草起到收敛、止血作用。我院著名中医专家李炳茂教授早年即应用大黄降压、降糖[23,24],取得了良好的效果。大黄具有泻下、抑菌、抗肿瘤、双向调节血压、抑制血小板聚集、清除氧自由基、抗肝纤维化、增强免疫力等作用。大黄在心血管系统的作用体现在可以降压、强心、降血脂、改善微循环。其机制可能是大黄抑制去氧肾上腺素对血管的收缩反应,抑制组胺诱导的血管收缩反应,同时大黄还是钙通道阻滞剂;其含有的大黄素有利尿排尿的效果,大黄蒽醌衍生物对高血压发病过程中重要的ACE有明显的抑制作用,降低血压;大黄对血管内皮和肺泡上皮具有保护作用[24-26]。麻黄中含有黄酮、黄烷、鞣质、挥发油、有机酸、多糖等多种成分,除具有发汗、解痉平喘、止咳、祛痰等作用外,还有利尿、兴奋中枢神经、抗氧化、降血糖、免疫抑制、抑制流感病毒、解热降温、抗炎、影响神经肌肉传递、抗变态反应等作用,还具有调血脉、双向调节血压作用[27]。甘草有类激素样作用,可抑制激素对自身受体的下调作用,增强和延长激素疗效。有研究表明,一些甘草方剂对心律失常有明显的抑制作用,机制可能是其中的甘草酸影响肾上腺素的敏感性[28]。仙鹤草中含有酚、酯、黄酮、鞣质、糖苷、有机酸、挥发油、三萜皂苷等复杂的化学成分,具有较强的生物活性。现代医药研究发现,仙鹤草也具有降低血压作用[9]。四药共同作用,起到降低血压、调节RAAS活性、维持血压节律的功效。
采用对照组血浆及心肌组织中PRA、AngⅡ和 ACE水平做比较,可以避免药物作用,结果表明心肌组织中各物质含量明显高于血浆中各物质含量,这可能解释为什么临床工作中一部分低肾素型高血压患者应用ACEI和ARB类药物能取得满意疗效。
传统中医药在我国广大人民群众中有良好的应用基础,且相对于西药来说可能价格更便宜,患者应用依从性更好,且疗效持久,稳定性好[20]。一项有关中医药治疗高血压病左心室肥厚疗效与安全性的Meta分析表明,但用中成药与单用西药比较,干预逆转左心室肥厚及降压疗效无明显差异,而在改善临床症状方面,中成药体现出优势,不良反应方面,中成药组的不良反应主要是胃肠道反应,而对照组的不良反应主要集中在咳嗽,与对照药(ACE抑制剂)的选择有关,但出现的不良反应都较轻微[29]。中成药是经过制剂加工制成的各种不同剂型的中药制品,如丸、膏、散、丹等剂型,是我国历代医药学家经过长期实践、总结的精华,应充分挖掘传统中医药的临床利用价值,提取、提纯其有效成分,以更方便患者应用。
1 中国高血压防治指南修订委员会主编.中国高血压防治指南(2010年修订版).第3版.北京:人民卫生出版社,2011.8.
2 鲁晓春.血压晨峰现象.中华老年心脑血管病杂志,2013,15:895-896.
3 郭艺芳,白晓谊.血压变异性的基本概念.中华高血压杂志,2011,19:601-602.
4 Ohkubo T,Hozawa A,Yamaguchi J,et al.Prognosis significance of the nocturnal decline in blood pressure in indiduals with and without hight 24-h blood pressure:the Ohasama study.J Hypertens,2002,20:2183-2218.
5 寇惠娟,汪鑫,高登峰,等.高血压患者血压昼夜节律、B型脑钠肽与左心室肥厚的关系.中国医学科学院学报,2016,38:514-521.
6 田俊萍,王鸿,王红霞,等.糖尿病和非糖尿病的缺血性卒中患者血压昼夜节律与预后的关系.首都医科大学学报,2016,37:62-69.
7 梁晓慧,徐新娟,珠勒皮亚·司马义,等.血压昼夜节律与肾素-血管紧张素系统及靶器官损害的关系.新疆医科大学学报,2009,32:118-121.
8 刘慧玲,徐凤金,李平,等.复方大黄制剂对糖尿病患者尿白蛋白排泄率、血尿素氮、血肌酐及血压的影响.河北中医,2007,29:988-989.
9 王德才,高允生,朱玉云,等.仙鹤草提取物对兔血压的影响.中国中医药信息杂志,2003,10:21-22,24.
10 范媛,朱佳.麻黄的临床应用.现代中医药,2013,33:52-53.
11 何文明.低肾素型高血压1例.中华高血压杂志,2012,20:1095-1096.
12 李朋朋,李红奇,许水清,等.健康大学生非杓型血压昼夜节律与体质的相关性研究.中华中医药杂志,2017,32:835-838.
13 曾哲,许曼燕,孟令英,等.绝经后高血压患者雌激素水平与血压昼夜节律变化及血管内皮功能的相关性.中国临床研究,2016,29:1062-1066.
14 Gadsbol lN,Nielsen DM,Giese J,et al.Diurnal monitoring of blood pressure and the renin-angiotensin system in hypertensive patients on long-term angio-tensin converting enzyme inhibition.J Hypertens,1990,8:733-740.
15 王希.肾素-血管紧张素-醛固酮系统激活对心血管疾病的影响.心血管病防治知识,2017,2:123-124.
16 朱玮玮,华琦.肾素-血管紧张素-醛固酮系统基因与高血压患者发生心血管事件相关性研究紧张.心血管病学进展,2015,36:394-397.
17 禹程远,公永太,李悦.夜间高血压研究进展.中国实用内科杂志在,2012,32:38-40.
18 许金红,刘晓云,宋建国.高血压的时间治疗用药方案.实用药物与临床,2012,15:54-56.
19 栾家杰,刘晓云,张文,等.缬沙坦/氨氯地平复方制剂择时用药对非杓型高血压患者血压昼夜节律的影响.中国药理学通报,2015,31:375-380.
20 刘金涛,张腾.中医药防治高血压病作用机制及优势述评.中医杂志,2015,56:77-82.
21 杨锡燕,岳超.老年高血压昼夜节律异常与中医辩证关系之初探.天津中医药,2012,29:131-132.
22 连建伦,孙雪,许水清,等.101例高血压患者中医证型与血压昼夜节律的相关性分析.河北中医药学报,2016,31:12-15.
23 李炳茂.大黄的降糖降压等作用.中医杂志,1992,32:8.
24 李炳茂,李耀峰,刘慧玲,等.复方大黄制剂治疗糖尿病视网膜病变200例.中医杂志,2000,41:119.
25 金兰.大黄的药理作用及临床应用进展.中国医药指南,2013,11:487-488.
26 李春盛,桂培春,何新华,等.大黄对内毒素诱导的急性肺损伤大鼠的保护作用.基础医学与临床,2001,21:65.
27 Kulah E,Dursun A,Aktunc E,et al.Effects of angiotensinconverting enzyme gene polymorphism and serum vitamin D levels on ambulatory blood pressure measurement and left ventricular mass in Turkish hypertensive population.Blood Press Monit,2007,12:207-213.
28 黄奕旻.炙甘草汤加减治疗冠心病心律失常的疗效观察.云南中医中药杂志,2014,35:48-50.
29 刘丹,曾勇,段吾磊,等.中成药治疗高血压病左心室肥厚疗效与安全性的Meta分析.中华中医药学刊,2017,35:273-278.
10.3969/j.issn.1002-7386.2017.22.010
项目来源:河北省中医药管理局立项项目(编号:2014320)
053000 河北省衡水市,哈励逊国际和平医院综合内科
R 289.61
A
1002-7386(2017)22-3403-05
2017-06-09)

