黄顶菊入侵对土壤氨氧化古菌群落多样性的影响①
李科利,赵晓红,2,刘红梅,杨殿林,曲 波,2,皇甫超河*
(1 农业部环境保护科研监测所,天津 300191;2沈阳农业大学植物园艺学院,沈阳 110866)
黄顶菊入侵对土壤氨氧化古菌群落多样性的影响①
李科利1,赵晓红1,2,刘红梅1,杨殿林1,曲 波1,2,皇甫超河1*
(1 农业部环境保护科研监测所,天津 300191;2沈阳农业大学植物园艺学院,沈阳 110866)
为了明确入侵植物黄顶菊对土壤氮循环关键过程硝化作用的影响机制,本研究通过对其入侵地和未入侵地、根围土和根际土氨氧化古菌(ammonia-oxidizing archaea, AOA)的群落多样性分析,探讨了AOA对黄顶菊入侵的响应规律。结果表明:黄顶菊入侵增加了入侵地根围土AOA的多样性,AOA的Shannon指数表现为:入侵地根围土>入侵地根际土>未入侵地土壤,且差异显著。铵态氮含量与pH的变化都会影响土壤AOA的群落结构。系统发育树分析表明,土壤AOA主要隶属于氨氧化古菌的Nitrososphaera cluster。黄顶菊入侵导致的AOA的多样性水平的提升主要是由于入侵地氨氧化菌群种类增加所致。
黄顶菊;氨氧化古菌;微生物多样性;根际效应;入侵植物
近年来,外来入侵植物对土壤氮循环影响成为研究热点之一[1-2]。入侵植物通常倾向于增加土壤氮素的有效性、提高土壤硝化作用速率,即入侵植物和入侵地土壤存在正反馈作用[3]。氨氧化作用(ammonia oxidation),也称亚硝化作用,是硝化作用的第一个反应步骤,也是限速步骤,是全球氮循环的中心环节[4]。2005年美国科学家首次分离得到一株氨氧化古菌(ammonia-oxidizing archaea,AOA)[5],随后的研究发现AOA广泛存在于陆地和海洋生态系统,并且其数量通常远远高于氨氧化细菌(ammonia oxidizing bacteria,AOB)[6]。在不同的土壤环境中,如土壤类型、植被类型、土壤pH、土壤铵态氮浓度和土壤有机质含量对不同的氨氧化微生物均有特异的选择性[7],进而对硝化作用乃至整个氮循环产生影响。AOA和AOB对不同环境因子的响应,可作为潜在环境因子变化的重要指标,对其生态特征的充分认识将为环境质量的变化提供预测、预警。一般认为,AOA较AOB更能够适应胁迫环境,并在低氧如水稻土和低pH土壤中发挥了重要的作用[8],而AOB则在中性和碱性的旱地土壤中发挥了重要作用[9-10]。He等[11]通过对酸性土壤(pH 3.7 ~ 5.8)的施肥试验表明,土壤总细菌的数量在长期施肥过程中没有明显的变化,而AOA和AOB的种群数量却发生了显著的改变;在只施加氮肥的土壤中AOA和AOB的数量最少,而在有机质与氮磷钾肥混施的土壤中数量最多;而且AOA和AOB的数量、土壤硝化潜势(PNR)和pH三者之间存在着显著的正相关关系。不仅如此,AOB的群落结构在各施肥处理之间没有显著差异,而AOA的群落结构差异显著。Di等[12]通过研究高氮草原的土壤氨氧化微生物多样性发现,施加氮肥没有影响AOA的丰度和活性,而AOB的丰度和活性与土壤硝化活性呈正相关关系。由此可见,AOA丰度与硝化作用速率呈显著正相关,相比AOB在表征硝化作用响应环境变化方面似乎起着更为重要的作用[13-14]。如AOA多样性变化对入侵种互花米草(Spartina alterniflora)响应更为强烈[15]。
外来入侵植物黄顶菊(Flaveria bidentis),菊科黄菊属,原产于南美洲,2001年首次发现于我国天津、河北,已经蔓延到我国多个省市,对入侵地的植物多样性和农业生产构成了巨大的威胁[16]。研究显示,随着黄顶菊入侵程度的增加,入侵地土壤全氮与铵态氮的含量提高[16],同时降低了土壤AOB 的多样性,硝化潜势和硝态氮的含量也都呈下降的趋势[17],但AOA对黄顶菊入侵的响应尚不明确。鉴于二者生态位差异和互补性[6],本研究选取黄顶菊入侵典型生境,研究其入侵对AOA群落组成和多样性的影响。
1 材料与方法
1.1 研究区概况
研究区位于天津市静海县黄顶菊入侵重发区(38°35' N, 116°42' E),海拔2.4 m,土壤为碱性潮土,处于暖温带大陆性季风气候区,年均气温11.8℃,年均降水量582 mm,无霜期193 d。该黄顶菊入侵样地主要的伴生植物有狗尾草(Setaira viridis)、芦苇(Phragmites australis)、猪毛菜(Salsola collina)和黄花蒿(Artemisia annua)、鬼针草(Bidens pilosa)等。
1.2 样地设计与土样采集
研究区均为黄顶菊危害的典型荒地生境,形状近方形,面积约0.16 hm2,样地设计时保证每种类型样地坡向、光照和土质基本一致。将研究区采样点分为2种类型样地。①黄顶菊未入侵样地(CK):样地内仅生长有本土植物;②黄顶菊入侵样地:样地内黄顶菊发生年限5 a以上,盖度在60% ~ 100%。两种类型样地间隔2 ~ 5 m,对照小区在黄顶菊扩散的前沿(保证除植被因素外其他条件基本一致)。在每个样地中随机建立5个面积为5 m × 5 m的小区,每个小区为一个重复,各小区间距离大于5 m。于2012年8月12—15日采集土样,此时黄顶菊处于初花期,生长旺盛。入侵样地土样又分为根际土(rhizosphere soil,RPS)和根围土(bulk soil,BS)取样。根际土取样采用抖落法,将每个小区中的10个植株的根际土混合为一个土样;根围土利用5点采样法,采集0 ~ 10 cm表土,组成一个混合土样。在取样前去除地面植物和凋落物等杂质。未入侵样地采样方法同入侵样地根围土采样方法。土样装于塑料自封袋中用冰盒带回实验室。将每个小区采集的土样过2 mm筛后分成3份,其中一份存置于 -20℃ 冰箱,用于分子生物学试验;一份存置于4℃ 冰箱,测定速效氮含量;剩余一份置于室内自然风干,用于其他理化性质的测定。
1.3 测定项目与方法
1.3.1 土壤理化性质测定[18]土壤速效氮采用氯化钾溶液浸提,靛酚蓝比色法测定;全氮采用连续流动分析仪(AA3,Germany)测定;有机质采用重铬酸钾外加热法测定;全钾、速效钾采用原子吸收分光光度计法测定;pH值采用电位法测定;土壤蛋白酶活性采用茚三酮比色法测定;脲酶活性采用靛酚蓝比色法测定。
1.3.2 土壤样品DNA的提取及PCR扩增 用试剂盒(PowerSoil™ DNA Isolation Kit)提取土壤总DNA,按照说明书的最大得率法操作,提取的DNA用1% 琼脂糖凝胶电泳检测。采用如表1所示的特异引物扩增得到amoA基因序列片段。PCR反应条件按照94 ℃ 5 min;94 ℃ 1 min,60 ℃ 1 min,72℃1 min,45个循环;72 ℃ 5 min,得到产物为635 bp的片段。
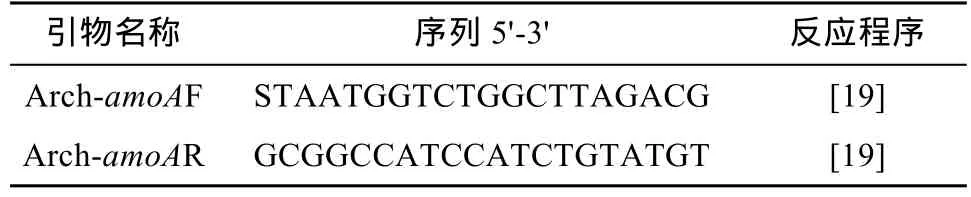
表1 氨氧化古菌PCR扩增引物及其序列
1.3.3 变性梯度凝胶电泳 对上述PCR 产物进行变性梯度凝胶电泳(DGGE)[8]。其中电泳条件为6%聚丙烯酰胺凝胶,变性梯度范围为20% ~ 70%,所用电泳缓冲液均为1×TAE。将25 μl PCR产物和5 μl 6×loading buffer用微量进样器加入孔中,150 V、60 ℃条件下电泳5 h。DGGE图谱用Bio-rad成像系统进行成像。
1.3.4 DGGE条带测序和系统发育分析 选取主要的DGGE条带,用不带GC夹子的Arch-amoAF和Arch-amoAR引物扩增AOA,PCR程序和体系同上。PCR扩增结果用6% 聚丙烯酰胺凝胶电泳检测。检测到的阳性克隆交由上海生工测序。将测序结果与NCBI数据库中的序列进行比对分析,获得相近典型菌株的基因序列。然后利用Mega 5.0中的邻接法(Neighbor-Joining)构建AOA的系统发育树。
1.4 数据处理
DGGE图像采用Quantity one软件进行数据化处理。采用Shannon指数(H)、均匀度指数(E)和丰富度指数(S)来评价土壤AOA的amoA基因多样性。多样性指数和均匀度指数的计算公式如下:

式中:H为Shannon指数,E为均匀度指数,S为DGGE胶中条带数目,Pi为第i条带灰度占该样品总灰度的比率。丰富度为DGGE胶中条带的数目。
采用Canoco 4.5软件包对环境因子与AOA群落结构进行典范对应分析。利用Mega 5.0构建系统发育树,古菌分类参考Wang等[8]的方法。
2 结果与分析
2.1 土壤氨氧化古菌的DGGE图谱分析及多样性分析
土壤AOA的DGGE电泳结果见图1。各土样间存在特异性条带,如条带l和m为土样BS和RPS所特有,其余条带则是3种土样所共有的条带,这表明不同土样存在某些共有的AOA,而某些特异的AOA则只存在于特定土样中。
对各土样的AOA进行变性梯度凝胶电泳后计算得到其Shannon多样性指数(H)(表2),H的排序为:BS > RPS > CK,且差异显著(P<0.05),说明黄顶菊入侵对于AOA多样性没有明显的根际效应。
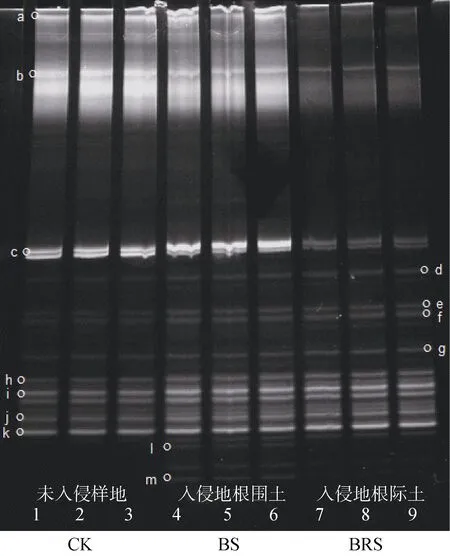
图1 土壤AOA的DGGE电泳图谱
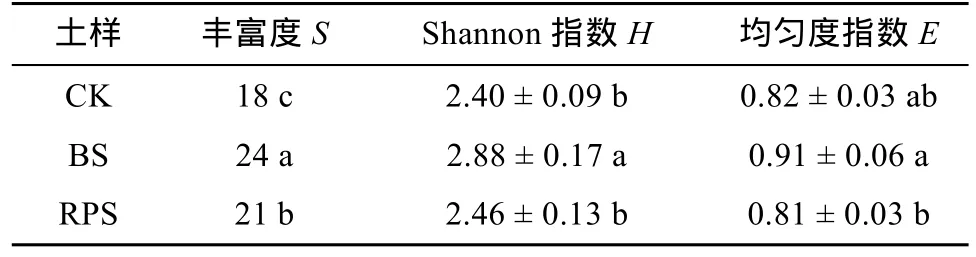
表 2 土壤AOA丰富度、Shannon指数和均匀度指数
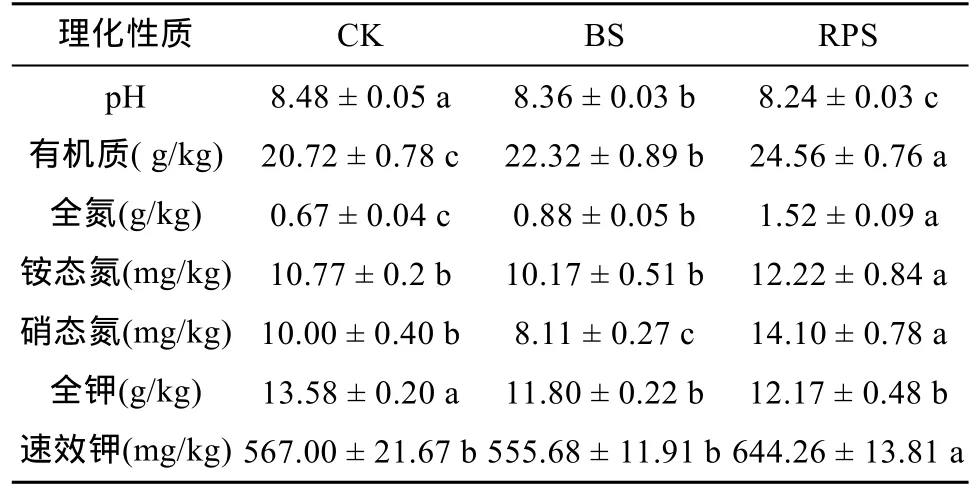
表3 黄顶菊入侵对土壤理化性质的影响[17]
2.2 土壤氨氧化古菌的测序及系统发育树的构建
本研究共割取13条主要DGGE条带,将测序得到的13个阳性克隆与Genbank中AOA序列进行比对,结果表明,13个条带的序列与已知序列的相似性均较高,相似度为97% ~ 100%。利用Mega软件对所有条带及已知序列进行系统发育树(图2)的构建,分析发现测得的序列均隶属于Nitrososphaera类群中亚类10(Nitrososphaera subcluster 10)。
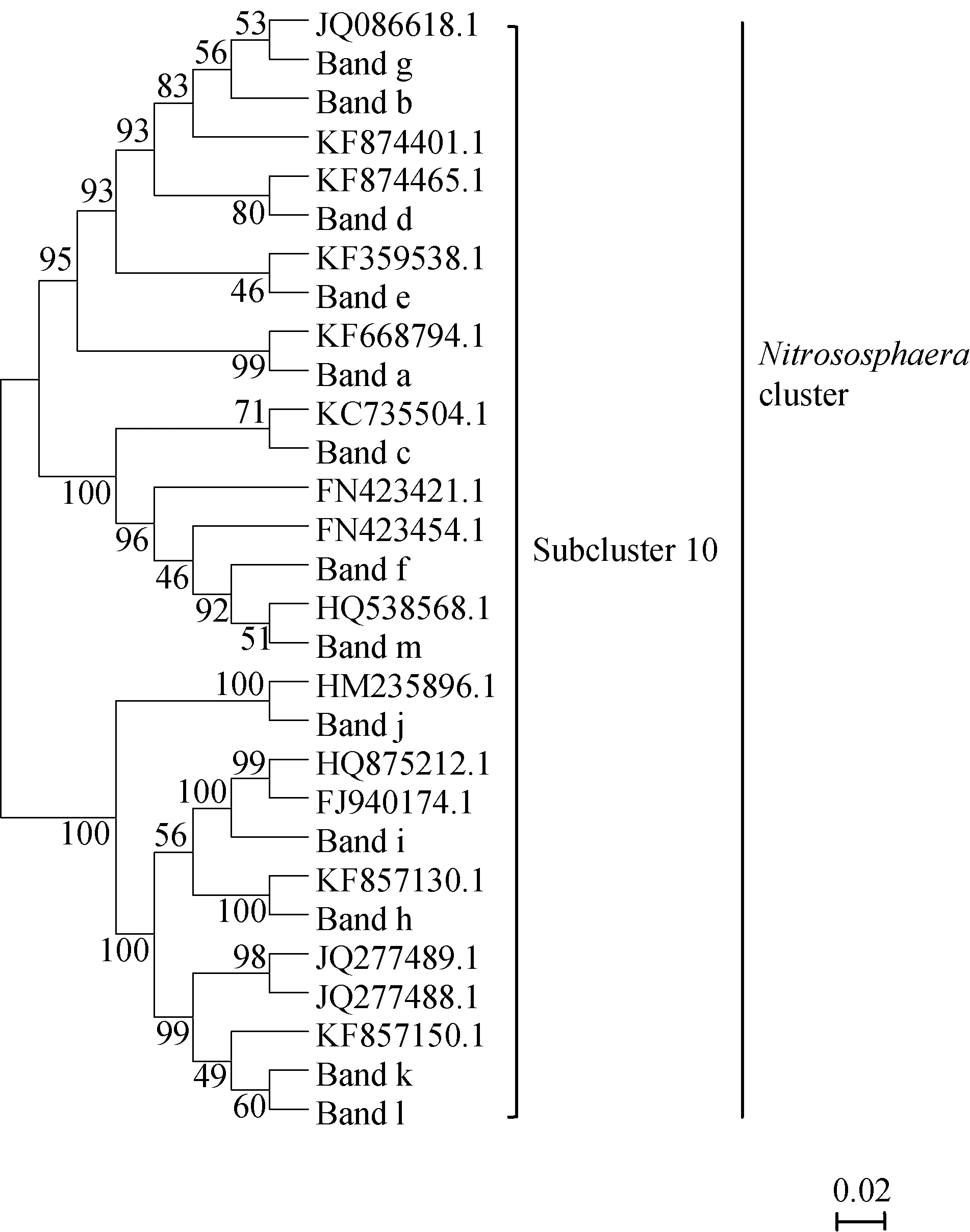
图2 土壤AOA系统发育树(邻接法)
2.3 土壤氨氧化古菌的amoA基因与土壤理化因子间的典范相关分析
为进一步解释AOA的群落结构与环境因子之间的关系,将AOA的指数H与土壤各项理化指标(表3)相结合进行典范相关分析(图3),其中以铵态氮对其影响最大,与第1轴相关系数为0.695 1,而土壤pH与第1轴呈负相关关系,相关系数为 -0.349 2;第2轴则反映了AOA在有机质(r=0.560 2)和速效钾(r=0.482 7)梯度上的变化。经蒙特卡洛检验(Monte Carlo permutation test)发现铵态氮(P=0.003)能够解释AOA的多样性,具有95% 以上的置信度,说明土壤铵态氮含量是影响AOA多样性指数H的关键理化因子。
3 讨论
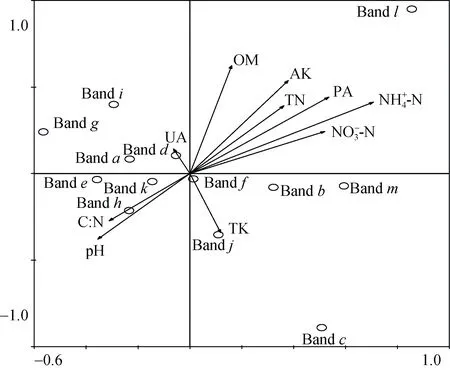
图3 典范对应性分析
土壤多样性是生物多样性的基础[20],入侵植物可以通过影响生境土壤微生物群落的结构,从而创造对自身有利的条件,进而影响入侵地生物多样性。如入侵种加拿大一枝黄花(Solidago canadenis)能够快速高效地获得养分,以创造有利于其入侵的土壤环境[21]。入侵植物会改变微生物的活性、丰度、群落组成、微生物的氮循环,影响生态系统的功能,从而在抑制本土植物生长的同时促进其自身生长[22]。外来入侵植物互花米草(Spartina alterniflora)显著提供入侵地AOA的群落多样性,而对AOB无明显影响[15]。赵晓红等[17]研究发现,黄顶菊入侵降低了非根际土AOB的多样性,但由于根际效应的存在,使得RPS的多样性最高。土壤中PNR可以作为表征AOA丰富度重要因子[23],Zhang等[15]对互花米草的研究表明,在互花米草入侵土壤中PNR和AOA的丰富度均降低。以往的研究表明,黄顶菊入侵土壤中PNR呈下降趋势[17],与AOB不同,在本研究中,AOA随着黄顶菊的入侵土壤多样性水平显著升高,且根围土AOA的丰富度大于根际土AOA的丰富度,因此黄顶菊入侵对AOA影响的根际效应并不明显。
对黄顶菊入侵地影响AOB群落的多样性影响最大的是土壤速效氮含量[16]。有研究发现酸性土壤中施用铵态氮肥可以促进AOB的丰度与多样性,降低AOA的丰度[24]。本研究中铵态氮同样是影响AOA多样性指数的关键理化因子,二者呈显著负相关(r=-0.566;P<0.05)。另一方面,土壤AOA、AOB多样性水平与pH变化关系密切。Weijers等[25]对全球范围内58种土壤样品的分析表明,泉古菌的丰度与土壤pH具有较好的负相关。Nicol等[26]发现当土壤pH为4.9 ~ 7.5时,AOA amoA基因的拷贝数及活性均随土壤pH的降低而升高,且随着土壤pH的下降AOB的多样性明显下降。本试验中,AOA多样性随土壤pH的下降呈上升趋势,这也表明黄顶菊入侵导致的土壤pH的下降[16]可能是AOA多样性水平升高的原因之一。
总之,通过对黄顶菊入侵地和未入侵地土壤AOB、AOA的PCR-DGGE对比分析比较,发现黄顶菊入侵影响了氨氧化微生物的群落丰富度及多样性,其中在降低入侵地AOB多样性水平[17]的同时增加了AOA的多样性水平。特别是入侵地AOA/AOB高于对照样地,且AOA的多样性变化主要受土壤铵态氮和土壤pH的影响,这些变化可能有利于其进一步入侵。本研究提供了黄顶菊入侵和土壤生态系统功能氨氧化微生物群落构成及土壤硝化潜势改变存在联系的直接证据,该结论也解释了其对铵态氮偏好利用的微生物学机制[27],而入侵地土壤理化性质的改变则可能是由于黄顶菊入侵引起了氨氧化微生物群落消长变化所致。
4 结论
1) 黄顶菊入侵通过增加入侵地氨氧化菌群种类,提升了AOA的多样性水平。
2) 铵态氮含量与pH变化均影响土壤AOA的群落结构。
[1] Ehrenfeld J G. Effects of exotic plant invasions on soil nutrient cycling processes[J]. Ecosystems, 2003, 6(6): 503-523
[2] Windham L, Ehrenfeld J G. Net impact of a plant invasion on nitrogen cycling processes within a brackish tidal marsh[J]. Ecological Applications, 2003, 13(4): 883-897
[3] Mack M C, D’Antonio C M, Ley R E. Alteration of ecosystem nitrogen dynamics by exotic plants: a case study of C4grasses in Hawaii[J]. Ecological Applications, 2001,11(5): 1323-1335
[4] 王敬, 程谊, 蔡祖聪,等. 长期施肥对农田土壤氮素关键转化过程的影响[J]. 土壤学报, 2016, 53(2): 292-304
[5] Könneke M, Bernhard A E, Jr D L T, et al. Isolation of an autotrophic ammonia-oxidizing marine archaeon[J]. Nature,2005, 437(7058): 543-546
[6] Leininger S, Urich T, Schloter M, et al. Archaea predominate among ammonia-oxidizing prokaryotes in soils[J].Nature, 2006, 442(7104): 806-809
[7] Jordan F L, Cantera J J L, Fenn M E, et al. Autotrophic ammonia-oxidizing bacteria contribute minimally to nitrification in a nitrogen-impacted forested ecosystem[J].Applied and Environmental Microbiology, 2005, 71(1):197-206
[8] Wang B Z, Zhao J, Guo Z, et al. Differential contributions of ammonia oxidizers and nitrite oxidizers to nitrification in four paddy soils[J]. The ISME Journal, 2015, 9(5):1062-1075
[9] Jia Z J, Conrad R. Bacteria rather than Archaea dominate microbial ammonia oxidation in an agricultural soil[J].Environmental Microbiology, 2009, 11(7):1658-1671
[10] Xia W W, Zhang C X, Zeng X W, et al. Autotrophic growth of nitrifying community in an agricultural soil[J].The ISME Journal, 2011, 5(7): 1226-1236
[11] He J Z, Shen J P, Zhang LM, et al. Quantitative analyses of the abundance and composition of ammonia-oxidizing bacteria and ammonia-oxidizing archaea of a Chinese upland red soil under long-term fertilization practices[J].Environrnental Microbiology, 2007, 9(9): 2364-2374
[12] Di H J, Cameron K C, Shen J P, et al. Alysimeter study of nitrate leaching from grazed grassland as affected by a nitrification in hibitor, dicy andiamide, and relationships with ammonia oxidizing bacteria and archaea[J]. Soil Use and Management, 2009, 25: 454-461
[13] Zhang L M, Offre P R, He J Z, et al. Autotrophic ammonia oxidation by soil thaumarchaea[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(40): 17240-17245
[14] Zhalnina K, de Quadros P D, Camargo F A, et al. Drivers of archaeal ammonia-oxidizing communities in soil[J].Frontiers in Microbiology, 2012, 3: 210
[15] Zhang Q F, Peng J J, Chen Q, et al. Impacts of Spartina alterniflora invasion on abundance and composition of ammonia oxidizers in estuarine sediment[J]. Journal of Soils & Sediments, 2011, 11(6): 1020-1031
[16] 张天瑞, 皇甫超河, 白小明, 等. 黄顶菊入侵对土壤养分和酶活性的影响[J]. 生态学杂志, 2010, 29(7): 1353-1358[17] 赵晓红, 杨殿林, 曲波, 等. 黄顶菊入侵对土壤氨氧化细菌群落结构及多样性的影响[J]. 生态学杂志, 2014,33(6): 1492-1500
[18] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000
[19] Christopher A F, Kathryn J R, J. Michael B, et al. Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(41): 14683-14688
[20] 任圆圆, 张学雷. 土壤多样性研究趋势与未来挑战[J].土壤学报, 2015, 52(1): 9-18
[21] 梁雷, 叶小齐, 吴明, 等. 加拿大一枝黄花入侵对杭州湾湿地围垦区土壤养分及活性有机碳组分的影响[J]. 土壤, 2016, 48(4):680-685
[22] Shannon-Firestone S, Reynolds H L, Phillips R P, et al.The role of ammonium oxidizing communities in mediating effects of an invasive plant on soil nitrification[J]. Soil Biology & Biochemistry, 2015, 90: 266-274
[23] Caffrey J M, Bano N, Kalanetra K, et al. Ammonia oxidation and ammonia-oxidizing bacteria and archaea from estuaries with differing histories of hypoxia[J]. The ISME Journal, 2007, 1(7): 660-662
[24] 魏天娇, 魏志军, 陈鹏, 等. 氮肥形态对香蕉种植土壤中氨氧化细菌与古菌的影响[J]. 土壤, 2015, 47(4): 690-697
[25] Weijers J W H, Schouten S, Spaargaren O C, et al.Occurrence and distribution of tetraether membrane lipids in soils: Implications for the use of the TEX 86proxy and the BIT index[J]. Organic Geochemistry, 2006,37(12):1680-1693
[26] Nicol G W, Leininger S, Schleper C, et al. The influence of soil pH on the diversity, abundance and transcriptional activity of ammonia oxidizing archaea and bacteria[J].Environmental microbiology, 2008, 10(11): 2966-2978
[27] Huangfu C H, Li H Y, Chen X W, et al. Response of an invasive plant, Flaveria bidentis, to nitrogen addition: a test of form-preference uptake[J]. Biological Invasions,2016, 18(11): 3365-3380
Effects of Flaveria bidentis Invasion on Diversity of Soil Ammonia-oxidizing Archaea
LI Keli1, ZHAO Xiaohong1,2, LIU Hongmei1, YANG Dianlin1, QU Bo1,2, HUANGFU Chaohe1*
(1 Agro-Environmental Protection Institute, Ministry of Agriculture, Tianjin 300191, China;2 College of Horticulture, Shenyang Agricultural University, Shenyang 110866, China)
To understand the effects of invasive plant Flaveria bidentis on nitrification processes, the community structures of soil ammonia-oxidizing archaea (AOA) were investigated using the method of PCR-DGGE in a Flaveria bidentis invaded habitat in Jinghai County of Tianjin, China. The results showed that the diversity of AOA community tended to increase with F.bidentis invasion. The Shannon diversity indexes (H) of AOA were in an order of invaded bulk soil > invaded rhizosphere soil >non-invaded soil, with significant differences detected. Ammonium nitrogen and pH value were the key factors determining the community structure of AOA. All identified AOA belonged to Nitrososphaera cluster, the presence of specific ammonia-oxidizing archaea mainly contributed to higher diversity of AOA found in F. bidentis-invaded soil.
Flaveria bidentis; Ammonia-oxidizing archaea; Microbial diversity; Rhizosphere effect; Invasive plant
S154. 3
A
10.13758/j.cnki.tr.2017.05.029
天津市自然科学基金项目(12JCQNJC09800)和公益性行业(农业)科研专项经费项目(201103027;200803022)资助。
* 通讯作者(huangfu24@163.com)
李科利(1990—),女,河南巩义人,硕士研究生,研究方向为入侵植物生态学。E-mail: 1763565935@qq.com

