反复种植失败患者冻融胚胎移植的三种内膜准备方案的分析
杜彦,李洁亮,杜静,卢惠燕,林秀峰
(中山市博爱医院生殖中心,中山 528403)
反复种植失败患者冻融胚胎移植的三种内膜准备方案的分析
杜彦,李洁亮,杜静,卢惠燕,林秀峰*
(中山市博爱医院生殖中心,中山 528403)
目的 使用GnRH-a 3.75 mg降调节激素替代、单纯激素替代及自然周期内膜准备方案对提高反复种植失败患者冻融胚胎移植(FET)妊娠率的利弊分析。 方法 选取160例(周期)行FET的反复种植失败患者,根据内膜准备方式分为自然周期组(A组)82例、激素替代周期组(B组)36 例和降调节激素替代组(C组)42例。比较三组患者的种植率、妊娠率、流产率和生殖激素水平。 结果 A、B和C三组患者的种植率分别为23.61%、21.25%和38.78%,临床妊娠率分别为42.68%、36.10%和61.90%;C组与A组、B组的种植率和临床妊娠率比较差异均有统计学意义(P<0.05)。A组与B组间胚胎移植日内膜厚度差异有统计学意义[(10.40±1.81)mm vs.(9.12±1.61)mm](P<0.05)。三组患者的流产率和异位妊娠率比较,差异无统计学意义(P>0.05)。 结论 与自然周期内膜准备方案及传统激素替代内膜准备方案比较,3.75 mg GnRH-a降调节激素替代内膜准备方式可提高反复种植失败患者冻融胚胎移植妊娠率而不增加流产率。
反复种植失败; 垂体降调节; 冻融胚胎移植; 子宫内膜容受性
(JReprodMed2017,26(11):1104-1108)
1983年世界上第一例冷冻胚胎移植获得临床妊娠[1],1985年第一例冻融胚胎获得健康婴儿出生[2]。经过30多年的努力,体外受精-胚胎移植(IVF-ET)及其衍生技术已取得了巨大的进步。尽管如此,仍有少部分夫妇助孕治疗后未能获得妊娠。胚胎着床是一个复杂的过程,有种植潜能的胚胎和具有容受性的子宫内膜是胚胎种植的必要因素。患者施行胚胎移植后,未能妊娠的最主要原因是种植失败。对于胚胎移植后未获妊娠的患者,本中心以<40岁连续2个周期共移植4个及以上优质卵裂期胚胎或2个及以上优质囊胚未获妊娠称为反复种植失败(repeated implantation failure,RIF)。
RIF可能是由于胚胎发育异常、子宫内膜容受性差,或者多种因素影响的最终结果。夫妇间遗传学的异常、精子缺陷、胚胎非整倍体及透明带异常等是RIF中的胚胎因素。病理状态的子宫内膜如宫腔粘连、子宫内膜增生症、粘附分子及免疫因子表达的异常等都可能降低子宫内膜容受性。而肥胖、吸烟、甲状腺功能异常、高泌乳素血症、子宫内膜异位症和输卵管积水则可能对两方面都不利。
资料与方法
一、研究对象与分组
回顾分析2016年1~10月在我中心诊断为RIF患者进行冻融胚胎移植(FET)的160个周期。纳入标准:(1)<40岁连续2个周期移植4个及以上优质卵裂期胚胎或2个及以上优质囊胚种植失败;(2)所有患者月经周期规律且经超声或宫腔镜证实宫腔形态正常,无子宫肌瘤、宫腔粘连、子宫内膜增生过长、子宫内膜异位症及子宫腺肌病;(3)本次移植至少有1枚优质胚胎。排除标准:(1)子宫内膜过薄(<7 mm);(2)BMI≥26 kg/m2;(3)染色体异常;(4)内科合并症如甲状腺功能异常。
根据内膜准备方式分为自然周期组(A组)82例、激素替代周期组(B组)36 例和降调节激素替代组(C组)42例。比较三组患者的种植率、妊娠率、流产率和生殖激素水平。
二、研究方法
1.内膜准备:(1)自然周期组(A组):月经周期第3~5天B超检查排除卵巢囊肿,依据患者月经周期长短,月经第9~11天再次B超监测卵泡大小,当卵泡直径≥14 mm,内膜厚度≥6 mm时,持续监测尿或者血LH值,必要时肌肉注射HCG10 000 U诱导排卵。排卵后第3天FET卵裂期胚胎,第5天移植囊胚。排卵后给予地屈孕酮(达芙通,雅培,荷兰)20 mg,bid,肌肉注射HCG 2 000 U,q3 d×3次行黄体支持;(2)激素替代周期组(B组):月经的第3~4天B超监测内膜情况,如内膜厚度>5 mm则不入组参与最后的实验数据统计。当日给予补佳乐(含戊酸雌二醇1 mg,拜耳,德国)2片,bid,连续服药7 d,第8天监测内膜厚度,如厚度>6 mm则继续原用药剂量,如厚度<6 mm,加药至每次3片,bid连续服药5 d。第12天时再次监测内膜,厚度<8 mm则加药至每次4片,bid,总服药周期最长不超过3周,3周后如内膜厚度仍<8 mm,则取消周期。当服药天数≥12 d,内膜厚度≥8 mm时,监测血清雌二醇(E2)水平,当E2>700 pmol/L时,继续服用补佳乐并加黄体酮60 mg/d肌肉注射。排卵后第4天FET卵裂期胚胎,第6天移植囊胚。移植术后继续补佳乐与黄体酮行黄体支持;(3)降调节激素替代组(C组):月经第1~3天排除妊娠后予GnRH-a(达菲林注射液,3.75 mg/支,博福-益普生,法国)3.75 mg肌肉注射,28 d后抽血及B超检查,达到垂体降调节标准即E2<183.5 pmol/L、卵泡刺激素(FSH)<5 U/L、黄体生成激素(LH)<5 U/L、子宫内膜厚度<5 mm时,采用HRT方案准备内膜(方法同B 组),但黄体支持增加地屈孕酮(达芙通,雅培,荷兰)20 mg,bid。
2.胚胎冻融和移植:胚胎冻融和移植按玻璃化冷冻操作常规解冻、复苏。卵裂期胚胎分四级。Ⅰ级胚胎:卵裂球大小均匀,无细胞死亡,碎片<5%;Ⅱ级胚胎:卵裂球大小较均匀,碎片占5%~20%;Ⅲ级胚胎:碎片较多,占21%~50%的胚胎;Ⅳ级胚胎:卵裂球不等大,碎片>50%,胞质颗粒不均,变黑,或有大量空泡。解冻后卵裂球成活率≥50%,认为该胚胎复苏。囊胚的质量通过镜下形态学观察进行评定,根据内细胞团和滋养层细胞进行质量评估。内细胞团分级:A 级,细胞数目多,排列紧密;B 级,细胞数目少,排列松散;C 级,细胞数目很少。滋养层细胞分级:A 级,上皮细胞层由较多的细胞组成,结构致密;B 级,上皮细胞由不多的细胞组成,结构松散;C级,上皮细胞层由稀疏的细胞组成。本中心优胚标准:卵裂期7~9细胞Ⅰ级和Ⅱ级胚胎,囊胚评分为3AB及以上胚胎。患者均按卫生部的规定移植1~3 个复苏胚胎。
3.观察指标及妊娠结局判断:移植后继续用药至第12~14天测血HCG≥25 U/L且持续升高,2周后B超监测孕囊,确定是否临床妊娠;临床妊娠确认后持续黄体支持至孕8~12周。早期流产率为移植后3个月内流产人数与临床妊娠人数的比值;胚胎种植率=种植胚胎数/移植胚胎数× 100%。
三、统计学方法
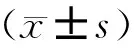
结 果
一、患者一般情况比较
共纳入患者160例,其中A组82例,B组36例,C组42例。患者年龄、体重指数(BMI)、卵巢基础状态、移植胚胎数、移植优质胚胎数等一般情况均符合正态分布,经检验组间差异均无统计学意义(P>0.05)。移植日子宫内膜厚度自然周期与激素替代周期有统计学差异(P<0.05)(表1)。
二、胚胎移植后临床妊娠率、早期流产率、胚胎种植率及异位妊娠率比较
三组间异位妊娠率、早期流产率均无统计学差异(P>0.05),自然周期组与激素替代周期组患者的临床妊娠率、胚胎种植率无统计学差异(P>0.05);但是降调节激素替代组的临床妊娠率、胚胎种植率与自然周期组、激素替代周期组有统计学差异(P<0.05)(表2)。
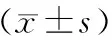
表1 各组患者一般情况及各项观察指标的比较
注:与B组比较,*P<0.05
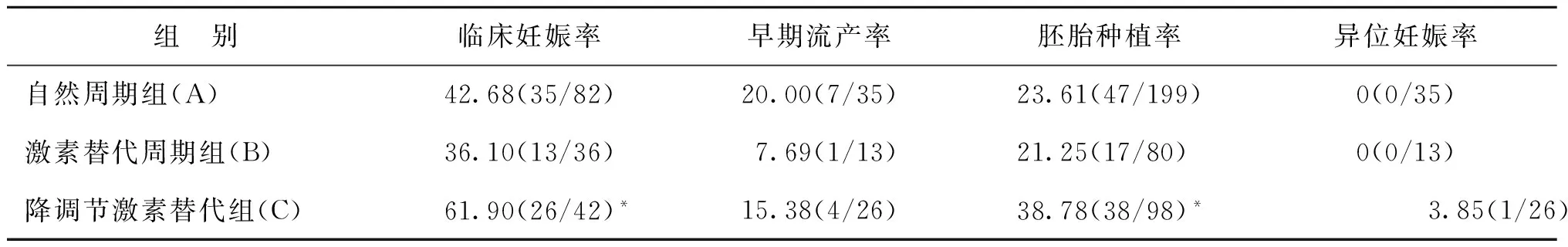
表2 三组患者移植后临床妊娠率、早期流产率、胚胎种植率及异位妊娠率(%)
注:与A组及B组比较,*P<0.05
讨 论
FET的成功妊娠明显增加了IVF-ET的累积妊娠率。在国家全面二孩政策出台后,FET为许多有冷冻胚胎的高龄患者提供了妊娠的希望。在胚胎予以冷冻保存的情况下,子宫内膜条件的好坏直接关系FET技术的成功与否。目前,FET内膜准备方案主要有自然周期、激素替代、降调节激素替代、促排卵周期等。临床上可依据患者的原发疾病、依从性、经济能力等选择不同的方案。
自然周期是FET中最为常见的子宫内膜准备方案,符合胚胎着床的生理要求,且实施方便、花费少。是月经周期规律且有正常排卵患者最经济有效的方案。正常生理过程中,受精卵着床经过定位、黏附和侵入三个过程,但子宫仅有一个极短的窗口期允许受精卵着床,称为种植窗,多为LH峰后7~11 d,非常短暂[3]。因此监测过程中需要反复观察患者尿液或血液的LH数值及卵泡发育情况以确定准确的排卵及种植窗开启时间,其过程繁琐,尤其是患者出现卵泡不破裂黄素化时更难监控,周期取消率高。另有少部分患者可能出现空卵泡,只有形态学改变,没有雌激素、孕激素的周期变化,妊娠率也会下降。在本研究中对于RIF患者,自然周期组的妊娠率较激素替代组高,但没有统计学意义,不建议做为常规选择方案。
激素替代周期多用于排卵障碍或者子宫内膜薄的患者。激素替代周期中患者复诊的次数明显减少,而且可依据患者的工作安排适当调整就诊及手术时间,同时避免因排卵异常导致的取消周期。但是单纯在早卵泡期添加外源性雌激素无法保证垂体被完全抑制,雌激素的增加可能负反馈诱发内源性早发LH 峰,从而影响子宫内膜微环境状态,降低子宫内膜容受性[4]。其次,激素替代周期依靠外源的雌、孕激素维持妊娠,较自然周期黄体支持用药剂量大、时间长,患者的经济负担会有所增加。虽然在本研究中患者的流产率较低,但统计学无差异,不建议作为RIF的首选方案。
降调节激素替代是在FET前给予GnRH-a降调节预处理后再使用激素替代周期行内膜准备。GnRH广泛分布于神经、内分泌、生殖、消化系统和免疫系统,通过传递信息,使各系统达到协调统一。当GnRH-a与脑垂体上的GnRH受体结合初期会促进其分泌FSH和LH,引起用药初期的激发作用,而在用药5~7 d后FSH和LH开始下降,14 d内降低到基础值以下,体内的雌激素处于早卵泡期甚至达绝经期水平,卵巢呈现静止状态,可抑制早发LH峰的出现,获得更高的临床妊娠率和活产率[5];Huang 等[6]的研究表明,子宫内膜间质细胞及上皮细胞均存在GnRH受体,体外细胞培养实验中,它能够激活绒毛膜滋养层和底蜕膜细胞上的尿激酶型纤维蛋白溶解酶,调控子宫内膜间质蛋白水解,从而有利于内膜蜕膜化和早期囊胚着床[7]。Taskin等[8]的研究提示GnRH-a降调节后行激素替代周期中,在予孕激素替代第5天行子宫内膜活检发现,子宫内膜胞饮突成熟发育数目较非GnRH-a激素替代周期组显著增多且治疗反应性增强,妊娠率提高。洪宇等[9]研究表明GnRH-a可以增加子宫内膜整合素avβ3 的表达,整合素avβ3 可以通过介导滋养层细胞与子宫内膜上皮细胞之间的相互作用,参与囊胚黏附,使胚胎植入子宫内膜,从而提高子宫内膜容受性。故GnRH-a不仅可使卵泡发育同步化,而且可增加子宫内膜容受性。因此,降调节激素替代可减少自发卵泡发育,降低取消率,使子宫内膜更易接受外源性激素调控,改善胚胎种植环境,还可灵活安排胚胎移植时间。
RIF的发生机制尚未明确,有不少的研究认为与免疫因素有关。对于存在免疫异常的患者,在FET中使用GnRH-a降调节,可部分逆转Th2类细胞因子,从而使Th1/Th2比例达到平衡,由此促进母胎免疫耐受,避免种植失败及妊娠丢失。Yang等[10]、方颖等[11]、吴晓燕等[12]研究表明,对于RIF患者,使用降调节激素替代周期较其他内膜准备方案显著提高胚胎种植率、临床妊娠率及继续妊娠率。
本研究通过回顾性分析也得出相同的结论:对于RIF患者FET时使用降调节激素替代周期的胚胎种植率和临床妊娠率高于激素替代周期与自然周期。
但是,由于长效GnRH-a的价格较高,使用此方案延长了患者FET的准备时间,增大了药物的使用,增加了患者的经济负担。因此,我们在临床上并不将其作为首选的FET方案。但对于RIF的患者可最终提高 FET 的妊娠率,可作为首选。
[1] Trounson A,Mohr L.Human pregnancy following cryopreservation,thawing and transfer of an eight-cell embryo[J].Nature,1983,305:707-709.
[2] Cohen J,Simons RF,Fehilly CB,et a1.Birth after replacement of hatching blastocyst cryopreserved at the expanded blastocyst stage[J].Lancet,1985,16:647-659.
[3] Marcus SF,Ledger WL.Efficacy and safety of long-acting GnRH agonists in in vitro fertilization and embryo transfer[J].Hum Fertil(Camb),2001,4:85-93.
[4] 张波,颜军昊.胚胎反复着床失败的病因及处理措施[J].生殖与避孕,2014,34:564-570.
[5] Eltoukhy T,Taylor A,Khalaf Y,et al. Pituitary suppression in ultrasound-monitored frozen embryo replacement cycles.A randomised study[J].Hum Reprod,2004,19:874-879.
[6] Huang HY,Raga F,Kruessel JS,et al. Gonadotropin-releasing hormone messenger ribonucleic acid and protein expression in Vero cells[J].J Assist Reprod Genet,2001,18:268-275.
[7] Liu J,Maccalman CD,Wang YL,et al. Promotion of human trophoblasts invasion by gonadotropin-releasing hormone(GnRH) I and GnRH Ⅱ via distinct signaling pathways[J].Mol Endocrinol,2009,23:1014-1021
[8] Taskin O,Akkoyunlu G,Simsek M,et al. Comparing the effects of GnRH-a on endometrial receptivity in patients undergoing ART and prepared frozen embryo transfer cycles[J].Fertil Steril,2002,78:S232.
[9] 洪宇,谢梅青,王良岸,等.GnRH-a对内异症术后患者黄体中期子宫内膜整合素avβ3和PR 表达的影响[J].中华妇产科杂志,2010,45:699-701.
[10] Yang X,Huang R,Wang YF,et al. Pituitary suppression before frozen embryo transfer is beneficial for patients suffering from idiopathic repeated implantation failure[J].HuaZhong Univ Sci Technolog Med Sci,2016,36:127-131.
[11] 方颖,洪黎明,杨晓葵.降调节联合激素替代周期方案在多次胚胎种植失败患者冻融胚胎移植周期中的应用[J].首都医科大学学报,2015,35:1-4.
[12] 吴晓燕,李志凌,林虹,等.多次胚胎移植失败患者采用冻融胚胎移植3种内膜准备方案结局分析[J].中国计划生育学杂志,2014,22:248-254.
[编辑:谷炤]
Analysis of the outcome of three kinds of endometrial preparation protocols in frozen-thawed embryo transfer cycle in patients with repeated implantation failure
DUYan,LIJie-liang,DUJing,LUHui-yan,LINXiu-feng*
ReproductiveCenterofBoAiHospital,Zhongshan528403
Objective:To analyze the outcome of down-regulation & hormone replacement,hormone replacement only and natural cycle in frozen-thawed embryo transfer in patients with repeated implantation failure.
Methods:A total of 160 patients with repeated implantation failure were selected and divided into natural cycle(group A,n=82),hormone replacement cycle(group B,n=36) and down-regulation & hormone replacement cycle(group C,n=42).The implantation rate,pregnancy rate,abortion rate and reproductive hormone level were compared among the three groups.
Results:The implantation rate was 23.61%,21.25% and 38.78% and the pregnancy rate was 42.68%,36.10% and 61.90% in group A,B,C respectively.There were significant differences in implantation rate and pregnancy rate between Group C and the other two groups(P<0.05).There was significant difference in endometrial thickness[(10.40±1.81) mm vs.(9.12±1.61) mm]on day of transplantation between Group A and Group B(P<0.05).There were no significant differences in abortion rate and ectopic pregnancy rate among the three groups(P>0.05).
Conclusions:Compared with hormone replacement only cycle and natural cycle,pregnancy rate can be effectively improved by hormone replacement cycle after down regulation in the patients with repeated implantation failure,and it does not increase the abortion rate.
Repeated implantation failure; Down regulation; Frozen-thawed embryo transfer; Endometrial receptivity
10.3969/j.issn.1004-3845.2017.11.011
2017-08-29;
2017-09-12
杜彦,女,广东中山人,副主任医师,生殖医学专业.(*
)

