高孕激素状态下促排卵方案在前次超短方案助孕失败的卵巢低反应患者中的应用
杨毅,孙振高,王晓明,徐凯月
(山东中医药大学第一临床医学院,山东中医药大学附属医院中西医结合生殖与遗传中心,济南 250014)
·临床实践·
高孕激素状态下促排卵方案在前次超短方案助孕失败的卵巢低反应患者中的应用
杨毅,孙振高*,王晓明,徐凯月
(山东中医药大学第一临床医学院,山东中医药大学附属医院中西医结合生殖与遗传中心,济南 250014)
目的 探讨高孕激素状态下促排卵(PPOS)方案对前次采用超短方案促排的卵巢低反应(POR)患者的促排卵结局。 方法 回顾性分析17 例前一周期行超短方案助孕失败,后改用PPOS方案的POR患者临床资料。 结果 17例患者两次促排卵方案的HCG日血清LH、E2、P水平均无统计学差异(P>0.05);PPOS方案HCG日直径>14 mm卵泡数显著多于前次超短方案组[(4.83±2.82)vs.(3.25±2.53)](P<0.01);PPOS方案的Gn启动量、Gn天数、Gn总剂量均小于前次超短方案,但均无统计学差异(P>0.05);PPOS方案获卵数显著多于前次超短方案[(4.29±3.11)vs.(2.76±2.33)](P<0.05);PPOS方案组患者MⅡ卵数、卵裂数、2PN数、可移植胚胎数、优质胚胎数、优质胚胎率、胚胎利用率均高于前次超短方案组,但均无统计学差异(P>0.05)。 结论 PPOS方案改善了POR患者HCG日优势卵泡数目及获卵数,为POR患者促排卵提供了新治疗思路。
高孕激素状态下促排卵; 超短方案; 卵巢低反应; 自身对照
近年,随着国家生育政策的改变,具有生育要求的高龄女性患者越来越多。助孕过程中,高龄女性发生卵巢低反应(POR)的几率较大,有研究表明,POR在高龄(≥40岁)女性中发生率超过50%[1]。POR表现为窦卵泡数少和(或)卵母细胞质量下降,对药物反应差,促排卵结局不理想,是目前困扰临床医生的难题之一。针对POR患者,现在尚无公认的可以改善其助孕结局的方案。超短方案作为POR患者促排卵方案之一,临床已应用多年。近几年,高孕激素状态下促排卵(PPOS)方案也逐渐应用于POR患者促排卵[2]。本研究选取前一取卵周期采用超短方案促排卵助孕失败,之后改用PPOS方案促排的POR患者,比较其前后两周期促排卵结局。
一、资料与方法
1.研究对象及分组:在2016年1月至2017年1月于山东中医药大学附属医院中西医结合生殖与遗传中心就诊患者中,选取2次及2次以上行IVF/ICSI且前次超短方案助孕失败,后应用PPOS方案的POR患者进行回顾性分析。
POR患者入选标准[3]:(1)高龄(≥40 岁)或存在卵巢反应不良的其它危险因素;(2)前次IVF周期POR,常规方案获卵数≤3个;(3)卵巢储备下降[窦卵泡数(AFC)<5~7个或基础抗苗勒管激素(AMH)<0.5~1.1 ng/ml]。至少满足3条中的2条即可诊断POR。如果年龄或卵巢储备功能检测正常,患者连续两个周期应用最大化的卵巢刺激方案仍出现POR也可诊断。
排除子宫内膜异位症(EMS)、多囊卵巢综合征(PCOS)及其他内分泌异常患者。
共纳入了17例符合标准的患者,采用自身对照方式比较前后两次促排卵结局。
2.促排卵方案回顾:(1)PPOS方案:月经周期第2~4天开始口服安宫黄体酮片(MPA,2 mg/片,浙江仙琚制药)10 mg/d,同日开始注射HMG(珠海丽珠医药),第6~7天起根据B超检测卵泡情况及血黄体生成素(LH)、雌二醇(E2)、孕激素(P)水平调整HMG用量,直至HCG注射日。当有3个卵泡直径≥16 mm或2个卵泡直径≥17 mm或1个卵泡直径≥18 mm时,给予HCG(珠海丽珠医药)10 000 U扳机,34~35 h后经阴道超声引导下取卵。取卵后根据男方精液质量进行IVF或ICSI,并在取卵后第3天对胚胎质量进行评估。(2)超短方案:月经周期的第3天皮下注射促性腺激素释放激素激动剂(GnRH-a,达必佳,辉凌,德国)0.1 mg,使用1 d,周期第4天开始每日添加HMG(珠海丽珠医药),第6~7天起根据B超监测卵泡情况以及血LH、E2、P水平调整HMG用量,直至HCG注射日。以下处理同PPOS方案。
3.观察指标:主要观察指标为Gn用量、获卵数、获卵率、可移植胚胎数、优质胚胎数、优质胚胎率、胚胎利用率等。优质胚胎率=(Ⅰ级+Ⅱ级胚胎数)/形成胚胎数×100%;胚胎利用率=移植胚胎数+冷冻胚胎数)/2PN卵裂数。
4.统计学处理:用SPSS 19.0统计学软件对数据进行统计学分析。应用t检验及χ2检验,P<0.05为差异有统计学意义。
二、结果
1.患者一般情况:在所有行IVF/ICSI患者中,符合条件纳入研究的患者共17 例。平均年龄(40.00±5.33)岁(26~51岁),平均不育年限(4.59±3.28)年(1~14年);基础FSH(11.93±4.42)U/L(4.75~23.34 U/L)、LH(4.92±2.17)U/L(1.51~9.14 U/L)、E2(166.29±94.65) pmol/L(51.38~333.97 pmol/L)、P(2.35±1.53) nmol/L(0.45~6.07 nmol/L)。
2.两次促排卵方案HCG日血清激素水平及优势卵泡比较:前后两次促排卵方案的HCG日血清LH、E2、P差异均无统计学意义(P>0.05);PPOS方案HCG日直径>14 mm卵泡数显著多于超短方案组(P<0.01)(表1)。
3.两次促排卵方案用药情况及获卵数比较:PPOS方案其Gn启动量、Gn天数、Gn总剂量均小于超短方案组患者,但差异均无统计学意义(P>0.05);PPOS方案获卵数显著多于前次超短方案(P<0.05)(表2)。
4.两次促排卵方案实验室指标比较:PPOS方案MⅡ卵数、卵裂数、2PN数均大于超短方案组,但差异均无统计学意义(P>0.05)(表3)。
5.两次促排卵方案胚胎情况比较:PPOS方案移植胚胎数、优质胚胎数、优质胚胎率、胚胎利用率均高于超短方案组,但差异均无统计学意义(P>0.05)(表4)。
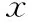
表1 两次方案HCG日血清激素水平及优势卵泡数比较(-±s)
注:与前次超短方案比较,*P<0.01
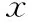
表2 两次方案用药情况及获卵数比较(-±s)
注:与前次超短方案比较,*P<0.05
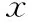
表3 两次方案实验室指标比较(-±s)
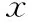
表4 两次方案胚胎情况比较[(-±s),n(%)]
三、讨论
POR是指卵巢对促性腺激素(Gn)刺激反应不良,体现在刺激周期后血雌激素峰值低、Gn用量多、获卵数少、临床妊娠率低等方面[4]。综合AMH水平、基础AFC、基础FSH等数据分析可以预测卵巢的反应性[5]。目前国际上普遍接受的POR标准是2011年欧洲人类胚胎与生殖学会(ESHRE)和美国生殖医学协会(ASRM)讨论并制定的博洛尼亚共识[3]。目前常用AMH水平、基础FSH水平等作为卵巢储备预测因子判断卵巢反应性及选定药物剂量。年龄是影响卵巢反应性的最主要因素,是卵巢储备功能最主要标志物之一[6]。随着年龄增大,患者发生POR的几率亦随之增高,POR常导致获卵数少、胚胎质量差,从而影响妊娠率[7]。如何改善POR患者的助孕结局已经成为生殖医学关注的热点及难点。
针对POR患者,目前尚无统一的治疗方案。临床常以超短方案作为POR患者促排卵方案,其优点表现在:应用短效GnRH-a可使内源性Gn迅速释放,“一过性升高”(“flare up”)作用有助于窦卵泡募集;GnRH-a使用时间短,对垂体功能的影响程度小。但由于高龄女性卵泡期较短,超短方案GnRH-a的flare-up作用未及时发挥而致卵泡同步性差,获卵数和妊娠率降低[8-9]。近年来Kuang等[10]研究黄体期促排卵时,发现高孕酮状态不影响卵泡的生长及卵母细胞质量并且能有效抑制早发性LH峰;Setwart等[11]也在动物实验中发现添加口服黄体酮可以增加卵巢对Gn的敏感性并延缓卵泡发育。孕酮本身对卵细胞发育和卵母细胞质量无显著影响,高孕酮水平主要影响子宫内膜的容受性[12]。Kuang等[13]进一步在卵巢功能正常的患者中进行高孕激素状态下促排卵(PPOS),发现仍然可以抑制LH峰,获得理想的临床结局。PPOS方案特点是主要作用于下丘脑的孕激素受体,不干扰垂体GnRH受体的功能,垂体Gn脉冲性分泌的特性没有被抑制。PPOS方案用于卵巢功能正常及PCOS患者简单、安全、有效[14],但国内对其在POR患者中的应用报道不多。
PPOS方案是在雌激素水平上升前使用孕激素,使下丘脑孕激素化,有效阻断雌激素诱导的正反馈作用,从而抑制早发LH峰发生[15]。由于醋酸甲孕酮(MPA)能有效抑制LH水平,而高龄患者卵巢对LH敏感性降低,可能需更高水平LH来满足卵泡发育[16],故PPOS方案促排卵中常全程添加LH(HMG)。本研究通过同一POR患者前后两次促排卵方案的自身对照研究,发现PPOS方案与前次超短方案比较,HCG日血清激素LH、E2、P无统计学差异,但PPOS方案HCG日直径>14 mm卵泡数显著多于前次超短方案;其余实验室指标(包括获卵数及卵/胚质量等)PPOS方案略优于前次超短方案,但均无统计学差异。结果提示,PPOS方案可作为POR患者促排方案所使用,与超短方案相比其HCG日>14 mm卵泡数及获卵数具有一定优势,说明PPOS方案是一种临床可行的促排卵方案,且在POR患者中呈现一定优势。但其HMG总剂量、HMG启动量、HMG使用天数、MⅡ卵数、卵裂数、2PN数、可移植胚胎数、优质胚胎数与超短方案周期相比均无统计学差异,可能与入选患者年龄较大、基础 FSH 更高,且大部分患者有前次或多次促排失败有关。
此外,由于MPA可使子宫内膜提前出现分泌期改变,种植窗提前,不能进行新鲜周期移植,需全胚胎冷冻后再行冻融胚胎移植(FET)。但PPOS方案的这一特点并不影响其在POR患者中的应用。首先,随着FET技术的不断完善和发展,FET与鲜胚移植的成功率无明显差异[17],胚胎长期冷冻保存对冻融胚胎的质量及发育潜力影响不大[18];其次,胚胎冷冻可避免本周期超生理水平激素对内膜的影响,使内膜得到更好的准备;第三,本研究发现与超短方案相比,PPOS方案可增加POR患者的获卵数,具有一定优势。本研究中PPOS方案组患者共行8个FET周期,其中1个周期治疗结局为妊娠,其余7个周期均未孕,妊娠率12.5 %。但多数患者胚胎尚未移植,不能提供完整的临床妊娠结局,因而未能对其妊娠结局进行全面分析。故本研究需今后继续扩大样本量,完善妊娠结局并作进一步观察研究。
[1] Revelli A,Biasoni V,Gennarelli G,et al. IVF results in patients with very low serum AMH are significantly affected by chronological age[J].J Assist Reprod Genet,2016,33:603-609.
[2] 张少娣,陈圆辉,王雪,等.高孕激素状态下促排卵方案(PPOS)与非典型微刺激方案在卵巢低反应患者体外受精-胚胎移植(IVF-ET)中的效果[J].生殖与避孕,2016,36:981-985.
[3] Ferranretti AP,La Marca A,Fauster BC,et al. ESHRE workinggroup on poor ovarian respone definition.ESHRE consensuson the definition of ‘poor response’ to ovarian stimulation forin vitro fertilization:the Bologna criteria[J].Hum Reprod,2011,26:1616-1624.
[4] 武学清,孔蕊,田莉,等.卵巢低反应专家共识[J].生殖与避孕,2015,35:71-79.
[5] Marca AL,Ferraretti AP,Palermo R,et al. The use of ovarian reserve markers in IVF clinical practice:a national consensus[J].Gynecol Endocrinol,2015,32:1-5.
[6] Scheffer JB,Scheffer BB,de Carvalho RF,et al. Age as a predictor of embryo quality regardless of the quantitative ovarian response[J].Int J Fertil Steril,2017,11:40-46.
[7] Zhang J,Qiu X,Gui Y,et al. Dehydroepiandrosterone im-proves the ovarian reserve of women with diminished ovar-ian reserveand is a potential regulator of the immune response in the ovaries[J].Biosci Trends,2015,9:350-359.
[8] Sbracia M,Farina A,Poverini R,et al. Short versus long gonadotropin-releasing hormone analogue suppression protocols for superovulation in patients>or=40 years old undergoing intracytoplasmic sperm injection[J].Fertil Steril,2006,84:644-648.
[9] Ho CH,Chen SU,Peng FS,et al. Prospective comparison of short and long GnRH agonist protocols using recombinant gonadotrophins for IVF/ICSI treatments[J/OL].Reprod Biomed Online,2008,16:632-639.
[10] Kuang Y,Hong Q,Chen Q,et al. Luteal-phase ovarian stimulation is feasible for producing competent oocytes in women undergoing in vitro fertilization/intracytoplasmic sperm injection treatment,with optimal pregnancy outcomes in frozen-thawed embryo transfer cycles[J].Fertil Steril,2014,101:105-111.
[11] Stewart RA,Crosier AE,Pelican KM,et al. Progestin priming before gonadotrophin stimulation and AI improves embryo development and normalises luteal function in the cat[J].Reprod Fertil Dev,2015,27:360-371.
[12] Aflatoonian A,Davar R,Hojjat F.Elevated serum proges-terone/MⅡ oocyte ratio on the day of human chorionic gonadotropin administration can predict impaired endome-trial receptivity[J].Iran J Reprod Med,2014,12:427-434.
[13] Kuang Y,Chen Q,Fu Y,et al. Medroxyprogesterone acetate is an effective oral alternative for preventing premature luteinizing hormone surges in women undergoing controlled ovarian hyperstimulation for in vitro fertilization[J].Fertil Steril,2015,104:62-70.
[14] Wang Y,Chen Q,Wang N,et al. Controlled ovarian stimu-lation using medroxyprogesterone acetate and hMG in patients with polycystic ovary syndrome treated for IVF:adouble-blind randomized crossover clinical trial[J].Medicine(Baltimore),2016,95:e2939.
[15] 沈秀,李颂军,周睿琼,等.高孕激素下促排卵方案用于FSH升高DOR患者的临床效果观察[J].生殖医学杂志,2017,26:351-356.
[16] Fabregues F,Penarrubia J,Creus M,et al. Tansdermaltestosterone may improve ovarian response to gonadotro-phins in low-responder IVF patients:a randomized,clin-ical trial[J].Hum Reprod,2009,24:349-359.
[17] Wong KM,Mastenbroek S,Repping S.Cryopreservation of human embryos and its contribution to in vitro fertilization success rates[J].Fertil Steril,2014,102:19-26.
[18] 王雪,甄璟然,孙正怡,等.囊胚冷冻保存时间对复苏移植临床结局的影响[J].生殖医学杂志,2016,25:389-394.
[编辑:罗宏志]
10.3969/j.issn.1004-3845.2017.11.019
2017-05-12;
2017-06-25
国家自然科学基金(81373676;81674018)
杨毅,男,山东济南人,硕士,中医妇科学专业.(*
)

