表现为无精子症的睾丸间质细胞瘤的诊断与治疗(1例报告及文献复习)
杨文博 兰 轲 张晓威 王兴兴 彭 雪 耿 冲 李 清 徐 涛 白文俊*
1. 北京大学人民医院泌尿外科(北京 100044);2. 北京大学人民医院病理科;3. 北京大学人民医院肿瘤科;4. 北京市大兴区人民医院泌尿外科
表现为无精子症的睾丸间质细胞瘤的诊断与治疗(1例报告及文献复习)
杨文博1兰 轲1张晓威1王兴兴2彭 雪3耿 冲4李 清1徐 涛1白文俊1*
1. 北京大学人民医院泌尿外科(北京 100044);2. 北京大学人民医院病理科;3. 北京大学人民医院肿瘤科;4. 北京市大兴区人民医院泌尿外科
目的探讨睾丸间质细胞瘤导致的无精子症诊断和治疗经验。方法报告1例睾丸间质细胞瘤导致的无精子症患者的临床资料并文献复习。患者男,24岁,已婚,因“婚后规律性生活1年未育”就诊,行精液检测示正常精液容量的无精子症。结果患者血浆促卵泡生成素(FSH)和黄体生成素(LH)水平明显被抑制,而雄烯二酮水平则明显升高,脱氢表雄酮水平正常,睾丸CT与盆腔核磁检查提示左侧睾丸占位性病变。行保留睾丸的病灶切除术。术后病理诊断为睾丸间质细胞瘤。术后随访6个月未见肿瘤复发或转移。患者性激素水平完全恢复正常,生精功能部分恢复。术后随访第7个月,性伴侣已孕2周。结论睾丸间质细胞瘤的主要治疗措施是睾丸切除术。对于肿瘤体积较小、青春期前和双侧睾丸间质细胞瘤的患者,保留睾丸的病灶切除术也许是安全可行的。
莱迪希细胞瘤/诊断, 治疗; 无精子症
睾丸肿瘤在男性所有肿瘤中占1%~1.5%,而睾丸间质细胞肿瘤更少见,只占睾丸肿瘤总数的1%,而具有激素分泌功能的睾丸间质细胞肿瘤则更少见。对于未成年男性,这种肿瘤会导致性早熟[1],而对于成年男性,临床特点和激素水平差异很大[2-7]。
本文报告1例临床表现为无精子症并且伴随血液循环中睾酮水平升高的睾丸间质细胞瘤,探讨其诊断和治疗经验。
资料与方法
患者男,24岁,已婚,因“婚后规律性生活1年未育”于2016年10月就诊于外院,行精液检测(见表1)示正常精液容量的无精子症。促卵泡生成素(FSH)<0.10mIU/mL;黄体生成素(LH)<0.10mIU/mL;总睾酮41.00nmol/L;雄烯二酮>10.0ng/mL。染色体核型:46,XY,G显带未见异常。肿瘤标志物:甲胎蛋白:2.94ng/mL,β-hCG<0.10mIU/mL。未作精液细菌培养。睾丸超声显示:右侧睾丸:正常大小,回声质地正常,未发现局灶病变,附睾正常,无精索静脉曲张;多普勒超声检查血管正常。左侧睾丸:内见低回声团块,大小21mm×19mm,形态规则,边界清晰,内部回声均匀,多普勒超声检查示周围见丰富血流信号。
后该病人转至我院,体格检查示正常成年男性发育,睾丸位于阴囊内。双侧睾丸未触及异常肿物。右侧睾丸略萎缩,输精管可触及。无男性乳房发育,无皮质醇增多症表现。甲状腺功能5项、脱氢表雄酮、8am促肾上腺皮质激素、8am皮质醇检验均未见明显异常。患者实验室检查示促性腺激素被显著抑制和雄烯二酮显著升高(见表2),这可能是精子生成衰竭的原因。脱氢表雄酮水平正常,这说明不是肾上腺型雄激素过多症。腹部超声未见明显异常(无肾上腺异常,无继发性病变)。进一步行睾丸CT与盆腔核磁检查。睾丸CT:左侧睾丸略显增大,密度稍欠均匀,左侧精索增粗,左侧阴囊内可见水样密度影,右侧睾丸及附睾大小如常,形态规整,密度无改变,鞘膜腔未见扩大,阴囊未见肿胀和增厚,右侧精索粗细正常,腹股沟管未见扩大,其内未见异常密度影。盆腔核磁显示:右侧睾丸大小约3.2cm×2.2cm,左侧睾丸大小约2.9cm×2.6cm,左侧睾丸内见类圆形稍短T1、稍短T2信号影(相对于正常睾丸组织),DWI呈高信号,大小约2.2cm×1.9cm。所示尿道、双侧附睾未见明确异常。提示:左侧睾丸占位性病变(见图1)。
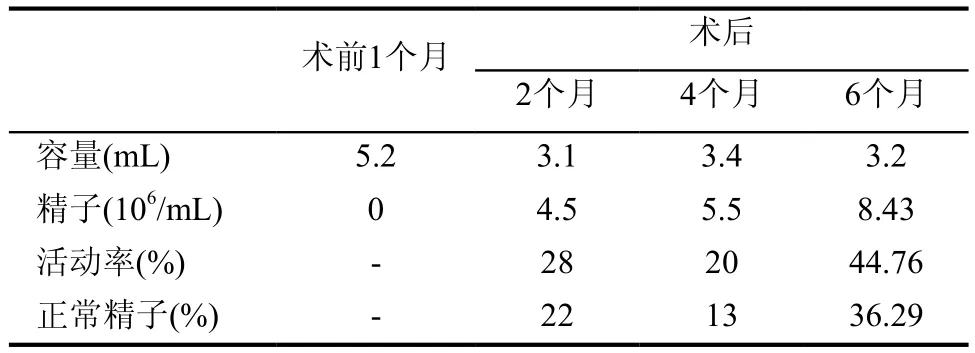
表1 精液分析
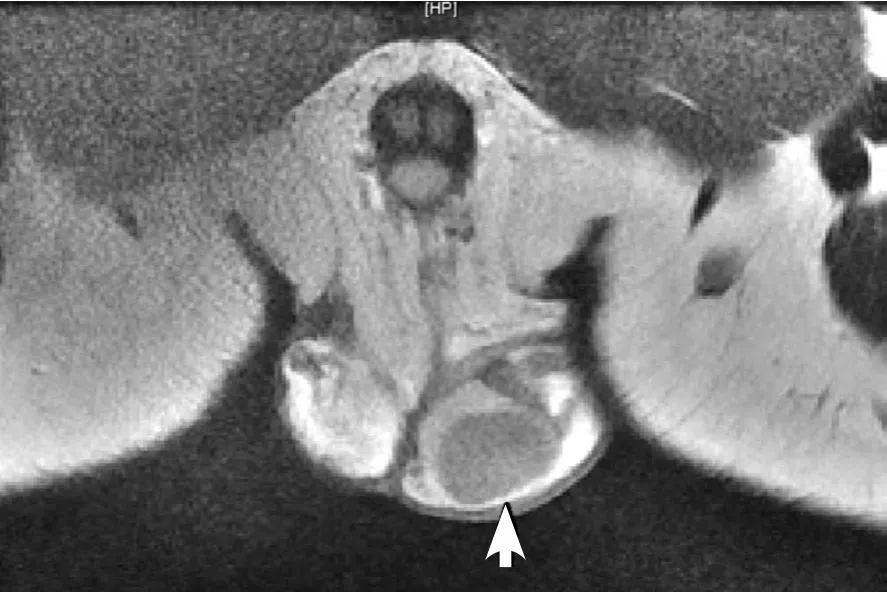
图1 睾丸间质细胞瘤盆腔MRI T2WI图像所见
结 果
术前诊断睾丸间质细胞瘤明确,采用保留睾丸的病灶切除术。
手术完整切除肿瘤35mm×25mm×15mm。肿瘤呈结节状,细胞呈多角形,实性巢片状生长,细胞胞浆丰富嗜酸性,细胞轻度异型,免疫组化染色结果:inhibin-a(+),calretinin(+),CK(-),EMA(-),S-100(-),Vimentin(+),CD99(灶+),PLAP(-),CD117(-),Ki-67(<5%+),符合睾丸间质细胞瘤(见图2)。(左侧睾丸鞘膜)纤维囊壁组织,未见上皮被覆。
肿瘤切除后,术后6个月随访发现促性腺激素、睾酮、雌激素和雄烯二酮水平恢复正常(见表2),未见肿瘤复发或转移,精液分析示精子生成功能部分恢复。术后随访第7个月,性伴侣已孕2周。
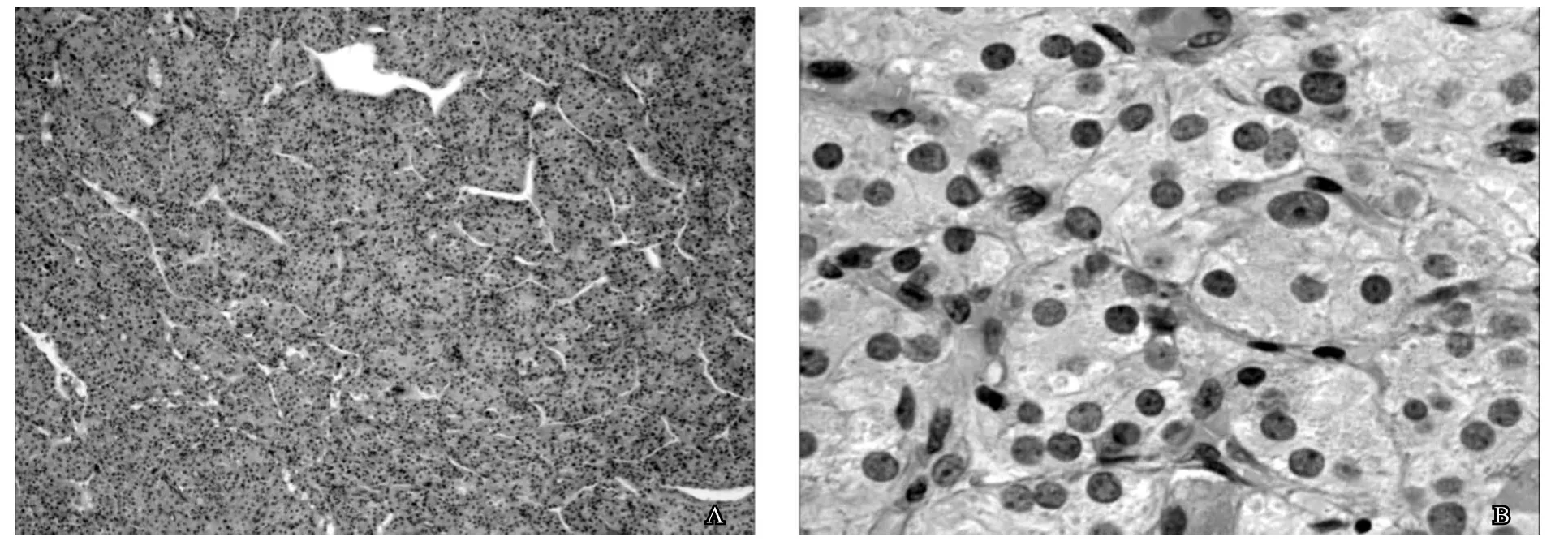
图2 睾丸间质细胞瘤
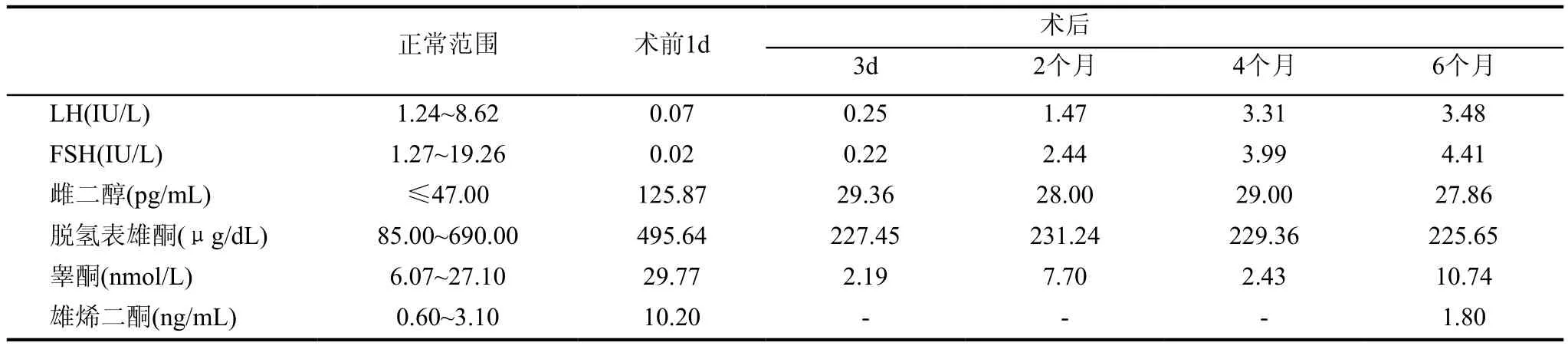
表2 术前术后性激素值的比较
讨 论
根据世界卫生组织分类,睾丸间质细胞瘤属于性索间质肿瘤,来源于间质细胞(Leydig cell),在生精小管之间的间质组织中形成。在此之前国内外报道的临床表现为无精子症的睾丸间质细胞瘤只有3例。Boulanger等[3]报告的病例中,血清睾酮、脱氢表雄酮、5α-雄甾烷-3α,17β-二醇水平都是正常的,雌二醇在正常范围内高值,而雄烯二酮则明显升高。精索静脉中的睾酮水平降低,提示肿瘤组织中17β-羟基类固醇脱氢酶部分缺乏。术后28个月,所有性激素均正常。还有日本学者[8]在2003年报道了一例,患者血浆LH和雌二醇水平正常,而FSH和睾酮明显降低,术后140d,FSH和LH较术前明显升高并且FSH恢复正常水平,精液分析结果示生精功能部分恢复,未见肿瘤复发。Prasivoravong等[9]在2016年报告的病例中,血清睾酮、脱氢表雄酮水平正常,雄烯二酮则明显升高。肿瘤分泌雄烯二酮,LH和FSH水平被完全抑制,临床表现为无精子症,在精索静脉取得血液样品检测到睾酮水平下降,说明肿瘤组织17β羟类固醇脱氢酶部分缺失。但是在肿瘤切除后3个月内,睾丸生精功能和所有性激素水平恢复正常,其后生育1子。
一、睾丸间质细胞瘤表现为无精子症的原因
本病例中,肿瘤具有雄激素分泌功能,此外血液循环中雌二醇水平也明显增高,促性腺激素水平明显被抑制,临床表现为不育和无精子症,在术后6个月,激素水平完全恢复正常,生精功能部分恢复。这说明促性腺激素的正常分泌对于维持生精功能具有重要作用。这和其他的睾丸间质细胞瘤的病例报告结果相一致。睾丸间质细胞瘤分泌的雄激素虽然可以引起促性腺激素明显降低,但并不足以维持生精。精子生成是个非常复杂的生理过程,有多种因素参与并影响男性的生育能力[10-12]。有证据表明,在生精过程中,FSH、LH和睾酮必须有条不紊正常发挥作用[13,14]。而睾丸内高水平的睾酮对于精子的生成必不可少。这一点经常被误认为,通过补充睾酮提高血液循环的睾酮的水平对于精子生成有作用。下丘脑节律性分泌促性腺激素释放激素(GnRH),刺激垂体腺体分泌FSH和LH[15]。LH可以促进睾丸间质细胞分泌睾酮,而FSH协同睾丸内睾酮一起作用于睾丸支持细胞促进精子生成。而睾酮、雌激素、二氢睾酮和支持细胞分泌的抑制素B可以负反馈调节下丘脑的GnRH分泌和垂体的FSH和LH的分泌活动[16-20](见图3)。本病例中,睾丸间质细胞瘤分泌雄烯二酮,进一步导致睾酮升高,外周脂肪细胞通过芳香化酶的作用,将从血液循环中摄取的睾酮进行芳香化生成雌二醇[21]。升高的睾酮、雌激素通过负反馈抑制下丘脑的GnRH分泌和垂体FSH和LH的分泌活动。因此本病例中,FSH和LH血清水平被完全抑制,进一步导致生精障碍。
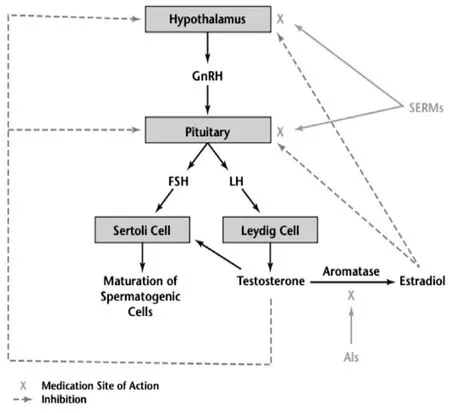
图3 体内促性腺激素和睾酮、雌二醇的关系[43]
二、睾丸间质细胞瘤的其他临床表现
正常生理情况下,间质细胞在LH的作用下产生睾酮[22]。睾丸间质细胞瘤常常是散发病例,并且只有少数情况才会伴有临床症状。睾丸间质细胞瘤的主要临床表现是睾丸占位、睾丸疼痛和激素水平改变引起的症状,例如性早熟、男子女性型乳房、勃起功能障碍等[8, 23-27]。
三、睾丸间质细胞瘤的术前精确诊断
睾丸实质性肿瘤几乎均为恶性[28]。睾丸间质细胞瘤又称 Leydig细胞瘤,是来源于睾丸间质细胞的一种罕见肿瘤,多为良性,只有10%~20%可能出现恶变,且多为成人型。因此,术前良性睾丸间质细胞瘤与其他恶性睾丸肿瘤的鉴别对于指导下一步临床工作有重要意义[29]。一般来说,睾丸内实性肿物或结节首先考虑为睾丸肿瘤,少数睾丸肿瘤生长迅速,类似睾丸附睾炎的表现,容易误诊为附睾睾丸炎[30]。睾丸间质肿瘤的术前诊断主要依靠大体检查、性激素检测、肿瘤标志物和影像学检查来确定[31]。
(一)实验室检查
1. 性激素检测:部分睾丸间质细胞瘤具有激素活性,分泌睾酮或者雌激素。在本病例中,患者的雄烯二酮明显升高,这提示睾丸占位组织学来源于睾丸间质细胞。然而,在我国雄烯二酮并不作为不育男性患者的常规检查。
2. 肿瘤标志物:间质细胞瘤患者的AFP、β-HCG、胎盘碱性磷酸酶和乳酸脱氢酶一般在正常范围内[32]。
本文中,术后6个月随访发现促性腺激素、睾酮、雄烯二酮和雌激素水平恢复正常,这说明肿瘤分泌了雄烯二酮。有学者推测,雄烯二酮水平增高导致肿瘤内部的17β羟类固醇脱氢酶被雄烯二酮完全负荷。这导致雄烯二酮过量逸散到血液中。也有可能是肿瘤细胞内的17β羟类固醇脱氢酶和正常的睾丸间质细胞内的酶并不完全相同。
(二)影像学检查
1. 彩色多普勒超声:检查经济方便,是睾丸肿瘤的常规检查方法,可以鉴别肿瘤是否来自睾丸,根据其肿瘤内部血流信号强弱初步鉴别良恶性[33]。对于不育男性患者,彩色多普勒超声应该作为常规检查,可以发现未触及的睾丸病变[34]。睾丸间质细胞瘤一般表现为均质性团块,肿瘤周围血流丰富,内部血流信号较弱。但其病理的分型特异性低[35]。
2. 对比增强MRI扫描:MRI对软组织分辨率明显优于 CT。一个大型前瞻性队列研究发现,增强MRI检查可以明确诊断睾丸间质细胞瘤,T2-WI图像上明显的低信号与良性病变显著相关,而边界清楚、T2-WI图像上明显的低信号以及肿瘤强化过程为“快进慢出”则可以诊断为良性睾丸间质细胞瘤[36]。其缺点是检查费用昂贵,检查时间过长。
四、睾丸间质细胞瘤的精准治疗
睾丸间质细胞瘤的主要治疗措施是睾丸切除术[26]。欧洲泌尿外科协会指南声明,不推荐对于单侧睾丸肿瘤行保留睾丸的肿瘤切除术,但是对于某些特殊病例(如青春期前患者)可以尝试行保留睾丸的病灶切除术,但是即使术后病理诊断为良性病变,也要定期随访[37]。一些学者[24,38]建议,对于青春期前患者可采用保留睾丸的病灶切除术治疗策略,然后定期做激素检测和阴囊超声检查随访。有学者发现,睾丸肿物直径小于2cm主要为良性病变,而肿瘤直径小于5mm则组织学为良性肿瘤的比例高达80%[39,40]。大多数睾丸间质细胞瘤患者有一个很好的预后,而对于肿瘤体积较小的患者,保留睾丸的病灶切除术是安全有效的[24,38,41]。Carmignani等[26]随访了24例良性睾丸间质细胞瘤患者根治性睾丸切除术后117个月(11~241个月不等),均未发现肿瘤复发。Suardi等[24]在2009年报道了37例睾丸间质细胞瘤患者的单中心的诊疗数据,肿瘤的平均直径为16.5(6~68)mm,有29例患者采用了保留睾丸的病灶切除术,平均随访了4.6(0.6~16.2)年,均无肿瘤复发,6例术前表现为男性乳房发育症的患者中有2例仍然伴有男性乳房发育症,4例患者睾酮水平低下。这些结果提示对于青春期前患者或者是肿瘤体积较小的睾丸间质细胞瘤,保留睾丸的病灶切除术是安全可行的。术中的冰冻病理诊断可以进一步帮助确认睾丸肿瘤的生物学行为[40]。但是在睾丸间质肿瘤出现恶性病理特征时,尤其是老年患者,推荐行根治性睾丸切除术和腹膜后淋巴结清扫术以防止肿瘤转移[30]。
五、睾丸间质细胞瘤的精准预后分析
睾丸间质细胞瘤有10%~20%可能出现恶变,且多为成人型。部分成人睾丸间质细胞肿瘤源于延胡索酸水合酶(fumarate hydratase,FH)基因突变,而FH基因突变是目前发现的少有的可以引起睾丸肿瘤的遗传因素[42]。对于这类患者,生育的男性后代是否应该建议定期行睾丸自查,还有待进一步研究。切除肿瘤后,其临床症状和化验值并不一定会恢复正常。良性睾丸间质细胞瘤患者的预后较好。而以无精子症就诊的睾丸间质细胞瘤随访期内均未发现肿瘤复发[3,8,9]。这些需要进一步的研究证实。对于以无精子症就诊的患者来说,采用激进的治疗措施如睾丸切除术,并不能达到患者满意。截止目前,报道的3例以无精子症就诊的睾丸间质细胞瘤病例中,患者术后均未经任何药物治疗,激素水平均完全恢复正常,生精功能部分或者完全恢复,可通过自然方式生育[3, 8, 9]。
结 论
分泌激素的睾丸间质细胞肿瘤有多种临床表现。而以无精子症为临床表现、诊断为睾丸间质细胞瘤的情况目前世界范围内仅报道3例。本文中,患者因正常性生活1年不育就诊诊断为无精子症,在诊治过程中彩色多普勒超声发现左侧睾丸肿物,保留睾丸的病灶切除术后6个月,性激素水平完全恢复正常,生精功能部分恢复正常。在最终的病理诊断前,通过检测血浆性激素水平、对比增强MRI扫描,有助于睾丸间质细胞瘤与其他睾丸恶性肿瘤的鉴别诊断,这对睾丸间质细胞瘤患者的手术方式的选择有指导意义。睾丸间质细胞瘤的主要治疗措施是睾丸切除术。对于青春期前的患者、肿瘤体积较小和双侧的良性睾丸间质细胞瘤,保留睾丸的病灶切除术也许是安全可行的,当然这还需要进一步的研究证实。
1 Turner WR, Derrick FC, Wohltmann H. Leydig cell tumor in identical twin. Urology 1976; 7(2):194-197
2 Kondoh N, Koh E, Nakamura M, et al. Bilateral Leydig cell tumors and male infertility: case report. Urol Int 1991; 46(1):104-106
3 Boulanger P, Somma M, Chevalier S, et al. Elevated secretion of androstenedione in a patient with a Leydig cell tumour. Acta Endocrinol (Copenh) 1984; 107(1):104-109
4 Gabrilove JL, Nicolis GL, Mitty HA, et al. Feminizing interstitial cell tumor of the testis: personal observations and a review of the literature. Cancer 1975; 35: 1184-1202
5 Perez C, Novoa J, Alcaniz J, et al. Leydig cell tumour of the testis with gynaecomastia and elevated oestrogen,progesterone and prolactin levels: case report. Clin Endocrinol (Oxf) 1980;13(5):409-412
6 Mineur P, De Cooman S, Hustin J, et al. Feminizing testicular Leydig cell tumor: hormonal pro fi le before and after unilateral orchidectomy. J Clin Endocrinol Metab 1987; 64(4):686-691
7 Caron PJ, Bennet AP, Plantavid MM, et al. Luteinizing-Hormone Secretory Pattern before and after Removal of Leydig-Cell Tumor of the Testis. Eur J Endocrinol 1994;131(2):156-159
8 Abe T, Takaha N, Tsujimura A, et al. Leydig cell tumor of the testis presenting male infertility: a case report.Hinyokika Kiyo 2003; 49(1): 39-42
9 Prasivoravong J, Barbotin AL, Derveaux A, et al. Leydig cell tumor of the testis with azoospermia and elevated delta4 androstenedione: case report. Basic Clin Androl 2016; 26: 14
10 Gandhi J, Hernandez RJ, Chen A, et al. Impaired hypothalamic-pituitary-testicular axis activity,spermatogenesis, and sperm function promote infertility in males with lead poisoning. Zygote 2017; 25(2):103-110
11 Verma R, Krishna A. Effect of tamoxifen on spermatogenesis and testicular steroidogenesis. Biochem Biophys Res Commun 2017; 486(1):36-42
12 Oliveira PF, Sousa M, Silva BM, et al. Obesity, energy balance and spermatogenesis. Reproduction 2017; 153(6):R173-R185
13 Ramaswamy S, Weinbauer GF. Endocrine control of spermatogenesis: Role of FSH and LH/ testosterone.Spermatogenesis 2014; 4(2):e996025
14 Huhtaniemi I. A short evolutionary history of FSH-stimulated spermatogenesis. Hormones (Athens) 2015;14(4):468-478
15 Veldhuis JD, Carlson ML, Johnson ML. The pituitary gland secretes in bursts: appraising the nature of glandular secretory impulses by simultaneous multiple-parameter deconvolution of plasma hormone concentrations. Proc Natl Acad Sci U S A 1987; 84(21):7686-7690
16 Cailleux-Bounacer A, Rohmer V, Lahlou N, et al. Impact level of dihydrotestosterone on the hypothalamicpituitary-leydig cell axis in men. Int J Androl 2009; 32(1):57-65
17 Kumar N, Sundaram K, Bardin CW. Feedback regulation of gonadotropins by androgens in rats: is 5 alphareduction involved? J Steroid Biochem Mol Biol 1995;52(1): 105-112
18 Veldhuis JD, Iranmanesh A, Samojlik E, et al. Differential sex steroid negative feedback regulation of pulsatile follicle-stimulating hormone secretion in healthy older men: deconvolution analysis and steady-state sex-steroid hormone infusions in frequently sampled healthy older individuals. J Clin Endocrinol Metab 1997; 82(4): 1248-1254
19 Kawakami S, Winters SJ. Regulation of lutenizing hormone secretion and subunit messenger ribonucleic acid expression by gonadal steroids in perifused pituitary cells from male monkeys and rats. Endocrinology 1999;140(8): 3587-3593
20 Tobin VA, Canny BJ. The regulation of gonadotropinreleasing hormone-induced calcium signals in male rat gonadotrophs by testosterone is mediated by dihydrotestosterone. Endocrinology 1998; 139(3): 1038-1045
21 Lakshman KM, Kaplan B, Travison TG, et al. The effects of injected testosterone dose and age on the conversion of testosterone to estradiol and dihydrotestosterone in young and older men. J Clin Endocrinol Metab 2010;95(8):3955-3964
22 Bremmer F, Schweyer S. Leydig cell, Sertoli cell and adult granulosa cell tumors. Pathologe 2016; 37(1):71-77
23 Agrawal U, Sharma M, Bhatnagar D, et al. Leydig cell tumor: an unusual presentation. Indian J Pathol Microbiol 2009; 52(3):395-396
24 Suardi N, Strada E, Colombo R, et al. Leydig cell tumour of the testis: presentation, therapy, long-term followup and the role of organ-sparing surgery in a singleinstitution experience. BJU Int 2009; 103(2): 197-200
25 Lopez PJ, Cadena Y, Paulos A, et al. Unusual presentation of a Leydig Cell Tumor. Arch Esp Urol 2010; 63(4): 303-305
26 Carmignani L, Salvioni R, Gadda F, et al. Long-term followup and clinical characteristics of testicular Leydig cell tumor: experience with 24 cases. J Urol 2006; 176(5):2040-2043; discussion 2043
27 Clegg ED, Cook JC, Chapin RE, et al. Leydig cell hyperplasia and adenoma formation: Mechanisms and relevance to humans. Reprod Toxicol 1997; 11(1):107-121
28 McGlynn KA, Trabert B. Adolescent and adult risk factors for testicular cancer. Nat Rev Urol 2012; 9(6):339-349
29 Fernandez-Perez GC, Tardaguila FM, Velasco M, et al.Radiologic findings of segmental testicular infarction.AJR Am J Roentgenol 2005; 184(5):1587-1593
30 郝宗耀, 叶元平, 刘明, 等. 152例睾丸肿瘤的临床诊治分析. 现代泌尿生殖肿瘤杂志 2013; 5(3): 139-142
31 牛海涛, 李涛, 王一, 等. 2005年欧洲泌尿外科会议睾丸肿瘤诊断治疗指南. 中华肿瘤杂志 2006; 28(8): 637-639
32 赖金枝, 张海洋, 傅强, 等. 双侧睾丸间质细胞瘤1例报告并文献复习. 中国男科学杂志 2009; 23(11): 51-54
33 刘毅生, 沈家亮, 陈德基. 睾丸肿瘤和肿瘤样病变的影像学分析. 中国医学影像学杂志 2013;21(8):606-610
34 Sakamoto H, Saito K, Shichizyo T, et al. Color Doppler ultrasonography as a routine clinical examination in male infertility. Int J Urol 2006; 13(8): 1073-1078
35 王志远, 吴泽惠, 杨通明, 等. 彩色多普勒超声诊断睾丸恶性肿瘤的应用价值. 临床超声医学杂志2011; 13(10):678-680
36 Manganaro L, Vinci V, Pozza C, et al. A prospective study on contrast-enhanced magnetic resonance imaging of testicular lesions: distinctive features of Leydig cell tumours. Eur Radiol 2015; 25(12): 3586-3595
37 Albers P, Albrecht W, Algaba F, et al. Guidelines on Testicular Cancer: 2015 Update. Eur Urol 2015; 68(6):1054-1068
38 Merlini E, Seymandi PL, Betta PG, et al. Testis sparing enucleation of a Leydig-cell tumour in a boy. Pediatr Med Chir 2003; 25(1): 63-65
39 Heidenreich A, Weissbach L, Holtl W, et al. Organ sparing surgery for malignant germ cell tumor of the testis. J Urol 2001; 166(6): 2161-2165
40 Steiner H, Holtl L, Maneschg C, et al. Frozen section analysis-guided organ-sparing approach in testicular tumors: technique, feasibility, and long-term results.Urology 2003; 62(3): 508-513
41 Nicolai N, Necchi A, Raggi D, et al. Clinical outcome in testicular sex cord stromal tumors: testis sparing vs. radical orchiectomy and management of advanced disease. Urology 2015; 85(2): 402-406
42 Carvajal-Carmona LG, Alam NA, Pollard PJ, et al. Adult Leydig cell tumors of the testis caused by germline fumarate hydratase mutations. J Clin Endocrinol Metab 2006; 91(8): 3071-3075
43 Rambhatla A, Mills JN, Rajfer J. The Role of Estrogen Modulators in Male Hypogonadism and Infertility. Rev Urol 2016;18(2): 66-72
(2017-07-10收稿)
Leydig cell tumor with azoospermia: A case report and literatures review
Yang Wenbo1, Lan Ke1, Zhang Xiaowei1, Wang Xingxing2,Peng Xue3, Geng Chong4, Li Qing1, XuTao1, Bai Wenjun1*
1. Department of Urology, Peking University People's Hospital, Beijing 100044, China;2. Department of Pathology, Peking University People's Hospital; 3: Department of Oncology, Peking University People's Hospital; 4: Department of Urology, Daxing District of Beijing People's Hospital Corresponding author: Bai Wenjun, E-mail: bai-wj@163.com
ObjectiveTo summarize and analyze the diagnosis and treatment of Leydig cell tumor with azoospermia.MethodsOne case of Leydig cell tumor of testis with azoospermia was reported and the related literatures were reviewed. A 24-year-old man was referred to our hospital for infertility. Semen analyses showed strict azoospermia with normal volume.Leydig cell tumor with azoospermia are rare and to date only 3 cases were reported at home and abroad.ResultsLuteinizing hormone (LH) and follicle-stimulating hormone (FSH) levels were significantly suppressed, whereas androstenedione was extremely elevated. Pelvic MRI and testis CT showed a focal lesion in the left testicle. The patient was diagnosed as Leydig cell tumor with azoospermia based on clinical characteristics and examination. The patient underwent testicular tumor enucleation.Leydig cell tumor of testis was con fi rmed by pathological analysis after the operation. No local recurrence or distant metastasis was detected during 6 months follow-up. In the 7 months follow-up, the sexual partners had been pregnant for 2 weeks.ConclusionTesticular Leydig cell tumors associated with azoospermia are rare. Azoospermia proved to be partly reversible within less than 6 months after tumor removal and normalization of hormone levels. The therapy of LCTs is surgical, and the standard therapy is orchidectomy. Testis-sparing surgery may be feasible and effective in case of pre-mature patients, bilateral and small tumors.
Leydig cell tumor/diagnosis, therapy; azoospermia
10.3969/j.issn.1008-0848.2017.05.009
R 737.21
*通讯作者,E-mail: bai-wj@163.com

