放养密度和微生态制剂对施氏鲟养殖水质的影响
王秋实,张镜群
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.西藏自治区农牧科学院水产科学研究所,西藏 拉萨 850032)
放养密度和微生态制剂对施氏鲟养殖水质的影响
王秋实1,张镜群2
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.西藏自治区农牧科学院水产科学研究所,西藏 拉萨 850032)
将初始体质量(54.86±10.19)g的施氏鲟Acipenser schrenckii饲养在面积16m2(4m×4m)、水深1.7~1.9m的陆基围隔中,密度分别为2 000尾/667m2、3 000尾/667m2、4 000尾/667m2和5 000尾/667m2,每个密度组均设3个平行,常规饲养,混合泼洒光合细菌、枯草芽孢杆菌和乳酸菌,第一次泼洒量为光合细菌50mL、枯草芽孢杆菌50g和乳酸菌50g,之后每5d泼洒第一次量的1/2,研究微生态制剂对静水土养殖池塘水质的影响。结果显示:水体中溶解氧量随养殖密度的增加逐渐降低(P>0.05),氨氮、亚硝酸盐浓度随养殖密度的增加逐渐升高(P>0.05)。在使用微孔增氧的条件下,泼洒微生态制剂对溶解氧量和氨氮浓度的影响不显著(P>0.05),但显著降低了水体亚硝酸盐浓度(P<0.05),显著增加了浮游动物生物量(P<0.05)。
施氏鲟;池塘养殖;微生态制剂;水质
施氏鲟Acipenser schrenckii生长迅速、肉质优良,是我国鲟养殖业中的重要种类。目前,我国鲟主要以流水养殖为主,人工繁育、生长发育、营养需求、病害防治相关的报道较多[1-5]。近年来,在我国的北方地区,鲟的静水土塘养殖获得成功[6-8],但关于鲟养殖池塘水质的调控未见报道。我国从20世纪80年代就开始了微生态制剂的研究,证明光合细菌有明显改善水质、降解氨氮的作用[9],枯草芽孢杆菌、乳酸菌可以有效降低水体中的亚硝态氨、减少疾病发生[10]。本试验利用陆基围隔试验法,研究光合细菌、乳酸菌、枯草芽孢杆菌Bacillus subtilis微生态制剂对不同放养密度施氏鲟养殖水体水质的调控作用,旨在掌握施氏鲟在池塘养殖条件下的水质调控方法,为鲟的健康池塘养殖提供参考。
1 材料与方法
1.1 材料
试验在黑龙江肇东市鲟龙渔业科技开发有限公司面积为2 000m2的静水土池塘中进行,池塘水源为地下水,水温22~28℃。试验鱼初始体质量(54.86 ±10.19)g,体全长(26.97±1.92)cm。
试验池中设置面积16m2(4m×4m)、水深1.7m~1.9m的陆基围隔。以高密度两面涂塑的聚乙烯编织布做围隔幔,围隔幔下部埋入池塘底泥0.5m,以木桩和竹竿为支架。围隔内用微孔增氧盘增氧,用罗茨鼓风机供气。
试验用光合细菌(5×109cfu/mL)、乳酸菌(2×109cfu/mL、枯草芽孢杆菌(2×109cfu/mL)均为山东宝来利来生物工程股份有限公司生产。
1.2 方法
1.2.1 试验设计
试验分为泼洒微生态制剂的处理组和不洒微生态制剂的对照组,各设4个放养密度:每个围隔48 尾(D1)、72 尾(D2)、96 尾(D3)和 120 尾(D4),即分别为 2 000 尾 /667m2、3 000 尾 /667m2、4 000 尾/667m2和5 000尾/667m2,每个密度组设3个平行。处理组围隔中泼洒混合光合细菌、枯草芽孢杆菌和乳酸菌调节水质,第一次泼洒量为光合细菌50mL、枯草芽孢杆菌50g和乳酸菌50g,之后每5d泼洒第一次剂量的1/2。
1.2.2 投喂和采样
试验期间投喂山东升索鲟配合饲料,根据鱼体质量的变化使用对应规格的饲料。每天投喂3次,投喂量为鱼体质量的2.0%~2.5%。每日测定溶解氧量,每5d测定氨氮、亚硝酸盐浓度。试验结束后取水样固定,测定浮游动物生物量。试验历时30d。
采用碘量法测定溶解氧量;次溴酸盐氧化法测定氨氮;萘乙二胺分光光度法测定亚硝酸盐;萨氏盘测定透明度。用有机玻璃采水器(5L)取水样10L,以25#浮游生物网过滤,向样品中加体积5%的福尔马林液(Formalin)固定,静置24h后虹吸到量杯中,继续沉降24h,最后虹吸定容到20mL,进行浮游动物定量。计数时吸取1mL样品液到计数框,全片记录计数框内的浮游动物种类和数量。以数量和湿重计算浮游动物生物量。
1.3 数据分析
应用SPSS软件分析数据,采用单因子方差分析法进行方差分析,用Duncan法进行组间多重比较,显著性水平0.05。
2 结果与分析
2.1 养殖密度对水体生态因子的影响
各对照组水体中溶解氧量随养殖密度的增大而逐渐下降,氨氮、亚硝酸盐浓度逐渐升高,但各密度组间差异不显著(P>0.05)(图1~图3)。
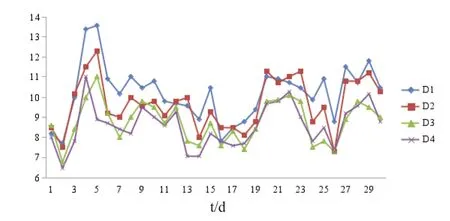
图1 不同养殖密度组水体溶解氧量的变化Fig.1 Changes in dissolved oxygen concentration in the water at different stocking densities
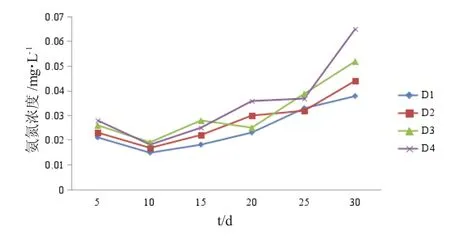
图2 不同养殖密度组水体氨氮浓度的变化Fig.2 Changes in ammonia concentration in the water at different stocking densities

图3 不同养殖密度组水体亚硝酸盐浓度的变化Fig.3 Changes in nitrite concentration in the water at different stocking densities
各对照组中浮游动物生物量随养殖密度的增大而显著增大(P<0.05),各密度组水体中大型浮游动物少,轮虫为优势种群,高密度组D4未发现桡足类和枝角类(表1)。

表1 不同养殖密度组水体浮游动物组成Tab.1 Zooplankton species composition in the water at different stocking densities
2.2 微生态制剂对水质的影响

图4 不同养殖密度的处理组水体溶解氧量的变化Fig.4 Changes in dissolved oxygen concentration in the water with addition of probiotics at different stocking densities
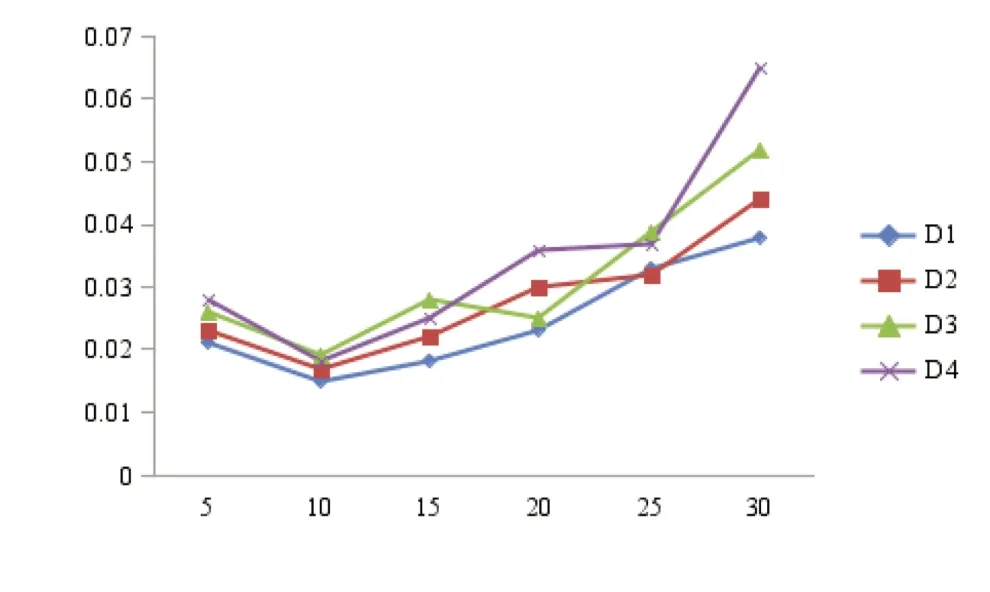
图5 不同养殖密度的处理组水体氨氮浓度的变化Fig.5 Changes in ammonia concentration in the water with addition of probiotics at different stocking densities

图6 不同养殖密度的处理组水体亚硝酸盐浓度的变化Fig.6 Changes in nitrite concentration in the water with addition of probiotics at different stocking densities
各处理组水体中溶解氧量随放养密度的增大逐渐下降,氨氮浓度逐渐升高,但各处理组间差异不显著(P>0.05),与对照组差异不显著(P>0.05);亚硝酸盐浓度逐渐升高,各处理组间差异不显著(P>0.05),但显著低于对照组(P<0.05)(图 4~ 图 6)。
随养殖密度的增大,各处理组水体中浮游动物生物量显著增大(P<0.05),显著高于对照组(P<0.05),大型浮游动物少,轮虫为优势种群(表2)。

表2 不同养殖密度的处理组水体中浮游动物组成Tab.2 Zooplankton species composition in the water with addition of probiotics at different stocking densities
3 讨论
3.1 放养密度对水体生态因子的影响
“养鱼先养水”。水质直接影响养殖鱼类的生存、生长和发育,良好的水质是水产养殖的首要条件。拥挤胁迫对鱼类生长的负面影响主要是过高养殖密度导致水体水质恶化[11]。本试验中,各密度对照组溶解氧水平随养殖密度的增大而降低,氨氮、亚硝酸盐浓度反之,但变化不明显。其主要原因是微孔增氧方式提升水体溶解氧量的效果较强,从一定程度上弥补了养殖密度增大溶解氧量的降低(各密度组溶解氧量始终高于6mg/L),较高的溶解氧量有助于氨氮和亚硝酸盐的降解,所以各试验组的水质始终处于较为良好的状态。
各密度对照组随养殖密度的增大,浮游动物生物量显著增大(P<0.05)。根据氨氮、亚硝酸盐变化趋势可以得知,随着养殖密度的增大,水体的营养盐水平逐渐升高,导致浮游植物生物量的增长。浮游动物主要以浮游植物为食,浮游动物的生物量亦增长。施氏鲟为底层鱼类,日常活动会引起底泥再悬浮,微孔增氧会加速这一过程,所有密度组水体都较浑浊,透明度不足10cm。枝角类是一种喜好清洁水质的种类[12],混浊的水体会影响枝角类的食物消化[13,14]、增加呼吸以及游泳的能量消耗[15],导致体质下降,降低怀卵率和存活率[14]。而桡足类虽然运动速度较快,但在围隔封闭水体中无隐蔽场所,很容易被施氏鲟幼鱼摄食。所以各对照组中大型浮游动物密度很低,在高密度组甚至未发现枝角类和桡足类。轮虫对食物的选择和适应性较强[16],对混浊水体的适应性较强。因此,鱼类活动和微孔增氧引起的水质混浊使浮游动物的竞争优势逐渐转向轮虫。
3.2 微生态制剂对水质的影响
本试验中,添加微生态的各处理组水体中溶解氧量随养殖密度的增大而逐渐下降,氨氮浓度逐渐升高,但组间差异不显著(P>0.05),与对照组差异不显著(P>0.05),表明溶解氧是氨氮降解的重要因素,虽然微生态制剂对水体氨氮的降解效果很有效[17],但充足的溶解氧使水体氨氮浓度保持在较低的水平,微生态制剂对水体的氨氮降解效果未能得到充分体现。
微生态制剂对水体中亚硝酸盐的降解效果十分显著。处理组的亚硝酸盐浓度比对照组低50%~70%,说明微生物是水体中亚硝酸盐降解的重要因子。
微生态制剂能够调节水体中的藻相,减少蓝藻等富营养化种类,增加水体的浮游植物生物量和细菌量,这是小型轮虫的食物来源。本试验中,食物来源的增加势必导致小型轮虫种群的数量明显提升,所以各处理组的浮游动物组成以轮虫为优势种群。
本试验结果表明,泼洒微生态制剂结合微孔增氧技术能够控制施氏鲟养殖水体的溶解氧、氨氮、亚硝酸盐水平,是一种有效水质调节手段。
[1]赵吉伟,邱岭泉,杨雨辉,等.不同投饵率对施氏鲟幼鱼生长及体成分的影响[J].中国水产科学,2004,11(4):375-378.
[2]李修峰,杨汉运,黄道明,等.池塘主养匙吻鲟商品鱼技术[J].水利渔业,2004,24(6):32-33.
[3]赵道全,陈杰,周晓林,等.俄罗斯鲟稚幼鱼生长发育研究[J].淡水渔业,2002,32(1):12-13.
[4]权可艳.西伯利亚鲟苗种培育技术总结[J].内陆水产,2005(5):11-12.
[5]吴文化,刘晓勇.杂交鲟稚鱼对几种药物敏感性的试验[J].水产学杂志,2003,16(1):35-39.
[6]王秋实,赵春刚,马国军,等.施氏鲟在静水池塘养殖的生长特性研究[J].黑龙江农业科学,2011(1):70-73.
[7]王秋实,孙大江,赵春刚,等.鲟亲鱼培育池塘中浮游生物的组成与变化特点的研究[J].水产学杂志,2011,24(2):41-45.
[8]王秋实,赵春刚,孙大江,等.静水池塘养殖施氏鲟商品鱼的生长特性[J].水产学杂志,2011,24(4):21-24.
[9]郑东,王爱珍,李文波,等.光合细菌在对虾养殖中的大面积推广应用[J].海洋通报,1994,13(5):93-96.
[10]WangYB,Xu ZR and Xia MS.The effectiveness ofcommercial probiotics in northern white shrimp Pcnaeus vannameiponds[J].FishSci,2005,71(5):1036-1041.
[11]KebusMJ,CollinsMT,BrownfieldMS,etal.Effectsofrearingdensityonthestressresponseandgrowthofrainbowtrout[J].AquatAnimHealth,1992,4(1):1-6.
[12]Kasprzak P,BenndorfJ,Mehner T,et al.Biomanipulation of lakeecosystems:anintroduction[J].FreshwBiol,2002(47):2277-2281.
[13]ArrudaJA,MarzolfGRandFaulkRT.Theroleofsuspended sediments in the nutrition ofzooplankton in turbid reservoirs[J].Ecology,1983,64(5):1225-1235.
[14]McCabeGDand O’Brien WJ.The effects ofsuspended silt onfeedingandreproductionofDaphnia pulex[J].American MidlandNaturalist,1983,110:324-337.
[15]蒋伟伟,刘正文,郭亮,等.沉积物再悬浮对浮游动物群落结构影响的模拟实验[J].湖泊科学,2010,22(4):557-562.
[16]PourriotR.Foodandfeedinghabitsofrotifers[J].Archiv fur Hydrobiologie Beihefte Ergebnisse der Limnologie,1977,8:243-260.
[17]胡菊香,吴生桂,邹清,等.生物水净化剂对养殖池塘水质的调控作用初探[J].水利渔业,2003,23(6):40-41.
Effects of Probiotics on Water Quality in Amur Sturgeon Acipenser schrenckii Culture Exposures at Different Stocking Densities
WANG Qiu-shi1,ZHANG Jing-qun2
(1.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China;2.Fisheries Institute,Tibet Academy of Agricultural and Animal Husbandry Sciences,Lhasa 850032,China)
Amur sturgeon Acipenser schrenckii with initial body weight of(54.86± 10.19)g were reared in a 16 m2(4 m× 4 m)and depth of 1.7 m~1.9 m exposure at stocking density of 2 000 ind./667m2,3 000 ind./667m2,4 000 ind./667m2and 5 000 ind./667m2,in which probioticswasadded into at a dose ofphotosynthetic bacteria(50 mL)+Bacillus subtilis(50 g)+lactobacillus(50 g),and half of the first dose 5 days since then,to evaluate effects of the probiotics on the water quality in a culture pond.The results showed that there were decrease in dissolved oxygen concentration(P > 0.05)and increase in ammonia and nitrite concentrations with increase in stocking density in the exposures,showing no significant effects of the probiotics on dissolved oxygen and ammonia nitrogen levels(P>0.05).However,probiotics led to significant reduction in nitrite concentration and to increase in zooplankton biomass(P < 0.05).
Acipenser schrenckii;pond culture;probiotics;water quality
S965.215
A
1005-3832(2017)05-0039-04
2017-06-15
黑龙江水产研究所基本科研专项(201111);黑龙江省重点科技攻关指导项目(GZ10A101).
王秋实(1982-),男,助理研究员.E-mail:qiushi_1982@126.com

