刺山柑总生物碱对系统性硬皮病小鼠Endoglin等影响❋
康小龙,何承辉,卢 军,刘 晶
(1. 新疆医科大学附属中医医院,乌鲁木齐 830000; 2. 新疆维吾尔自治区药物研究所,乌鲁木齐 830004)
【实验研究】
刺山柑总生物碱对系统性硬皮病小鼠Endoglin等影响❋
康小龙1,何承辉2△,卢 军1,刘 晶1
(1. 新疆医科大学附属中医医院,乌鲁木齐 830000; 2. 新疆维吾尔自治区药物研究所,乌鲁木齐 830004)
目的:观察刺山柑总生物碱对系统性硬皮病(SSc)小鼠α-平滑肌肌动蛋白(α-SMA)、基质金属蛋白酶-1(MMP-1)、Endoglin及白细胞介素-6(IL-6)水平的影响。方法:BALB/c小鼠90只按随机数字表法分为空白对照组、模型组、青霉胺组及刺山柑总生物碱低、中、高剂量组。除空白对照组外,其余各组小鼠背部皮下注射盐酸博莱霉素建立SSc模型。成模后给药8周,ELISA法测定小鼠皮肤和肺组织α-SMA、皮肤组织Endoglin和血清MMP-1、IL-6水平。结果:与空白对照组比较,模型组小鼠皮肤和肺组织α-SMA、皮肤组织Endoglin和血清IL-6水平升高,血清MMP-1水平降低;与模型组比较,刺山柑总生物碱高剂量组α-SMA、Endoglin和IL-6水平降低,MMP-1水平升高。结论:刺山柑总生物碱可减少SSc α-SMA表达,降低Endoglin和IL-6的异常升高,升高MMP-1水平,改善SSc组织纤维化。
刺山柑总生物碱;系统性硬皮病;α-平滑肌肌动蛋白;基质金属蛋白酶-1;Endoglin;白细胞介素-6
系统性硬皮病(systemic sclerosis, SSc)是一种危及皮肤和内脏器官的结缔组织疾病,以皮肤增厚和内脏器官纤维化为主要临床表现[1]。刺山柑(CapparisspinosaL.)又名槌果藤、野西瓜、老鼠瓜,为白花菜科(Capparaceae)山柑属(CapparisL.)植物,系维吾尔医习用药材之一,主要用药部位为果实等,其性味辛苦温,具有祛风散寒、除湿、消肿止痛、扩张血管的功效。有研究表明,刺山柑果实乙醇提取物可抑制SSc患者成纤维细胞增殖及Ⅰ型胶原的合成[2];刺山柑鲜果75%乙醇调制的糊膏以及刺山柑干果流浸膏均能显著抑制硬皮病模型小鼠的真皮增厚和胶原沉积[3]。李凡等[4]用刺山柑治疗硬皮病患者6例,获较满意疗效。本课题组从刺山柑果实中提取了有效部位刺山柑总生物碱,拟用于SSc的治疗。本实验观察了刺山柑总生物碱对SSc小鼠α-平滑肌肌动蛋白(α-SMA)、基质金属蛋白酶-1(MMP-1)、Endoglin及白细胞介素-6(IL-6)水平的影响,以探讨其抗SSc组织纤维化的作用机理。
1 材料与方法
1.1 材料
1.1.1 实验动物 8周龄清洁级BALB/c小鼠,体质量18~24 g,购自新疆实验动物研究中心(合格证号SCXK(新)2003-0002)。
1.1.2 药材与试剂 刺山柑药材购自新疆麦迪森维药有限公司饮片厂,经新疆维吾尔自治区药物研究所何江研究员鉴定为正品;盐酸博莱霉素粉针剂,日本化药株式会社(批号430312);青霉胺片,上海信谊药厂(批号052130503)。
刺山柑总生物碱制备方法:取刺山柑果实晒干粉碎后加10倍量95%乙醇,80 ℃水浴中提取2次,每次0.5 h浓缩干燥,得刺山柑总生物碱,经UV测定,总生物碱含量为32%以上。
刺山柑总生物碱乳膏制法:将提取的刺山柑总生物碱与白凡士林、单硬脂酸甘油酯、硬脂酸、月桂氮卓酮等基质混匀,水浴加热至90 ℃熔融后为油相;水相为浓缩液与甘油混匀后水浴加热至90 ℃;乳化剂为十二烷基硫酸钠、对羟基苯甲酸乙酯加入适量水中,水浴加热溶解;待油相、水相温度降至85 ℃后,将水相和乳化剂加入油相中,边加边搅拌使之乳化完全。
小鼠α-SMA ELISA试剂盒(上海联硕生物科技公司,批号201602);小鼠Endoglin ELISA试剂盒(武汉华美生物科技公司,批号J27030162);小鼠IL-6 ELISA试剂盒(美国R&D公司,批号201603);小鼠MMP-1 ELISA试剂盒(上海江莱生物科技公司,批号201602);二辛可宁酸蛋白定量试剂盒(江苏碧云天生物技术研究所,批号20160320)。
1.1.3 主要仪器 酶标仪,购自美国赛默飞世尔科技公司。
1.2 方法
1.2.1 SSc模型的建立及给药方法 取雌性BALB/c小鼠90只,体质量(21.9±1.8) g,按随机数字表法分为空白对照组、模型组、刺山柑总生物碱低(225 mg·kg-1)、中(450 mg·kg-1)、高(900 mg·kg-1)剂量组及阳性药青霉胺组(125 mg·kg-1)组各15只,采用博莱霉素皮下注射法诱导SSc模型[5]。将小鼠背部中央区被毛剃除,盐酸博莱霉素粉针剂用生理盐水溶解,配成浓度为300 μg·mL-1药液,注射入模型组及各给药组小鼠背部皮下,空白对照组小鼠背部皮下注射生理盐水0.1 mL/d共30 d,模型组小鼠背部注射部位出现皮肤增厚、弹性变差等病理改变。30 d后,刺山柑总生物碱各剂量组小鼠背部用刺山柑总生物碱乳膏外敷,青霉胺组灌胃给予青霉胺,空白对照组、模型组背部外敷不含药基质,每日1次,连续60 d。
1.2.2 小鼠皮肤及肺组织α-SMA和皮肤组织Endoglin水平测定 末次给药后4 h处死小鼠,取小鼠背部注射区皮肤及肺组织制成10%组织匀浆,3 500 r/min离心10 min分离上清。上清液中α-SMA和Endoglin含量采用ELISA试剂盒测定,按试剂盒说明书进行操作,同时用二辛可宁酸蛋白定量试剂盒检测上清液中总蛋白浓度,以每毫升上清液中总蛋白含量校正ELISA结果。
1.2.3 小鼠血清MMP-1和IL-6含量测定 末次给药后4 h,取小鼠静脉血,4000 r/min离心10 min后分离血清,ELISA法测定MMP-1和IL-6含量,按试剂盒说明书进行操作。
1.3 统计学方法
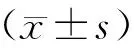
2 结果
表1显示,与空白对照组比较,模型组小鼠皮肤及肺组织α-SMA、皮肤组织Endoglin、血清IL-6含量明显升高,血清MMP-1含量明显降低(P<0.01);与模型组比较,900 mg·kg-1刺山柑总生物碱和125 mg·kg-1青霉胺可降低α-SMA、Endoglin、IL-6含量,升高MMP-1含量(P<0.05或P<0.01);与青霉胺组比较,刺山柑总生物碱高剂量组α-SMA、Endoglin和MMP-1含量比较差异无统计学意义(P>0.05)。

表1 刺山柑总生物碱对系统性硬皮病小鼠α-SMA、Endoglin、MMP-1和IL-6水平的影响
注:与空白对照组比较:aP<0.01;与模型组比较:bP<0.05,cP<0.01
3 讨论
SSc患者皮肤和内脏器官成纤维细胞被异常激活,增殖性和合成胶原能力增强,部分细胞转化为肌成纤维细胞并表达α-SMA,最终导致皮肤硬化和内脏器官纤维化[6]。本研究也发现,SSc模型组小鼠皮肤及肺组织α-SMA水平较空白对照组显著增高,900 mg·kg-1刺山柑总生物碱可明显降低α-SMA水平。本课题组前期研究表明,经刺山柑总生物碱治疗后的SSc小鼠真皮鳞状上皮变薄,皮肤及肺组织羟脯氨酸、Ⅰ型胶原水平降低[7];病理观察结果表明,刺山柑总生物碱可明显改善SSc小鼠皮肤和肺部炎症和纤维化[8]。以上结果提示,刺山柑总生物碱可能通过抑制SSc纤维化形成过程中成纤维细胞向肌成纤维细胞的转化,抑制胶原合成,改善SSc组织纤维化。
基质金属蛋白酶(MMPs)是一种重要的蛋白水解酶,是ECM降解过程中必不可少的酶类, 其中MMP-1是最早被纯化和cDNA克隆的脊椎动物胶原酶,可降解Ⅰ、Ⅱ、Ⅲ、Ⅶ和Ⅹ型胶原及蛋白多糖。研究表明[9],局限性硬皮病患者与健康对照组体外培养的成纤维细胞相比,MMP-1表达量下降;Tsou等[10]发现,SSc患者成纤维细胞MMP-1表达较正常对照组显著降低,提示MMP-1可能参与SSc组织纤维化的形成。本研究表明,SSc模型组小鼠血清MMP-1含量较空白对照组显著降低,900 mg·kg-1刺山柑总生物碱可明显升高MMP-1水平,提示刺山柑总生物碱可能通过增加MMP-1表达,减少胶原合成,使SSc ECM降解增加,改善SSc组织纤维化。
Endoglin又名CD105,是一种细胞膜糖蛋白,在TGF-β信号通路中发挥调节作用,参与血管发育与重塑[11]。研究表明,硬皮病患者纤维化过程中内皮细胞和成纤维细胞Endoglin表达增加[12-13],SSc患者尤其是伴有肺动脉高压者,血清可溶性Endoglin水平较正常人升高[14]。动物实验也表明,发生纤维化的硬皮病模型动物Endoglin表达增加[15],以上研究提示Endoglin可能涉及纤维化的形成。本实验发现,SSc模型组小鼠皮肤组织Endoglin水平较空白对照组明显增高,900 mg·kg-1刺山柑总生物碱可降低Endoglin含量,提示刺山柑总生物碱对SSc Endoglin的异常表达有一定的调节作用。
IL-6是一种多效细胞因子,参与B和T淋巴细胞的增殖与分化、抗体生成及T淋巴细胞激活[16]。研究表明[17-18],IL-6可能与SSc发病密切相关,SSc患者血清和皮损组织IL-6水平较正常人增高,其外周血白细胞生成IL-6增加,且IL-6水平与皮肤厚度呈正相关;另外,用抗IL-6受体单克隆抗体可以改善硬皮病模型动物皮肤纤维化[19]。本研究表明,刺山柑总生物碱高剂量可降低SSc小鼠血清IL-6水平,提示刺山柑总生物碱对SSc IL-6异常升高有一定的调节作用。
[1] 李杨,邓丹琪. 系统性硬皮病治疗的研究进展[J]. 中国皮肤性病学杂志,2011,25(5):393-396.
[2] 曹越兰,李欣,郑敏. 槌果藤对进行性系统性硬化症患者成纤维细胞增殖和Ⅰ型胶原产生的影响[J]. 中国中药杂志,2008,33(5):560-562.
[3] 曹越兰,李欣,王群. 槌果藤对硬皮病小鼠模型皮肤硬化抑制作用的实验研究[J]. 中国中药杂志,2008,33(2):215-217.
[4] 李凡,阿曼古力,阿不力克木,等. 维吾尔药槌果藤治疗硬皮病6例[J]. 中华皮肤科杂志,1997,30 (1):51.
[5] 闫小宁,张建荣,李文彬,等. 温阳除痹汤对硬皮病模型小鼠CTGF的影响[J]. 中国中西医结合皮肤性病学杂志,2013,12(1):13-16.
[6] BHATTACHARYYA S, WEI J, VARGA J. Understanding fibrosis in systemic sclerosis: shifting paradigms, emerging opportunities[J]. Nat Rev Rheumatol, 2011, 8(1): 42-54.
[7] 康小龙,何承辉,田红林,等. 刺山柑总生物碱乳膏外用对系统性硬皮病小鼠组织纤维化的改善作用[J]. 中国现代应用药学,2016,33(1):32-35.
[8] 康小龙,何承辉,刘晶,等. 刺山柑总生碱对系统性硬皮病小鼠Ⅲ型胶原表达的影响[J]. 中国医科大学学报,2016,45(8):688-691
[9] 朱晨雨,孙秋宁. UVA-1及UVA照射对局限性硬皮病患者成纤维细胞Ⅰ型胶原和MMP-1表达的影响[J]. 国际皮肤性病学杂志,2012,38(4):217-220.
[10] TSOU PS, BALOGH B, PINNEY AJ, et al. Lipoic acid plays a role in scleroderma: insights obtained from scleroderma dermal fibroblasts[J]. Arthritis Res Ther, 2014, 16(5): 411-424.
[11] MORRIS E, CHROBAK I, BUJOR A, et al. Endoglin promotes TGF-β/Smad1 signaling in scleroderma fibroblasts[J]. J Cell Physiol, 2011, 226(12): 3340-3348.
[12] HOLMES AM, PONTICOS M, SHI-WEN X, et al. Elevated CCN2 expression in scleroderma: a putative role for the TGFbeta accessory receptors TGFbetaRIII and endoglin[J]. J Cell Commun Signal, 2011, 5(3): 173-177.
[13] MORRIS E, CHROBAK I, BUJOR A, et al. Endoglin promotes TGF-beta/Smad1 signaling in scleroderma fibroblasts[J]. J Cell Physiol, 2011, 226(12): 3340-3348.
[14] CORAL-ALVARADO P, QUINTANA G, GARCES MF, et al. Potential biomarkers for detecting pulmonary arterial hypertension in patients with systemic sclerosis[J]. Rheumatol Int, 2009, 29(9), 1017-1024.
[15] DOCHERTY NG, LOPEZ-NOVOA JM, AREVALO M, et al. Endoglin regulates renal ischaemia-reperfusion injury[J]. Nephrol Dial Transplant, 2006, 21(8): 2106-2119.
[16] DESALLAIS L, AVOUAC J, FRECHET M, et al. Targeting IL-6 by both passive or active immunization strategies prevents bleomycin-induced skin fibrosis[J]. Arthritis Res Ther, 2014, 16(4): R157.
[17] DE LAURETIS A, SESTINI P, PANTELIDIS P, et al. Serum interleukin-6 is predictive of early functional decline and mortality in interstitial lung disease associated with systemic sclerosis[J]. J Rheumatol, 2013, 40(4): 435-446.
[18] JURISIC Z, MARTINOVIC-KALITERNA D, MARASOVIC-KRSTULOVIC D, et al. Relationship between interleukin-6 and cardiac involvement in systemic sclerosis[J]. Rheumatology (Oxford), 2013, 52(7): 1298-1302.
[19] KITABA S, MUROTA H, TERAO M , et al. Blockade of interleukin-6 receptor alleviates disease in mouse model of scleroderma[J]. Am J Pathol, 2012, 180(1): 165-176.
EffectsoftotalAlkaloidsfromSpinosaonEndoglininMicewithSystemicSclerosis
KANG Xiao-long1, HE Cheng-hui2△, LU Jun1, LIU Jin1
(1.HospitalofChineseMedicineAffiliatedtoXinjiangMedicalUniversity,Urumqi830000,China; 2.XinjiangMedicineResearchInstitute,Urumqi830004,China)
Objective To observe the effects of capparis spinosa total alkaloid on the α-smooth muscle actin (α-SMA), matrix metalloproteinase-1 (MMP-1), Endoglin and interleukin-6 (IL-6) levels in mice models of systemic sclerosis (SSc). Methods Totally 90 BALB/c mice were randomly divided into control group, model group, penicillamine group and capparis spinosa total alkaloid low-, medium- and high-dose group. Mice models with SSc were established by repeated local injections of bleomycin in mice back, except for the control group. After treatment by medicine for 8 weeks, the levels of α-SMA in skin and lung tissue, Endoglin in skin tissue and MMP-1, IL-6 in serum were measured by ELISA. Results The levels of α-SMA in skin and lung tissue, Endoglin in skin tissue and IL-6 in serum were markedly lowered and MMP-1 in serum was markedly increased by high-dose capparis spinosa total alkaloid than in model group mice. Conclusion Capparis spinosa total alkaloid could ameliorate fibrosis of SSc by down-regulating expression of α-SMA, Endoglin, IL-6 and up-regulating expression of MMP-1.
Capparis spinosa total alkaloid; Systemic sclerosis; α-smooth muscle actin; Endoglin; Interleukin-6; Matrix metalloproteinase-1
R285.5
B
1006-3250(2017)10-1384-03
国家自然科学基金资助项目(81260235)-刺山柑总生物碱改善系统性硬皮病组织纤维化的作用机理研究
康小龙(1975-),男,陕西扶风人,副主任药师,医学博士,从事中药作用机制研究。
△通讯作者:何承辉(1974-),女,四川自贡人,副研究员,医学硕士,硕士研究生导师,从事药物新制剂与新剂型研究,Tel:0991-5853365,E-mail: 408705201@qq.com。
2017-04-22

