细粒棘球绦虫EgM123基因序列分析及EgM家族基因在虫体不同发育阶段的差异表达分析
毛丽萍,王正荣,王 伟,魏玉圆,翟少华,甘尚权,简子健*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.省部共建绵羊遗传改良和健康养殖国家重点实验室,新疆石河子 832000)
细粒棘球绦虫EgM123基因序列分析及EgM家族基因在虫体不同发育阶段的差异表达分析
毛丽萍1,王正荣2,王 伟1,魏玉圆1,翟少华1,甘尚权2,简子健1*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.省部共建绵羊遗传改良和健康养殖国家重点实验室,新疆石河子 832000)
对细粒棘球绦虫EgM123基因进行分子克隆和生物信息学分析,同时对EgM家族基因在虫体不同发育阶段的mRNA转录水平进行初步研究。采集绵羊肝脏包囊中原头蚴,提取总RNA,通过RT-PCR获取EgM123纯化的PCR产物,克隆到pGEM-T载体并测序,对测序结果进行结构和功能的预测分析。以Actin基因为内参基因,采用SYBR Green real-time RT-PCR技术,对不同发育阶段,即其原头蚴和成虫的EgM4、EgM9、EgM123的表达量进行检测。结果表明,EgM123基因ORF为594 bp,编码197个氨基酸,蛋白分子质量为21.959 ku,等电点为7.94。EgM123蛋白无信号肽、跨膜螺旋区和卷曲螺旋结构,是一种亲水性的可溶性蛋白质,存在23个磷酸化位点。根据亚细胞定位预测显示,EgM123蛋白主要位于细胞核内。二级结构预测含α-螺旋9.64%、β-折叠22.84%、无规则卷曲62.94%。EgM123氨基酸序列中有6个潜在的抗原表位。RT-qPCR结果显示,成虫阶段EgM家族基因表达量极显著高于原头蚴阶段。在发育的同一阶段,EgM123基因极显著高于EgM4、EgM9基因的表达量。通过EgM家族基因在虫体不同发育阶段的mRNA转录水平,EgM123基因在虫体成虫阶段高表达,以期为筛选细粒棘球绦虫终末宿主疫苗候选基因提供理论依据。
细粒棘球绦虫;EgM123蛋白;抗原基因;生物信息学
细粒棘球绦虫(Echinococcusgranulosus,Eg)属带科(Taenidae)、棘球属(Echinococcus)绦虫,能够引起严重的人畜共患病——棘球蚴病(又称包虫病),且呈全球性分布[1-3]。Eg成虫寄生于犬科食肉动物的小肠内,感染性虫卵随着粪便排出体外,污染环境,传播于人和家畜。Eg幼虫主要寄生于人和其他中间宿主的肝脏(70%)、肺脏(20%)、肌肉和脑组织(10%)[4-5]。犬是棘球蚴的主要传染源,也是细粒棘球绦虫的终末宿主。我国是棘球蚴病高发国家,其中以新疆、青海、西藏、四川等牧区发病率较高[6]。据统计,每年用于包虫病的治疗的费用以及畜牧业经济损失在30亿美元[7]。Zhang W等[8]研究发现,EgM家族基因对细粒棘球绦虫终末宿主具有较好的免疫原性,其中EgM123主要分布于成熟细粒棘球绦虫的睾丸中,主要调节精子的产生和受精后表达一种虫卵膜蛋白[9]。目前,对于终末宿主犬的免疫保护性抗原[10]尚未明确,研究有效诊断方法及疫苗是包虫病综合防控的关键。
本研究以Eg全基因组序列为参考序列,设计引物,通过RT-PCR获得EgM123基因序列,并对该蛋白进行生物信息学预测和分析,同时比较EgM家族中的EgM4、EgM9、EgM123在细粒棘球绦虫原头蚴和成虫之间表达量的差异,为进一步研究EgM123基因的蛋白功能,以及疫苗候选靶标提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 样品 细粒棘球绦虫原头蚴,采自新疆石河子市牛、羊定点屠宰场。收集绵羊感染细粒棘球绦虫的肝脏及肺脏器官,经750 mL/L酒精消毒后,采集新鲜的包囊液样本,置-20℃保存备用。成虫由新疆畜牧科学院张壮志研究员惠赠。
1.1.2 主要试剂和仪器 超纯RNA提取试剂盒,北京康为世纪生物科技有限公司产品; M-MLV Reverse Transcriptase、Stbl3菌种,美国Invitrogen公司产品; pGEM○R-T,美国Promega公司产品; DNA Marker、 PCR反应试剂、 LightCycler 480 SYBR Green Ⅰ Master,宝生物工程(大连)有限公司产品; 胶回收试剂盒、小量质粒提取试剂盒,美国Omega公司产品; LightCycler 2.0 PCR,Roche公司产品。
1.2 方法
1.2.1 棘球蚴囊液中原头蚴的形态学观察 从感染绵羊的肝脏及肺脏器官吸取出的囊液,滴加到载玻片上,放置于显微镜下观察原头蚴形态特征。
1.2.2 引物的设计与合成 根据GenBank中发表的相关EgM4、 EgM9、 EgM123基因序列(GenBank登录号:AF482719、AF482720、AF-482718)和Actin基因序列(GenBank登录号:L-07775.1),使用Primer Premier 5.0软件设计细粒棘球绦虫EgM123基因全长ORF基因引物以及特异性的Actin(内参基因)、EgM4、EgM9、EgM123基因荧光定量引物,由上海生工生物工程技术服务有限公司合成(表1)。

表1 引物与序列Table 1 Primers and sequences
1.2.3 总RNA的提取及cDNA合成 从Eg感染绵羊的肝脏抽取Eg囊液放入1.5 mL的EP管中,置-20℃保存。用北京康为世纪生物科技有限公司的Ultrapure RNA kit,提取含有原头蚴的囊液中RNA,测定OD 260 nm与OD 280 nm比值在1.8~2.0,置-80℃保存备用。取1 μg RNA模板,按照M-MLV Reverse Transcriptase试剂盒说明书合成cDNA第一链,置-20℃保存备用。
1.2.4 EgM123基因全长ORF序列的扩增 cDNA模板2 μL,按比例加入PCR反应体系:ExTap(5 U/μL) 0.25 μL ,10×ExTapbuffer 5 μL,dNTP Mixture 4 μL,上、下游引物各2 μL(10 μmol/L),加ddH2O 补至50 μL,95℃预变性5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,35 个循环;72℃延伸10 min。 10 g/L 琼脂糖凝胶电泳检测RT-PCR产物,纯化、回收PCR产物,并与载体pGEM-T连接。以连接产物转化至Stbl3 感受态细胞并接种于抗性的LB/Amp+固体培养基平板中,挑取阳性克隆,进行PCR验证。阳性重组载体命名为pGEM-T-EgM123,送上海生工生物工程技术服务有限公司测序。
1.2.5 细粒棘球绦虫EgM123基因编码氨基酸序列及生物学信息分析 利用生物信息学分析的相关软件对细粒棘球绦虫EgM123基因编码产物的氨基酸序列、蛋白质特性及结构进行预测和分析。利用ProtParam(http://web.expasy.org/protparam/)分析蛋白质理化性质;利用ProtScale(http://web.expasy.org/protscale/)预测蛋白质疏水性/亲水性;利用TMHMM Server,v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析蛋白质跨膜区;通过SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)预测蛋白质信号肽;采用NetPhos 2.0 Server (http://www.cbs.dtu.dk/services/NetPhos-2.0/)预测蛋白质磷酸化位点;利用COILS Server (http://embnet.vital-it.ch/software/COILS-form.html)进行蛋白质亚细胞定位分析;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa-automat.pl?page=npsa-sop ma.html)进行蛋白质二级结构预测;采用PHYRE2(http://www.sbg.bio.ic.ac.uk/phyre2/html/pa ge.cgi?id =index)预测蛋白质三级结构;利用DNA Star 软件中的Protean进行蛋白质抗原位表位分析。
1.2.6 SYBR Green Ⅰ相对荧光定量PCR的建立 采用细粒棘球绦虫的原头蚴、成虫的cDNA为模板,选用Actin为内参基因,以QEg4、QEgM9、QEgM123为引物,按照LightCycler 480 SYBR Green Ⅰ Master荧光定量试剂盒的说明书进行RT-qPCR。反应体系20 μL:2×Master Mix 10 μL,F、R(10 μmol/L)各0.5 μL,cDNA 1 μL,无菌水补至8.0 μL。反应条件:95 ℃ 5 min;95℃ 10 s,65℃ 20 s(收集荧光信号),72℃ 20 s,45个循环;融解曲线:95℃ 5 s,65℃ 1 min,97℃ 0 s;冷却40℃ 10 s。每个样品做3个重复试验。
1.2.7 相对荧光定量PCR数据分析 采用Ct法(Qr=2-ΔΔCt)分析EgM4、EgM9、EgM123基因在原头蚴、成虫阶段中表达量的差异性。首先计算出各样品重复的平均值,再计算出不同基因与内参基因的Ct值(Ct值=目的基因的Ct值-内参基因的Ct值)。选用EgM4基因组作对照,用其他基因的Ct差值减去EgM4基因组对照的Ct差值,即为ΔΔCt,然后通过计算2-ΔΔ Ct来计算不同基因、不同阶段之间mRNA相对表达量的差异性,用SPSS 16.0分析软件进行显著性检验。
2 结果
2.1 棘球蚴囊液中原头蚴的形态学观察结果
通过显微镜观察,原头蚴为内陷型,外观呈现大小不等的椭圆形或梨型,顶部可见不规则圆形的内陷孔,尾部有排泄孔(图1)。

A.细粒棘球绦虫原头蚴(100×);B.细粒棘球绦虫原头蚴(200×);a.小钩;b.排泄孔
A.Echinococcusgranulosusprotoscoleces(100×);B.Echinococcusgranulosusprotoscoleces(200×);a.Hooklet;b.Draining hole
图1显微镜下细粒棘球绦虫原头蚴形态
Fig.1 Morphology ofEchinococcusgranulosusprotoscoleces under microscope
2.2 细粒棘球绦虫EgM123基因扩增
利用特异性引物扩增EgM123基因序列,经10 g/L琼脂糖凝胶电泳检测,出现594 bp的特异性条带,与预期大小相一致(图2)。
2.3 细粒棘球绦虫EgM123蛋白的生物信息学分析
2.3.1 细粒棘球绦虫EgM123蛋白理化特性预测分析 测序结果显示,EgM123 cDNA全长为594 bp,利用ProtParam tool软件预测细粒棘球绦虫EgM123蛋白分子质量为21.959 ku,分子式为C989H1 563N237O280S22,等电点理论值为7.94,编码197个氨基酸,其中脯氨酸(Pro)最多,占整个氨基酸组成的15.2%;精氨酸(Arg)、甘氨酸(Gly)、酪氨酸(Tyr)最少,均占0.5%。由于该蛋白不稳定参数为73.3(>40),因此,EgM123表达后是一种不稳定蛋白。
2.3.2 EgM123蛋白疏水性/亲水性预测分析 运用ExPASy服务网页中的Protscale程序预测细粒棘球绦虫EgM123编码蛋白质的疏水性(图3)。蛋白质疏水性最大值为1.52,最小值为-2.089,从总体来看,此蛋白亲水性/疏水性平均分值为-0.122,表现为亲水性,由此可推断细粒棘球绦虫EgM123基因编码的蛋白质是一种可溶性蛋白质。
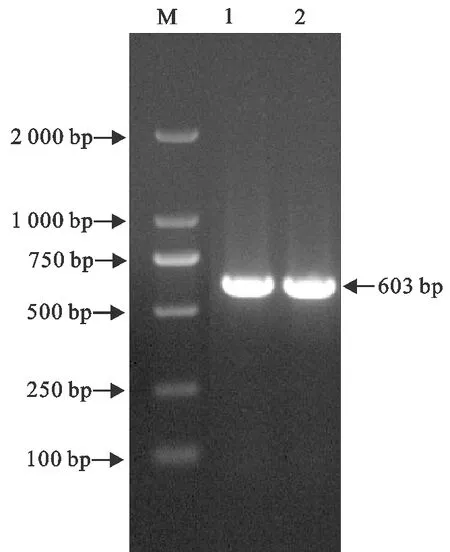
M.DNA 标准DL 2 000;1、2.RT-PCR 扩增产物M.DNA Marker DL 2 000;1,2.RT-PCR products图2 EgM123基因的RT-PCR扩增结果Fig.2 RT-PCR amplification of EgM123 gene
2.3.3 EgM123基因跨膜区分析 利用TMHMM Server v.2.0 在线软件对EgM123蛋白的跨膜区域分析显示细粒棘球绦虫EgM123蛋白无跨膜螺旋结构。
2.3.4 EgM123基因信号肽预测 通过signalp 4.1对EgM123进行信号肽预测显示C、S、Y值均不高于阈值,表明EgM123不具有信号肽酶切位点,说明此蛋白可能为非分泌蛋白。
2.3.5 EgM123基因蛋白质磷酸化位点分析 NetPhos 3.1预测分析表明,EgM123蛋白存在23个磷酸化位点,其中11个丝氨酸(Ser)磷酸化位点(101、111、125、132、134、149、162、164、165、167、168)、11个苏氨酸(Thr)磷酸化位点(25、39、47、53、94、118、127、135、139、181、196),1个酪氨酸(Tyr)磷酸化位点(37)(图4)。
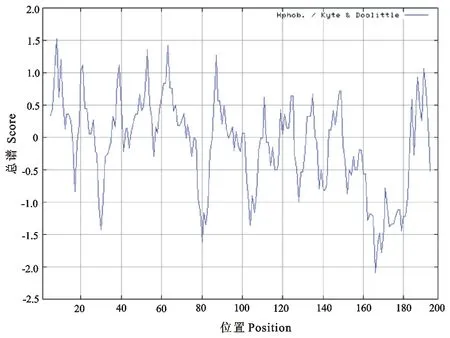
图3 EgM123蛋白的亲/疏水性预测Fig.3 Hydrophobicity prediction of EgM123 protein

图4 EgM123蛋白的磷酸化位点分析Fig.4 Phosphorylation site analysis of EgM123 protein
2.3.6 EgM123蛋白的亚细胞定位分析 采用TargetP在线软件预测显示EgM123蛋白主要位于细胞核(65.2%),少量分布于细胞质(13%)、线粒体(13%),表明此蛋白可能主要在细胞核中发挥生物学作用。
2.3.7 EgM123蛋白二级结构和三级结构预测 通过在线软件SOPMA预测细粒棘球绦虫EgM123蛋白二级结构,结果显示α-螺旋(h)占9.64%,β-折叠(e)占22.84%,β-转角(t)占4.57%,无规则卷曲(c)占62.94%(图5)。通过在线软件Phyre2预测三级结构(图6)。

图5 EgM123 蛋白二级结构Fig.5 Prediction of secondery structure of EgM123 protein

图6 EgM123蛋白三级结构Fig.6 Prediction of 3D structure of EgM123 protein
2.3.8 EgM123蛋白抗原表位预测分析 抗原表位是决定抗原特异性的特殊化学基团。通过DNAStar软件对EgM123氨基酸序列进行抗原表位预测分析结果显示,EgM123可能有6个潜在的抗原表位(23-34、67-75、102-106、114-120、138-142、150-182)区域,主要集中在67-184位(图7)。
2.3.9 细粒棘球绦虫EgM家族基因在不同时期表达量的RT-qPCR结果 以Actin基因为管家基因、原头节的EgM4作为参照,相对定量Ct法(Qr=2-ΔΔ Ct)的mRNA表达量差异性分析表明(图8),成虫阶段EgM4、EgM9、EgM123基因表达量极显著高于原头蚴阶段,表达量分别为18、15、36倍。在成虫阶段,EgM123基因极显著高于EgM4、EgM9基因的表达量。原头蚴、成虫发育阶段各基因均有表达,但在成虫阶段表达较为旺盛,尤其EgM123表达量较高。

图7 EgM123的抗原表位分析Fig.7 Analysis of antigenic epitopes in EgM123
3 讨论
EgM123主要分布于成熟细粒棘球绦虫的睾丸中,其次为子宫上皮细胞,主要调节精子的产生和受精后表达一种虫卵膜蛋白[9]。有研究发现,细粒棘球绦虫的原头节感染试验犬35 d后,开始形成受精卵,此阶段EgM123基因表达丰富,推测它在虫卵成熟的过程中起决定作用[10],但对EgM123基因编码蛋白质的生物信息学分析尚不清楚。本文通过在线软件对EgM123基因进行生物信息学分析,通过蛋白质的理化性质、疏水性/亲水性、跨膜区、信号肽、亚细胞定位、二级结构、三级结构以及抗原表位的预测等分析EgM123基因编码蛋白质功能。就预测结果而言,EgM123基因主要分布在细胞核,编码的197个氨基酸,构成了一种不稳定的非分泌蛋白。该蛋白有6个潜在的抗原表位区域,这是有效的抗原基因必备的结构基础。
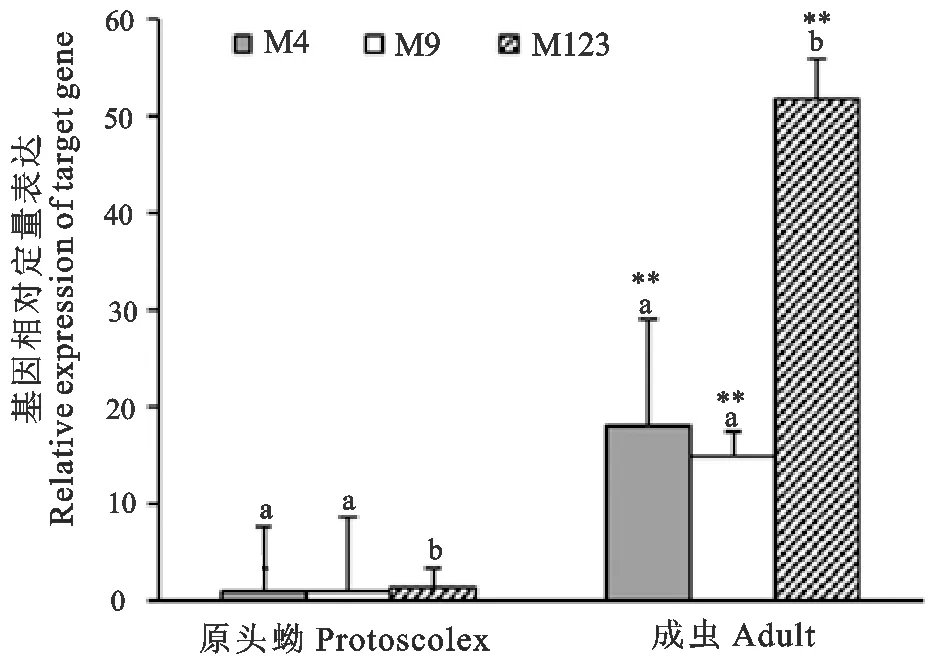
**表明不同时期相同基因之间比较差异极显著(P<0.01);不同字母表示同一时期不同基因之间比较差异极显著(P<0.01)
**Indicate that extremely significant difference between the same gene in different periods (P<0.01);With different letters mean extremely significant difference between the different genes at the same period (P<0.01)
图8 EgM家族基因在细粒棘球绦虫不同发育阶段的mRNA转录水平
Fig.8 The mRNA transcription levels of EgM genes family in different development stages ofEchinococcusgranulosu
EgM家族基因对细粒棘球绦虫病终末宿主免疫抗原的研究,Zhang W等[10]利用差异显著逆转录PCR(DDRT-PCR)筛选出成熟虫体与非成熟虫体差异表达的基因,即EgM家族基因由24重复氨基酸序列构成,其中EgM4、EgM9、EgM123中重复序列分别为6、4、5个,该重复序列是由正负电荷交互分布构成α螺旋。免疫学试验证明,EgM基因家族与融合蛋白协同免疫感染犬后,能持续产生较高水平的特异性抗体,并被免疫荧光组织化学定位所证实[11-15]。通过EgM家族基因表达载体与谷胱甘肽构建融合蛋白,免疫攻虫犬,其保护率达到97%~100%[16]。通过以上研究表明,EgM家族蛋白对终末宿主具有良好的保护性。
本研究通过SYBR Green荧光定量PCR,检测EgM4、EgM9、EgM123基因在细粒棘球绦虫的原头蚴、成虫阶段mRNA转录水平。本试验优点为:采用SYRB Green Ⅰ荧光标记物,无需设计探针,具有灵敏度高、操作简单、价格低廉等优点,是一种结合于所有dsDNA双螺旋小沟区域能够激发绿色波长;利用相对定量方法,以表达水平相对稳定的管家基因作为内参,测定目的基因的相对比例;采用Actin为内参基因,将EgM家族基因在虫体不同发育时期mRNA表达进行分析发现,在成虫阶段,EgM4、EgM9、EgM123的表达较高,尤其是EgM123的表达量是EgM4、EgM9的2.5倍,这表明EgM123基因是细粒棘球绦虫成虫阶段携带的主要基因,参与虫卵成熟阶段的调节或代谢方面有着重要的调控,可作为预防细粒棘球绦虫成虫侵袭的候选基因抗原,但其抗原性与免疫原性、协同免疫以及免疫方法的研究还有待进一步证实。本研究证实,EgM123基因在成虫生长发育阶段表达旺盛,为了能够更好地抑制细粒棘球绦虫的感染,可以通过抑制终末宿主(犬)排卵来降低细粒棘球绦虫病发生、发展。
[1] World Health Organization.Multicriteria-based ranking for risk management of food-borne parasites:report of a joint FAO/WHO expert meeting,3-7 September 2012//[C].FAO headquarters:Rome Italy,2014.
[2] Shafiei R,Teshnizi S H,Kalantar K,et al.The seroprevalence of human cystic echinococcosis in Iran:a systematic review and meta-analysis study[J].J Parasitol Res,2016,2016(4):1-8.
[3] Rojas C A A,Ebi D,Paredes R,et al.High intraspecific variability ofEchinococcusgranulosussensu stricto in Chile[J].Parasitol Int,2017,66(2):112-115.
[4] Wang S,Yang T,Zhang X,et al.Construction ofinvivofluorescent imaging ofEchinococcusgranulosusina mouse mode1[J].Korean J Parasitol,2016,54(3):291-299.
[5] Wen H,Yang W G.Public health importance of cystic echinococcosis in China[J].Acta Tropica,1997,67(1-2):133-145.
[6] 林宇光,卢明科,洪凌仙.我国棘球绦虫及棘球蚴病研究进展[J].中国人兽共患病学报,2012,28(6):616-627.
[7] World Health Organisation.Echinococcosis.Fact sheet No.377[R].World Health Organisation,2015.
[8] Zhang W,Li J,You H,et al.A gene family fromEchinococcusgranulosusdifferentially expressed in mature adult worms[J].Mol Biochem Parasitol,2003,126(1):25-33.
[9] Thompson R C A.Biology and systematics ofEchinococcus[J].Adv Parasitol,2017,95:65-109.
[10] 王进成,由 弘.棘球蚴病的免疫学研究进展[J].中国兽医杂志,2004,40(6):42-44.
[11] 郭宝平,张壮志,古努尔·吐尔逊,等.EgM9免疫犬产生抗体变化规律的观察[J].中国人兽共患病学报,2010,26(4):325-329.
[12] 杨 帆.EgM123抗血清对体外培养原头蚴免疫杀伤研究[D].新疆乌鲁木齐:新疆农业大学,2015.
[13] 赵 莉,张壮志,石保新,等.EgM123免疫犬血清抗体监测[J].草食家畜,2011(4):72-75.
[14] 石保新,巫 剑,张壮志,等.EgM9蛋白免疫犬肠系膜淋巴结中抗体的免疫荧光组织化学定位[J].中国兽医科学,2010,40(4):406-409.
[15] 巫 剑.细粒棘球绦虫感染犬及EgM9蛋白免疫犬引起的免疫应答研究[D].新疆乌鲁木齐:新疆农业大学,2010.
[16] Zhang W,Mcmanus D P.Vaccination of dogs againstEchinococcusgranulosus,the cause of cystic hydatid disease in humans[J].J Infect Dis,2006,194(7):966-974.
AnalysesofEgM123GeneSequenceandDifferentialExpressionofEgMGeneFamilyinDifferentDevelopmentStagesofEchinococcusgranulosus
MAO Li-ping1,WANG Zheng-rong2,WANG Wei1,WEI Yu-yuan1,ZHAI Shao-hua1,GAN Shang-quan2,JIAN Zi-jian1
(1.CollegeofVeterinaryMedicine,XinjiangAgriculturalUniversity,Urumqi,Xinjiang,830052,China;2.StateKeyLaboratoryforSheepGeneticImprovementandHealthyProduction,Shihezi,Xinjiang,832000,China)
Molecular cloning and bioinformatics analysis of EgM 123 gene were performed, moreover,the expressions of EgM family genes in different developmental stages at the mRNA level of transcription ofEchinococcusgranulosuswere detected in this study.The hydatid protoscoleces were collected from the ovine livers withEchinococcusgranulosusand the total RNA was extracted as a template.The amplification product of EgM123 gene was obtained by RT-PCR.Then the product was cloned into pGEM-T vector and sequenced.The results of sequence were analyzed to predict its structure and function.Using Actin gene as an internal control,the expressions of EgM4,EgM9 and EgM123 mRNA from the protoscoleces and the adults in the different stages were detected by qPCR.The results showed that the ORF of EgM123 gene contained 594 bp,encoding 197 amino acids.It had a molecular weight of 21.959 ku,and the isoelectric point of 7.94.It is a hydrophilic soluble protein with 23 phosphorylation sites and without signal peptide,transmembrane helix region and a coiled coil structure.The EgM123 protein was mainly located in the nucleus by subcellular localization and secondary structure contained 9.64% of alpha helix,22.84% of beta helix and 62.94% of random coil.The EgM123 had 6 potential antigenic epitopes by the indicated analysis of amino acid sequence.RT-qPCR results showed that the EgM family gene expression was significantly higher at the adult stage.The expression level of EgM123 gene was significantly higher than that of EgM4,and EgM9 genes in the same time period.EgM gene family was studied at the level of mRNA transcription in different developmental stages of the parasite,EgM123 gene is highly expressed in the adult stage,This study provided the theoretical basis on the candidate gene vaccine againstEchinococcusgranulosusin definitive hosts.
Echinococcusgranulosus;EgM123 protein;antigen gene;bioinformatics
S852.734;Q789
A
1007-5038(2017)10-0020-07
2017-01-17
国家自然科学基金项目(31360623);研究生科研创新项目(XJAUGRI2015017)
毛丽萍(1989-),女,安徽砀山人,硕士研究生,主要从事动物分子与免疫病理学研究。*

