马链球菌马亚种的分离鉴定及fneB基因序列分析
王雨朦,何国文,买占海,沙娅·奴尔兰,王德超,朱义忠,恩克·博力德,况 玲*,苏战强*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.新疆伊犁种马场,新疆昭苏 835600)
马链球菌马亚种的分离鉴定及fneB基因序列分析
王雨朦1,何国文1,买占海1,沙娅·奴尔兰1,王德超1,朱义忠2,恩克·博力德2,况 玲1*,苏战强1*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.新疆伊犁种马场,新疆昭苏 835600)
新疆伊犁某地区一些马群中不断出现以全身多发性脓肿为特征的患病马匹,为了查明其是否为马腺疫,以及由何种马链球菌感染所致,无菌采集典型患病马匹脓汁样品,常规THB增菌,绵羊鲜血平板划线分离单菌落后,用透射电镜对分离菌的微观形态进行观察,PCR对其fneB基因进行克隆与序列分析,最后用生化试验进行验证。结果表明,从12匹患病马的脓肿组织中,共采集了25份样品,从中分离鉴定出来源于不同患病马的2株马链球菌马亚种菌株,这2株菌的形态均符合链球菌的特点;基因克隆测序结果表明,其中1株与英国源的兽疫亚种H70和马亚种4047核苷酸同源性较高,均达97%~98%,另1株与英国源的马亚种4047和瑞典源某马亚种核苷酸同源性较高,均达98%~99%。这2株菌之间核苷酸序列同源性达98.3%,氨基酸同源性则达99.3%。马链球菌马亚种是引起伊犁某地区这些患马全身多发性脓肿的主要致病菌,它们可能来源于之前从欧洲和美洲引进的马匹,提示在进行疫病防控工作时,要特别注意海关检疫,积极防止疫病的传入。
马;马链球菌;分离鉴定;fneB基因;基因分析
马链球菌作为条件致病菌,可以引起马属动物上呼吸道、子宫、脐带等部位的疾病以及伤口感染[1]。马链球菌(Streptococcusequi)属于兰氏分群(Lancefield group)的C群β溶血链球菌,包括兽疫亚种(Streptococcusequissp.zooepidemicus)、马亚种(Streptococcusequissp.equi)和类马亚种(Streptococcusequissp.equisimilis)3个不同的亚种[2]。其中兽疫亚种在哺乳动物中较常见,偶尔会引起严重的疾病[1],相比之下,马亚种作为专性病原体,可引起马匹上呼吸道疾病,甚至导致具有高度传染性的马腺疫,是危害世界养马业最重要的病原菌之一[3]。马亚种是引起马腺疫的病原菌,1251年Jordanus Ruffus在兽医科学杂志中首次对马腺疫进行了相关描述[4],而马链球菌于1888年被Schutz J W[5]首次鉴定出,尽管对这种疾病进行了一个多世纪的研究,它仍是世界上最常报道的马的疾病之一。马腺疫在英国,每年仅被发现的就有超过600次,每次疫情可以持续几个星期,甚至几年,其发病率可达100%,病死率达10%[6]。在我国,据效宏儒[7]的调查报告,甘肃山丹军马一场在1971年—1979年的14 745匹马中,马腺疫累计发生1 997例,发病率为13.55%,治愈1 914匹,治愈率达95.8%,死亡83匹,病死率4.2%。王积禄[8]1982年统计了青海海北地区某牧场552匹马驹腺疫发病情况,发病517匹,发病率93.7%,死亡7匹,病死率为1.3%。据姜山[9]报道,1995年8月,四川省宝兴县1 241匹马中发生马腺疫868匹,发病率70% ,死亡7匹,病死率0.8%。吴家骥[10]2000年调查了贵州省黔西县3个乡的1 230匹马,发生马腺疫534匹,发病率43.4%。 马腺疫感染最初的特征是发热,咳嗽,之后出现淋巴结脓肿和黏脓性鼻腔出血[11],即使马匹发病严重,临床症状明显,但是对鼻拭子、鼻洗液、脓汁等的细菌学培养仍是该病的确诊标准[12]。
马链球菌感染的发生,涉及几种表面锚定蛋白(黏附素),使菌体能够结合到宿主的扁桃体上皮细胞上。黏附因子FN结合蛋白有FNEB蛋白、FNE蛋白和SFS蛋白3种,其中FNEB蛋白被认为是细菌黏附和内化到哺乳动物细胞过程中最重要的胞外蛋白[13]。本试验选取编码FNEB蛋白的fneB基因来鉴定马链球菌马亚种,并与其他马亚种基因序列比较,对比它们的差异性,为建立马链球菌病的防控措施提供科学依据。
1 材料与方法
1.1 材料
1.1.1 样品来源 无菌采集新疆伊犁某马场全身多发性脓肿马匹的脓汁25份,编号N1~N25。
1.1.2 主要试剂 快速革兰染液、THB培养基、细菌基因组DNA提取试剂盒、胎牛血清(Hyclone),北京鼎国昌盛生物技术有限责任公司产品;链球菌细菌生化编码鉴定管A203,杭州滨和微生物有限公司产品;DNA Marker、pMD-19T,TaKaRa公司产品;2×TaqPCR Green Mix、ddH2O、感受态细胞DH5α,天根生化科技(北京)有限公司产品;胶回收试剂盒、质粒提取试剂盒,Omega公司产品。
1.1.3 主要仪器 自动高压灭菌器(HVE-50)、离心机(Eppendorf AG 22331 Hamburg)、空气浴振荡培养箱(ST-F 160AC)、SW-CJ-2F双人双面垂直洁净工作台,上海博讯实业有限公司医疗设备厂产品;透射电镜,日立H-600A,日立公司产品;TPro fessional PCR仪,Biometra公司产品;凝胶成像系统(Universal Hood Ⅱ),Bio-Rad公司产品。
1.2 方法
1.2.1 细菌分离与培养 将采集到的样品吸取200 μL加入到10 mL 50 mL/L血清THB液体培养基中,37 ℃、180 r/min振荡18 h~24 h进行增菌培养。吸取增菌液20 μL画线接种于50 mL/L绵羊鲜血培养基,倒置于37℃恒温培养箱,培养18 h~24 h。观察鲜血培养基表面的菌落形态,挑取β溶血的单菌落继续在鲜血培养基上画线,进行细菌纯化,至鲜血培养基上呈现的菌落形态单一、稳定,之后进行下一步鉴定。
1.2.2 细菌形态学观察
1.2.2.1 光学显微镜观察 挑取1.2.1中纯化的单菌落进行革兰染色,在油镜下观察。
1.2.2.2 透射电镜观察 挑取1.2.1中纯化的单菌落于THB液体培养基中,180 r/min振荡培养6 h,吸取20 μL菌液于预制好的铜网上,室温放置2 min,使细菌吸附在FORMVAR膜表面,用20 g/L磷钨酸负染后,用透射电镜观察。
1.2.3 引物合成 根据NCBI收录的马链球菌马亚种4047全基因组中的fneB基因序列,利用DNA Star设计引物,引物由上海生工生物工程技术服务有限公司合成。PCR扩增引物序列和反应运行参数见表1。

表1 PCR扩增引物序列和反应运行参数Table 1 Primer sequences and parameters of PCR
1.2.4 fneB基因的扩增 按细菌基因组DNA提取试剂盒的说明,取1.5 mL培养的菌液于EP管中12 000 r/min离心1 min,按照说明书进行,最后将所收集的DNA溶液于-20℃保存备用。PCR反应体系为25 μL:2×TaqPCR Green Mix 12.5 μL,上、下游引物各1 μL,DNA模板1 μL,ddH2O补至25 μL。用凝胶成像分析系统观察结果。
1.2.5 fneB基因的克隆与鉴定 将琼脂糖凝胶放于波长为365 nm的紫外灯照射下,切割含目的片段的凝胶,然后放入预先称重的离心管中,根据DNA胶回收试剂盒的说明书操作,回收PCR产物。分别取1、5、4 μL的PCR回收产物、Solution Ⅰ、pMD19-T载体混匀,16℃过夜连接。
将连接产物加入感受态细胞 DH5α 中,冰浴 30 min;42℃热休克90 s,立即冰浴5 min; 无菌条件下加800 μL LB液体培养基,37℃振荡培养40 min~60 min;吸取200 μL菌液均匀涂布于含有Amp抗性的LB平板上(40 μg/mL),37℃培养12 h,同时设空白对照组。
挑取板上的单个菌落接种到含有Amp抗性的LB液体培养基中37℃振荡培养6 h后,按照质粒提取试剂盒的说明,提取细菌质粒,所得阳性重组质粒送与北京鼎国昌盛生物技术有限责任公司测序。
1.2.6 生化鉴定 将PCR鉴定为阳性的菌株按照链球菌生化编码鉴定手册(GYZ—12ST)操作,对分离菌进行生化试验验证,观察鉴定管颜色变化,结合鉴定手册判定结果。
2 结果
2.1 细菌分离培养
采集的25份样品,经多次培养纯化,有2份样品在绵羊鲜血培养基上可见β溶血的灰白色边缘整齐、中间隆起且湿润光滑,大小约1 mm的圆菌落。
2.2 细菌形态学观察
革兰染色镜检可见蓝色成对或呈短链状排列的球菌(图1)。透射电镜明显可见排列成链状的球菌,球菌大小在0.5 μm~1.0 μm之间,符合马链球菌特征[14](图2)。

图1 革兰染色镜检(1 000×)Fig.1 Gram staining(1 000×)

图2 透射电镜观察Fig.2 Observation under transmission electron microscope
2.3 fneB序列的生物信息学分析
2.3.1 fneB基因扩增 按照所设计的fneB基因引物,所分离到的2株菌均能在435 bp处扩增出目的条带(图3)。

M.DNA 标准DL 2 000;1.N20;2.N25;3.阴性对照M.DNA Marker DL 2 000;1.N20;2.N25;3.Negative control图3 fneB基因PCR扩增结果Fig.3 PCR amplification result of fneB gene
2.3.2 fneB基因的同源性比较 利用MegAlign软件中的Clustal V将测序结果与GenBank登录的fneB基因序列进行同源性比较,结果分离株N20与N25的核苷酸同源性达98.3%,氨基酸同源性达99.3%(图4)。N20与英国源兽疫亚种H70、马亚种4047核苷酸同源性较高,达97%~98%,N25与英国源马亚种4047、瑞典源马亚种核苷酸同源性较高,达98%~99%(图5)。说明分离株N20、N25为马链球菌马亚种。
2.4 细菌生化鉴定
PCR鉴定为阳性的菌株生化试验结果见表2。
3 讨论
马腺疫是由马链球菌马亚种引起马属动物的一种急性接触性传染病,具有高发病率的特点,它给世界养马业带来的直接影响是马术活动的取消以及巨大的经济损失[15]。马链球菌马亚种是影响经济和动物福利重要的马病原体。本试验在春夏季节对全身多发性脓肿病例的马匹脓汁进行马链球菌马亚种的分离,成功分离到2株马链球菌马亚种,经fneB基因PCR鉴定、生化鉴定、同源性分析,表明分离株与4047菌株属同一亚种。本试验分离株与英国源分离株同源性高,可能与该地区引进的马匹有关,这与Anzai T等[16]和Ivens P A S等[17]分析得出的马链球菌马亚种的传播可能是世界马匹贸易导致的结论一致,本研究为检疫检验部门提供了理论依据。通过对比本研究分离株与新疆马腺疫链球菌[18](ID:KF679507)发现,3株马链球菌虽为同一亚种,但引发的临床病征不同,说明马链球菌马亚种除引起马腺疫外,还可引起全身多发性脓肿。Neamat-Allah A N F等[12]研究表明,马腺疫在全年中所有季节都发生,但在春季发生率较高(达45.52%),而 Radostits O M等[19]认为马腺疫大多发生在寒冷潮湿的季节,本研究分离的马链球菌马亚种来自于夏季发生全身多发性脓肿的患马,可以推断当季节变换,天气转寒时,该马场有暴发马腺疫的危险。
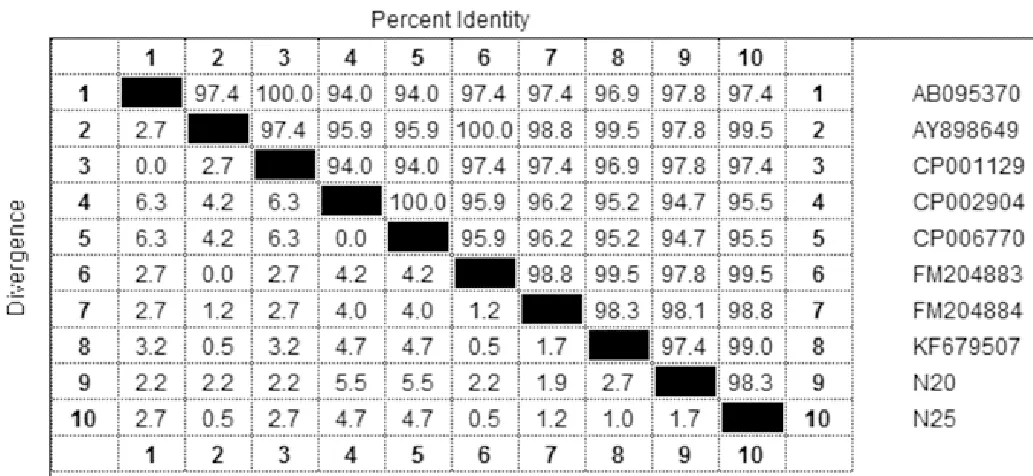
图4 分离株fneB基因核苷酸同源性分析Fig.4 Homology analysis of nucleic acids of fneB gene of isolates
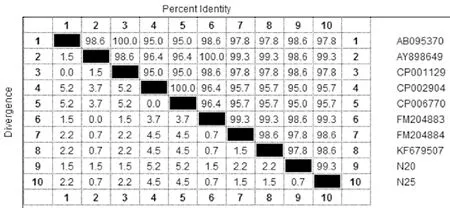
图5 分离株fneB基因编码的氨基酸同源性分析Fig.5 Homology analysis of fneB gene encoding amino acid of isolates

表2 分离菌生化鉴定结果Table 2 Biochemical identification results of isolates
Boyle A G等[20]对3种分离鉴定马链球菌的方法进行比较,发现直接PCR为检测马链球菌的优选方法,本试验先用PCR对分离菌进行鉴定,后用生化试验进行验证,发现生化试验结果不符合链球菌生化特性,但细菌测序结果确定为马链球菌马亚种,这提示生化鉴定可能出现假阴性的结果,不足以用于细菌鉴定,应与分子生物学鉴定方法相结合,这是较为可靠的鉴定方法。
马链球菌马亚种在马属动物中建立持续感染的能力可能是造成世界各地马腺疫高发病率的原因,所以鉴定健康携带者是预防马腺疫发生的一个关键点。带菌马已被认为是维持病原体长期存在和暴发感染的重要因素[21],但在健康马群体中监测马亚种的存在是具有挑战性的。Tirosh-Levy S等[22]强烈推荐血清学和细菌学组合的方法来鉴定持续感染的马,这在马腺疫发生期间,利用分子信息掌握马亚种流行病学和追踪新菌株有重要意义。
[1] Barnham M,Ljunggren A,Mcintyre M.Human infection withStreptococcuszooepidemicus(Lancefield group C):three case reports[J].Epidemiol Infect,1987,98(2):183.
[2] 杜茂昌.马腺疫链球菌的分离鉴定及其灭活疫苗的研制[D].陕西杨凌:西北农林科技大学,2015.
[3] Lindmark H,Nilsson M,Guss B.Comparison of the fibronectin-binding protein FNE fromStreptococcusequisubspeciesequiwith FNZ fromS.equisubspecieszooepidemicusreveals a major and conserved difference[J].Infect Immun,2001,69(5):3159.
[4] 郭纪珂,王晓钧.马腺疫[J].畜牧兽医科技信息,2013(10):16-18.
[5] Schütz J W.TheStreptococcusof strangles[J].J Compar Pathol Thera,1988(1):191-208.
[6] Laus F,Preziuso S,Spaterna A,et al.Clinical and epidemiological investigation of chronic upper respiratory diseases caused by beta-haemolytic streptococci in horses[J].Compar Immunol Microbiol Infect Dis,2007,30(4):247-260.
[7] 效宏儒.关于群牧马马腺疫发生规律的初步探讨[J].畜牧兽医杂志,1984(2):38-40.
[8] 王积禄.中西结合治疗马腺疫[J].青海畜牧兽医杂志,1982(3):103.
[9] 姜 山.马腺疫病的诊疗[J].中国兽医杂志,1997(9):38.
[10] 吴家骥,崔明志.马腺疫的中草药治疗[J].中兽医学杂志,2000(4):17-18.
[11] May J P,Walker C A,Maskell D J,et al.Development of aninvivoHimar1 transposon mutagenesis system for use inStreptococcusequisubsp.equi[J].Fems Microbiol Lett, 2004, 238(2):401-409.
[12] Neamat-Allah A N F,Damaty H M E.Strangles in Arabian horses in Egypt:Clinical,epidemiological,hematological,and biochemical aspects[J].Vet World,2016,9(8):820-826.
[13] Lannergãrd J,Flock M,Johansson S,et al.Studies of fibronectin-binding proteins ofStreptococcusequi[J].Infect Immun,2005,73(11):7243.
[14] 赫什D C,麦克劳克伦N J,沃克R L.兽医微生物学[M].北京:科学出版社,2007:65-68.
[15] Emma M,Kavanagh K S,Buckley T C,et al.Lineages ofStreptococcusequisspequiin the Irish equine industry[J].Irish Vet J,2013,66(1):10.
[16] Anzai T,Kuwamoto Y,Wada R,et al.Variation in the N-terminal region of an M-like protein ofStreptococcusequiand evaluation of its potential as a tool in epidemiologic studies[J].Am J Vet Res,2005,66(12):2167-2171.
[17] Ivens P A S,Matthews D,Webb K,et al.Molecular characterisation of strangles outbreaks in the UK:the use of M-protein typing ofStreptococcusequissp.equi[J].Equine Vet J,2011,43(3):359-364.
[18] 徐全圆.马腺疫链球菌的分离鉴定及FN结合蛋白免疫原性的研究[D].新疆乌鲁木齐:新疆农业大学,2014.
[19] Radostits O M,Blood D C,Done S H.Veterinary medicine:A textbook of the diseases of cattle,sheep,pigs,goats and horses[J].J Equine Vet Sci,2007(1):625.
[20] Boyle A G,Rankin S C,Duffee L,et al.Streptococcusequidetection polymerase chain reaction assay for equine nasopharyngeal and guttural pouch wash samples[J].J Vet Int Med,2015,30(1):276-281.
[21] Newton J R,Verheyen K,Talbot N C,et al.Control of strangles outbreaks by isolation of guttural pouch carriers identified using PCR and culture ofStreptococcusequi[J].Equine Vet J,2000,32(6):515.
[22] Tirosh-Levy S,Blum S E,Steward K F,et al.Streptococcusequisubspeciesequiin horses in Israel:seroprevalence and strain types[J].Vet Rec Open,2016,3(1):1-5.
Isolation,IdentificationandfneBGeneSequencingofStreptococcusequisubsp.equi
WANG Yu-meng1,HE Guo-wen1,MAI Zhan-hai1,SHAYA·Nuerlan1,WANG De-chao1,ZHU Yi-zhong2,ENKE·Bolide2,KUANG Ling1,SU Zhan-qiang1
(1.CollegeofVeterinaryMedicine,XinjiangAgriculturalUniversity,Urumqi,Xinjiang,830052,China;2.TheFieldofStallionIliXinjiang,Zhaosu,Xinjiang,835600,China)
There is a kind of disease happened among horses in Yili region of Xinjiang,which characterized by constantly appearance of multiple abscesses.In order to find if it is horse strangles,and to determine the type ofStreptococcusequi,pus samples from typical sick horses were collected.THB culture medium was used for enrichment,and sheep blood plate was streaked for getting single colony.Transmission electron microscopy was used to observe the microscopic morphology of the isolates,and the fneB gene was cloned by PCR.Finally,the biochemical tests were used to verify.A total of 25 samples were collected from abscess tissues of 12 diseased horses.There are 2Streptococcusequisubsp.equistrains were isolated and identified from 2 different horses,and the morphology of both strains were consistent with the characteristics ofStreptococcus.Gene cloning and sequencing results showed that compared to British sourcedStreptococcusequisubsp.zooepidemicusH70 andStreptococcusequisubsp.equi4047,one isolate has high nucleotide homology,which is up to 97%-98%.Another isolate has high nucleotide homology with British sourcedStreptococcusequisubsp.equi4047 and a Swedish strain,which is up to 98%-99%.The nucleotide sequence homology between this 2 isolates was up to 98.3%,and the amino acid homology between them was up to 99.3%.Streptococcusequisubsp.equiwas the main pathogenic bacteria of Ili horse multiple abscesses,they may origin from those imported Europe and the American horses.Suggesting that we should pay special attention to custom quarantine,and make sure that some diseases must not be introduced to our country when we carry out work on preventing and controlling of animal diseases.
equine;Streptococcusequi;isolation and identification;fneB gene;gene sequencing
2017-01-11
国家科技支撑计划项目(2012BAD46B02)
王雨朦(1993-),女,新疆乌鲁木齐人,硕士研究生,主要从事兽医临床研究。*
S852.611;S852.21
A
1007-5038(2017)10-0008-05
——和田盘羊

