Box-Behnken 设计-响应面法优化桂枝茯苓胶囊的闪式提取工艺Δ
王正宽,刘圆,石晓朦,王振中,萧伟#(1.江苏康缘药业股份有限公司康缘现代中药研究院,江苏连云港222047;2.中药制药过程新技术国家重点实验室,江苏连云港222047;3.中药提取精制新技术重点研究室,江苏连云港222047)
·制剂与工艺·
Box-Behnken 设计-响应面法优化桂枝茯苓胶囊的闪式提取工艺Δ
王正宽1,2,3*,刘圆1,2,3,石晓朦1,2,3,王振中1,2,3,萧伟1,2,3#(1.江苏康缘药业股份有限公司康缘现代中药研究院,江苏连云港222047;2.中药制药过程新技术国家重点实验室,江苏连云港222047;3.中药提取精制新技术重点研究室,江苏连云港222047)
目的:优化桂枝茯苓胶囊的闪式提取工艺。方法:以内刃转速、液固比、提取时间等为考察因素,以没食子酸、芍药苷、苯甲酸、肉桂酸、苯甲酰芍药苷、苦杏仁苷转移率的综合评价值为考察指标,在单因素试验基础上结合Box-Behnken设计-响应面法对桂枝茯苓胶囊闪式提取工艺进行优化;进行验证试验,并与常规的煎煮提取法(提取2次,共用时240 min)进行效果比较。结果:闪式提取桂枝茯苓胶囊的最优工艺为以水为提取溶剂,内刃转速5 600 r/min,液固比10.5∶1,提取时间60 s。在此条件下验证试验的平均综合评价值为85.40%(n=3),与预测值85.55%的相对误差为0.15%,并高于煎煮提取法(72.65%)。结论:优化的闪式提取工艺用于桂枝茯苓胶囊的提取,具有高效、快速的特点。
桂枝茯苓胶囊;单因素试验;Box-Behnken设计;响应面法;闪式提取;工艺优化
桂枝茯苓胶囊为东汉张仲景《金匮要略》中古方桂枝茯苓丸的改进剂型,由桂枝、茯苓、牧丹皮、白芍和桃仁组成,诸药合用,达活血化瘀、消肿散结之功[1]。其还可与米非司酮联合用于治疗子宫肌瘤等[2],是治疗妇科疾病的首选良方。目前,现有的桂枝茯苓胶囊提取方法具有水提取时间长(4 h)、指标成分保留率低(约70%)、蒸汽耗能大等缺点。近几年,国内开始研究应用闪式提取技术提取中药的指标成分,该技术利用闪式提取器设备中内刃高速转动,并与外刃发生切割的过程中产生强力涡流,从而产生剧烈搅拌作用使指标成分快速转移至溶剂中,最终达到分离指标成分的目的。与传统煎煮提取方法比较,闪式提取技术提取中药有效成分具有快速、高效、节能、热稳定[3]等优点。但目前报道的闪式提取技术研究的对象多为单一中药材,用于中药复方提取的研究文献报道较少[4]。因此,笔者尝试利用闪式提取技术对中药复方桂枝茯苓胶囊的提取工艺进行改进,并期望为其他复方中药提供一项新的提取工艺技术。
1 材料
1.1 仪器与设备
JHBE-100闪式提取器(西安金南生物科技有限公司);2695高效液相色谱(HPLC)仪[美国Waters科技(上海)有限公司];H1650-W台式高速离心机(湖南湘仪实验室仪器开发有限公司);AG-135电子分析天平[瑞士梅特勒-托利多(上海)有限公司]。
1.2 药材、对照品与试剂
桂枝、茯苓、牡丹皮、白芍、桃仁饮片均购自江苏省连云港市康缘医药商业有限公司(批号分别为:Y1607054、Y1607047、Y160819、Y160805、Y1606045),经连云港康济大药房连锁有限公司吴舟执业药师鉴定,符合2015年版《中国药典》(一部)标准,均为真品;芍药苷、没食子酸、苯甲酸、苯甲酰芍药苷、肉桂酸、苦杏仁苷对照品(中国食品药品检定研究院,批号分别为:110736-201539、110831-201204、100419-201302、B-024120905、110786-200503、110820-201506,纯度分别为:96.4%、89.9%、100%、≥98%、≥98%、93.4%);三氟乙酸、乙腈、甲醇等为色谱纯;其余试剂均为分析纯。
2 方法与结果
2.1 苦杏仁苷的含量测定
2.1.1 色谱条件按2015年版《中国药典》(一部)“桃仁”项下苦杏仁苷含量测定方法[5]测定。以十八烷基硅烷键合硅胶为填充剂,甲醇-水(20∶80)为流动相,流速为1 mL/min,检测波长为218 nm,进样量为10 μL。取“2.1.2”和“2.1.3”项下对照品和供试品溶液进样分析,色谱图见图1。理论板数按苦杏仁苷峰计,应不低于2 500。
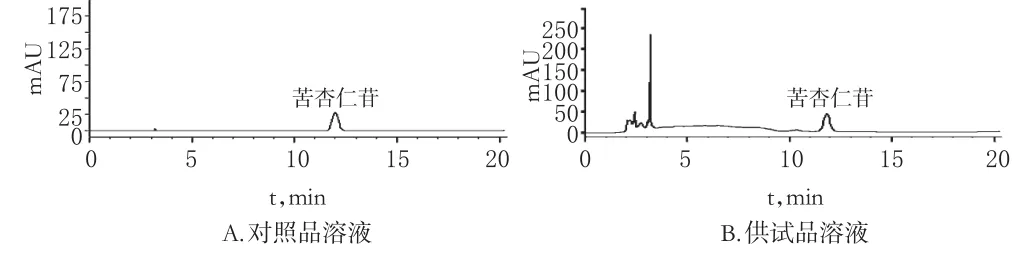
图1 苦杏仁苷的高效液相色谱图Fig1 HPLC chromatograms of amygdalin
2.1.2 对照品溶液的制备取苦杏仁苷对照品适量,精密称定,加50%乙醇制成260 μg/mL的对照品溶液。
2.1.3 供试品溶液的制备精密吸取单因素考察中内刃转速第一次试验的提取液1 mL至10 mL量瓶中,加50%乙醇稀释至刻度,摇匀,离心(转速:16 500 r/min,半径:90 mm,下同)5 min,取上清液,得供试品溶液。
2.1.4 线性关系考察分别精密吸取上述对照品溶液1、2、4、6、8、10 mL置于10 mL量瓶中,加50%乙醇定容至刻度,摇匀,即得系列对照品溶液。分别进样10 μL,以进样质量浓度为横坐标(x)、峰面积为纵坐标(y)绘制标准曲线,得回归方程为y=23.61x+19.64(r=0.999 5)。结果表明,苦杏仁苷检测质量浓度线性范围为26.0~260 μg/mL。
2.2 没食子酸、芍药苷、苯甲酸、肉桂酸、苯甲酰芍药苷的含量测定
2.2.1 色谱条件参考文献[6]及前期试验确定的色谱条件。以十八烷基硅烷键合硅胶为填充剂,色谱柱为Waters Symmetry C18(250 mm×4.6 mm,5 μm);以含0.02%三氟乙酸的水溶液为流动相A,以乙腈为流动相B,流速为1 mL/min,梯度洗脱(程序见表1);检测波长为230 nm;进样量为10 μL。分别取“2.2.2”和“2.2.3”项下混合对照品和供试品溶液进样分析。各相邻峰间分离度均大于1.5,理论板数按芍药苷峰计,应不低于4 000,色谱图见图2。

表1 梯度洗脱程序Tab1 Gradient elution program
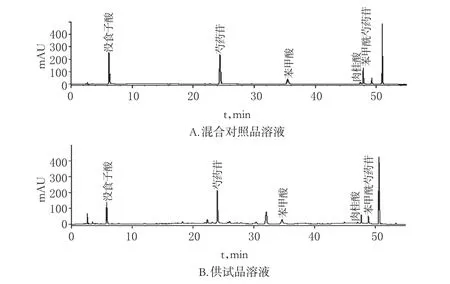
图2 没食子酸、芍药苷、苯甲酸、肉桂酸、苯甲酰芍药苷的高效液相色谱图Fig2 HPLC chromatograms of gallic acid,paeoniflorin,benzoicacid,cinnamicacidand benzoyl paeoniflorin
2.2.2 混合对照品溶液的制备分别取没食子酸、芍药苷、苯甲酸、肉桂酸、苯甲酰芍药苷对照品适量,精密称定,加50%甲醇制成质量浓度分别为101.5、260.6、30.7、22.4、58.3 μg/mL的混合对照品溶液,即得。
2.2.3 供试品溶液的制备精密吸取单因素考察中内刃转速第一次试验的提取液1 mL至10 mL量瓶中,加50%甲醇稀释至刻度,摇匀,离心5 min,取上清液,得供试品溶液。
2.2.4 线性关系考察分别精密吸取“2.2.2”项下混合对照品溶液1.0、2.0、4.0、6.0、8.0、10.0 mL置于10 mL量瓶中,加50%甲醇稀释至刻度,摇匀,即得系列对照品溶液。按“2.2.1”项下色谱条件分别进样10 μL,以进样质量浓度为横坐标(x)、峰面积为纵坐标(y)绘制标准曲线,得没食子酸、芍药苷、苯甲酸、肉桂酸、苯甲酰芍药苷的回归方程分别为y=13.975x+1.323 2(r=0.999 9)、y=13.068x-5.531 4(r=0.999 9)、y=49.391x-3.286 9(r=1.000 0)、y=89.04x+0.218 9(r=0.999 9)、y=51.09x+5.323(r=1.000 0)。结果表明,没食子酸、芍药苷、苯甲酸、肉桂酸、苯甲酰芍药苷的检测质量浓度线性范围分别为10.15~101.5、26.06~260.6、3.07~30.7、2.24~22.4、5.83~58.3 μg/mL,定量限分别为10.15、26.06、3.07、2.24、5.83 μg/mL。
2.2.5 精密度考察精密吸取“2.2.2”项下混合对照品溶液10 μL,连续进样6次。分别计算没食子酸、芍药苷、苯甲酸、肉桂酸、苯甲酰芍药苷峰面积的RSD,结果分别为1.01%、1.22%、1.05%、1.17%、1.08%(n=6)。
2.2.6 稳定性考察取“2.2.3”项下供试品溶液,分别在室温下放置0、4、8、12、16、20、24 h后进样分析。分别计算没食子酸、芍药苷、苯甲酸、肉桂酸、苯甲酰芍药苷峰面积的RSD,结果分别为1.12%、1.28%、1.20%、1.15%、0.98%(n=7)。
2.2.7 重复性考察取单因素考察中内刃转速第一次试验的提取液,按“2.2.3”项下方法制备成供试品溶液,共6份,进样测定。分别计算没食子酸、芍药苷、苯甲酸、肉桂酸、苯甲酰芍药苷峰面积的RSD,结果分别为2.08%、1.95%、2.37%、1.93%、2.04%(n=6)。
2.2.8 准确度考察量取已知含量的单因素考察中内刃转速第一次试验的提取液适量,加入定量的没食子酸、芍药苷、苯甲酸、肉桂酸、苯甲酰芍药苷对照品,按“2.2.3”项下方法制备成供试品溶液,进样测定并计算。结果,没食子酸、芍药苷、苯甲酸、肉桂酸、苯甲酰芍药苷平均加样回收率分别为99.31%、99.43%、100.03%、99.42%、100.01%,RSD分别为2.08%、1.98%、1.79%、2.04%、2.07%(n=6)。
2.3 闪式提取工艺考察指标的确定
根据闪式提取器的提取原理[7]及桂枝茯苓胶囊产品的性能特点,对其进行闪式提取工艺考察。所有试验药材均进行粗粉碎(16目,下同),每份试验用药材粗粉为1.2 kg(1个处方量),以水为提取溶剂,选择对闪式提取效果可能有影响的因素,如内刃转速、液固比、提取时间等进行考察。在单因素试验的基础上结合Box-Behnken设计-响应面法进行优化,得到各自试验提取液。由于桂枝茯苓胶囊药液中各指标成分[8-9]含量不同,其中芍药苷、苦杏仁苷含量较高,故各给予二者30%的权重比例;而没食子酸、苯甲酸、肉桂酸、苯甲酰芍药苷含量相对较低,故各给予10%的权重比例。权重共计100%。分别测定各指标成分含量并计算其转移率[转移率(%)=药液中指标成分总量/药材中指标成分总量×100%]。
按权重对各指标成分转移率进行综合评价,以综合评价值作为提取效果的评判依据。综合评价值=(芍药苷转移率×30%+苦杏仁苷转移率×30%+没食子酸转移率×10%+苯甲酸转移率×10%+肉桂酸转移率×10%+苯甲酰芍药苷转移率×10%)×100%。
2.4 单因素考察试验
2.4.1 内刃转速固定液固比为10∶1、提取时间为60 s,考察内刃转速(2 000、3 000、4 000、5 000、6 000 r/min)对各指标成分转移率的影响。结果,综合评价值分别为56.3%、73.8%、83.6%、85.3%、84.4%,故选择内刃转速4 000、5 000、6 000 r/min为后续优化试验的考察水平。2.4.2液固比固定内刃转速为5 000 r/min、提取时间为60 s,考察不同液固比(6∶1、8∶1、10∶1、12∶1、14∶1)对各指标成分转移率的影响。结果,综合评价值分别为72.3%、83.8%、85.6%、83.3%、79.5%。从生产效率及成本考虑,选择液固比为8∶1、10∶1、12∶1为后续优化试验的考察水平。
2.4.3 提取时间固定内刃转速为5 000 r/min、液固比为10∶1,考察不同提取时间(30、60、90、120、150 s)对各指标成分转移率的影响。结果,综合评价值分别为62.3%、83.2%、83.7%、83.1%、80.5%,故选择提取时间60、90、120 s为后续优化试验的考察水平。
2.5Box-Behnken设计
2.5.1 试验设计在单因素试验的基础上以内刃转速(A)、液固比(B)、提取时间(C)为考察因素,根据Box-Behnken设计原理[10-13],每个因素设3个水平,用代码值-1、0、1表示。因素与水平见表2。

表2 因素与水平Tab2 Factor and levels
2.5.2 试验结果与方差分析根据Box-Behnken设计方案,对桂枝茯苓胶囊闪式提取工艺进行试验。提取所得药液按“2.1.3”“2.2.3”项下方法制成供试品溶液,按“2.1.1”“2.2.1”项下色谱条件进样测定,分别计算苦杏仁苷、芍药苷、没食子酸、苯甲酸、苯甲酰芍药苷、肉桂酸转移率,按不同权重进行综合评价,试验结果见表3。采用Design-Expert 8.0.6软件对综合评价数据进行回归方差分析,结果见表4。

表3 Box-Behnken设计与结果Tab3 Box-Behnken design and results

表4 回归模型方差分析结果Tab4 Variance analysis result of regression model
表3中,试验1~12号为析因试验,13~17号为中心验证试验,以估计试验误差。对表3中综合评价数据进行二次多元回归拟合,综合评价值以Y表示,得回归方程:Y=84.972 00+1.786 25A+0.608 75B+0.187 50C+0.320 00AB-0.382 50AC+0.047 50BC-1.678 50A2-1.503 50B2-1.616 00C2。
由表4可知,一次项A及二次项A2、B2、C2对提取效果有极显著性影响;一次项B、C及交互项AB、AC、BC对提取效果无显著性影响。本试验模型的P>F且小于0.01,提示模型显著性较高;而失拟误差项的P>0.05,提示模型对试验拟合情况较好,试验误差小,可采用此模型对桂枝茯苓胶囊闪式提取效果进行分析和预测。
2.6 响应面法分析
利用Design-Expert 8.0.6软件,根据回归方程绘制不同影响因素对响应值(综合评价值)的三维曲线图[12],响应面图见图3。

图3 3个因素与综合评价值间的响应面三维图Fig3 Three-dimensional response surface of 3 factors and comprehensive evaluation value
根据Design-Expert 8.0.6软件及回归方程等求解得桂枝茯苓胶囊闪式提取最优工艺为内刃转速5 557 r/min、液固比10.522∶1、提取时间60.15 s,此时综合评价值的预测值为85.55%。从设备及实际可操作性考虑,对该最优工艺进行适当修正,即设定内刃转速5 600 r/min、液固比10.5∶1、提取时间60 s。
2.7 工艺验证
按修正工艺进行3批中试再验证试验,每份药材粗粉量均为1.2 kg。结果,综合评价均值为85.40%(RSD=0.51%,n=3),与预测值结果几乎一致,相对误差为0.15%。这提示建立的综合评价结果与内刃转速、液固比、提取时间之间关系的回归模型是科学、合理的。验证试验结果见表5。

表5 闪式提取工艺验证试验结果(%%)Tab5 Verification result of flash extraction technology(%%)
2.8 闪式提取与煎煮提取比较
为进一步比较桂枝茯苓胶囊闪式提取法与常规煎煮提取法的提取效果,首先对其煎煮提取工艺进行正交优化试验研究(具体内容略),得到优化后的煎煮提取工艺,然后按最优工艺进行放大验证试验(称取1.2 kg药材粗粉),在同等条件下比较煎煮提取与闪式提取的提取效果,结果见表6。

表6 桂枝茯苓胶囊闪式提取与煎煮提取效果比较Tab6 Comparison of effects of flash extraction and decocting extraction for Guizhi fuling capsule
由表6可知,闪式提取所用时间与煎煮提取用时比较大大缩短,溶剂用量也减少一半,且综合评价值明显更高。
通过单因素及响应面优化试验,确定闪式提取桂枝茯苓胶囊的最优工艺为以水为提取溶剂,设定内刃转速5 600 r/min、液固比10.5∶1、提取时间60 s。此优化工艺下,桂枝茯苓胶囊中指标成分转移率的综合评价值达85%左右,提取效果明显优于常规的煎煮提取。
3 讨论
闪式提取在常温下即可对中药中的指标成分进行提取,故能有效保护热敏性成分,最大限度地保留植物原有成分;提取时间短,数秒至几分钟内即可完成,提取速度远高于传统方法;且大大降低了能耗,从而降低了生产成本,操作简便、易行,使用安全可靠[14]。闪式提取法适用于中药各个部位、多种溶剂、多种成分的提取[3],
是一种具有发展潜力的新型提取技术。但目前该技术也有一定局限性,即该技术尚处在实验室阶段,且大多只针对单味药材进行研究。本试验尝试用该技术进行了复方中药有效成分的提取研究,结果显示该技术在复方中的应用也具有明显的优势。本研究为其他中药复方的提取研究提供了一种新思路、新方法,同时也为闪式提取技术向产业化过渡应用提供了技术支持,具有一定的参考意义。
[1] 秦泗涟,马利华,贾晓斌,等.桂枝茯苓方物质基础及其制剂质量控制模式研究进展[J].中国实验方剂学杂志,2011,17(13):270-272.
[2] 黄婉怡,刘锦,周立蓉,等.桂枝茯苓胶囊联合米非司酮治疗子宫肌瘤的临床观察[J].中国药房,2015,26(33):4641-4643.
[3] 黄越燕,谭荣德.闪式提取技术在中药成分提取中的研究进展[J].中国医院药学杂志,2015,35(1):83-87.
[4] 孟庆举,刘晓谦,杨华,等.闪式提取技术的研究进展[J].中国实验方剂学杂志,2013,19(19):349-355.
[5] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:277-278.
[6] 张艳海,张大伟,孟兆青,等.在线二维液相色谱法快速测定桂枝茯苓胶囊中芍药苷、丹皮酚、苦杏仁苷和肉桂酸的含量[J].中国中药杂志,2013,38(23):4088-4092.
[7] 陈菲,盛柳青,麻佳蕾.松针中原花青素的闪式提取及其抗氧化活性[J].中国医药工业杂志,2014,45(2):120-123.
[8] 王振中,范麒如,窦霞,等.桂枝茯苓胶囊对大鼠体外培养卵巢颗粒细胞增殖的影响及物质基础评价[J].中国中药杂志,2009,34(10):1307-1309.
[9] 王振中,范麒如,窦霞,等.桂枝茯苓胶囊抑制小鼠离体子宫收缩效应及其物质基础评价[J].中草药,2009,40(4):609-611.
[10] 郭树琴,吴胜举,李岱.响应面法优化超声提取绿茶茶多酚工艺[J].生物加工过程,2009,7(1):39-43.
[11] 徐璐,汪涛,郭巧生,等.响应面法优化超声辅助法提取昆仑雪菊色素的工艺研究[J].中国中药杂志,2014,39(24):4792-4797.
[12] 王正宽,刘圆,周茆,等.中试规模下Box-Behnken法优化延胡索微波提取工艺[J].中草药,2015,46(16):2394-2399.
[13] 范成杰,江道峰,凌宗士.响应面法优化黄芩中黄芩苷闪式提取工艺[J].中国实验方剂学杂志,2012,18(6):48-51.
[14] 李精云,刘延泽.组织破碎提取法在中药研究中的应用进展[J].中草药,2011,42(10):2145-2149.
Optimization of Flash Extraction Technology for Guizhi Fuling Capsule by Box-Behnken Design-response Surface Method
WANG Zhengkuan1,2,3,LIU Yuan1,2,3,SHI Xiaomeng1,2,3,WANG Zhenzhong1,2,3,XIAO Wei1,2,3(1.Kanion Modern Chinese Medicine Research Institute,Jiangsu Kanion Pharmaceutical Co.,Ltd.,Jiangsu Lianyungang 222047,China;2.State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process,Jiangsu Lianyungang 222047,China;3.The Key Laboratory for the New-tech Research of TCM Extraction and Purification,Jiangsu Lianyungang 222047,China)
OBJECTIVE:To optimize the flash extraction technology for Guizhi fuling capsule.METHODS:Using blade speed,liquid-solid ratio,extraction time as investigation factors,using the comprehensive evaluation values consisting of transfer rates of gallic acid,paeoniflorin,benzoic acid,cinnamic acid,benzoyl paeoniflorin,amygdalin as investigation index,single factor test was combined with Box-Behnken design-response surface method to optimize the flash extraction technology for Guizhi fuling capsule.Verification test was conducted and compared with conventional decoction extraction method(extracting twice,totally 240 min).RESULTS:The optimal flash extraction technology for Guizhi fuling capsule was using water as extraction solvent with blade speed of 5 600 r/min and liquid-solid ratio of 10.5∶1,extracting for 60 s.The average comprehensive evaluation value of verification test was 85.40%(n=3),with relative error of 0.15%to the predicted value(85.55%),higher than decoction extraction method(72.65%).CONCLUSIONS:Optimized flash extraction technology for Guizhi fuling capsule is efficient and rapid.
Guizhi fuling capsule;Single factor test;Box-Behnken design;Response surface method;Flash extraction;Technology extraction
R284.2
A
1001-0408(2017)31-4429-05
DOI 10.6039/j.issn.1001-0408.2017.31.28
国家“重大新药创制”科技重大专项——现代中药创新集群与数字制药技术平台课题(No.2013ZX09402203)
*高级工程师。研究方向:中药新技术、新工艺。电话:0518-81152363。E-mail:wangzk781@126.com
#通信作者:研究员级高级工程师,博士。研究方向:中药新药的研究与开发。电话:0518-81152367。E-mail:Kanionlunwen@163.com
2017-03-27
2017-06-14)
(编辑:刘萍)

