白藜芦醇对高血脂模型小鼠的预防作用和对模型金黄地鼠的改善作用研究
郜娜,杨庆宇(1.郑州大学附属肿瘤医院/河南省肿瘤医院药学部,郑州450008;.郑州人民医院药学部,郑州450053)
白藜芦醇对高血脂模型小鼠的预防作用和对模型金黄地鼠的改善作用研究
郜娜1*,杨庆宇2(1.郑州大学附属肿瘤医院/河南省肿瘤医院药学部,郑州450008;2.郑州人民医院药学部,郑州450053)
目的:研究白藜芦醇对高血脂模型小鼠的预防作用和对模型金黄地鼠(以下简称地鼠)的改善作用。方法:以高脂高胆固醇饲料饲养诱导高血脂动物模型。将小鼠和地鼠均分为模型组和白藜芦醇低、中、高剂量组(小鼠给予40、80、160 mg/kg,地鼠给予25、50、100 mg/kg),每组10只,同时设立10只相应动物为正常对照组。除正常对照组动物喂食正常饲料和ig生理盐水外,其余小鼠在喂食高脂高胆固醇饲料的同时ig相应药物;其余地鼠先建模2周,成模后再ig相应药物,给药期间继续喂食高脂高胆固醇饲料。持续给药4周,每周检测各组小鼠和地鼠血清中总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)水平,给药4周后检测各组小鼠和地鼠血清中前蛋白转化酶枯草溶菌素9(PCSK9)mRNA及蛋白、微小RNA-27a(miRNA-27a)表达,以及小鼠肝组织中低密度脂蛋白受体(LDLR)蛋白表达。结果:与正常对照组比较,模型组小鼠从给药2周后开始血清中TC、LDL-C、PCSK9 mRNA及蛋白、miRNA-27a水平均明显升高(P<0.05),肝组织中LDLR蛋白水平明显降低(P<0.05);模型组地鼠给药期间血清中TC、LDL-C、PCSK9 mRNA及蛋白、miRNA-27a水平均明显升高(P<0.05)。与模型组比较,各给药组小鼠和地鼠上述指标均明显改善(P<0.05),且与剂量呈正相关。结论:白藜芦醇对高血脂模型小鼠有预防作用,对模型地鼠有改善作用。其机制可能是通过下调血清中miRNA-27a表达与PCSK9蛋白表达,进而升高肝组织中LDLR蛋白水平,最终降低血清中LDL-C水平。
白藜芦醇;高血脂;小鼠;金黄地鼠;前蛋白转化酶枯草溶菌素9;微小RNA-27a;低密度脂蛋白受体
心脑血管疾病是目前造成全球人口死亡的最重要原因之一。动脉粥样硬化是造成心脑血管疾病的主要原因,其进程缓慢、发展隐匿,可以长期无任何症状,因此通常不容易引起人们的注意。但随着动脉粥样硬化的不断发展,血管壁上沉积着的“小斑块”逐渐增多、增大,堵塞血管,使血流变慢,严重时导致血流中断[1]。血液中显著升高的低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDL-C)水平是动脉粥样硬化的最主要诱因[2]。LDL-C受体(LDL-C receptor,LDLR)可将血液中多余的LDL-C转移到肝等器官组织,维持血液中LDL-C稳态。有研究发现,前蛋白转化酶枯草溶菌素9(Proprotein convertase subtilisin/kexin type 9,PCSK9)可与LDLR结合,并促使后者在溶酶体中降解,从而减少了靶器官中LDLR的水平及其循环时间,使得血液中高水平的LDL-C不能被及时移除,从而诱发高胆固醇血症,最终诱发动脉粥样硬化[2-3]。因此,PCSK9是降血脂及抗动脉粥样硬化药物开发的重要及热门的靶点之一。
微小RNA(microRNAs,miRNAs)被证实在维持胆固醇稳态相关基因调节方面具有重要的作用,是针对高胆固醇血症药物开发的重要靶点[4]。miRNAs是一类由约22个核苷酸组成的单链RNA,可以调节相关基因的转录水平[5]。Alvarez ML等[6]研究表明,miRNA-27a在细胞水平上可以降低LDLR水平,使胆固醇代谢紊乱。
有研究表明,白藜芦醇(Resveratrol)在高蔗糖饲养的模型大鼠中可降低血脂、增加机体抗氧化能力[7]。另有报道显示,白藜芦醇可改善胰岛素抵抗,降低糖尿病模型小鼠的血糖和血脂。本研究以高脂高胆固醇饲料饲养小鼠及金黄地鼠(以下简称地鼠)建立高血脂模型,探讨白藜芦醇对模型小鼠的预防作用和对模型地鼠的改善作用,同时揭示其是否通过调节miRNA-27a/PCSK9通路影响LDLR水平,从而发挥维持胆固醇稳态的作用。
1 材料
1.1 仪器
CX31-P光学显微镜(日本Olympus公司);XS205分析天平、MS12001L电子秤(瑞士Mettler Toledo公司);Sorvall Legend Micro 17XS205低温离心机、Multiskan FC酶标仪(美国Thermo公司);CFX96荧光定量聚合酶链式反应(RT-PCR)仪和Mini-PROTEAN®Tetra Cell蛋白电泳及显影系统(美国Bio-Rad公司)。
1.2 药品与试剂
白藜芦醇(美国Sigma公司,批号:R5010,纯度:99%);高脂高胆固醇饲料(美国Research Diet公司,批号:D12336,成分:46%碳水化合物、16%脂肪、1.25%胆固醇);总胆固醇(Total cholesterol,TC)和LDL-C试剂盒(南京建成生物工程研究所);小鼠PCSK9酶联免疫吸附(ELISA)试剂盒(美国R&D公司);LDLR抗体(美国Biovision公司);兔抗地鼠PCSK9抗体(美国GenScript公司);β-肌动蛋白(β-actin,美国Cell Signaling公司);兔免疫球蛋白G(IgG)磁珠(美国eBioscience公司)。
1.3 动物
50只4~6周龄清洁级C57BL/6J小鼠,♂,体质量18~22 g;60只6~8周龄清洁级叙利亚金黄地鼠,♂,体质量80~100 g。动物均购自北京维通利华实验动物技术有限公司,生产许可证号均为SCXK(京)2012-0001。
2 方法
2.1 分组、造模与给药
2.1.1 小鼠所有小鼠饲养于清洁级环境中,保持环境湿度为55%~65%,温度为25℃,并且维持12 h/12 h明暗交替。适应性喂养1周后,取40只小鼠随机分为模型组和白藜芦醇低、中、高剂量组,每组10只。模型组小鼠ig等体积生理盐水;白藜芦醇低、中、高剂量组小鼠分别ig 40、80、160 mg/kg的白藜芦醇溶液。上述4组小鼠给药期间以高脂高胆固醇饲料饲养直至实验结束。另取10只小鼠饲以正常饲料,ig等体积生理盐水,作为正常对照组。
2.1.2 地鼠所有地鼠饲养于清洁级环境中,保持环境湿度为55%~65%、温度为25℃、12 h/12 h的明暗交替。适应性喂养1周后,取40只地鼠以高脂高胆固醇饲料饲养复制高血脂模型,2周后40只地鼠的LDL-C值均在3.87~7.69 mmol/L范围内,随后将其随机分为模型组和白藜芦醇低、中、高剂量组,每组10只。模型组地鼠ig等体积生理盐水;白藜芦醇低、中、高剂量组地鼠分别ig 25、50、100 mg/kg的白藜芦醇溶液。上述4组地鼠给药期间以高脂高胆固醇饲料饲养直至实验结束。另取10只地鼠饲以正常饲料,ig等体积生理盐水,作为正常对照组。
本实验中,小鼠及地鼠给药剂量均根据实验室前期研究结果确定,给药周期均为4周。
2.2 血样采集与血脂检测
各组小鼠及地鼠分别于给药前(0周)和给药1、2、3、4周后,禁食不禁水12 h,经眼底静脉窦采血50 μL,1 500 r/min离心(离心半径10 cm)15 min,取上层血清。按照试剂盒说明书分别检测血清中TC和LDL-C水平。
2.3 血清中PCSK9 mRNA和miRNA-27a表达的检测
末次给药后,各组小鼠和地鼠均采用Trizol法抽提血清总RNA,进行反转录。反转录反应体系:总RNA 50~5 000 ng、随机通用引物2µL,1 pmol/L、2×反转录反应体系混合物10µL,混合反转录酶1µL,加去RNA酶水至反应体系为20µL。反应条件:轻轻混匀,42℃孵育反转录30 min;85℃加热5 min失活反转录酶,4℃冷却。所得cDNA于-20℃保存,备用。采用RT-PCR检测小鼠血清中PCSK9 mRNA、miRNA-27a表达与地鼠血清中PCSK9 mRNA表达,以U6作为内参。引物序列:小鼠miRNA-27a上游引物为5′-UUCACAGUGGCU-AAGUUCCGC-3′,下游引物为5′-UUCACAGUGGCUAAGUUCUGC-3′,扩增长度为178 bp;小鼠PCSK9上游引物为5′-TTGCAGCAGCTGGGAACTT-3′,下游引物为5′-CCGACTGTGATGACCTCTGGA-3′,扩增长度为76 bp;地鼠PCSK9上游引物为5′-TGCTCCAGAGGTCATCACAG-3′,下游引物为5′-GTCCCACTCTGTGACATGAAG-3′,扩增长度为168 bp;U6上游引物为5′-CTCGCTTCGGCAGCACATA-3′,下游引物为5′-AACGCTTCACGAATTGCG-3′,扩增长度为798 bp。PCR反应体系(20µL):SYBR Green Mix染料9µL,cDNA模板2µL,上、下游引物各0.8µL(终浓度200 nmol/L),纯水7.4µL。PCR反应条件:95℃预变性10 min;95℃变性15 s,60℃退火1 min,72℃延伸1 min,40个循环;72℃延伸10 min。以2-ΔΔct计算相对表达量,其中ct为目标扩增产物达到设定阈值所需的循环数。
2.4 血清中PCSK9蛋白表达的检测
2.4.1 小鼠按小鼠PCSK9 ELISA试剂盒说明书操作,检测各组小鼠末次给药后血清中PCSK9蛋白含量。
2.4.2 地鼠由于无市售地鼠PCSK9 ELISA试剂盒,本研究参考文献[8]中方法,以小鼠PCSK9 ELISA试剂盒检测各组地鼠血清中PCSK9蛋白表达,同时采用Western blot法检测地鼠血清中PCSK9蛋白表达进行验证。取10 μL末次给药后地鼠血清样品,裂解、电泳转膜后,加入2 μg PCSK9抗体,4℃下孵育1 h;加入50 μL兔IgG磁珠,4℃下持续缓慢振荡过夜,离心弃上清,RIPA裂解液洗磁珠3次,再次离心;加100 μL十二烷基硫酸钠(SDS)上样缓冲液,充分涡旋后煮样10 min;加入增强化学发光(ECL)试剂显色,以β-actin为内参检测PCSK9蛋白表达。
2.5 肝组织中LDLR蛋白表达检测
取血结束后,处死小鼠,取肝组织50 mg,分别在0.5 mL蛋白裂解液中匀浆3次,每次间隔30 s。将匀浆液在4℃下3 000×g离心15 min,收集上清,4℃下12 000×g离心15 min,再次收集上清,即为总蛋白。采用Bradford法计算各样本中蛋白浓度。蛋白样品或免疫共沉淀收集的样品经上样缓冲液处理后,进行5%~15%SDS-聚丙烯酰胺凝胶电泳(PAGE),4℃下100 V电泳转膜2 h。转移膜经以5%TBST缓冲液稀释的脱脂奶粉室温封闭2 h后,加入LDLR抗体(稀释比例为1∶1 000),4℃过夜,用TBST缓冲液振荡冲洗3遍;加入二抗(稀释比例为1∶2 000),室温下孵育2 h,用TBST缓冲液振荡冲洗3遍。转移膜最后用ECL试剂显色,凝胶成像仪拍照,Quantity One软件分析。用样品的吸光度与内参β-actin的吸光度的比值表示蛋白表达水平。
2.6 统计学方法
3 结果
3.1 小鼠和地鼠血清中TC及LDL-C
与正常对照组比较,模型组小鼠给药1周后血清中TC、LDL-C水平均升高,但差异无统计学意义(P>0.05),给药2、3、4周后血清中TC、LDL-C水平均明显升高(P<0.05);地鼠给药1、2、3、4周后血清中TC、LDL-C水平均明显升高(P<0.05)。与模型组比较,各给药组小鼠和地鼠上述指标均明显改善(P<0.05),且与剂量呈正相关。给药4周后,白藜芦醇高剂量组地鼠血清中TC、LDL-C水平均趋于正常对照组水平。该结果提示,白藜芦醇对高血脂小鼠有预防作用,对高血脂地鼠有改善作用。各组小鼠和地鼠给药不同时间后血清中TC、LDL-C水平的测定结果见图1。
3.2 小鼠和地鼠血清中PCSK9 mRNA
与正常对照组比较,模型组小鼠和地鼠血清中PCSK9 mRNA表达水平均明显升高(P<0.05)。与模型组比较,各给药组小鼠和地鼠血清中PCSK9 mRNA表达水平均明显降低(P<0.05),且与剂量呈正相关。各组小鼠和地鼠血清中PCSK9 mRNA表达的测定结果见图2。
3.3 小鼠和地鼠血清中miRNA-27a
与正常对照组比较,模型组小鼠和地鼠血清中miRNA-27a表达水平明显升高(P<0.05)。与模型组比较,各给药组小鼠和地鼠血清中miRNA-27a表达水平明显降低(P<0.05),且与剂量呈正相关。各组小鼠和地鼠血清中miRNA-27a表达的测定结果见图3。
3.4 小鼠和地鼠血清中PCSK9蛋白

图2 各组小鼠和地鼠血清中PCSK9 mRNA表达的测定结果(±s,n=10)Fig2 Results of PCSK9 mRNA expression in serum of mice and hamsters in each group(±s,n=10)

图3 各组小鼠和地鼠血清中miRNA-27a表达的测定结果(±s,n=10)Fig3 Results of miRNA-27a expression in serum of mice and hamsters in each group(±s,n=10)
与正常对照组比较,模型组小鼠和地鼠血清中PCSK9蛋白表达水平明显升高(P<0.05)。与模型组比较,各给药组小鼠和地鼠血清中PCSK9蛋白表达水平明显降低(P<0.05),且与剂量呈正相关。各组小鼠和地鼠血清中PCSK9蛋白含量的ELISA测定结果见图4;各组地鼠血清中PCSK9蛋白表达的电泳图见图5,测定结果见图6。

图4 各组小鼠和地鼠血清中PCSK9蛋白含量的ELISA测定结果(±s,n=10)Fig4 Results o f PCSK9 protein content in serum of mice and hamsters in each group by ELISA(±s,n=10)
3.5 小鼠肝组织中LDLR蛋白

图5 各组地鼠血清中PCSK9蛋白表达的电泳图Fig5 Electrophoresis charts of PCSK9 protein expressionin serum of hamsters in each group

图6 各组地鼠血清中PCSK9蛋白表达的测定结果(±s,n=10)Fig6 Results of PCSK9 protein expression in serum of hamsters in each group(±s,n=10)
与正常对照组比较,模型组小鼠肝组织中LDLR蛋白表达水平明显降低(P<0.05)。与模型组比较,各给药组小鼠肝组织中LDLR蛋白表达水平均明显升高(P<0.05),且与剂量呈正相关。各组小鼠肝组织中LDLR蛋白表达的电泳图见图7,测定结果见图8。

图7 各组小鼠肝组织中LDLR蛋白表达的电泳图Fig7 Electrophoresis charts of LDLR protein expressionin liver tissue of mice in each group
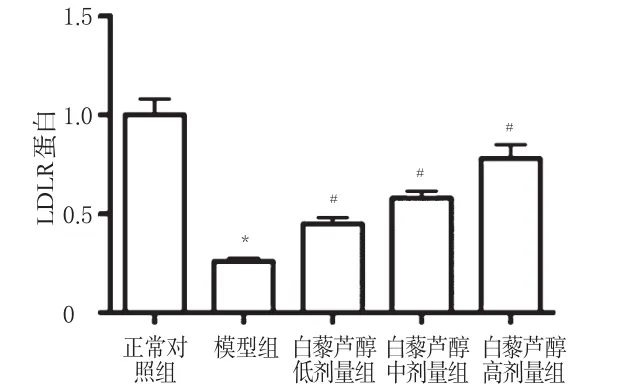
图8 各组小鼠肝组织中LDLR蛋白表达的测定结果(±s,n=10)Fig8 Results of LDLR protein expression in liver tissue of mice in each group(±s,n=10)
4 讨论
目前已经证实多种miRNAs是胆固醇稳态转录后调节因子,包括miRNA-122、miRNA-370和miRNA-33。最新研究表明,miRNA-27家族(包括miRNA-27a和miR-NA-27b)是胆固醇和脂质代谢的关键调节因子。Choi JE等[9]研究表明,miRNA-27a可通过下调LDLR表达降低丙肝病毒的感染,并证实过表达miRNA-27a可以下调LDLR的表达。尽管其研究明确证实,miRNA-27a可以下调LDLR的表达,但是其没有阐明miRNA-27a调节LDLR表达的具体作用机制。
PCSK9是一种新型的胆固醇稳态调节因子,其可在翻译后调节LDLR水平。PCSK9主要由肝、小肠和肾分泌。在血浆中,PCSK9直接与肝脏LDLR胞外结构域表皮生长因子(EGF)-A结合,之后以PCSK9-LDLR复合体进入到细胞,LDLR在溶酶体内被降解,最终导致血清中LDL-C水平升高。在人体内,PCSK9功能获得性突变可致高胆固醇血症和动脉粥样硬化的发生;相反,PCSK9功能失去性突变可显著降低血清中LDL-C水平,从而预防心脑血管疾病的发生。
本研究采用高脂高胆固醇饲料饲养诱导小鼠及地鼠高血脂模型,以考察白藜芦醇对高血脂的防治作用。小鼠被广泛地用于高血脂模型的复制,采用高脂或高脂高碳水化合物饲料长期饲养建立饮食诱导肥胖,小鼠会呈现明显的高血脂、肥胖和葡萄糖耐量受损[10]。然而,小鼠体内的血浆载脂蛋白主要是高密度脂蛋白(HDL),而不同于人类(载脂蛋白主要是低密度脂蛋白),不能很好地模拟人类高血脂症的病理特征[11]。近年来,叙利亚金黄地鼠被广泛应用于脂蛋白代谢疾病的研究[12],其主要载脂蛋白为非HDL,血浆中能表达胆固醇酯转运蛋白(CETP),肝可通过LDLR介导LDL-C的摄取,肝和肠道可分别特定地产生载脂蛋白B-100,肠道可产生载脂蛋白B-48,其脂代谢谱与人类较为接近。当喂食富含胆固醇的饲料时,地鼠可快速发展成高血脂症和高甘油三酯血症,是研究脂代谢的理想动物模型。由本研究结果可以看出,白藜芦醇可以显著降低高血脂模型小鼠及地鼠血清中的TC、LDL-C和PCSK9 mRNA及蛋白水平,下调小鼠肝组织中LDLR蛋白表达;同时,白藜芦醇能显著降低高血脂模型小鼠及地鼠血清中miRNA-27a表达水平。由此可见,白藜芦醇可通过下调血清miRNA-27a和PCSK9蛋白表达,进而升高肝LDLR蛋白水平,最终降低血清中LDL-C水平。
综上所述,本研究结果显示,白藜芦醇下调miRNA-27a表达的同时降低PCSK9水平,增加LDLR蛋白表达,最终降低血清中LDL-C水平。以上结果证实白藜芦醇是治疗高脂血症的有效药物,具有很好的临床开发前景。
[1] Contu R,Latronico MV,Condorelli G.Circulating micro-RNAs as potential biomarkers of coronary artery disease:a promise to be fulfilled?[J].Circ Res,2010,107(5):573-574.
[2] Go GW,Mani A.Low-density lipoprotein receptor(ldlr)family orchestrates cholesterol homeostasis[J].Yale J Biol Med,2012,85(1):19-28.
[3] Goldstein JL,Brown MS.The LDL receptor[J].Arterioscler Thromb Vasc Biol,2009,29(4):431-438.
[4] Fernandez-Hernando C,Moore KJ.MicroRNA modulation of cholesterol homeostasis[J].Arterioscler Thromb Vasc Biol,2011,31(11):2378-2382.
[5] Bartel DP.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[6] Alvarez ML,Khosroheidari M,Eddy E,et al.MicroRNA-27a decreases the level and efficiency of the LDL receptor and contributes to the dysregulation of cholesterol homeostasis[J].Atherosclerosis,2015,242(2):595-604.
[7] 张小华.白藜芦醇对慢性肝损伤模型小鼠的肝保护作用研究[J].中国药房,2011,22(17):1560-1561.
[8] Dong B,Singh AB,Liu J,et al.Hepatic HNF1 transcription factors control the induction of PCSK9 mediated by rosuvastatin in normolipidemic hamsters[J].Int J Mol Med,2017,39(3):749-756.
[9] Choi JE,Hur W,Kim JH,et al.MicroRNA-27a modulates HCV infection in differentiated hepatocyte-like cells from adipose tissue-derived mesenchymal stem cells[J].PLoS One,2014,9(5):e91958.
[10] Hansen G,Jelsing J,Vrang N.Effects of liraglutide and sibutramine on food intake,palatability,body weight and glucose tolerance in the gubra DIO-rats[J].Acta Pharmacol Sin,2012,33(2):194-200.
[11] Kennedy AJ,Ellacott KL,King VL,et al.Mouse models of the metabolic syndrome[J].Dis Model Mech,2010,3(3/4):156-166.
[12] Dillard A,Matthan NR,Lichtenstein AH.Use of hamster as a model to study diet-induced atherosclerosis[J].Nutr Metab:Lond,2010,doi:10.1186/1743-7075-7-89.
Study on the Preventive Effect of Resveratrol on Model Mice and Improvement Effect on Model Golden Hamsters with Hyperlipidemia
GAO Na1,YANG Qingyu2(1.Dept.of Pharmacy,the Affiliated Tumor Hospital of Zhengzhou University/Henan Cancer Hospital,Zhengzhou 450008,China;2.Dept.of Pharmacy,Zhengzhou People’s Hospital,Zhengzhou 450053,China)
OBJECTIVE:To study the preventive effect of resveratrol on model mice and improvement effect on model golden hamsters(shorter for hamsters)with hyperlipidemia.METHODS:Hyperlipidemia animal models were induced by using high-fat and high-cholesterol diet.Mice and hamsters were both randomly divided into model group and resveratrol low-dose,medium-dose,highdose groups(40,80,160 mg/kg for mice,25,50,100 mg/kg for hamsters),10 in each group.10 corresponding animals were selected as normal control group.Except that normal control group was fed normal diet and intragastrically administrated normal saline,other mice were intragastrically administrated relevant medicines when fed high-fat and high-cholesterol diet;other hamsters were firstly modeled for 2 weeks and intragastrically administrated relevant medicines after modeling.High-fat and high-cholesterol diet was fed during administration.It was administrated for 4 weeks.Total cholesterol(TC)and low density lipoprotein cholesterol(LDL-C)levels in serum of mice and hamsters were detected every week.After 4 weeks,pre-protein converting enzyme subtilisin 9(PCSK9)mRNA and protein expression,microRNA-27a(miRNA-27a)expression in serum of mice and hamsters,and low density lipoprotein receptor(LDLR)protein expression in liver tissue of mice were detected.RESULTS:Compared with normal control group,the TC,LDL-C,PCSK9 mRNA and protein,miRNA-27a levels of mice in model group were obviously increased after 2 weeks of administration(P<0.05);LDLR protein level in liver tissue was obviously decreased(P<0.05).TC,LDL-C,PCSK9 mRNA and protein,miRNA-27a levels of hamsters in model group were obviously increased(P<0.05).Compared with model group,above-mentioned indexes of mice and hamsters in each administration group were obviously improved(P<0.05),which were positively correlated with dose.CONCLUSIONS:Resveratrol has preventive effect on model mice and improvement effect on model golden hamsters with hyperlipidemia.The mechanism may be down-regulating miRNA-27a expression and PCSK9 protein expression in serum,to increase LDLR protein level in liver tissue,and finally reduce LDL-C level.
Resveratrol;Hyperlipidemia;Mice;Golden hamsters;Pre-protein converting enzyme subtilisin 9;MicroRNA-27a;Low density lipoprotein receptor
R965;R972+.6
A
1001-0408(2017)31-4393-05
DOI 10.6039/j.issn.1001-0408.2017.31.19
*主管药师。研究方向:医院药学。电话:0371-65587016。E-mail:gaona6677@126.com
2017-03-26
2017-06-27)
(编辑:邹丽娟)

