线粒体Omi/HtrA2信号通路参与人脑挫裂伤后神经细胞凋亡的研究
汤蓓 石键 周玲 沈红卫 吴慧平 胡佳元 郑绍俭
线粒体Omi/HtrA2信号通路参与人脑挫裂伤后神经细胞凋亡的研究
汤蓓 石键 周玲 沈红卫 吴慧平 胡佳元 郑绍俭
目的揭示人脑急性创伤性脑损伤后Omi/HtrA2介导的神经细胞凋亡线粒体途径的激活。方法选择100例脑外伤开颅手术中获得的脑挫裂伤脑组织作为外伤组,另外选择100例脑出血患者手术径路中获得的正常脑组织作为对照组,采用流式细胞仪检测神经细胞凋亡,采用Western-blot检测Omi/HtrA2、X染色体连锁凋亡抑制蛋白(XIAP)、pro-caspase 3、pro-caspase 9和剪切聚腺苷二磷酸-核糖多聚酶(PARP)表达,采用四肽荧光底物法检测caspase 3和caspase 9活性。结果外伤组脑组织凋亡神经细胞比例、Omi/HtrA2、pro-caspase 3、pro-caspase 9和剪切PARP表达及caspase 3和caspase 9活性较对照组显著升高(均P<0.01),外伤组脑组织XIAP表达较对照组显著下降(P<0.01)。外伤组脑组织Omi/HtrA2表达与凋亡神经细胞比率、pro-caspase 3、pro-caspase 9和剪切PARP表达及caspase 3和caspase 9活性呈显著正相关(均P<0.01),与XIAP表达呈显著负相关(P<0.01);外伤组脑组织XIAP表达与凋亡神经细胞比率、pro-caspase 3、pro-caspase 9和剪切PARP表达及caspase 3和caspase 9活性呈显著负相关(均P<0.01)。结论Omi/HtrA2介导的线粒体途径可能参与人急性创伤性脑损伤后神经细胞凋亡过程。
人类创伤性脑损伤神经细胞凋亡Omi/HtrA2
线粒体凋亡途径是急性创伤性脑损伤后神经细胞凋亡的主要途径之一[1-3]。Omi/HtrA2作为一种线粒体丝氨酸蛋白酶,可降解染色体连锁凋亡抑制蛋白(XIAP),解除对caspase蛋白的活性抑制,从而激发细胞凋亡[4-11]。动物实验证实,Omi/HtrA2介导的线粒体信号通路参与了脓毒症、癫痫和脑缺血/灌注损伤后神经细胞凋亡过程[12-14]。本研究通过检测人脑挫裂伤脑组织凋亡神经细胞,观察Omi/HtrA2、XIAP、剪切聚腺苷二磷酸-核糖多聚酶(PARP)、pro-caspase 3和pro-caspase 9等表达情况,揭示人脑急性脑损伤后Omi/HtrA2介导的神经细胞凋亡线粒体信号途径的激活,从而为临床急性脑损伤病理生理机制和分子治疗的研究提供新方向。
1 对象和方法
1.1 对象收集2013年1月至2016年6月建德市第一人民医院经开颅手术治疗的脑挫裂伤患者共100例(外伤组),男60例,女40例,年龄18~78(44.7±14.8)岁。选择同期开颅手术治疗的高血压性基底节区脑出血患者100例作为对照组,男56例,女44例,年龄41~78(58.0±11.4)岁。外伤组脑标本为开颅手术中脑挫裂伤组织,对照组脑标本为手术径路中正常脑组织。两组患者均未合并其他部位严重外伤、神经系统疾病、恶性肿瘤、严重感染及免疫性疾病。两组患者性别、年龄比较差异均无统计学意义(均P>0.05)。本研究经建德市第一人民医院伦理委员会同意,所有家属均签署知情同意书。
1.2 神经细胞凋亡检测粉碎脑组织后,用尼龙网过滤细胞团块,离心后弃去上清液,然后用700ml/L乙醇固定,由杭州柯帝生物技术有限公司采用流式细胞仪(美国BD公司FACSCB flow cytometer)检测凋亡神经细胞。应用Cell Quest软件获取细胞10 000个,进行凋亡细胞计数。以Mod Fit软件进行凋亡峰拟合及细胞周期分析并绘制DNA分布图,G1期前的G1亚峰(Ap)即为凋亡峰,结果以凋亡百分数表示。
1.3 蛋白表达的检测制作脑组织匀浆,由杭州柯帝生物技术有限公司采用Western-blot检测脑组织Omi/HtrA2、XIAP、剪切PARP、pro-caspase 3和pro-caspase 9等表达情况。采用二辛可宁酸法测定蛋白浓度,50μg蛋白经电泳后,电转移至PVDF膜上,5%脱脂奶粉Tris 0.9%氯化钠溶液和吐温20缓冲液(TBST)室温封闭1h;加入相应单克隆抗体4℃孵育过夜,TBST洗膜3次;加入HRP标记的IgG二抗室温摇床孵育1h,TBST洗膜3次;化学发光试剂作用5min,X光胶片曝光。冲洗并扫描后结果用Quality one软件分析杂交条带灰度值,以β-actin水平为内对照,计算相对灰度值,即为蛋白表达水平。
1.4 蛋白活性的检测取脑组织制作匀浆,由杭州柯帝生物技术有限公司采用四肽荧光底物法检测caspase-3和caspase-9蛋白活性。取脑组织匀浆100μl和caspase-3底物AC-DEVD-AMC或caspase-9底物ACLEHD-AFC 10μl,加入HEPES缓冲液至1ml,37℃孵育1 h。使用荧光分光光度计在激发波长400nm,释放波长505nm处测定荧光强度,以未加脑组织时的荧光强度为参照值,计算荧光强度,结果以相对荧光强度表示。
1.5 统计学处理应用SPSS19.0统计软件,计量资料以表示,组间比较采用t检验;计数资料组间比较采用χ2检验;采用Pearson相关分析揭示各变量间的关系。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者脑组织各指标的比较外伤组脑组织凋亡神经细胞比例、Omi/HtrA2、pro-caspase 3、pro-caspase 9和剪切PARP表达及caspase 3和caspase 9活性较对照组均明显升高(均P<0.01),外伤组脑组织XIAP表达较对照组明显下降(P<0.01),见图1、表1。
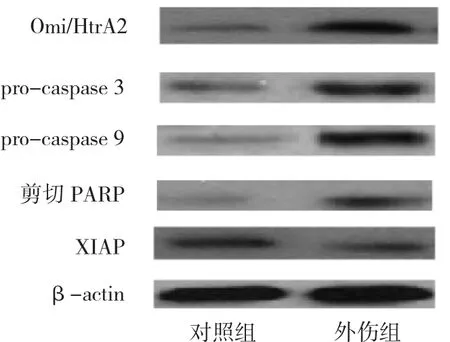
图1 两组脑组织Omi/HtrA2、XIAP、pro-caspase 3、pro-caspase 9和剪切PARP表达的比较
2.2 外伤组各指标的相关性分析外伤组脑组织Omi/HtrA2表达与凋亡神经细胞比例、pro-caspase 3、procaspase 9和剪切PARP表达及caspase 3和caspase 9活性均呈正相关性(r=0.533、0.529、0.583、0.601、0.621、0.541,均P<0.01),与XIAP表达均呈负相关性(r=-0.568,P<0.01);外伤组脑组织XIAP表达与凋亡神经细胞比例、pro-caspase 3、pro-caspase 9和剪切PARP表达及caspase 3和caspase 9活性均呈负相关性(r=-0.610、-0.494、-0.583、-0.611、-0.594、-0.550,均P<0.01)。
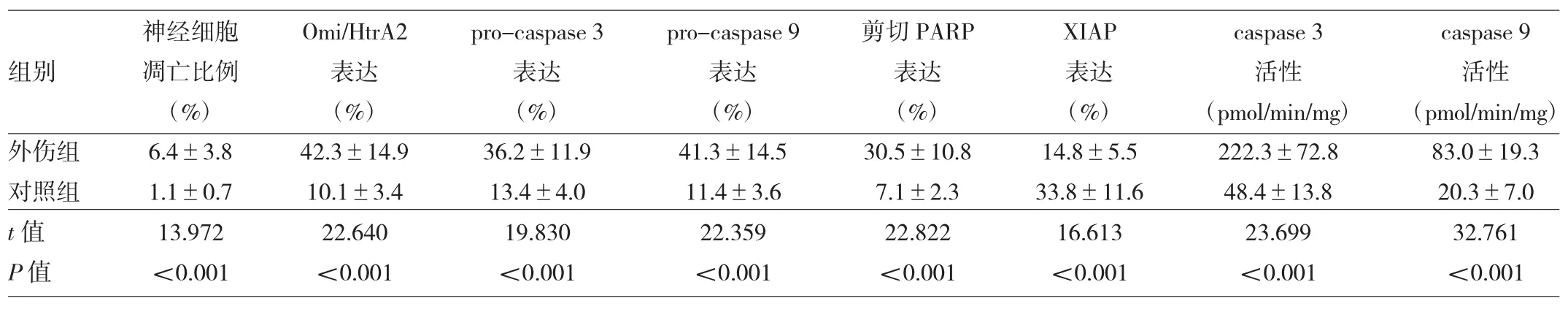
表1 两组患者脑组织各指标的比较
3 讨论
神经细胞凋亡是导致颅脑损伤后神经功能障碍的重要原因之一,抑制神经细胞凋亡可以明显改善颅脑损伤动物的神经功能[15-17]。pro-caspase 3、pro-caspase 9、PARP、caspase 3和caspase 9等在神经细胞凋亡中具有重要作用,这些蛋白表达的升高促进了神经细胞凋亡的发生[18-20]。正如本研究所发现,凋亡神经细胞比例、procaspase 3、pro-caspase 9和剪切PARP表达及caspase 3和caspase 9活性在颅脑损伤患者挫伤脑组织中明显升高。这些数据说明,神经细胞凋亡确实在人类颅脑损伤后继发性脑损伤中扮有重要的角色。
线粒体途径是神经细胞凋亡重要的信号通路之一。Omi/HtrA2是一种由内质网合成的丝氨酸蛋白酶,由MTS/MLS引导转运进入线粒体,通过自身蛋白酶解或者被线粒体加工肽酶降解形成成熟的Omi分子[4-8]。当细胞受到刺激发生应激反应而线粒体膜通透性增加时,Omi/HtrA2分子从线粒体释放并进入细胞质而发挥作用[9-11]。XIAP是内源性caspases抑制物,可结合和抑制活化的caspase 9。当细胞受到刺激后,Omi/HtrA2分子被释放到细胞质,降解XIAP,解除了XIAP对caspase 9的抑制,导致下游caspase 3活化,进而DNA断裂而发生细胞凋亡[6,11]。目前动物实验已经证实,脑损伤大鼠皮层Omi/HtrA2表达增高,而XIAP表达降低[12-14]。本研究留取颅脑损伤患者脑挫伤皮层进而检测Omi/HtrA2和XIAP表达,也发现了类似的结果。同时,本研究发现,Omi/HtrA2表达与凋亡神经细胞比例、pro-caspase 3、pro-caspase 9和剪切PARP表达及caspase 3和caspase 9活性呈正相关,与XIAP表达均呈负相关;XIAP表达与凋亡神经细胞比例、pro-caspase 3、pro-caspase 9和剪切PARP表达及caspase 3和caspase 9活性均呈负相关。这些说明,Omi/HtrA2介导的线粒体途径可能参与了人类外伤性脑损伤后神经细胞凋亡的发生。
目前已有研究揭示,Omi/HtrA2的特异性抑制剂(UCF-101)可明显减少脓毒症或脑缺血大鼠的神经细
胞凋亡,一定程度上改善神经功能[12-14]。这些研究结果也从另外一个方面说明,特异性地抑制Omi/HtrA2表达可能抑制颅脑损伤后神经细胞,从而改善颅脑损伤患者,这也为颅脑损伤治疗提供了新思路。
[1] Zhai X,Ding Y,Wang Q,et al.Rutin Acid Ameliorates Neural Apoptosis Induced by Traumatic Brain Injury via Mitochondrial Pathways in Mice[J].Neuroimmuno modulation,2016,23(3):179-187.
[2] Gao Y,Zhuang Z,Gao S,et al.Tetrahydrocurcumin reduces oxidative stress-induced apoptosis via the mitochondrial apoptotic pathway by modulating autophagy in rats after traumatic brain injury[J].Am J TranslRes,2017,9(3):887-899.
[3] Sun G Z,Gao F F,Zhao Z M,et al.Endoplasmic reticulum stressinduced apoptosis in the penumbra aggravates secondary damage in rats with traumatic brain injury[J].Neural Regen Res,2016,11(8):1260-1266
[4] Liu X,Lei J,Wang K,et al.Mitochondrial Omi/HtrA2 Promotes Caspase Activation Through Cleavage of HAX-1 in Aging Heart[J].Rejuvenation Res,2017,20(3):183-192.
[5] Xu Z,Chen Y,Xu G,et al.Omi/HtrA2 pro-apoptotic marker differs in various hepatocellular carcinoma cell lines owing to ped/pea-15 expression level[J].OncolRep,2015,33(2):905-912.
[6] Winkler J,Rand M L,Schmugge M,et al.Omi/HtrA2 and XIAP are components of platelet apoptosis signalling[J].Thromb Haemost,2013,109(3):532-539.
[7] Sun L L,Zhang L,Meng XL,et al.Effects of fluid shear stress on the expression of Omi/HtrA2 in human umbilical vein endothelial cells[J].MolMed Rep,2013,7(1):110-114.
[8] Goo H G,Rhim H,Kang S.HtrA2/Omi influences the stability of LON protease 1 and prohibitin,proteins involved in mitochondrial homeostasis[J].Exp CellRes,2014,328(2):456-465.
[9] Goo H G,Jung M K,Han S S,et al.HtrA2/Omi deficiency causes damage and mutation of mitochondrial DNA[J].Biochim Biophys Acta,2013,1833(8):1866-1875.
[10] Kang S,Fernandes-Alnemri T,Alnemri E S.A novel role for the mitochondrial HTRA2/OMI protease in aging[J].Autophagy,2013,9(3):420-421.
[11] Dan H C,Sun M,Kaneko S,et al.Akt phosphorylation and stabilization of X-linked inhibitor of apoptosis protein(XIAP)[J].J BiolChem,2016,291(43):22846.
[12] Hu Y,Huang M,Wang P,et al.Ucf-101 protects against cerebraloxidative injury and cognitive impairment in septic rat[J].Int Immunopharmacol,2013,16(1):108-113.
[13] Su D,Ma J,Zhang Z,et al.Protective Effects of UCF-101 on Cerebral Ischemia-Reperfusion(CIR)is Depended on the MAPK/p38/ERK Signaling Pathway[J].Cell Mol Neurobiol,2016,36(6):907-914.
[14] Su D,Su Z,Wang J,et al.UCF-101,a novelOmi/HtrA2 inhibitor,protects against cerebral ischemia/reperfusion injury in rats[J].Anat Rec(Hoboken),2009,292(6):854-861.
[15] Keskin I,Gunal M Y,Ayturk N,et al.Dose-dependent neuroprotective effect of enoxaparin on cold-induced traumatic brain injury[J].NeuralRegen Res,2017,12(5):761-764.
[16] Huang T Q,Song J N,Zheng F W,et al.Protection of FK506 against neuronal apoptosis and axonal injury following experimental diffuse axonalinjury[J].MolMed Rep,2017,15(5):3001-3010.
[17] Zhang G,Zhang F,Zhang T,et al.Tetramethylpyrazine Nitrone Improves Neurobehavioral Functions and Confers Neuroprotection on Rats with Traumatic Brain Injury[J].Neurochem Res,2016,41(11):2948-2957.
[18] Miao Q,Ge M,Huang L.Up-regulation of GBP2 is Associated with Neuronal Apoptosis in Rat Brain Cortex Following Traumatic Brain Injury[J].Neurochem Res,2017,42(5):1515-1523.
[19] Ma J,Shui S,Han X,et al.microRNA-22 attenuates neuronal cell apoptosis in a cell model of traumatic brain injury[J].Am J TranslRes,2016,8(4):1895-1902.
[20] Yao J,Zheng K,Zhang X.Rosiglitazone exerts neuroprotective effects via the suppression of neuronal autophagy and apoptosis in the cortex following traumatic brain injury[J].Mol Med Rep,2015,12(5):6591-6597.
Mitochondrial Omi/HtrA2 signaling pathway involved in neuronal apoptosis after cerebral contusion and laceration
TANG Bei,SHI Jian,ZHOU Ling,et al.
Department of Intensive Care Unit,Jiande First People's Hospital,Jiande 311600,China
ObjectiveTo investigate the effect of Omi/HtrA2 mediated mitochondrial signaling pathway in neuronal apoptosis after acute traumatic brain injury.MethodsBrain tissue samples were collected during craniotomy from 100 patients with cerebral contusion and laceration(trauma group),and normal brain tissue samples were collected from 100 patients with intracerebral hemorrhage(control group).Flow cytometry was applied to determine apoptotic neuronal cells,Western-blotting was performed to test expressions of Omi/HtrA2,X-linked inhibitor of apoptosis protein(XIAP),pro-caspase-3,pro-caspase-9 and cleaved poly ADP-ribose polymerase(PARP),and four peptide fluorescence substrate method was employed to detect activities of caspase 3 and caspase 9 proteins.Results Percentage of apoptotic nerve cells,expressions of Omi/HtrA2,pro-caspase 3,pro-caspase 9 and cleaved PARP as well as activities of caspase 3 and caspase 9 proteins were significantly higher and the expression of XIAP was significantly lower in brain tissues of trauma group than those in control group(allP<0.01).In trauma group,expression of Omi/HtrA2 was positively correlated with percentage of apoptotic nerve cells,expressions of pro-caspase 3,pro-caspase 9 and cleaved PARP as well as activities of caspase 3 and caspase 9 proteins,and negatively correlation with the expression of XIAP.The expression of XIAP was negatively correlated with percentage of apoptotic nerve cells,expressions of Omi/HtrA2,pro-caspase 3,pro-caspase 9 and cleaved PARP as well as activities of caspase 3 and caspase 9 proteins.Conclusion Omi/HtrA2 mediated mitochondrial signaling pathway may be involved in neuronal apoptosis after acute traumatic brain injury.
Human Traumatic brain injury Neuronal apoptosisOmi/HtraA2
10.12056/j.issn.1006-2785.2017.39.20.2017-377
浙江省医药卫生科技计划平台项目(2014ZDA019)
311600建德市第一人民医院重症医学科(汤蓓、周玲、沈红卫、吴慧平、胡佳元),脑外科(郑绍俭);浙江大学医学院附属第二医院脑外科(石键)
周玲,E-mail:95225410@qq.com
2017-02-27)
(本文编辑:严玮雯)

