瑶山鸡TRHR基因编码区序列SNP检测及其与繁殖性状的相关性
伍革民+徐龙鑫+朱丽莉+唐继高
摘要:为探明促甲状腺激素释放激素受体基因TRHR(thyrotropin-releasing hormone receptor,TRHR)与瑶山鸡繁殖性状的关联性,以找出可作为瑶山鸡繁殖性状选育的重要标记,采用PCR产物测序法对促甲状腺激素释放激素基因TRH(thyrotropin-releasing hormone,TRH)编码区进行序列变异检测,并与繁殖性状进行关联分析。结果表明,在瑶山鸡群中,TRHR基因检测到5个编码区变异位点和1个内含子变异位点,5个编码区变异位点均能引起蛋白质相应氨基酸发生同义突变;统计分析表明,6个位点与300日龄产蛋量、首次就巢日龄、首次就巢持续时间和就巢次数等性状均没有显著关联性;初步说明,该基因不能作为瑶山鸡繁殖性状选育的候选基因开展辅助选育,但可以作为鸡生长性状的候选基因开展进一步研究。
关键词:促甲状腺激素释放激素受体基因(TRHR);遗传变异;荔波县瑶山鸡;繁殖性状;选育;变异位点;同义突变
中图分类号: S831.2文献标志码: A文章编号:1002-1302(2017)17-0047-03
荔波县瑶山鸡原产于贵州省黔南布依族苗族自治州荔波县,该鸡具有耐粗饲、抗逆性强、适应性强、饲料报酬高、肉质鲜美细嫩等特点,是贵州地方鸡种中生长发育较快的鸡种之一。荔波县瑶山鸡年产蛋量仅90枚左右,具有较强的就巢性。目前笔者针对荔波县瑶山鸡已经开展了多个世代的常规选择育种,产蛋量从90枚提高到110枚左右,但后期進展相当缓慢,继续常规选育,产蛋量没有明显提高。因此,笔者开展了一些与繁殖性状相关的候选基因遗传检测,试图探寻有效的辅助选育标记。促甲状腺激素释放激素受体基因TRHR(thyrotropin-releasing hormone receptor,TRHR)是笔者选择的候选基因之一。TRHR受体主要分布于垂体促甲状腺激素细胞和促乳素细胞膜表面,是下丘脑—垂体—性腺轴中的激素之一[1]。促甲状腺激素释放激素TRH(thyrotropin-releasing hormone,TRH)发挥生物功能均须通过与其靶细胞表面的TRH受体(TRHR)结合,以激活胞内第2信使通路[2-3]。TRHR蛋白序列高度保守,鸡的TRHR蛋白质结构和功能有相当大的进化约束,其蛋白质序列与鼠没有明显差异[4]。TRHR基因结构在不同物种中存在差异,如大鼠TRHR全部编码序列位于同一外显子上,而小鼠蛋白编码区则分布于2个外显子上,内含子靠近蛋白末端,人的TRHR蛋白编码区也由2个外显子组成,但内含子位于第5与第6跨膜螺旋之间的第3胞内环上[5]。鸡的TRHR基因编码区包括2个外显子,基因序列全长>13 819 bp,mRNA序列全长1 182 bp,2个外显子中间分布有12 637 bp的内含子序列。文献搜索没有发现鸡的TRHR基因序列变异或差异表达与繁殖、生长等表型性状的相关报道,对NCBI数据库进行鸡的TRHR基因的单核苷酸多态性(SNP)搜索,没有检索到鸡中该基因的SNP登记,本研究针对该基因编码区设计引物,采用PCR产物回收后直接测序法,检测瑶山鸡群体该基因编码区的序列变异情况,并与部分繁殖性状进行关联分析,以探讨其作为繁殖性状辅助选育基因的可行性。
1材料与方法
1.1荔波县瑶山鸡
试验鸡为120日龄荔波县瑶山鸡母鸡,60羽,选自贵阳市乌当区百宜乡洛坝村种鸡场,均采用常规饲养管理,个体笼养,群体一致性较好,性能较为稳定。翅下静脉采血1.0~1.5 mL,加EDTA-Na2抗凝,-20 ℃保存。
1.2性状测定
120日龄母鸡转入产蛋舍单只笼养至300日龄,测定或观测开产日龄、开产体质量、就巢性等繁殖性状,测定方法按照NY/T 823—2004《家禽生产性能名词术语和度量统计方法》[6]进行。
1.3基因组DNA提取及引物设计
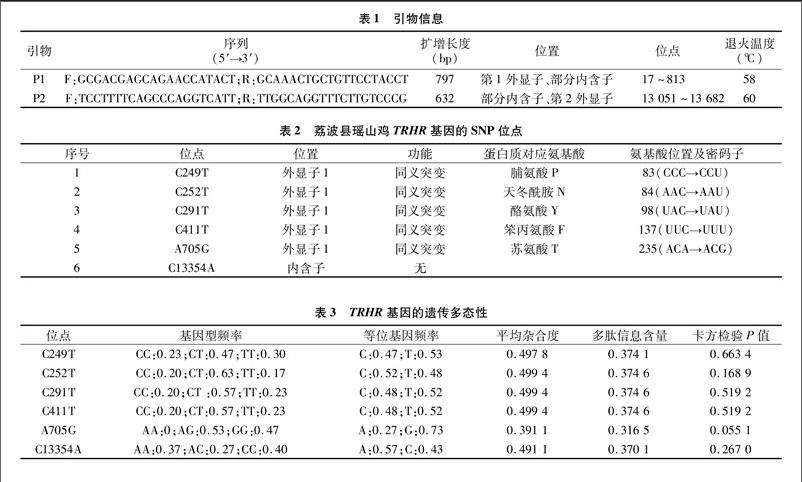
采用TIANamp Blood DNA Kit试剂盒提取血样DNA。根据GenBank中鸡的TRHR基因编码区序列合成2对引物(天根生化科技有限公司),引物信息见表1。
1.4PCR扩增及测序
PCR反应体系:DNA模板1 μL,上下游引物各1 μL,2×Taq PCR MasterMix试剂10 μL,加ddH2O至20 μL。PCR反应参数:95 ℃预变性6 min,95 ℃变性30 s,特定温度(表1)退火30 s,72 ℃延伸45 s),35个循环;最后72 ℃延伸 10 min。PCR产物用1%琼脂糖凝胶电泳检测,采用PCR产物回收试剂盒回收PCR产物后委托诺赛基因组研究中心有表1引物信息
引物序列
(5′→3′)扩增长度
(bp)位置位点退火温度
(℃)P1F:GCGACGAGCAGAACCATACT;R:GCAAACTGCTGTTCCTACCT797第1外显子、部分内含子17~81358P2F:TCCTTTTCAGCCCAGGTCATT;R:TTGGCAGGTTTCTTGTCCCG632部分内含子、第2外显子13 051~13 68260
限公司对60个样本进行测序检测。
1.5统计分析
使用DNAstar软件对测序结果进行校正,进入基因库网站采用Blast分析序列SNPs,采用DNAMAN软件分析SNPs变异导致蛋白质编码变异的情况。以Excel软件统计60羽鸡TRHR基因分型,利用PopGen32软件分析群体多样性,利用SPSS 18.0软件采用单因子方差分析方法分析基因型与繁殖性状的相关性。
2结果与分析
2.1序列变异检测和群体遗传多样性
60羽瑶山鸡中共检测到6个变异位点;5个位点位于第1外显子区,基因位置分别为249、252、291、411、705位置,变异分别引起蛋白质第83、84、98、137、235氨基酸位置发生同义突变;1个位点位于内含子区;第2外显子区没有检测到核苷酸变异(表2)。对各位点在瑶山鸡群体的遗传多样性分析结果表明,各位点平均杂合度在0.39~0.50之间,多态信息含量在0.31~0.37之间,遗传多样性处于中等水平。哈迪温伯格平衡的卡方检验结果表明,各位点均没有偏离平衡状态(P>0.05,表3)。
2.2变异位点基因型与繁殖性状的相关性
变异位点基因型与个体繁殖性状的单因素方差分析F检验结果见表4,均值描述及基因型间多重比较结果见表5。从表4、表5可知,本次检测到的TRHR基因编码区的5个变异位点和内含子区的1个变异位点基因型间开产日龄、300日龄产蛋量、首次就巢日龄、首次就巢持续时间、首次就巢至重新开产间隔以及300日龄就巢次数等繁殖性状差异不显著,位点变异与上述繁殖性状无显著性关联。
3结论与讨论
候选基因鉴定法是分析数量性状基因的重要方法之一。TRHR主要分布于垂体促甲状腺激素细胞和促乳素细胞中,是下丘脑-垂体-性腺轴中的激素之一[1]。免疫组织化学方法研究表明,TRHR激素在猕猴子宫中表达,对子宫功能有直接作用[7]。定量PCR表明,猪TRHR基因在脑、垂体和睾丸中表达[8]。笔者推测,TRHR可能与性腺功能有关,因此,笔者把TRHR基因作为鸡繁殖性状关联的候选基因之一,开展序列变异检测并与繁殖性状关联研究。结果表明,在瑶山鸡群体检测的该基因5个编码区变异点和1个内含子变异点与300日龄产蛋量、就巢性状等没有显著关联性,说明该基因不能用于瑶山鸡繁殖性状辅助选育的候选基因。在鸡中,该基因序列变异或差异表达与表型性状的关联研究没有检索到相关文献报道,但在其他动物中有相关研究报道,这些报道主要集中于对生长性状的研究。报道发现,人类TRHR基因突变造成中枢性甲状腺功能减退综合征,患者表现出生长发育迟缓、矮胖和行动迟钝等症状[9]。TRHR基因在一项全基因组关联分析中被指出与人类瘦体质量个体变异有顯著关联[10]。研究表明,TRHR基因多态性对猪个体头质量和胴体长有显著效益,与系水力、肌内水分和肌内脂肪等肉质指标有显著关联[3]。高密度SNP芯片检测结果表明,1个拷贝数变异多态区域上游的TRHR基因可能通过骨骼肌的发育调控作用,影响羔羊生长发育性状[11]。上述试验表明,该基因有可能是生长发育性状的一个候选基因,本试验初步否定了该基因作为繁殖性状选育的候选基因,但不排除该基因作为鸡生长性状的候选基因开展进一步试验,本研究为该基因在鸡中的研究提供了理论思路。
参考文献:
[1]Savage J J,Yaden B C,Kiratipranon P,et al. Transcriptional control during mammalian anterior pituitary development[J]. Gene,2003,319:1-19.
[2]De Groef B,Geris K L,Manzano J,et al. Involvement of thyrotropin-releasing hormone receptor,somatostatin receptor subtype 2 and corticotropin-releasing hormone receptor type 1 in the control of chicken thyrotropin secretion[J]. Molecular and Cellular Endocrinology,2003,203(1):33-39.
[3]蒋晓玲. 猪下丘脑-垂体-甲状腺轴五个关键基因的研究[D]. 杭州:浙江大学,2011:111-115.
[4]Sun Y M,Millar R P,Ho H,et al. Cloning and characterization of the chicken thyrotropin-releasing hormone receptor[J]. Endocrinology,1998,139(8):3390-3398.
[5]Gershengorn M C,Osman R. Molecular and cellular biology of thyrotropin-releasing hormone receptors[J]. Physiological Reviews,1996,76(1):175-191.
[6]家禽生产性能名词术语和度量统计方法:NY/T 823—2004[M]. 北京:中国农业出版社,2006.
[7]Hulchiy M,Zhang H,Cline J M,et al. Receptors for thyrotropin-releasing hormone,thyroid-stimulating hormone,and thyroid hormones in the macaque uterus:effects of long-term sex hormone treatment[J]. Menopause,2012,19(11):1253-1259.
[8]Jiang X,Cai Z,Zhao X,et al. Mapping,cDNA cloning and tissue expression of the porcine thyrotropin-releasing hormone receptor gene[J]. Animal Biotechnology,2011,22(1):30-36.
[9]Collu R,Tang J Q,Castagne J,et al. A novel mechanism for isolated central hypothyroidism:inactivating mutations in the thyrotropin-releasing hormone receptor gene[J]. The Journal of Clinical Endocrinology & Metabolism,1997,82(5):1561-1565.
[10]Liu X G,Tan L J,Lei S F,et al. Genome-wide association and replication studies identified TRHR as an important gene for lean body mass[J]. The American Journal of Human Genetics,2009,84(3):418-423.
[11]刘佳森. 绵羊全基因组CNV与部分性状的关联分析[D]. 北京:中国农业科学院,2012:53-60.陈俊晖,漆子钰,骆亮,等. 金边朱砂根组培快繁体系的建立[J]. 江苏农业科学,2017,45(17):50-53.
doi:10.15889/j.issn.1002-1302.2017.17.013

