间隙灌溉和控释肥施用耦合措施对稻麦轮作系统土壤微生物群落丰度的影响
纪洋,于海洋,Ralf Conrad,徐华*
1. 南京信息工程大学应用气象学院,江苏 南京 210044;2. 土壤与农业可持续发展国家重点实验室//中国科学院南京土壤研究所,江苏 南京 210008;3. Max Planck Institute for Terrestrial Microbiology,Marburg Germany 35043
间隙灌溉和控释肥施用耦合措施对稻麦轮作系统土壤微生物群落丰度的影响
纪洋1,2,于海洋2,Ralf Conrad3,徐华2*
1. 南京信息工程大学应用气象学院,江苏 南京 210044;2. 土壤与农业可持续发展国家重点实验室//中国科学院南京土壤研究所,江苏 南京 210008;3. Max Planck Institute for Terrestrial Microbiology,Marburg Germany 35043
间隙灌溉模式下控释肥施用可减缓稻麦轮作系统CH4和N2O排放交互排放效应,从而降低综合温室效应,然而有关间隙灌溉和控释肥施用耦合措施对稻麦轮作系统土壤微生物的影响鲜有研究。通过采集稻麦轮作系统田间原位试验新鲜土样,采用核酸定量技术研究间隙灌溉和控释肥施用耦合措施下稻麦轮作系统土壤微生物群落丰度的变化,以探讨此耦合措施降低稻麦轮作系统降低CH4和N2O排放的微生物机理。结果发现,除古菌外,稻季土壤细菌、产甲烷菌、甲烷氧化菌、氨氧化菌和反硝化菌群落丰度均高于麦季;间隙灌溉显著影响稻田产甲烷菌、甲烷氧化菌、氨氧化菌和反硝化菌数量的季节变化;与尿素相比,施用控释肥增加了稻麦轮作系统细菌、古菌和产甲烷菌数量,降低了甲烷氧化菌、氨氧化菌、反硝化菌数量。稻季CH4和N2O的排放量与土壤微生物丰度之间存在显著相关性:CH4排放量与古菌、产甲烷菌和甲烷氧化菌数量均呈极显著正相关关系(P<0.01),而与氨氧化菌数量呈显著负相关关系(P<0.05);N2O排放量与氨氧化菌、甲烷氧化菌、nirK型和nosZ型反硝化菌数量均呈显著正相关关系(P<0.05),而与nirS型反硝化菌无显著相关性。研究表明,间隙灌溉和控释肥施用耦合措施通过影响稻麦轮作系统相关功能微生物的群落丰度进而减缓CH4和N2O气体的交互排放效应。
间隙灌溉;控释肥;稻麦轮作;土壤微生物;CH4和N2O排放
土壤中微生物数量庞大、作用复杂,在土壤生物地球化学过程研究中据有重要地位(吴金水等,2015)。受传统的研究方法和手段的限制,目前对土壤微生物的认识十分有限。近年来,分子生物学技术在环境微生物领域的应用,促进了人类对微生物种群演变及其环境功能的了解(Prosser,2002)。由于古菌和细菌的16S rDNA具有多个保守区段,被广泛用于土壤及环境样品的古菌和细菌群落研究(Dunbar et al.,2001)。稻田 CH4排放包括 CH4产生、再氧化和传输3个过程(蔡祖聪等,2009),其中产甲烷菌和甲烷氧化菌是参与前两个过程的重要微生物(于海洋等,2017)。产甲烷菌功能基因mcrA控制甲烷化的最后一步反应,其将辅酶M连接的甲基催化还原为CH4,甲烷氧化菌功能基因pmoA编码利用甲烷的第一个关键酶,将甲烷氧化为甲醇(Theisen et al.,2005;Conrad et al.,2012)。硝化过程和反硝化过程是农田N2O产生的最主要途径,而硝化和反硝化是由微生物驱动的生物化学过程。amoA基因控制硝化作用的第一步反应:NH3氧化成NH2OH,是硝酸盐形成的关键反应之一(Chu et al.,2007)。亚硝酸还原酶是反硝化过程中的关键酶,其编码基因(nirK和nirS)是反硝化微生物的关键功能基因(Liu et al.,2006)。nosZ基因在反硝化过程中调控着N2O转化成N2的关键环节(Rösch et al.,2002)。因此,土壤中含有上述基因的功能微生物种群丰度结构及其演变规律受到广泛关注。
以前期淹水、中期烤田和后期干湿交替为特征的间隙灌溉是我国稻田主要的水分管理措施(Yan et al.,2005)。相对于持续淹水,稻田烤田可显著抑制水稻生长期 CH4排放,但却极大促进 N2O排放。水稻生长季持续淹水造成稻田极端厌氧,有利于CH4的产生排放;相反,间隙灌溉模式下烤田提高了土壤通透性,土壤中原有的还原状态被破坏,土壤Eh迅速增加,土壤CH4的生成受到限制(Zhang et al.,2013)。烤田期间土壤氧化CH4能力的提高是导致CH4排放减少的另一个原因(Zhang et al.,2012)。然而,稻田烤田为土壤提供大量的 O2,有利于硝化和反硝化反应同时进行,极大促进稻季N2O排放(蔡祖聪等,2009)。控释肥是既适应作物全生长季不同生育阶段氮素营养的需求,而又不至于导致土壤中剩余无机氮浓度过高的一种可控释放氮肥。国内外大量研究表明,施用控释肥可明显减少稻麦轮作系统温室气体排放,尤其是N2O气体的排放(Delgado et al.,1996;林匡飞等,2000;李方敏等,2004;易琼等,2013)。前期研究发现,间隙灌溉和控释肥施用耦合措施可弥补烤田造成的N2O排放增加,减缓稻田CH4和N2O排放交互排放效应,同时避免高量氮肥施入带来的生态环境效应(Ji et al.,2013;2014)。然而,有关此耦合措施对稻麦轮作系统土壤微生物种群的影响,尤其是对与CH4和 N2O排放相关的功能微生物种群的了解很少。近年来,随着分子生物学技术的迅猛发展,基于 16S rDNA基因及其他功能基因的非培养技术,包括聚合酶链式反应(PCR)、克隆文库技术(Clone)和核酸定量技术(real-time PCR)的出现为揭示自然环境中微生物群落结构多样性的分子生态学研究开辟了一个全新的研究平台(Heid et al.,1996)。
本研究通过采集稻麦轮作系统田间原位试验新鲜土样,采用荧光定量PCR技术研究间隙灌溉和控释肥施用耦合措施对与CH4和 N2O排放相关的土壤微生物群落丰度的影响,以探讨此耦合措施降低稻麦轮作系统温室气体排放的微生物机理,从而为农田系统温室气体减排提供理论和实践依据。
1 材料与方法
1.1 试验方案及样品采集
供试土壤是采自于 2010—2011年江苏省句容市行香镇(31°58′N,119°18′E)稻麦轮作试验田上的原位新鲜土。试验地属北亚热带季风气候区,年平均气温为 15.1 ℃,年平均降雨量为 1100~1200 mm,稻-麦轮作是该地区的主要耕作制度。试验土壤为发育于下蜀黄土的爽水性水稻土,其基本理化性质为:pH值6.91,有机碳含量为18.9 g·kg-1,全N含量为1.2 g·kg-1,砂粒(2~0.02 mm)14%,粉粒(0.02~0.002 mm)69%,粘粒(<0.002 mm)17%,土壤WHC为55%。
试验共设3个处理:(1)对照处理(CK):不施氮肥;(2)尿素处理(U):稻季尿素施用量(以N 计)为 240 kg·hm-2,麦季尿素施用量为 200 kg·hm-2;(3)控释肥处理(C):与尿素处理相同施氮量。本试验所施用的控释肥为山东金正大生态工程股份有限公司生产的可降解树脂包膜尿素肥料,含氮量为42%。小区面积均为3 m×5 m,每个处理3次重复,随机区组排列。
田间管理措施与当地农田管理相同。麦季尿素按基肥∶追肥为6∶4施用(施用时间分别为2010年11月20日和2011年3月6日);稻季尿素按基肥∶分蘖肥∶穗肥为 5∶2.5∶2.5施用(施用时间分别为2011年7月2日、7月22日和8月20日);稻麦季控释肥均作为基肥一次性施入。所有处理均施用 450 kg·hm-2的过磷酸钙和 225 kg·hm-2的氯化钾,作为基肥一次性施入。小麦品种为扬麦16号,于2010年11月20日播种,2011年6月10日收割;水稻品种为华粳3号,于2011年7月2日移栽(水稻移栽密度为24 holes·m-2),11月6日收割。水分管理参照当地稻田常规管理方式,采用传统的前期淹水(7月1日—8月1日)、中期烤田(8月2日—8月13日)、后期干湿交替(8月14日—10月7日)和末期排水落干(10月8日—11月6日)管理模式。
麦季土壤样品于2011年6月10日(小麦成熟期)采集;稻季土壤样品分别于2011年7月23日水稻幼苗期(淹水期)、8月3日分蘖期(烤田开始)、8月11日拔节期(烤田结束)和11月4日(成熟期)采集。各小区按“S”形多点采样法取表层(0~15 cm)土壤混合。取200 g新鲜土壤用液氮冷冻后于-80 ℃保存,供分子生物学研究。
1.2 土壤DNA提取及定量PCR
称取0.5 g土壤用Fast DNA SPIN KIT试剂盒(MP Biomedicals,Eschwege,Germany)提取总 DNA(Conrad et al.,2012),操作按说明书进行。所提DNA质量与长度通过1%凝胶电泳检测。所得DNA均稀释10倍后再进行下游实验。细菌16S rRNA基因、古菌16S rRNA基因、两个CH4排放相关功能基因(产甲烷菌功能基因mcrA、甲烷氧化菌功能基因pmoA)以及4个N2O排放相关功能基因(氨氧化细菌功能基因 amoA、反硝化菌功能基因 nirS、nirK、nosZ)的定量PCR分析均采用SYBR Green染色法。各基因定量PCR所用的引物和参考文献如表 1 所示。采用 SPSS 13.0 for Windows(SPSS Inc.,USA)软件对不同处理的功能基因数目进行显著性差异分析(One-way ANOVA),并对稻田CH4和N2O排放量与土壤微生物种群数量进行相关性分析(Pearson two-tailed test)。
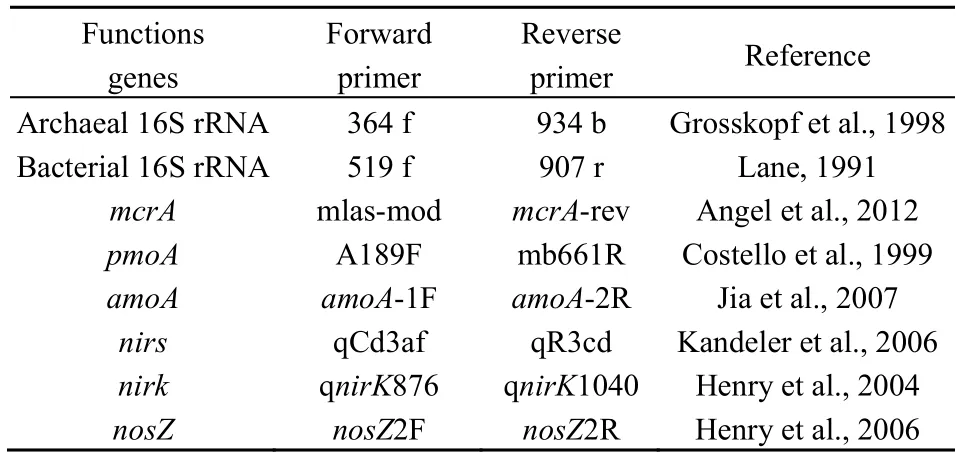
表1 各目标基因定量PCR所用引物及参考文献Table 1 Primers and references used in qPCR
2 结果与分析
2.1 稻麦轮作系统土壤细菌和古菌的群落丰度
图1所示为麦季收获期和后续稻季不同生长发育阶段土壤细菌和古菌群落的丰度变化。稻麦轮作系统土壤中检测到的细菌数量多于古菌,介于7.2×108~6.0×109copies·g-1(干土,下同)之间,其中稻季细菌数量明显高于麦季。随着水稻生长,各处理细菌数量逐渐降低。与不施氮肥的对照处理相比,水稻生长前期,施用尿素和控释肥均促进细菌数量增加,其中尿素处理细菌数量高于控释肥处理;而在水稻和小麦收获期,施用尿素降低细菌数量,施用控释肥对细菌数量没有显著影响。检测到的古菌数量在 1.3×108~3.7×108copies·g-1之间,稻麦两季之间古菌数量没有显著差异,随着水稻生长,各处理古菌数量逐渐增加。与不施氮肥的对照处理相比,施用尿素和控释肥均降低稻季和麦季古菌数量;与尿素相比,施用控释肥增加土壤中古菌数量。
2.2 稻麦轮作系统土壤产甲烷菌和甲烷氧化菌的群落丰度
如图 2所示,产甲烷菌(mcrA)数量介于3.9×106~2.1×107copies·g-1之间,其中稻季产甲烷菌数量明显高于麦季。在水稻生长季,分蘖期和拔节期处于排水落干的烤田期,其产甲烷菌数量小于处于淹水的水稻幼苗期和干湿交替的收获期。在水稻幼苗期,施用尿素和控释肥均促进产甲烷菌数量的增加,随着水稻生长,氮肥施用逐渐抑制产甲烷菌生长,在水稻和小麦收获期,尿素和控释肥均显著抑制产甲烷菌生长,其中控释肥处理产甲烷菌数量高于尿素处理。

图1 稻麦轮作系统中土壤细菌和古菌的群落丰度Fig. 1 Abundances of Bacteria and Archaea in the rice-wheat rotation ecosystem
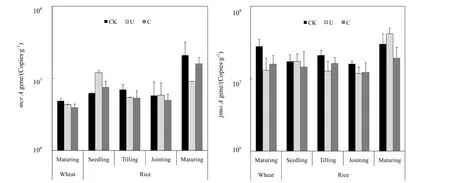
图2 稻麦轮作系统中土壤产甲烷菌(mcrA)和甲烷氧化菌(pmoA)的群落丰度Fig. 2 Abundances of methanogens (mcrA) and methanotrophs (pmoA) genes in the rice-wheat rotation ecosystem
甲烷氧化菌(pmoA)数量介于 1.3×107~4.2×107copies·g-1之间,其中稻季甲烷氧化菌的数量大于麦季,且随着水稻的生长而增加。在麦季收获期,尿素和控释肥施用均降低麦季甲烷氧化菌数量。在水稻生长前期,尿素施用抑制甲烷氧化菌生长,随着水稻的生长,在水稻收获期,尿素施用促进甲烷氧化菌生长。在整个稻季,控释肥施用抑制甲烷氧化菌生长,但其抑制作用小于尿素处理。
2.3 稻麦轮作系统土壤氨氧化细菌和反硝化菌的群落丰度
图3所示为麦季收获期和后续稻季不同生长发育阶段土壤中与N2O排放相关的功能基因的丰度变化。稻麦轮作系统土壤中氨氧化菌(amoA)的数量比3种反硝化菌数量(nirS、nirK和nosZ)多出2~3个数量级,前者介于 1.6×109~2.1×1010copies·g-1之间,后者分别介于 7.6×106~3.4×107、3.5×107~9.6×107和 2.7×107~1.1×108copies·g-1之间。麦季氨氧化菌的数量小于稻季;整个稻季,氨氧化菌数量变化呈单峰型,在水稻分蘖和拔节期达到最大值,而此时期正是水稻烤田期,土壤经排水落干后硝化作用增强,尿素和控释肥施用促进氨氧化菌生长,其中尿素处理氨氧化菌数量高于控释肥处理,随着水稻生长,土壤中氮素含量逐渐减少,氨氧化菌数量随之下降。在水稻和小麦收获期,氮肥处理氨氧化菌数量均高于不施氮处理,其中尿素较控释肥更能促进氨氧化菌生长。
稻季土壤中与反硝化作用有关的nirS、nirK和nosZ基因拷贝数均高于麦季,说明稻季土壤氧化还原条件更有利于反硝化作用的进行。麦季收获期,施氮处理以上3种基因拷贝数均高于不施氮处理,但仅nosZ基因有显著性差异;水稻生长季,3种基因拷贝数随着水稻的生长而下降,且尿素处理>控释肥处理>不施氮处理。
3 讨论
3.1 间隙灌溉对稻麦轮作系统土壤微生物丰度和结构的影响
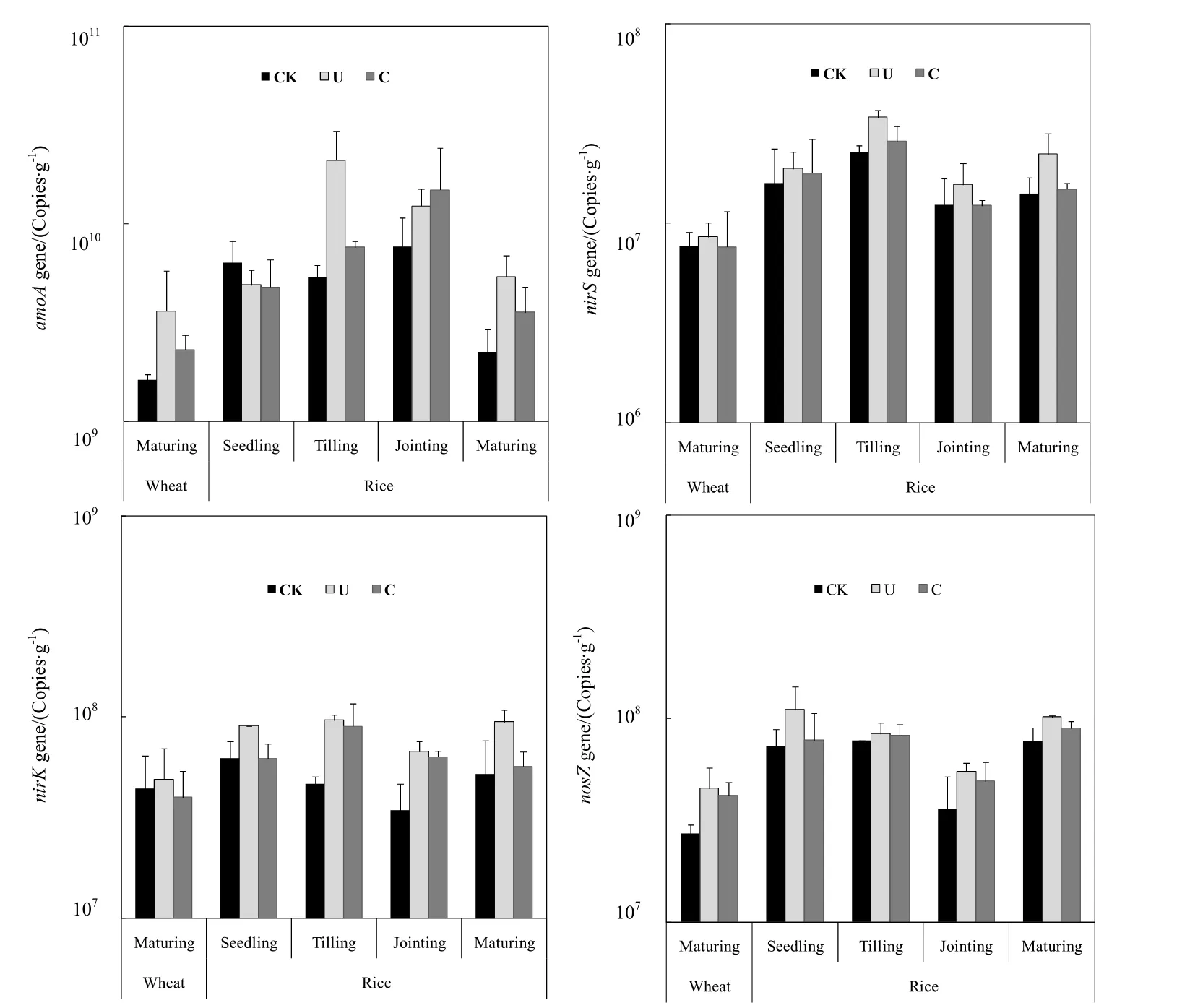
图3 稻麦轮作系统中土壤氨氧化菌(amoA)和反硝化菌(nirS/nirK/nosZ)的群落丰度Fig. 3 Abundances of ammonia-oxidizing bacteria (amoA) and denitrifiers (nirS/nirK/nosZ) in the rice-wheat rotation ecosystem
本研究中土壤微生物的丰度在稻麦轮作系统生育期内存在较为明显的季节差异。除古菌外,稻季土壤细菌、产甲烷菌、甲烷氧化菌、硝化菌和反硝化菌丰度均高于麦季,这是由于稻季氮肥施用量大,水分管理方式较为复杂,根系分泌物的大量产生丰富了土壤有机质的类型和总量,为土壤微生物的生长提供了适宜的条件(Watanabe et al.,2006)。李大明等(2013)研究发现在水稻生长旺盛期(分蘖期),产甲烷菌的数量显著高于其他时期,本研究也得到类似的结果。本研究稻季的水分管理参照当地稻田常规管理方式,采用前期淹水、中期烤田、后期干湿交替和末期排水落干的管理模式,为了有效控制水稻分蘖,烤田在水稻生长的旺期分蘖期进行。整个水稻生长季产甲烷菌的丰度随着间隙灌溉的进行和水稻的生长而呈现动态变化。在水稻幼苗期,土壤处于持续淹水状态,厌氧环境有利于产甲烷菌的生长;分蘖和拔节期,虽然水稻生长旺盛,但烤田增加了土壤通气性,破坏了产甲烷菌的生存条件,产甲烷菌数量下降,达到最低值;随着后期干湿交替的进行,产甲烷菌所需厌氧环境逐渐恢复,根系分泌物的大量产生又为产甲烷菌的增加提供了充足的反应底物,产甲烷菌数量逐渐增加,在收获期达到最大值。Ma et al.(2012)通过研究不同水分管理方式对稻田产甲烷菌数量和结构的影响发现,间隙灌溉水分管理方式显著增加稻田甲烷氧化菌数量。在本研究中,甲烷氧化菌数量随着水稻生长而逐渐增加,在收获期达到最大值,烤田对甲烷氧化菌的数量没有显著影响,这可能是由于烤田期土壤铵态氮大部分转化为硝态氮,尽管烤田有利于甲烷氧化菌的生长,但硝态氮对甲烷氧化菌有一定的胁迫作用(Boer et al.,1988)。
以往研究表明,土壤潜在硝化势、反硝化势分别与氨氧化菌、反硝化菌数量呈正相关关系,土壤中大多数微生物数量与土壤氮素养分含量呈正相关(Yuan et al.,2012);在间隙灌溉模式下,烤田提高稻田土壤通透性,为土壤提供大量的 O2,NH4+-N单氧化酶活性抑制被解除,有利于硝化和反硝化反应同时进行(Towprayoon et al.,2005)。本研究中,水稻生长前期,由于氮肥中氮素快速水解,氨氧化菌和多种反硝化菌数量均随水稻的生长而逐渐增加;水稻分蘖和拔节期,烤田破坏了土壤厌氧环境,土壤通透性的提高促进氨氧化菌生长和硝化作用的进行,同时硝化作用的产物硝态氮又为多种反硝化菌提供充足的底物,因此氨氧化菌和多种反硝化菌数量在分蘖—拔节期达到最大值,其中氨氧化菌的数量高于反硝化菌,这与以往研究结果一致(Yan et al.,2000);由于氮素的不断消耗,氨氧化菌和反硝化菌数量随之逐渐降低。
3.2 稻麦轮作系统CH4和N2O排放与土壤微生物丰度的关系
土壤微生物在农田 CH4和N2O的产生和排放中发挥着重要作用。稻田CH4排放包括CH4产生、再氧化和传输 3个过程(蔡祖聪等,2009),其中前两个过程都与产甲烷菌和甲烷氧化菌数量及活性密切相关(Theisen et al.,2005)。硝化过程和反硝化过程是农田N2O产生的最主要途径,而硝化和反硝化是由硝化菌和反硝化菌驱动的生物化学过程(蔡祖聪等,2009)。以往研究发现,水稻田土壤的甲烷排放量受到甲烷氧化菌、产甲烷菌种群数量及其活性的影响,而土壤中N2O的产生与氨氧化细菌和nirS基因反硝化细菌数量的增加有关(陈中云等,2001;保琼莉等,2011)。结合 Ji et al.(2013;2014)研究数据(表2),得到了类似的结果,稻田CH4和N2O的排放量与土壤微生物丰度之间存在显著相关性(表3)。稻季不同生长季CH4排放量与相应阶段的古菌和产甲烷菌数量之间均存在极显著正相关关系(P<0.01);不同生长季 N2O的排放量与相应阶段的氨氧化菌、nirK基因反硝化菌和nosZ基因反硝化菌数量之间均呈显著正相关关系(P<0.05),这与以往研究结果一致(Conrad,2007;Miller et al.,2008;Maeda et al.,2010),但与 nirS基因反硝化菌数量没有显著相关性(P>0.05)。因此,控制农田产甲烷菌和硝化、反硝化菌数量可以有效减少CH4和N2O的排放量。
甲烷氧化菌和氨氧化菌分别参与碳氮循环,在CH4和N2O排放方面起着重要作用。甲烷氧化菌和氨氧化菌都倾向于生长在相近的土层,即“通气-厌气”界面,可氧化CH4和(Bodelier et al.,1999),这些细菌氧化CH4和的方式是很类似的。因此,甲烷氧化菌氧化甲烷的同时也能氧化铵态氮,氨氧化菌也能消耗大量甲烷(贾仲君等,2003),稻田甲烷氧化和铵氧化具有强烈的交互作用。本研究中,稻季CH4排放量与甲烷氧化菌数量呈显著正相关关系,而与氨氧化菌呈显著负相关关系(表 3)。以往研究表明,土壤高浓度 CH4会促进甲烷氧化菌的生长和活性(Arif et al.,1996)。张广斌等(2010)研究表明,CH4产生潜势对稻田CH4排放量的影响较大,而CH4氧化潜势对其影响较小。本研究中,由于产甲烷菌数量的增加促进CH4产生,而高浓度的CH4同时又促进甲烷氧化菌的生长,产甲烷菌数量增加对CH4产生的促进作用强于甲烷氧化菌数量增加对CH4氧化的促进作用,因此产甲烷菌与甲烷氧化菌的数量同时与 CH4排放呈正相关关系。Oneill et al.(1977)高初始甲烷浓度培养会抑了氨氧化菌对的氧化,CH4浓度对氨氧化菌的影响与底物浓度也密切相关,CH4/+比例越高,氨氧化菌氧化甲烷能力越强。本研究中,稻季氨氧化菌数量高峰期出现在排水落干的烤田期(图 3),良好的通气条件抑制产甲烷菌的生长和CH4产生,另外淹水期产生的高浓度CH4抑制了氨氧化菌对的氧化,增强了对CH4的氧化能力,因此稻季CH4排放与氨氧化菌数量呈显著负相关关系。
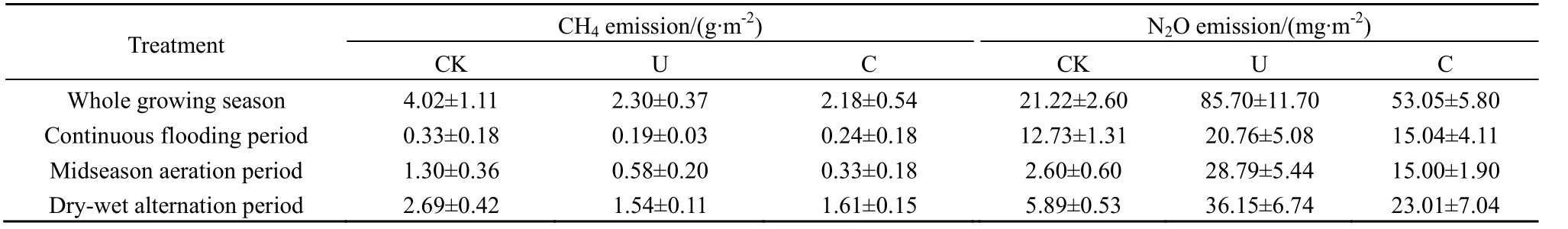
表2 水稻生长季CH4和N2O排放量Table 2 CH4 and N2O emission during the rice growing season
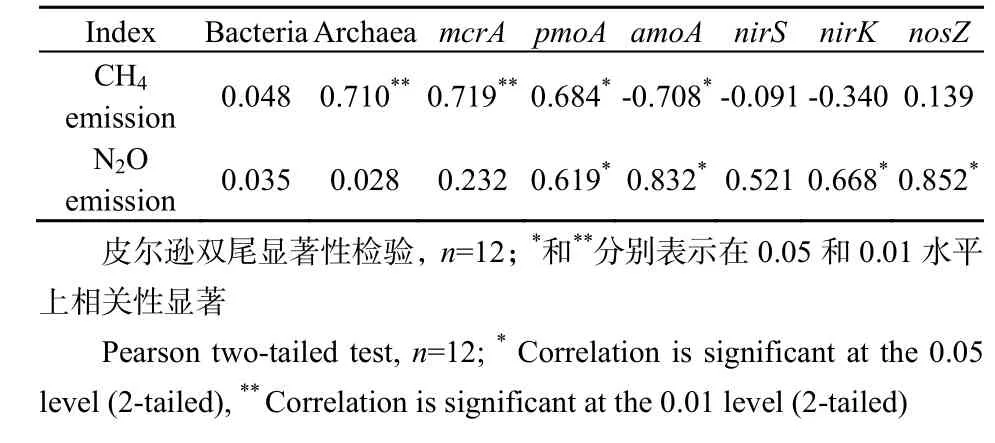
表3 稻田CH4和N2O排放量与土壤微生物种群数量的相关性分析结果Table 3 Correlation between CH4 and N2O emission and the abundance of soil microbial communities
3.3 控释肥施用对稻麦轮作系统土壤微生物丰度的影响
控释肥作为一种新型肥料,不仅可以提高肥料利用率,有效防止环境污染,而且具有提高土壤酶活性、增加土壤微生物数量、降低环境污染等优点(Trenkel,1997)。孟庆英等(2012)研究结果表明,控释肥施用有利于增加土壤细菌、土壤氮素含量及玉米产量;罗兰芳等(2007)研究发现,短期施用控释氮肥稻田土壤的细菌数量明显高于不施氮处理,周年土壤细菌明显高于尿素处理。氮肥养分释放特性不同,其对土壤中微生物数量及土壤中氮素产生影响不同(Yuan et al.,2012)。本研究表明,与不施氮处理相比,施用尿素降低稻麦季收获期细菌数量,而施用控释肥增加其数量,这可能是由于尿素施用量过多会导致高浓度 N的胁迫作用同时改变土壤pH值,从而影响细菌的数量和活性,而控释肥可调节养分释放模式,满足作物全生育期对氮的生理需求,更利于提高土壤氮素含量为微生物创造良好的生存环境,刺激微生物的生长和活性。
氮肥施用对土壤产甲烷菌和甲烷氧化菌的影响较为复杂。Schimel(2000)研究表明,氮促进植株生长,为CH4产生提供前体基质,从而促进产甲烷菌的生长和活性;而许静等(2012)研究结果则相反,高氮肥施用在一定程度上会抑制产甲烷菌的生长,降低其数量。本研究中,施用氮肥降低稻麦季古菌和产甲烷菌丰度,控释肥的抑制作用小于尿素,这可能是由于尿素施用后通过硝化作用产生硝态氮,提升了土壤氧化还原电位,间接抑制产甲烷古菌的生长。铵态氮肥对土壤甲烷氧化菌的影响随NH4+和 CH4浓度的不同而变化(Oneill et al.,1977),本研究中,稻季生长前期,氮肥施用降低甲烷氧化菌数量,但稻麦季收获期,氮肥施用增加其数量,这是由于在稻田高内源CH4浓度条件下,施用铵态氮肥对稻田CH4氧化菌的作用开始表现为抑制,随着时间的延长和铵态氮的逐渐消失,高浓度CH4和铵态氮的存在促进了甲烷氧化菌的生长(Cai et al.,1997)。以上分析表明,2011年稻季施氮处理降低CH4排放量(表2),主要是由于氮肥对产甲烷菌生长的抑制作用及其对水稻生长前期甲烷氧化菌生长的促进作用。水稻生长前期,与尿素相比,施用控释肥对产甲烷菌和甲烷氧化菌数量没有明显影响,且 2011年稻季尿素处理和控释肥处理 CH4排放量之间无显著差异(表2),这进一步说明稻田CH4排放量与产甲烷菌和甲烷氧化菌数量之间具有显著相关性。
土壤中硝化细菌和反硝化细菌的数量与活性分别影响着土壤硝化作用和反硝化作用的强度。罗兰芳等(2007)研究发现,短期施用控释氮肥稻田土壤的氨化细菌和反硝化菌数量明显高于不施氮处理,氨化细菌、反硝化细菌的数量比尿素处理低,土壤中大多数微生物数量与土壤氮素养分含量呈正相关。本研究得到类似的结论,施用氮肥显著增加了稻麦季氨氧化菌和多种反硝化菌的数量,其中控释肥处理微生物数量显著低于尿素处理,这是由于尿素迅速溶解,氮素的剧增刺激了氨氧化菌和多种反硝化菌的生长繁殖,而控释肥的氮释放速率缓慢,对硝化菌和反硝化菌的影响较小。然而,氨氧化菌和反硝化菌数量并不随氮肥施用量的增加而增加。侯彦林等(2004)室内培养实验结果表明,当施肥量低于肥土比 1∶400时,硝化菌和反硝化菌数量随施肥量的增加无显著变化,而当施肥量高于肥土比 1∶400时,其随施肥量增加而下降,与Boer et al.(1988)的研究结果一致,这是由于尿素溶解后,高浓度 NO3--N抑制了硝化菌和反硝化菌的生长。本研究 2011年田间原位试验结果表明,稻季N2O排放主要集中在烤田期,与尿素相比,施用控释肥显著降低烤田期N2O排放量,从而降低整个稻季总排放量(表2),这与控释肥对硝化菌、反硝化菌数量的影响密切相关;施用控释肥显著降低氨氧化菌和多种反硝化菌数量,烤田期控释肥的抑制作用最为明显(表3)。因此,施用控释肥可降低氨氧化菌和多种反硝化菌的数量,进而降低稻季N2O排放量。
4 结论
本研究通过采集稻麦轮作系统田间原位试验新鲜土样,研究此间隙灌溉和控释肥施用耦合措施下稻麦轮作系统土壤微生物群落丰度的变化,以探讨此耦合措施降低稻麦轮作系统综合温室效应的微生物机理。整个稻麦轮作系统,除古菌外,稻季土壤细菌、产甲烷菌、甲烷氧化菌、氨氧化菌和反硝化菌丰度均高于麦季。间隙灌溉显著影响稻季产甲烷菌、甲烷氧化菌、氨氧化菌和反硝化菌数量的季节变化。稻季CH4和N2O的排放量与土壤微生物丰度之间存在显著相关性(P<0.05)。与尿素相比,施用控释肥降低了土壤氨氧化菌和 nirS/nirK/nosZ型反硝化菌,从而降低稻麦轮作系统 N2O的排放量;增加了土壤细菌、古菌和产甲烷菌数量,降低了甲烷氧化菌数量,从而影响稻麦轮作系统CH4的排放量。本研究表明,间隙灌溉和控释肥施用耦合措施通过影响稻麦轮作系统相关微生物的群落丰度进而减缓CH4和N2O气体的交互排放效应。
ANGEL R, CLAUS P, CONRAD R. 2012. Methanogenic archaea are globally ubiquitous in aerated soils and become active under wet anoxic conditions [J]. ISME Journal, 6: 847-862.
ARIF M A S, HOUWEN F, VERSTRAETE W. 1996. Agricultural factors affecting methane oxidation in arable soil [J]. Biology and Fertility of Soils, 21(1-2): 95-102.
BODELIER, P L E, FRENZEL E F. 1999. Contribution of methanotrophic and nitrifying bacteria to CH4and NH4+oxidation in the rhizosphere of rice plants as determined by new methods of discrimination [J].Applied and Environmental Microbiology, 65(5): 1826-1833.
BOER W D, DUYT S H, LAANBROCK H J. 1988. Autotrophic nitrification in a fertilized acid health soil [J]. Soil Biology and Biochemistry, 20(6): 845-850.
CAI Z C, XING G X, YAN X Y, et al. 1997. Methane and nitrous oxide emissions from rice paddy fields as affected by nitrogen fertilizers and water management [J]. Plant and Soil, 196(1): 7-14.
CHU H, FUJII T, MORIMOTO S, et al. 2007. Community structure of ammonia-oxidizing bacteria under long-term application of mineral fertilizer and organic manure in a sandy loam soil [J]. Applied and Environmental Microbiology, 73(2): 485-491.
CONRAD R. 2007. Soil microbial communities and global climate changemethanotrophic and methanogenic communities as paradigms. In Modern Soil Microbiology: Second Edition [M]//VANELSAS J D,JANSSON J, TREVORS J T. Boca Raton (FL): CRC Press: 263-282.
CONRAD R, KLOSE M, LU Y, et al. 2012. Methanogenic pathway and archaeal communities in three different anoxic soils amended with rice straw and maize straw [J]. Frontiers in Microbiology, doi:10.3389/fmicb.2012.00004.
COSTELLO A M, LIDSTROM M E. 1999. Molecular characterization of functional and phylogenetic genes from natural populations of methanotrophs in lake sediments [J]. Applied and Environmental Microbiology, 65(11): 5066-5074.
DELGADO J, MOSIER A. 1996. Mitigation alternatives to decrease nitrous oxides emissions and urea-nitrogen loss and their effect on methane flux [J]. Journal of Environmental Quality, 25(5): 1105-1111.
DUNBAR J, TICKNOR L O, KUSKE C R. 2001. Phylogenetic specificity and reproducibility and new method for analysis of terminal restriction fragment profiles of 16S rRNA genes from bacterial communities [J].Applied and Environmental Microbiology, 67(1): 190-197.
GROSSKOPF R, JANSSEN P H, LIESACK W. 1998. Diversity and structure of the methanogenic community in anoxic rice paddy soil microcosms as examined by cultivation and direct 16S rRNA gene sequence retrieval [J]. Applied and Environmental Microbiology,64(3): 960-969.
HEID C A, SREVRNS J. 1996. Real time quantitative PCR [J]. Genome Research, 6(10): 986-994.
HENRY S, BAUDOIN E, LOPEZ-GUTIERREZ J C, et al. 2004.Quantification of denitrifying bacteria in soils by nirK gene targeted real-time PCR [J]. Journal of Microbiological Methods, 59(3): 327-335.
HENRY S, BRU D, STRES B, et al. 2006. Quantitative detection of the nosZ gene, encoding nitrous oxide reductase, and comparison of the abundances of 16S rRNA, narG, nirK, and nosZ genes in soils [J].Applied and Environmental Microbiology, 72(8): 5181-5189.
JI Y, LIU G, MA J, et al. 2014. Effects of urea and controlled release urea fertilizers on methane emission from paddy fields: a multi-year field study [J]. Pedosphere, 24(5): 662-673.
JI Y, LIU G, MA J, et al. 2013. Effect of controlled-release fertilizer (CRF)mitigating N2O emission from paddy field in South China: a multi-year field observation [J]. Plant and Soil, 371(1-2): 473-486.
JIA Z J, SUGANO A, ASARI N, et al. 2007. Molecular characterization of methane-oxidizing bacteria associated with rice straw decomposition in a rice field [J]. Soil Science and Plant Nutrition, 53(6): 729-739.
KANDELER E, DEIGLMAYR K, TSCHERKO D, et al. 2006. Abundance of narG, nirS, nirK, and nosZ genes of denitrifying bacteria during primary successions of a glacier foreland [J]. Applied and Environmental Microbiology, 72(9): 5957-5962.
LANE D J. 1991. 16S/23S rRNA sequencing. In Nucleic Acid Techniques in Bacterial Systematics [M]//STACKEBRANDT E, GOODFELLOW M.New York: Wiley: 115-147.
LIU B R, JIA G M, CHEN J, et al. 2006. A review of methods for studying microbial diversity in soils [J]. Pedosphere, 16(1): 18-24.
MA K, CONRAD R, LU Y H. 2012. Responses of methanogen mcrA genes and their transcripts to an alternate dry/wet cycle of paddy field soil [J].Applied and Environmental Microbiology, 78 (2): 445-450.
MAEDA K, MORIOKA R, HANAJIMA D, et al. 2010. The impact of using mature compost on nitrous oxide emission and the denitrifier community in the cattle manure composting process [J]. Microbial Ecology, 59(1): 25-36.
MILLER M N, ZEBARTH B J, DANDIE C E, et al. 2008. Crop residue influence on the denitrification, N2O emissions and denitrifiers community abundance [J]. Soil Biology and Biochemistry, 40(10):2553-2562.
ONEILL J G, WILKINSON J F. 1977. Oxidation of ammonia by methane oxidizing bacteria and the effects of ammoniaon methane oxidation [J].Journal of General Microbiology, 100: 407-412.
PROSSER J I. 2002. Molecular and functional diversity in soil microorganisms [J]. Plant and Soil, 244(1-2): 9-17.
RÖSCH C, MERGEL A, BOTHE H, et al. 2002. Biodiversity of denitrifying and dinitrogen-fixing bacteria in an acid forest soil [J].Applied and Environmental Microbiology, 68(8): 3818-3829.
SCHIMEL J. 2000. Global change: rice, microbes and methane [J]. Nature,403: 375-377.
THEISEN A R, ALI M H, RADAJEWSKI S, et al. 2005. Regulation of methane oxidation in the facultative methanotroph Methylocella silvestris BL2 [J]. Molecular Microbiology, 58(3): 682-692.
TOWPRAYOON S, SMAKGAHN K, POONKAEW S. 2005. Mitigation of methane and nitrous oxide emissions from drained irrigated rice fields[J]. Chemosphere, 59(11): 1547-1556.
TRENKEL M E. 1997. Controlled-Release and Stabilized Fertilizers in Agriculture [M]. Pairs: Published by international Fertilizer Industry Association.
WATANABE T, KIMURA M, ASAKAWA S. 2006. Community structure of methanogenic archaea in paddy field soil under double cropping(rice-wheat) [J]. Soil Biology and Biochemistry, 38(6): 1264-1274.
YAN X Y, DU L, SHI S, et al. 2000. Nitrous oxide emission from wetland rice soil as affected by the application of controlled-availability fertilizers and mid-season aeration [J]. Biology and Fertility of Soils,32(1): 60-66.
YAN X Y, YAGI K, AKIYAMA H, et al. 2005. Statistical analysis of the major variables controlling methane emission from rice fields [J].Global Change Biology, 11(7): 1131-1141.
YUAN Q, LIU P F, LU Y H. 2012. Differential responses of nirK- and nirS-carrying bacteria to denitrifying conditions in the anoxic rice field[J]. Environmental Microbiology Reports, 4(1): 113-122.
ZHANG G B, JI Y, MA J, et al. 2012. Intermittent irrigation changes production, oxidation, and emission of CH4in paddy fields determined with stable carbon isotope technique [J]. Soil Biology and Biochemistry, 52: 108-116.
ZHANG G B, LIU G, ZHANG Y, et al. 2013. Methanogenic pathway and fraction of CH4oxidized in paddy fields: seasonal variation and effect of water management in winter fallow season [J]. PLoS ONE, 8(9):e73982.
保琼莉, 巨晓棠. 2011. 夏玉米根系密集区与行间N2O浓度及与氨氧化细菌和反硝化细菌数量的关系[J]. 植物营养与肥料科学, 17(5):1156-1165.
蔡祖聪, 徐华, 马静. 2009. 稻田生态系统CH4和N2O排放[M]. 合肥:中国科学技术大学出版社: 70: 155-160.
陈中云, 闵航, 陈美慈, 等. 2001. 不同水稻土甲烷氧化菌和产甲烷菌数量与甲烷排放量之间相关性的研究[J]. 生态学报, 21(9): 1499-1504.
侯彦林, 王曙光, 郭伟. 2004. 尿素施肥量对土壤微生物和酶活性的影响[J]. 土壤通报, 35(3): 303-306.
贾仲君, 蔡祖聪. 2003. 稻田甲烷氧化与铵氧化关系研究进展[J]. 农村生态环境, 19(4): 40-44.
李大明, 成艳红, 刘满强, 等. 2013. 双季稻田甲烷排放与土壤产甲烷菌群落结构和数量关系研究[J]. 农业环境科学学报, 32(4): 866-873.
李方敏, 樊小林, 刘芳, 等. 2004. 控释肥料对稻田氧化亚氮排放的影响[J]. 应用生态学报, 15(11): 2170-2174.
林匡飞, 项雅玲, 姜达炳, 等. 2000. 湖北地区稻田甲烷排放量及控制措施的研究[J]. 农业环境保护, 19(5): 267-270.
罗兰芳, 郑圣先, 廖育林, 等. 2007. 控释氮肥对稻田土壤微生物的影响及其与土壤氮素肥力的关系[J]. 湖南农业大学学报, 33(5): 608-613.
孟庆英, 朱宝国, 王囡囡, 等. 2012. 控释尿素与常规尿素不同配施对根际土壤微生物数目、土壤氮素及玉米产量的影响[J]. 土壤通报,43(5): 1173-1176.
吴金水, 葛体达, 胡亚军. 2015. 稻田土壤关键元素的生物地球化学耦合过程及其微生物调控机制[J]. 生态学报, 35(20): 6626-6634.
许静, 严陈, 林毅, 等. 2012. FACE对水稻土产甲烷古菌丰度的影响[J].土壤学报, 49(6): 1248-1251.
易琼, 逄玉万, 杨少海, 等. 2013. 施肥对稻田甲烷与氧化亚氮排放的影响[J]. 生态环境学报, 22(8): 1432-1437.
于海洋, 杨玉婷, 马静, 等. 2017. 硝化抑制剂对覆膜稻田CH4和N2O排放的影响[J]. 生态环境学报, 26(3): 461-467.
张广斌, 张晓艳, 马二登, 等. 2010. 冬季土地管理对稻季CH4产生、氧化和排放的影响[J]. 生态与农村环境学报, 26(2): 97-102.
Effect of the Coupling Technique of Intermittent irrigation and Controlledrelease Fertilizer on the Abundance of Soil Microbial Communities from Rice-wheat Rotation Ecosystem
JI Yang1,2, YU Haiyang2, CONRAD Ralf3, XU Hua2*
1. College of Applied Meteorology, Nanjing University of Information Science & Technology, Nanjing 210044, China;
2. State Key Laboratory of Soil and Sustainable Agriculture//Institute of Soil Science, Chinese Academy of Science, Nanjing 210008, China;
3. Max Planck Institute for Terrestrial Microbiology, Marburg, 35043 Germany
The coupling technique of intermittent irrigation and controlled-release fertilizer (CRF) application is expected to reduce CH4and N2O emissions from rice-wheat rotation ecosystem by the author’s previous studies, but its effect on the microbial communities remain poorly understood. Fresh soils were sampled through the rice-wheat rotation seasons in a field experiment to elucidate the microbial mechanisms of effects of the coupling technique of intermittent irrigation and controlled-release fertilizer(CRF) application on CH4and N2O emissions by analyzing the abundance of soil microbial communities using the method Real-time PCR. The abundances of bacterial, methanogens, methanotrophs, ammonia-oxidizing bacteria and denitrifiers were higher during rice growing season than that during wheat growing season. Intermittent irrigation significantly influenced the seasonal variation of abundances of methanogens, methanotrophs, ammonia-oxidizing bacteria and nirS/nirK/nosZ-type denitrifiers. Compared with urea,CRF increased the abundances of archaea, bacteria and methanogens, while decreased the abundances of methanotrophs,ammonia-oxidizing bacteria, nirS/nirK/nosZ-type denitrifiers. CH4and N2O emissions were significantly correlated with the abundances of soil microbial communities. CH4emission was positively correlated with the abundances of archaea, methanogens and methanotrophs (P<0.01), while it was negatively correlated with the abundances of ammonia-oxidizing bacteria (P<0.05). N2O emission was positively correlated with the abundances of ammonia-oxidizing bacteria, methanotrophs, nirK-type and nosZ-type denitrifiers (P<0.05), while no significant relationship was found with nirS-type denitrifiers. The results indicated that the coupling technique of intermittent irrigation and controlled-release fertilizer application mitigated the CH4and N2O emissions from rice-wheat rotation ecosystem by influencing the abundance of related functional microbial communities.
intermittent irrigation; controlled-release fertilizer; rice-wheat rotation; soil microbial communities; CH4and N2O emissions
10.16258/j.cnki.1674-5906.2017.10.008
S154.3; X172
A
1674-5906(2017)10-1696-08
纪洋, 于海洋, Ralf Conrad, 徐华. 2017. 间隙灌溉和控释肥施用耦合措施对稻麦轮作系统土壤微生物群落丰度的影响[J]. 生态环境学报, 26(10): 1696-1703.
JI Yang, YU Haiyang, CONRAD Ralf, XU Hua. 2017. Effect of the coupling technique of intermittent irrigation and controlledrelease fertilizer on the abundance of soil microbial communities from rice-wheat rotation ecosystem [J]. Ecology and Environmental Sciences, 26(10): 1696-1703.
国家自然科学基金项目(41401268);江苏省基础研究计划青年基金项目(BK20140992);江苏省高校自然科学研究面上项目(14KJB210006);土壤与农业可持续发展国家重点实验室开放基金课题(Y412201414)
纪洋(1986年生),女,讲师,博士,研究方向为农田温室气排放的生态环境过程及微生物调控机制研究。E-mail: jiyang@nuist.edu.cn*通信作者:徐华(1966年生),男,研究员,博士。E-mail: hxu@issas.ac.cn
2017-07-25

