羧甲基化龙眼肉多糖制备工艺优化及其抗氧化、免疫活性
韦毅铭,何 舟*,田海芬,王 警,吴妮妮,黄 静,杨艳芳,李雪华,*,农真真,魏 梅,潘 欣,李 果
(1.广西医科大学药学院,广西 南宁 530021;2.广西壮族自治区人民医院,广西 南宁 530021;3.百色市人民医院,广西 百色 533000)
羧甲基化龙眼肉多糖制备工艺优化及其抗氧化、免疫活性
韦毅铭1,何 舟2,*,田海芬3,王 警1,吴妮妮1,黄 静1,杨艳芳1,李雪华1,*,农真真1,魏 梅1,潘 欣1,李 果1
(1.广西医科大学药学院,广西 南宁 530021;2.广西壮族自治区人民医院,广西 南宁 530021;3.百色市人民医院,广西 百色 533000)
利用响应面法优化羧甲基化龙眼肉多糖制备工艺,并测定其体外抗氧化活性,同时建立小鼠免疫低下模型,对所得多糖进行体内免疫调节活性研究。以羧甲基取代度为指标,通过单因素试验对一氯乙酸(monochloroacetic acid,MCA)浓度、反应温度、反应时间进行分析,得到羧甲基化龙眼肉多糖最佳制备条件为MCA浓度1.2 mol/L、反应温度73 ℃、反应时间3.2 h,取代度可达1.053。抗氧化活性研究表明,在质量浓度为200~3 200 μg/m L范围内,龙眼肉多糖(polysaccharide from Dimocarpus longan pulp,LYP)、羧甲基化龙眼肉多糖(crboxymethylated polysaccharide from Dimocarpus longan pulp,CM-LYP)的抗氧化能力与质量浓度呈剂量依赖关系,当剂量质量浓度达3 200 μg/m L时,LYP、CM-LYP对羟自由基清除率分别为(42.35±5.67)%、(84.39±4.47)%,对超氧阴离子自由基的清除率分别为(51.91±5.34)%、(87.91±7.32)%,对脂质过氧化的抑制率分别为(67.91±5.72)%、(79.85±2.92)%、对H2O2诱导的红细胞溶血的抑制率分别为(47.23±3.5)%、(54.66±2.83)%,表明羧甲基的引入增强了龙眼肉多糖的抗氧化活性;体内免疫活性实验表明,羧甲基化龙眼肉多糖可提高免疫抑制小鼠的脾脏指数、促进血清溶血素形成、提高血清和脾脏中溶菌酶含量及调节Th1/Th2平衡,与修饰前龙眼肉多糖相比,羧甲基化龙眼肉多糖具有更好的免疫调节作用。
龙眼肉多糖;羧甲基化;响应面法;抗氧化活性;体内免疫活性
龙眼(Dimocarpus longan Lour.)亦称“桂圆”,属无患子科龙眼属植物,最早被记载于《神农本草经》,盛产于我国华南地区。据文献报道,龙眼具有壮阳益气,补心益脾,润肤美容,延年益寿等功效,可以治疗或改善贫血,心悸,神经衰弱等症状[1]。龙眼肉多糖(polysaccharide from Dimocarpus longan pulp,LYP)是龙眼肉中主要的活性成分之一,课题组前期研究显示,其毒副作用低,具有良好的生物活性、免疫调节功能及抗肿瘤活性[2-5]。
多糖的生物活性与其结构息息相关,对多糖进行修饰,可得到新的具有不同活性的多糖衍生物。化学、生物和物理方法是常见的修饰方法,其中化学修饰是开发多糖类药物的一种重要方法,如针对多糖的构效关系,对其空间结构、分子质量、活性基团种类等进行修饰,可改善其生物活性,甚至赋予新的生物活性[6-8]。多糖修饰的方法有很多,如硫酸化、磷酸化、乙酰化、烷基化、磺酰化、羧甲基化等[9-15]。其中羧甲基化由于其反应过程具有易于控制,成本低廉,反应产物无毒性等优点,在多糖的结构修饰研究中得到了广大研究者的关注[16]。
羧甲基化修饰主要是在多糖的支链上引入羧甲基基团,据相关文献报道,羧甲基的引入可改善多糖的生物活性[17-19]。基于此,本实验对龙眼肉多糖进行了羧甲基化修饰,并优化其制备工艺,并对龙眼肉多糖修饰产物的分子质量、抗氧化活性、体内免疫活性等进行测定,以期对羧甲基化龙眼肉多糖(crboxymethylated polysaccharide from Dimocarpus longan pulp,CM-LYP)理化性质和活性的影响有初步的了解,为龙眼肉多糖的进一步开发和利用提供理论依据。
1 材料与方法
1.1 材料与试剂
龙眼干果购自广西南宁交易市场,经广西中医药研究所严克俭检验员鉴定为石硖龙眼(Dimocarpus longan Lour.)。
注射用环磷酰胺(cyclophospham ide,CY) 山西普德药业股份有限公司;红细胞保存液、培养基、豚鼠血清、溶菌酶试剂盒、IFN-γ试剂盒、IL-4试剂盒 上海源叶生物科技有限公司;三氯乙酸、硫代巴比妥酸、VC、一氯乙酸(monochloroacetic acid,MCA)、盐酸羟胺、三氯化铁、氢氧化钠、无水乙醇、30%过氧化氢溶液、木瓜蛋白酶、葡萄糖、苯酚、浓硫酸、盐酸、羟基乙酸(乙醇酸)、变色酸等均为分析纯。
SPF级昆明小鼠,体质量(20±2)g,周龄6~8 周,购于广西医科大学实验动物中心。
1.2 仪器与设备
Lambda650型紫外-可见光分光光度计、Spectrum100型傅里叶变换红外光谱仪 美国Perkin Elmer仪器有限公司;TDL-5A型低速台式离心机 上海菲恰尔分析仪器有限公司;HH-6型数显恒温水浴锅 国华电器有限公司;G1362A型高效液相色谱 美国Agilent公司;A L 20 4型电子天平、X S 20 5DU十万分之一电子天平 瑞士梅特勒-托利多公司;FD-1D-50型真空冷冻干燥机 北京博医康实验仪器有限公司;M ultiskan MK3酶联免疫检测仪 美国Thermo公司;BP190S电子分析天平 德国Startorius公司。
1.3 方法
1.3.1 LYP、CM-LYP的制备
LYP的制备按参考文献[20]方法进行。
CM-LY P的制备:取LY P 0.20 0 0 g,加入10 m L 3.0 mol/L氢氧化钠溶液,搅拌溶解后,缓慢加入MCA,60 ℃反应3 h后,冰乙酸或氢氧化钠调节pH 7,过滤,滤液经透析后冷冻干燥得CM-LYP。
1.3.2 CM-LYP的多糖含量、取代度测定及结构鉴定
LYP、CM-LYP中多糖含量测定:采用苯酚-硫酸法[21];LYP、CM-LYP结构测定:采用傅里叶变换红外光谱仪[22];LYP、CM-LYP的相对分子质量测定:采用高效凝胶渗透色谱法[23];CM-LYP羧基化取代度[24]测定:采用紫外分光光度法。
1.3.3 CM-LYP制备单因素试验和正交优化试验
1.3.3.1 CM-LYP制备单因素试验
固定反应温度60 ℃,反应时间3.0 h,测定不同MCA浓度(0.5、1、1.5、2、2.5 mol/L)对羧甲基化取代度的影响得出最佳MCA浓度;其次固定反应时间为3.0 h,MCA浓度为1.5 mol/L,测定不同反应温度(40、50、60、70、80 ℃)对羧甲基化取代度的影响,得出最佳反应温度;最后固定温度为70 ℃,MCA浓度为1.5 mol/L,测定不同反应时间(2、2.5、3、3.5、4 h)对羧甲基化取代度的影响,得出最佳反应时间。
1.3.3.2 CM-LYP制备的响应面优化设计

表1 响应面试验因素与水平Tab le 1 Code and level of independent variables used in response surface analysis
响应面试验设计如表1所示,按照Box-Behnken设计原理,在单因素试验的基础之上,以羧甲基化取代度为响应值,选取MCA浓度、反应温度和反应时间3 个单因素为自变量,优化龙眼肉多糖羧甲基化的制备工艺。
1.3.4 LYP、CM-LYP的抗氧化活性测定
1.3.4.1 LYP、CM-LYP对羟自由基的清除
分别配制3 组不同浓度的样品溶液,阳性对照VC组溶液质量浓度为20、40、80、160、320 μg/m L;LYP实验组溶液质量浓度为200、400、800、1 600、3 200 μg/m L;CM-LYP实验组溶液质量浓度为200、400、800、1 600、3 200 μg/m L。分别取1 m L样品溶液,依次加入1 m L 9 mmol/L FeSO4溶液、1 m L 9 mmol/L水杨酸的乙醇溶液、6 m L蒸馏水,摇匀。以等体积的蒸馏水代替样品溶液作空白对照组,以蒸馏水代替水杨酸测得吸光度(Ac)。最后加入1 m L 8.82 mmol/L H2O2溶液,37 ℃恒温水浴反应1 h后,在510 nm波长处测定吸光度(Ax)。实验结果用清除率(I)表示,见公式(1)。以I为纵坐标,多糖或VC质量浓度对数为横坐标作图,建立回归方程,计算IC50。
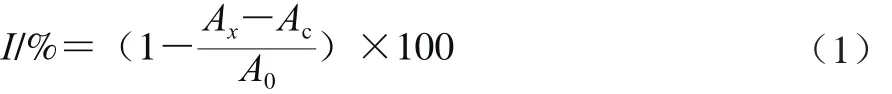
式中:Ac为本底组(蒸馏水代替水杨酸)的吸光度; Ax为样品组的吸光度;A0为对照组(用蒸馏水代替多糖)的吸光度。
1.3.4.2 LYP、CM-LYP对超氧阴离子自由基的清除
样品溶液的配制同1.3.4.1节。取4.6 m L 50 mmol/L pH 8.2的Tris-HCl缓冲液于试管中,置于25 ℃水浴中预热20 m in后,分别加入1 m L各样品溶液,再加入0.4 m L 10 mmol/L邻苯三酚溶液,摇匀后,置于25℃恒温水浴中反应4 m in,然后加入0.1 m L 8 mol/L HCl溶液终止反应,在325 nm波长处测定吸光度(Bx),用蒸馏水1 m L代替样品溶液测定吸光度(B0),用蒸馏水0.4 m L代替10 mmol/L邻苯三酚溶液测定吸光度(Bc)。清除率(E)的计算见公式(2)。
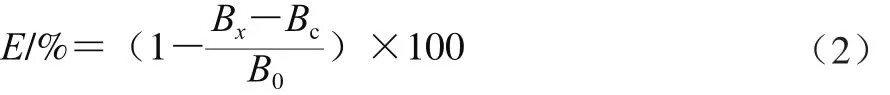
式中:Bc为本底组(蒸馏水代替邻苯三酚)的吸光度;Bx为样品组的吸光度;B0为对照组(蒸馏水代替样品溶液)的吸光度。
1.3.4.3 LYP、CM-LYP对小鼠肝匀浆脂质过氧化的影响
分别配制3 组不同质量浓度的样品溶液:阳性对照VC组溶液质量浓度为125、250、500、1 000、2 000 μg/m L;LYP实验组溶液质量浓度为250、500、1 000、2 000、4 000 μg/m L;CM-LYP实验组溶液质量浓度为250、500、1 000、2 000、4 000 μg/m L。
将昆明小鼠断颈处死后,快速取出肝脏,用冰冷生理盐水洗净,滤纸吸干水分后称质量,在冰水浴中将其研磨制成10 g/100 m L组织匀浆,高速离心后吸取上清液备用。分别移取上清液1.0 m L置于数支试管中,精密加入1.0 m L不同质量浓度的预先配制的样品溶液,充分摇匀,37 ℃恒温温孵1.5 h后,依次加入2 m L体积分数10%三氯乙酸溶液,2 m L体积分数0.67% 2-硫代巴比妥酸溶液,充分混匀后置于98 ℃水浴中反应15 m in,离心,取上清液,在532 nm波长处测定其吸光度(Hx)。以1m L生理盐水代替样品溶液测定吸光度(H0)。以1 m L生理盐水代替质量分数10%肝匀浆测定吸光度(Hc)。每个浓度组平行测定5 份。测定结果以脂质过氧化抑制率(F)表示,抑制率的计算见公式(3)。
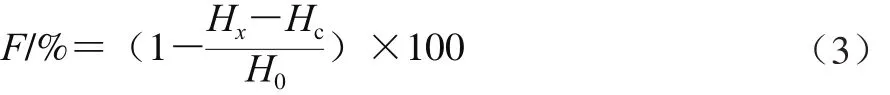
式中:Hc为本底组(生理盐水代替肝匀浆)的吸光度;Hx为样品组的吸光度;H0为对照组(生理盐水代替样品溶液)的吸光度。
1.3.4.4 LYP、CM-LYP对H2O2诱导红细胞溶血的影响
分别配制3 组不同质量浓度的样品溶液:阳性对照VC组溶液质量浓度为28.6、57.1、114.3、228.6、457.1 μg/m L;LYP实验组溶液质量浓度为28.6、57.1、114.3、228.6、457.1 μg/m L;CM-LYP实验组溶液质量浓度为28.6、57.1、114.3、228.6、457.1 μg/m L。
昆明小鼠摘除眼球后收集全血,离心,弃上清液得红细胞,采用生理盐水清洗,离心,用生理盐水制成体积分数0.5%的红细胞悬液。取1 m L红细胞悬液,加入1 m L不同质量浓度的样品溶液,再加入0.2 m L 50 mmol/L H2O2溶液,37 ℃水浴温孵1 h后,加5 m L生理盐水稀释,离心,取上清液,以生理盐水为空白,在415 nm波长处测定吸光度(Kx)。以生理盐水1 m L代替样品溶液测定吸光度(K0),用生理盐水1 m L代替0.5%红细胞悬浮液测定吸光度(Kc)。每个质量浓度组平行测定5 次。抑制率的计算见公式(4),并计算半数抑制溶血浓度IC50。

式中:Kc为空白对照组测定的吸光度;Kx为实验组测定的吸光度;K0为阳性对照组测定的吸光度。
1.3.5 LYP、CM-LYP对小鼠体内免疫活性测定
1.3.5.1 实验分组与实验方法
将110 只昆明小鼠((20±2)g,雌雄各半)按体质量随机分为11 组,每组10 只。正常对照组:每天腹腔注射生理盐水0.2 m L;环磷酰胺模型组(CY组):每隔3 d腹腔注射20 mg/kg环磷酰胺一次;阳性对照香菇多糖组:每隔3 d腹腔注射环磷酰胺一次,每天灌胃香菇多糖40 mg/kg;CM-LYP组:每隔3 d腹腔注射环磷酰胺一次,每天灌胃CM-LYP一次,分为160、80、40、20 mg/kg 4 个剂量组;LYP组:每隔3 d腹腔注射环磷酰胺一次,每天灌胃LYP一次,分为160、80、40、20 mg/kg 4 个剂量组。实验连续进行21 d。最后一天给药后24 h,眼球采血,将所有小鼠处死,分别测定其脾脏指数、溶菌酶、溶血素、IFN-γ和IL-4含量。
1.3.5.2 LYP、CM-LYP对免疫抑制小鼠脾脏指数的影响
将小鼠断颈处死后摘取脾脏,将脾脏周围的结缔组织剔除干净,用生理盐水洗去残留在脾脏上的血渍,用滤纸吸干脾脏表面的水分后称质量,并立即置于冰上,待后期处理。脾脏指数计算方法见公式(5):
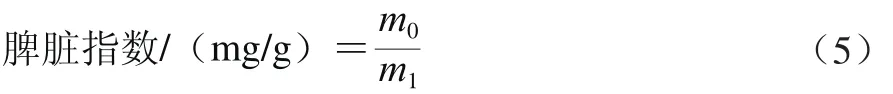
式中:m1为小鼠体质量/g;m0为脾脏质量/mg。
1.3.5.3 LYP、CM-LYP对免疫抑制小鼠血清中溶血素的影响
小鼠连续饲养至第15天后,对小鼠腹腔注射体积分数2%绵羊红细胞(sheep red blood cell,SRBC)溶液0.2 m L使致敏,1 h后眼球取血,2 000 r/m in离心10 m in,取血清0.2 m L,用生理盐水稀释50倍,置于管中,再加入3.75 m L 的体积分数3% SRBC溶液和体积分数10%的豚鼠血清稀释液0.2 m L,空白组以生理盐水作对照,然后置于25 ℃温箱保温1 h后,取出放入冰浴中终止反应,1 000 r/m in离心2 m in,取上清液,在540 nm波长处测定OD值。精密吸取体积分数2% SRBC溶液0.5 m L溶于1.5 m L蒸馏水中为100%溶血管,用生理盐水等体积稀释后作为50%溶血管,用酶标仪测定540 nm波长处的吸光度,即得SRBC半数溶血时的OD值。样品的半数溶血值(HC50)计算见公式(6)[25]:

1.3.5.4 LYP、CM-LYP对免疫抑制小鼠脾脏和血清中溶菌酶含量的影响
按1.3.5.2节取脾脏,与生理盐水按料液比为1∶9(g/m L),在冰水浴中制备10%组织匀浆,5 000 r/m in离心10 m in,取沉淀,分装后置于-20 ℃冰箱备用。用溶菌酶试剂盒测定脾脏组织和血清中溶菌酶(lysozyme,LZM)含量。
1.3.5.5 LYP、CM-LYP对免疫抑制小鼠血清中IFN-γ和IL-4含量的影响
小鼠连续饲养至第21天后,摘除眼球收集全血,离心,取上清液得血清。分别采用IFN-γ、IL-4试剂盒测定小鼠血清中IFN-γ和IL-4含量,操作方法按照说明书进行。
2 结果与分析
2.1 多糖结构鉴定
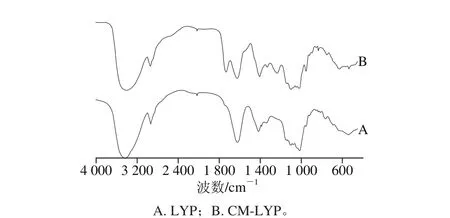
图1 龙眼肉多糖羧甲基化修饰前后红外光谱分析Fig. 1 FTIR spectra of LYP and CM-LYP
由图1可以看出,CM-LYP在1 603.43、1 420.15、1 326.22 cm-1波数处出现了—CH2COOH的特征吸收峰,其中,1 603.43 cm-1波数处吸收峰为强峰,属C—O键非对称伸缩振动;在1 420.15、1 326.22 cm-1波数处2 个峰为中强峰,属羰基C=O的对称伸缩振动和—CH—的变角振动峰。说明了羧甲基已成功引入到龙眼肉多糖的分子结构中。

图2 LYP、CM-LYP的高效凝胶色谱图Fig. 2 HPGPC profi les of LYP and CM-LYP
如图2所示,经测定,龙眼肉多糖羧甲基化修饰前后的多糖质量分数分别为95.8%和95.2%,分子质量分别为1.51×105D和1.29×105D。
2.2 CM-LYP制备工艺优化
2.2.1 单因素试验结果
2.2.1.1 MCA浓度对羧甲基化取代度的影响
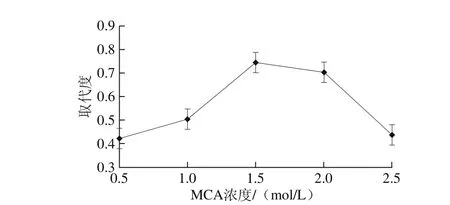
图3 MCA浓度对取代度的影响Fig. 3 Effect of MCA concentration on degree of substitution
如图3所示,随着MCA浓度的逐渐升高,取代度逐渐增大,当MCA浓度超过1.5 mol/L后,取代度下降。因此确定最优的MCA浓度为1.5 mol/L。
2.2.1.2 反应温度对羧甲基化取代度的影响

图4 反应温度对取代度的影响Fig. 4 Effect of reaction tem perature on degree of substitution
如图4所示,在40~70 ℃范围内,伴随反应温度的升高,取代度逐渐增大,随着温度的进一步提高,取代度开始下降,因此最佳反应温度应为70 ℃。
2.2.1.3 反应时间对羧甲基化取代度的影响

图5 反应时间对取代度的影响Fig. 5 Effect of reaction time on degree of substitution
如图5所示,当反应时间为2.0~3.0 h时,取代度随着时间的延长而增大,3.0 h时取代度最高,超过3.0 h时,取代度出现下降,因此确定最优的反应时间为3.0 h。
2.2.2 羧甲基化龙眼肉多糖工艺优化
选取反应时间、反应温度和MCA浓度为研究因素,以羧甲基化取代度为指标,使用统计分析软件Design-Expert 8.05建立三因素三水平共17 个试验点的响应面试验,以优化羧甲基化龙眼肉多糖合成条件,响应面试验及方差分析结果如表2和表3所示。
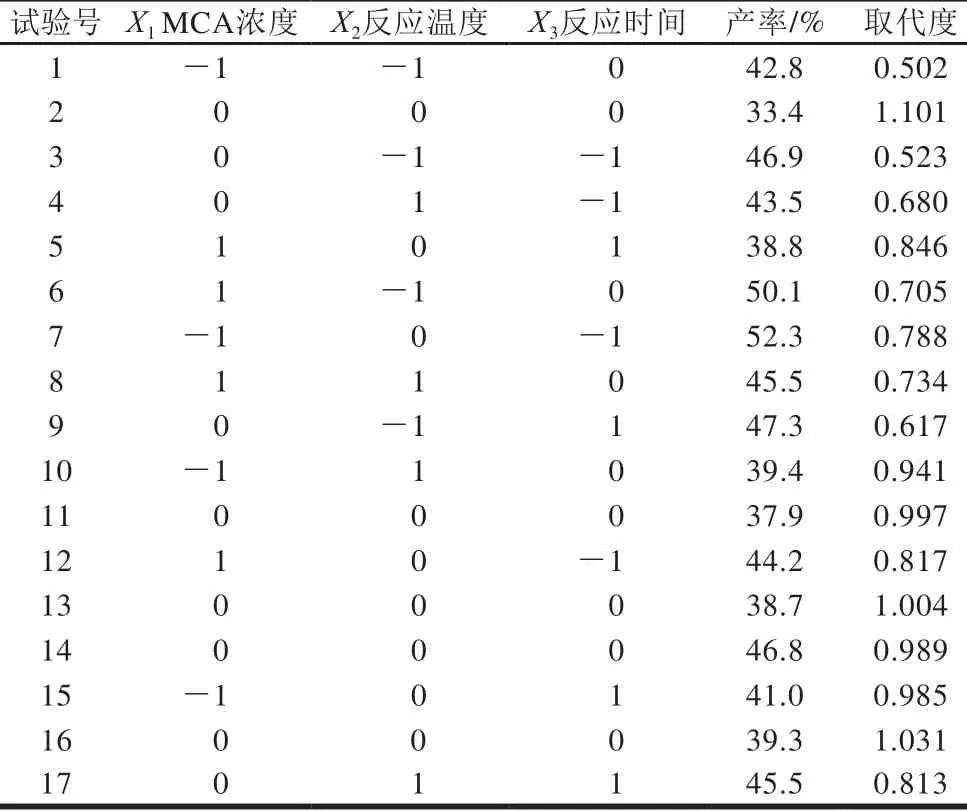
表2 响应面试验优化及结果Table 2 Experimental design and results for RSM
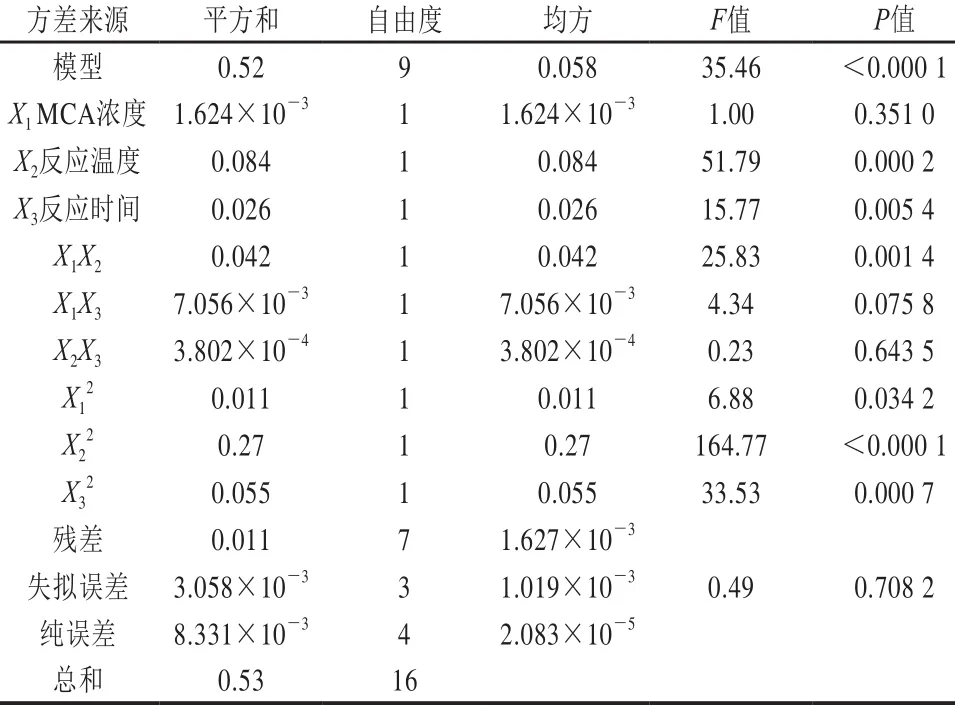
表3 方差分析Table 3 Analysis of variance
响应面优化试验的结果见表2,采用Design-Expert 8.06软件对试验结果进行二次方程拟合,得到以下方程:Y=1.02-0.014X1+0.10X2+0.057X3-0.10X1X2-0.042X1X3-9.750×10-3X2X3-0.052X12-0.25X22-0.11X32。
从表3可以看出,模型的显著水平P<0.000 1,因变量和全体自变量之间的线性关系显著(r=0.52/0.53=0.981)。失拟项不显著(P=0.708 2),说明其他因素对取代度干扰很小,回归模型与实际情况相符合。影响取代度大小的因素主次顺序依次为反应温度、反应时间和MCA浓度。相互影响因素中,MCA浓度与反应温度相互影响最为显著。

图6 各因素交互作用对羧甲基化取代度的影响Fig. 6 Response surface plots showing the interactive effects of reaction conditions on degree of substitution
如图6所示,对响应面图进行分析,得出最佳工艺条件为MCA浓度1.2 mol/L、反应温度73 ℃、反应时间3.2 h,此时CM-LYP的羧甲基取代度达到1.057。
2.2.3 模型验证
为了验证模型的稳定性、可行性,本实验固定合成工艺条件为MCA浓度1.2 mol/L、反应温度73℃、反应时间3.2 h。在该工艺条件下,平行3 次对龙眼肉多糖进行羧甲基化修饰,结果如表4所示,实际获得的羧甲基的取代度与理论值相近,表明所建立的回归曲线数学模型预测性较好,也证实响应面法优选龙眼肉多糖羧甲基化工艺结果稳定、可行。

表4 验证实验Table 4 Validation of the optim ized conditions
2.3 LYP、CM-LYP体外抗氧化活性测定结果
2.3.1 LYP、CM-LYP清除羟自由基能力
如表5所示,LYP、CM-LYP均具有清除羟自由基的能力,且呈现剂量依赖关系。从物质的量浓度考虑,LYP、CM-LYP、VC的IC50分别为4.67×10-5、3.44×10-6、4.80×10-4mol/L,说明羧甲基的引入可以提高LYP对羟自由基的清除能力,且优于VC,这可能与修饰后的多糖的结构以及羟基基团的含量有关。
表5 LYP和CM-LYP对羟自由基的清除率(x ±s,n=5)Table 5 Percentage scavenging of hydroxyl radical by LYP and CM-LYP (x s, n= 5)

表5 LYP和CM-LYP对羟自由基的清除率(x ±s,n=5)Table 5 Percentage scavenging of hydroxyl radical by LYP and CM-LYP (x s, n= 5)
样品 质量浓度/(μg/m L) I/% IC50/(mol/L)200 10.42±2.64 LYP 400 21.77±5.29 800 28.63±3.76 1 600 36.90±3.97 3 200 42.35±5.67 4.67×10-5 200 31.14±5.54 CM-LYP 400 42.67±3.27 800 58.44±7.02 1 600 77.36±5.29 3 200 84.39±4.47 3.44×10-6 20 12.78±2.78 VC 40 26.65±3.02 80 48.85±3.94 160 72.23±5.66 320 82.18±3.13 4.80×10-4
2.3.2 LYP、CM-LYP清除超氧阴离子自由基能力
表6 LYP和CM-LYP对超氧阴离子自由基的清除率(x ±s,n=5)Table 6 Percentage scavenging of superoxide anion radical by LYP and CM-LYP (x s, n= 5)

表6 LYP和CM-LYP对超氧阴离子自由基的清除率(x ±s,n=5)Table 6 Percentage scavenging of superoxide anion radical by LYP and CM-LYP (x s, n= 5)
样品 质量浓度/(μg/m L) E/% IC50/(mol/L)200 23.76±4.14 LYP 400 34.57±3.59 800 41.78±2.77 1 600 47.23±2.87 3 200 51.91±5.34 1.88×10-5 200 33.98±6.10 CM-LYP 400 45.40±4.73 800 55.68±3.87 1 600 76.09± 5.17 3 200 87.91±7.32 3.24×10-6 20 16.44±1.85 VC 40 29.56±4.72 80 45.68±2.69 160 66.09±4.30 320 73.91±5.45 5.37×10-4
如表6所示,LYP、CM-LYP对超氧阴离子自由基的清除率与质量浓度呈剂量相关。从物质的量浓度考虑,LYP、CM-LYP、VC的IC50分别为1.88×10-5、3.24×10-6、5.37×10-4m o l/L,说明羧甲基的引入可以增强LYP对超氧阴离子自由基的清除能力,且优于VC。
2.3.3 LYP、CM-LYP对小鼠肝匀浆脂质过氧化的影响
表7 LYP和CM-LYP对脂质过氧化的影响(x ±s,n=5)Tab le 7 Inhibitory effects of LYP and CM-LYP on lipid peroxidation(x s, n= 5)
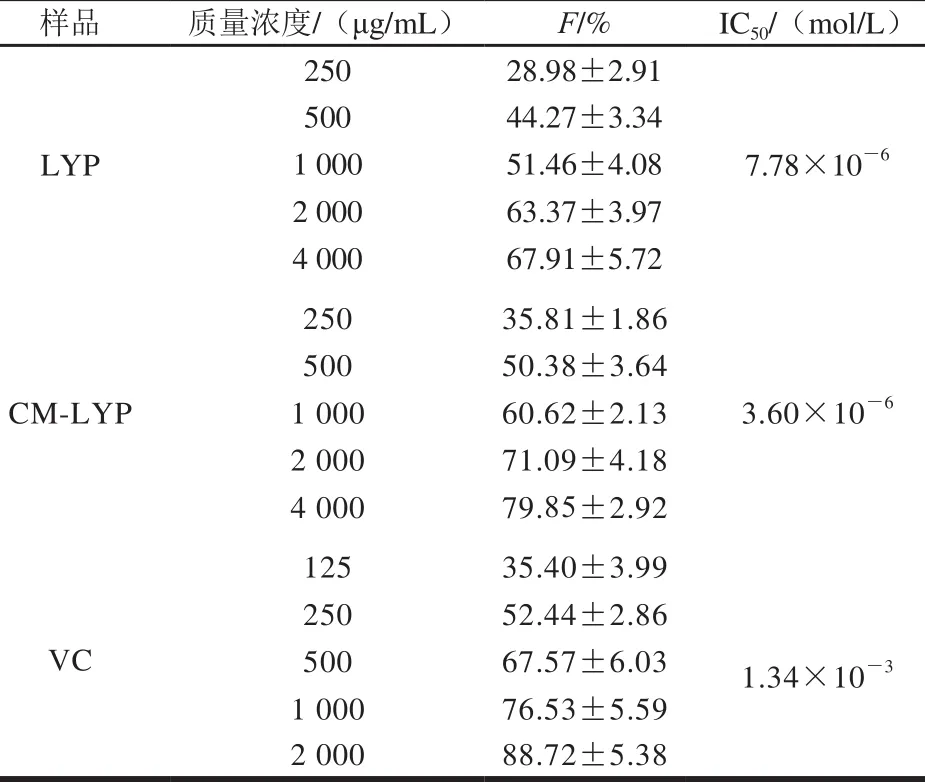
表7 LYP和CM-LYP对脂质过氧化的影响(x ±s,n=5)Tab le 7 Inhibitory effects of LYP and CM-LYP on lipid peroxidation(x s, n= 5)
样品 质量浓度/(μg/m L) F/% IC50/(mol/L)250 28.98±2.91 500 44.27±3.34 LYP 1 000 51.46±4.08 7.78×10-6 2 000 63.37±3.97 4 000 67.91±5.72 250 35.81±1.86 500 50.38±3.64 CM-LYP 1 000 60.62±2.13 3.60×10-6 2 000 71.09±4.18 4 000 79.85±2.92 125 35.40±3.99 250 52.44±2.86 VC 500 67.57±6.03 1.34×10-3 1 000 76.53±5.59 2 000 88.72±5.38
如表7所示,在一定范围内,LYP、CM-LYP、VC均可有效抑制小鼠肝匀浆自发性脂质过氧化反应,且与质量浓度呈现一定的剂量依赖关系。从物质的量浓度考虑,LYP、CM-LYP、VC的半数抑制浓度分别为7.78×10-6、3.60×10-6、1.34×10-3mol/L,表明羧甲基的引入,可增强LYP抑制脂质过氧化能力,且优于VC。2.3.4 LYP、CM-LYP对H2O2诱导的红细胞溶血的影响
表8 LYP和CM-LYP对H2O2诱导的红细胞溶血的影响(x±s,n=5)Table 8 Inhibitory effects of LYP and CM-LYP) on red cell hemolysis induced by H 2O2 (x s, n= 5)

表8 LYP和CM-LYP对H2O2诱导的红细胞溶血的影响(x±s,n=5)Table 8 Inhibitory effects of LYP and CM-LYP) on red cell hemolysis induced by H 2O2 (x s, n= 5)
样品 质量浓度/(μg/m L) H/% IC50/(mol/L)28.6 17.74±1.46 57.1 21.62±4.19 LYP 114.3 31.37±3.05 228.6 38.9±4.37 5.26×10-6 457.1 47.23±3.59 28.6 28.38±2.21 57.1 33.81±4.73 CM-LYP 114.3 44.35±5.17 1.74×10-6 228.6 48.45±3.55 457.1 54.66±2.83 28.6 26.05±3.83 57.1 34.15±4.05 VC 114.3 41.69±5.87 9.61×10-4 228.6 52.44±3.29 457.1 67.18±5.02
如表8所示,随着样品质量浓度的增加,溶血抑制率逐渐升高,表明LYP、CM-LYP、VC均能抑制H2O2诱导的红细胞溶血,且其抑制能力与样品质量浓度呈现一定剂量效应。VC、LYP、CM-LYP的IC50分别为9.61×10-4、5.26×10-6、1.74×10-6mol/L,表明羧甲基的引入增强了LYP的抗溶血能力,且优于VC。
2.4 体外免疫活性
2.4.1 LYP、CM-LYP对免疫抑制小鼠脾脏指数的影响脾脏是机体最大的外周免疫器官,含有大量由骨髓干细胞发育而来的B淋巴细胞,另外还有大量T淋巴细胞和巨噬细胞,因此脾脏参与细胞免疫、体液免疫及非特异性免疫[25]。脾脏指数能反映免疫器官的发育和免疫细胞的功能状况,脾脏指数的高低能够较为客观地反映机体非特异性免疫能力[26]。
表9 LYP和CM-LYP对免疫抑制小鼠脾脏指数的影响(x ±s,n=10)Tab le 9 Effects of LYP and CM-LYP on sp leen index in immunosuppressed m ice (x s, n= 10)
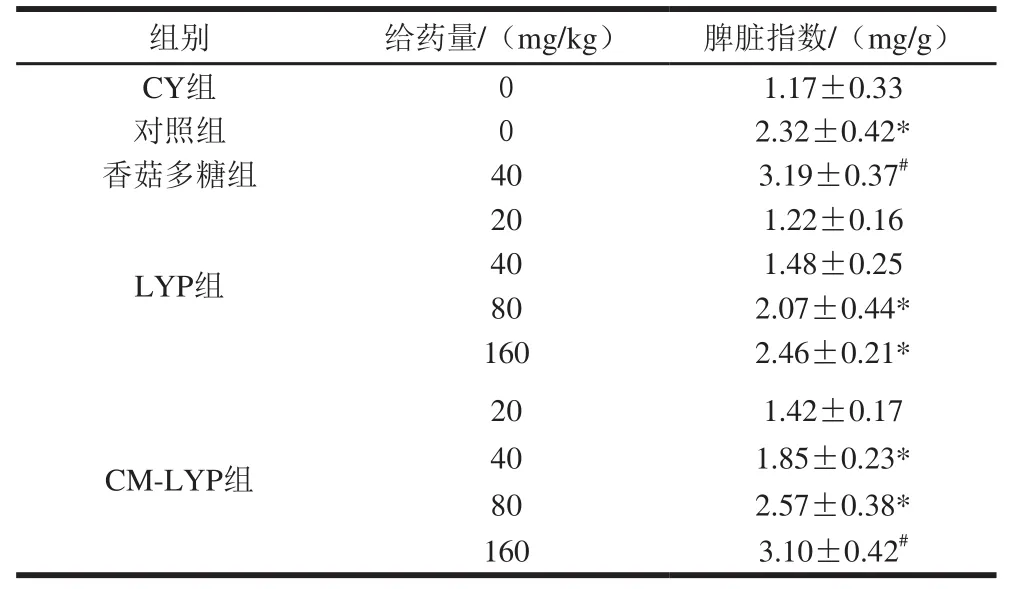
表9 LYP和CM-LYP对免疫抑制小鼠脾脏指数的影响(x ±s,n=10)Tab le 9 Effects of LYP and CM-LYP on sp leen index in immunosuppressed m ice (x s, n= 10)
注:*. P<0.05,实验组与CY组具有显著差异;#. P<0.05,实验组与正常对照组具有显著差异。下表同。
组别 给药量/(mg/kg) 脾脏指数/(mg/g)CY组 0 1.17±0.33对照组 0 2.32±0.42*香菇多糖组 40 3.19±0.37#LYP组20 1.22±0.16 40 1.48±0.25 80 2.07±0.44*160 2.46±0.21*20 1.42±0.17 40 1.85±0.23*80 2.57±0.38*160 3.10±0.42#CM-LYP组
从表9可以看出,与正常对照组相比,环磷酰胺模型组脾脏指数显著降低(P<0.05),说明本研究成功建立了环磷酰胺免疫抑制小鼠模型。与环磷酰胺模型组比较,阳性对照香菇多糖和不同剂量的LYP、CM-LYP均能显著的提高免疫抑制小鼠的脾脏指数且呈现剂量依赖效应(P<0.05)。说明LYP、CM-LYP均能够降低环磷酰胺诱导产生的脾脏指数,在一定程度上可提高机体免疫力。
2.4.2 LYP、CM-LYP对免疫抑制小鼠血清溶血素的影响
以SRBC作为抗原,刺激机体产生特异性抗体(溶血素,即SRBC抗体),并释放至外周血。抗原抗体相互结合形成抗原抗体复合物,暴露出补体(豚鼠血清)结合点,激活补体,导致SRBC产生溶血现象,因此,可通过测定致敏动物血清中溶血素含量得知药物对体液免疫的影响。
由表10可以看出,与正常对照组相比,环磷酰胺组小鼠血清的半数溶血值(HC50)显著降低(P<0.05),说明本研究成功建立了环磷酰胺免疫抑制小鼠模型。阳性对照香菇多糖组、LYP组和CM-LYP组均能提高免疫抑制小鼠血清中的溶血素含量(P<0.05),且这种变化呈现剂量依赖关系。以上结果说明LYP在80~160 mg/kg范围内、CM-LYP在40~160 mg/kg范围内能改善免疫抑制小鼠的体液免疫功能。
表10 LYP和CM-LYP对免疫抑制小鼠溶血素的影响(x ±s,n=10)Table 10 Effects of LYP and CM-LYP on hemolysin in serum of immunosuppressed m ice (x s, n= 10)

表10 LYP和CM-LYP对免疫抑制小鼠溶血素的影响(x ±s,n=10)Table 10 Effects of LYP and CM-LYP on hemolysin in serum of immunosuppressed m ice (x s, n= 10)
组别 给药量/(mg/kg) HC50 CY组 0 1.17±0.33正常对照组 0 2.32±0.42*香菇多糖组 40 3.19±0.37#20 1.22±0.16 LYP组40 1.48±0.25 80 2.07±0.44*160 2.46±0.21*20 1.42±0.17 CM-LYP组40 1.85±0.23*80 2.57±0.38*160 3.10±0.42#
2.4.3 LYP、CM-LYP对免疫抑制小鼠脾脏和血清中溶菌酶的影响
LZM又称胞壁质酶,是一种能水解致病菌中黏多糖的碱性酶,具有抗菌、消炎、抗病毒和增强免疫力等作用,其水平或活性是先天性免疫力的一个重要指标[27]。
表11 LYP、CM-LYP对免疫抑制小鼠血清和脾脏中LZM的影响(x ±s,n=10)Table 11 Effects of CM-LYP on LZM on lysozyme activity in serum and sp leen of immunosupp ressed m ice (x s, n= 10)

表11 LYP、CM-LYP对免疫抑制小鼠血清和脾脏中LZM的影响(x ±s,n=10)Table 11 Effects of CM-LYP on LZM on lysozyme activity in serum and sp leen of immunosupp ressed m ice (x s, n= 10)
溶菌酶含量/(U/m L)血清 脾脏CY组 0 314.9±53.7 126.4±12.1正常对照组 0 443.4±66.1* 223.8±26.5*香菇多糖组 40 628.7±68.5# 256.9±33.9#组别 给药量/(mg/kg)LYP组20 328.5±49.8 136.7±16.4 40 386.1±55.4* 154.0±15.3 80 457.6±47.9* 180.4±28.5*160 487.7±39.7* 197.8±24.2*CM-LYP组20 384.1±55.2* 177.9±18.7*40 433.6±67.8* 202.3±27.5*80 532.5±44.1* 242.7±22.5*160 566.2±67.4* 252.9±30.6*
由表11可以看出,与正常对照组比较,环磷酰胺组小鼠血清中的LZM含量显著降低(P<0.05),说明免疫抑制小鼠模型建立成功。与模型组相比,阳性对照香菇多糖组(40 mg/kg)、龙眼肉多糖组(40~160 mg/kg)、羧甲基化龙眼肉多糖组(20~160 mg/kg)均显著地提高免疫抑制小鼠血清中L ZM水平(P<0.05),且这种变化呈现剂量依赖关系。
由表11可知,与正常对照组相比较,环磷酰胺组小鼠脾脏中的LZM含量显著降低(P<0.05),说明免疫抑制小鼠模型建立成功。与模型组相比,阳性对照香菇多糖组(40 mg/kg)、龙眼肉多糖组(80~160 mg/kg)、羧甲基化龙眼肉多糖组(20~160 mg/kg)均明显提高免疫抑制小鼠脾脏中LZM水平(P<0.05),且这种变化呈现剂量依赖关系。以上结果说明龙眼肉多糖羧甲基化衍生物对免疫抑制小鼠的非特异性免疫功能恢复有促进作用。
2.4.4 LYP、CM-LYP对小鼠血清中IFN-γ和IL-4含量的影响
Th1细胞亚群与人类多种疾病的关系非常复杂且非常重要,Th1/Th2平衡失调与许多疾病的发生、发展、治疗等有密切的关系[28]。IFN-γ主要来自于Th1细胞的分泌,能够激活T淋巴细胞、NK细胞和巨噬细胞以增强免疫功能,主要介导细胞免疫。IL-4主要由Th2细胞分泌,介导体液免疫应答,能够促进B淋巴细胞的增殖和活化,促进免疫球蛋白的生成和类型转换,从而正向调控机体的体液免疫。因此,可通过测定小鼠血清中IFN-γ、IL-4含量,得出Th1/Th2平衡情况,从而反映出LYP、CM-LYP的免疫调节活性。
LYP、CM-LYP对小鼠血清中IFN-γ含量的影响如表12所示。与空白对照组比较,CY组小鼠血清中的IFN-γ含量提升了3 倍以上(P<0.05),主要偏向细胞免疫。随着LYP、CM-LYP给药剂量的增加,血清中的IFN-γ含量逐渐降低,表明Th1免疫应答模式减弱。当给药剂量超过80 mg/kg时血清中的IFN-γ含量稳定并处于正常水平(P>0.05)。
表12 LYP、CM-LYP对免疫抑制小鼠血清中INF-γ和IL-4含量的影响(x±s,n=10)Table 12 Effects of LYP and CM-LYP on INF-γand IL-4 levels in serum of immunosuppressed m ice (x s, n= 10)

表12 LYP、CM-LYP对免疫抑制小鼠血清中INF-γ和IL-4含量的影响(x±s,n=10)Table 12 Effects of LYP and CM-LYP on INF-γand IL-4 levels in serum of immunosuppressed m ice (x s, n= 10)
IL-4质量浓度/(pg/m L)CY组 0 178.63±13.44# 42.54±5.98#正常对照组 0 51.07±4.15* 83.87±6.75*香菇多糖组 40 51.67±4.89* 102.59±7.43*#组别 给药量/(mg/kg)INF-γ质量浓度/(pg/m L)LYP组20 153.83±12.37*# 43.22±5.22#40 126.47±7.81*# 57.84±5.33*#80 50.19±7.91* 70.19±7.91*#160 46.96±6.12* 97.95±8.07*#CM-LYP组20 82.19±4.73*# 62.09±5.61*#40 59.45±5.36*# 85.59±6.54*80 51.08±3.38* 93.30±5.62*#160 41.74±2.77* 115.3±7.09*#
LYP、CM-LYP对小鼠血清中IL-4含量的影响如表12所示。与空白对照组比较,CY组小鼠血清中的IL-4含量下降显著(P<0.05),主要偏向细胞免疫。随着LYP、CM-LYP给药剂量的增加,血清中的IL-4含量逐渐升高,表明Th2免疫应答模式增强。当CM-LYP给药剂量为80 mg/kg时血清中的IL-4含量接近正常水平(P>0.05)。综上所述,随着LYP、CM-LYP的给药浓度逐渐增大,免疫抑制小鼠血清中IFN-γ、IL-4含量逐渐恢复至正常水平,即Th1/Th2趋于平衡,表明,LYP、CM-LYP对免疫抑制小鼠具有免疫调节作用,且同等剂量浓度下,CM-LYP的免疫调节能力优于LYP。
3 结 论
采用响应面法优化CM-LYP制备工艺,以羧甲基取代度为衡量指标,通过单因素试验对MCA浓度、反应温度、反应时间进行响应面分析,建立羧甲基化取代度与各影响因素之间的回归模型,得到CM-LYP的最佳工艺条件为MCA浓度1.2 mol/L、反应温度73 ℃、反应时间3.2 h时,取代度高达1.053。
自由基是指单独存在的、具有配对价电子的离子、原子、分子,主要包括超氧阴离子自由基、羟自由基和H2O2等。自由基性质活泼和反应性强,易造成生物膜系统损伤及细胞内氧化磷酸化障碍,对人体的健康和寿命危害较大[29-31]。实验结果表明,LYP、CM-LYP均能够抑制小鼠肝脏脂质过氧化,抑制H2O2引起的红细胞溶血,清除羟自由基和超氧阴离子自由基,且在同等质量浓度下,CM-LYP的抗氧化活性要强于修饰前的LYP。
体内免疫实验结果表明,当给药剂量在20~160 mg/kg范围内,LYP、CM-LYP均能提高免疫功能抑制小鼠的脾脏指数,促进免疫功能抑制小鼠体内溶血素形成,提高免疫功能抑制小鼠脾脏组织和血清中的溶菌酶含量,调节免疫抑制小鼠血清中Th1/Th2的平衡。综上所述,CMLYP对免疫功能抑制小鼠的非特异性免疫功能、细胞免疫功能、体液免疫功能均有明显的改善和促进作用,且在相同剂量浓度下,CM-LYP较修饰前的LYP具有更强的免疫活性,说明羧甲基的引入有利于提高LYP的免疫调节活性。
[1] 黄建蓉, 李琳, 李冰. 龙眼肉生理功效和活性成分的研究进展[J]. 食品工业科技, 2007, 28(3): 221-224. DOI:10.3969/j.issn.1002-0306.2007.03.071.
[2] 黄雪芳. 龙眼肉多糖硫酸酯化修饰及修饰前后体外抗肿瘤活性初步研究[D]. 南宁: 广西医科大学, 2011: 38-51.
[3] 宁苑灵, 蒙法艳, 蒋洁, 等. 响应面法优化磷酸酯化龙眼肉多糖的制备工艺[J]. 中国实验方剂学杂志, 2013, 19(6): 50-53. DOI:10.13422/j.cnki.syfjx.2013.06.005.
[4] 宁苑灵. 磷酸酯化和不同分子量片断龙眼肉多糖的制备及其免疫调节作用和抗氧化作用的研究[D]. 南宁: 广西医科大学, 2013: 51-86.
[5] WANG J, ZHAO B, WANG X, et al. Preparation and characterization of sulfated galactomannan from guar gum: optim ization of reaction conditions by BBD and molecule conformational studies[J]. Journal of the Taiwan Institute of Chem ical Engineers, 2012, 43(6): 889-896.DOI:10.1016/j.jtice.2012.08.001.
[6] 王晓璐, 汲晨锋. 多糖修饰物及其抗肿瘤作用机制研究[J]. 氨基酸和生物资源, 2015, 37(4): 12-17. DOI:10.16333/j.1001-6880.2014.11.025.
[7] 孟思彤, 徐艳芝, 王振月. 多糖的化学修饰对其生物活性影响研究进展[J]. 天然产物研究与开发, 2014 (11): 1901-1905. DOI:10.16333/j.1001-6880.2014.11.025.
[8] HUANG X, WANG D Y, LU Y, et al. Effect of sulfated astragalus polysaccharide on cellular infectivity of infectious bursal disease virus[J]. International Journal of Biological Macromolecules, 2008,42(2): 166. DOI:10.1121/1.1694995.
[9] 张颖, 曾艳, 张丽姣, 等. 解淀粉芽孢杆菌果聚糖的化学修饰与抗氧化、抗肿瘤活性研究[J]. 食品工业科技, 2016, 37(13): 96-100.DOI:10.13386/j.issn1002-0306.2016.13.011.
[10] CHEN Y, ZHANG H, W ANG Y, et a l. A cety lation and carboxymethylation of the polysaccharide from Ganoderma atrum and their antioxidant and immunomodulating activities[J]. Food Chem istry,2014, 156(3): 279-288. DOI:10.1016/j.carbpol.2010.04.002.
[11] WANG J, GUO H, ZHANG J et al. Su lfated modification,characterization and structure-antioxidant relationships of Artemisia sphaerocephala, polysaccharides[J]. Carbohydrate Polymers, 2010,81(4): 897-905. DOI:10.1016/j.carbpol.2010.04.002.
[12] JIE J, MENG F Y, ZHOU H, et al. Sulfated modifi cation of longan,polysaccharide and its immunomodulatory and antitumor activity in vitro[J]. International Journal of Biological Macromolecules, 2014,67(6): 323-329. DOI:10.1016/j.ijbiomac.2014.03.030.
[13] 李全才, 李春霞, 勾东霞, 等. 磷酸化多糖的研究进展[J]. 生命科学,2013(3): 262-268. DOI:10.13376/j.cbls/2013.03.011.
[14] 林秀珠, 罗志敏, 马秀玲, 等. 烷基化普鲁兰多糖的制备及性质[J].福建师范大学学报(自然科学版), 2007 (2): 62-66.
[15] 张丽华, 宋逍, 赵鹏, 等. 款冬花多糖的羧甲基化衍生物合成工艺研究[J]. 天然产物研究与开发, 2013, 25(7): 892-896. DOI:10.3969/j.issn.1001-6880.2013.07.005.
[16] 申林卉, 刘丽侠, 陈冠, 等. 多糖化学结构修饰方法的研究进展[J].药物评价研究, 2013(6): 465-468.
[17] 符辉, 吴奇辉, 王广兰, 等. 羧甲基茯苓多糖抗疲劳作用研究[J].天然产物研究与开发, 2014(3): 403-406. DOI:10.16333/j.1001-6880.2014.03.023.
[18] 孙志涛, 陈芝飞, 郝辉, 等. 羧甲基化黄芪多糖的制备及其保润性能[J]. 天然产物研究与开发, 2016(9): 1427-1433. DOI:10.16333/j.1001-6880.2016.9.015.
[19] 王晓璐, 汲晨锋. 多糖修饰物及其抗肿瘤作用机制研究[J]. 氨基酸和生物资源, 2015(4): 12-17. DOI:10.14188/j.ajsh.2015.04.003.
[20] 王警, 吴妮妮, 黄静, 等. 响应面试验优化龙眼肉多糖乙酰化工艺及其抗氧化活性[J]. 食品科学, 2016, 37(16): 63-68. DOI:10.7506/spkx1002-6630-201616010.
[21] 钟方晓, 任海华, 李岩. 多糖含量测定方法比较[J]. 时珍国医国药,2007, 18(8): 1916-1917.
[22] WANG J, YANG T, TIAN J, et al. Synthesis and characterization of phosphorylated galactomannan: the effect of DS on solution conformation and antioxidant activities[J]. Carbohydrate Polymers,2014, 113(11): 325-335. DOI:10.1016/j.carbpol.2014.07.028.
[23] MENG F Y, NING Y L, QI J, et al. Structure and antitumor and immunomodulatory activities of a water-soluble polysaccharide from Dimocarpus longan pulp[J]. International Journal of Molecular Sciences, 2014, 15(3): 5140-5162. DOI:10.3390/ijms15035140.
[24] 焦中高, 刘杰超, 王思新, 等. 羧甲基化红枣多糖制备及其活性[J].食品科学, 2011, 32(17): 176-180.
[25] WANG Z, WANG Y, LI Z, et al. Hum anization o f a m ouse monoclonal antibody neutralizing TNF-alpha by guided selection[J].Journal of Immunological Methods, 2000, 241(1/2): 171-184.DOI:10.1016/S0022-1759(00)00203-9.
[26] 李俊, 黄艳, 廖日权, 等. 罗汉果多糖对小鼠免疫功能的影响[J].中国药理学通报, 2008(9): 1237-1240.
[27] 田丹, 杨元信. 溶菌酶: 先天性免疫系统中的重要防御物质[J]. 养殖与饲料, 2015(1): 43-45. DOI:10.13300/j.cnki.cn42-1648/s.2015.01.015.
[28] 姚金晶, 陈宜涛. Th1/Th2平衡调节与疾病发生的研究进展[J].现代生物医学进展, 2009(13): 2597-2600. DOI:10.13241/j.cnki.pmb.2009.13.023.
[29] 夏世金, 孙涛, 吴俊珍. 自由基、炎症与衰老[J]. 实用老年医学,2014(2): 100-103.
[30] 李建喜, 杨志强, 王学智, 等. 活性氧自由基在动物机体内的生物学作用[J]. 动物医学进展, 2006, 27(10): 33-36. DOI:10.16437/j.cnki.1007-5038.2006.10.008.
[31] 熊珊珊, 石英英, 石汉平. 活性氧与肿瘤研究进展[J].中华肿瘤防治杂志, 2014, 21(13): 1045-1048. DOI:10.16073/j.cnki.cjcpt.2014.13.017.
Optim ization of Preparation of Carboxymethylated Polysaccharides from Longan (Dimocarpus longan) Pulp by Response Surface Methodology and Their Antioxidant Activity and Immunoregulatory Activity
WEI Yim ing1, HE Zhou2,*, TIAN Haifen3, WANG Jing1, WU Nini1, HUANG Jing1, YANG Yanfang1,LI Xuehua1,*, NONG Zhenzhen1, WEI Mei1, PAN Xin1, LI Guo1
(1. Pharmaceutical College, Guangxi Medical University, Nanning 530021, China; 2. The People’s Hospital of Guangxi Zhuang Autonomous Region, Nanning 530021, China; 3. The People’s Hospital of Baise, Baise 533000, China)
In this study, the carboxymethylation of polysaccharides (LYP) extracted from longan (Dimocarpus longan)pulp was investigated using monochloroacetic acid (MCA) w ith polysaccharides-to-MCA ratio, reaction time and reaction temperature as independent variables. The degree of substitution (DS) was taken as response value to optimize the important reaction conditions by response surface methodology. Meanwhile, the antioxidant activity and immunoregulatory of carboxymethlated polysaccharides (CM-LYP) in vivo were measured. The results showed that the optim ized conditions that provided the maximum DS of 1.053 were determ ined as follows: reaction time, 3.2 h; MCA concentration, 1.2 mol/L;and reaction temperature, 73 ℃. The antioxidant activity of CM-LYP was concentration dependent in a certain range of concentration. The percentage inhibition of hydroxyl and superoxide anion radicals, lipid peroxidation, red blood cell hemolysis induced by H2O2were (42.35 ± 5.67)%, (51.91 ± 5.34)%, (67.91 ± 5.72)%, and (47.23 ± 3.5)% by LYP, and(84.39 ± 4.47)%, (87.91 ± 7.32)%, and (79.85 ± 2.92)%, and (54.66 ± 2.83) % by CM-LYP, respectively, implying that the antioxidant activity of LYP was improved as compared to the native polysaccharides. The immunoregulatory activity invivo showed that CM-LYP significantly improved spleen index in immunosuppressed, increased serum hemolysin level and lysozyme activity in serum and spleen, and maintained Th1/Th2 balance, and the effect was better than that of LYP.
longan pulp polysaccharides; carboxymethylation; response surface methodology; immune activity; antioxidant activity
2017-01-06
广西科学研究与技术开发计划项目(桂科重12118005-1-2);广西教育厅专利资助项目(KY2015ZL020)
韦毅铭(1991—),男,硕士研究生,主要从事天然产物化学研究。E-mail:18260903735@163.com
*通信作者:何舟(1982—),男,主治医师,硕士,主要从事中草药有效成分及免疫研究。E-mail:229189314@qq.com李雪华(1963—),女,教授,硕士,主要从事天然产物活性物质提取与活性研究。E-mail:onlythankforyou@163. com
10.7506/spkx1002-6630-201722041
R284.3
A
1002-6630(2017)22-0275-09
韦毅铭, 何舟, 田海芬, 等. 羧甲基化龙眼肉多糖制备工艺优化及其抗氧化、免疫活性[J]. 食品科学, 2017, 38(22):275-283. DOI:10.7506/spkx1002-6630-201722041. http://www.spkx.net.cn
WEI Yiming, HE Zhou, TIAN Haifen, et al. Optimization of preparation of carboxymethylated polysaccharides from longan (Dimocarpus longan) pulp by response surface methodology and their antioxidant activity and immunoregulatory activity[J]. Food Science,2017, 38(22): 275-283. (in Chinese w ith English abstract)
10.7506/spkx1002-6630-201722041. http://www.spkx.net.cn

