人脐带Wharton’s Jelly来源间充质干细胞与人牙周膜干细胞成骨分化能力的对比研究
黄银莉 周洪 苏晓霞 钟天宇
人脐带Wharton’s Jelly来源间充质干细胞与人牙周膜干细胞成骨分化能力的对比研究
黄银莉 周洪 苏晓霞 钟天宇
目的比较人脐带Wharton’s Jelly来源间充质干细胞(human umbilical cord Wharton’s Jelly-derived mesechymal stem cells, hUCWJMSCs)与人牙周膜干细胞(periodontal mesenchymal stem cells,hPDLSCs)成骨分化能力。方法体外培养hUCWJMSCs和hPDLSCs。MTT法检测细胞增殖情况;成骨诱导后测定细胞的ALP活性,茜素红染色检测细胞矿化能力,Real-time PCR分析OPN和Runx2基因的表达。结果hUCWJMSCs增殖能力高于hPDLSCs; 经矿化诱导后hPDLSCs ALP表达、矿化结节形成高于hUCWJMSCs(P<0.05);Runx2在hPDLSCs中表达高于hUCWJMSCs(P<0.05);而hUCWJMSCs中OPN表达高于hPDLSCs(P<0.05)。结论hUCWJMSCs、hPDLSCs均具有成骨分化能力,hPDLSCs成骨分化能力较强。
人脐带Wharton’s Jelly间充质干细胞(hUCWJMSCs); 人牙周膜干细胞(hPDLSCs); 成骨分化
口腔颌面部骨组织工程技术中种子细胞的选择一直是研究的重点[1-2]。牙周膜干细胞多用于牙周骨组织缺损的研究,但因其来源受限、细胞产量较低、存在混杂细胞等缺点,故寻找新的替代种子细胞成为研究重点。人脐带Wharton’s Jelly来源间充质干细胞(human umbilical cord Wharton’s Jelly-derived mesechymal stem cells,hUCWJMSCs)在细胞增殖、多向分化、免疫特性以及旁分泌等方面更具优势,引起广泛关注[3];其成骨能力已被证实并应用于骨组织工程,被认为是一种新的骨组织种子细胞[4-5]。本实验通过体外研究,比较hUCWJMSCs与人牙周膜干细胞(periodontal mesenchymal stem cells,hPDLSCs)成骨分化能力,探讨hUCWJMSCs应用于牙周骨组织工程的可行性。
1 材料与方法
1.1 材料
DMEM/F12培养基、胎牛血清、胰酶(Gibco公司,美国),地塞米松、茜素红、β-甘油磷酸钠、L-抗坏血酸2-磷酸盐(Sigma公司,美国),总RNA提取试剂盒(Invitrogen公司,美国),引物合成、PCR试剂盒、cDNA合成试剂盒(Takara公司,日本),ALP半定量试剂盒(南京建成生物技术公司),倒置相差显微镜(Nikon,日本)。
1.2 实验方法
1.2.1 MTT法检测 hUCWJMSCs、hPDLSCs增殖能力
脐带来源:健康足月产妇中获得新鲜脐带,实验获得西安交通大学口腔医院伦理委员会批准,患者对其用途均知情同意。
取生长状态良好的P3代细胞,调整细胞浓度至5×104/ml,接种到96 孔板,每孔100 μl,MTT法连续8 d检测2 种细胞增殖情况,每个时间点做3 个复孔,绘制增殖曲线。
1.2.2 hUCWJMSCs和hPDLSCs体外成骨分化能力比较
1.2.2.1 成骨诱导后ALP表达的比较 取P3代hUCWJMSCs、hPDLSCs干细胞,以2×104/孔接种于24 孔板中,待细胞生长达到 70%~80%融合时进行成骨诱导,成骨诱导液为:DMDM/F12培养基,100 U/ml链霉素、100 U/ml青霉素,0.25 μg/ml两性霉素B、终浓度10%FBS,10 nmol/L地塞米松、10 mmol/L β-磷酸甘油及50 μmol/L的L-抗坏血酸-2-磷酸。3 d换1 次培养液;用普通培养基同时培养细胞,其它培养条件与成骨分化组相同,做为阴性对照。
分别在诱导0、1、3、5、7、14、21 d收集实验组和对照组上清液进行碱性磷酸酶半定量检测。检测步骤按碱性磷酸酶半定量试剂盒进行。
1.2.2.2 成骨诱导后茜素红染色及矿化结节半定量比较 取P3代hUCWJMSCs、hPDLSCs干细胞,以5×104细胞/孔的细胞密度接种于6 孔中,在37 ℃,5%CO2恒定湿度培养,待细胞密度达60%以上融合时进行成骨诱导。成骨诱导14、21 d后进行茜素红染色、拍照。每孔加入1 ml 10%氯化十六烷基置室温下30 min,吹打是钙化结节完全溶解,吸取上清液300 μl,562 nm紫外分光光度计测量A值。分别在14、21 d以普通培养基培养细胞作为阴性对照,每个时间点做3 个复孔。收集数据并做统计学分析。
1.2.2.3 Real-time PCR比较成骨基因表达 取P3代hUCWJMSCs、hPDLSCs干细胞,以5×104细胞/孔的密度接种于6 孔中,成骨诱导0、3、7、14、21 d,以普通培养基培养细胞作为阴性对照,每个时间点做3 次。Trizol提取总RNA,按反转录试剂盒说明书合成cDNA(表 1)。
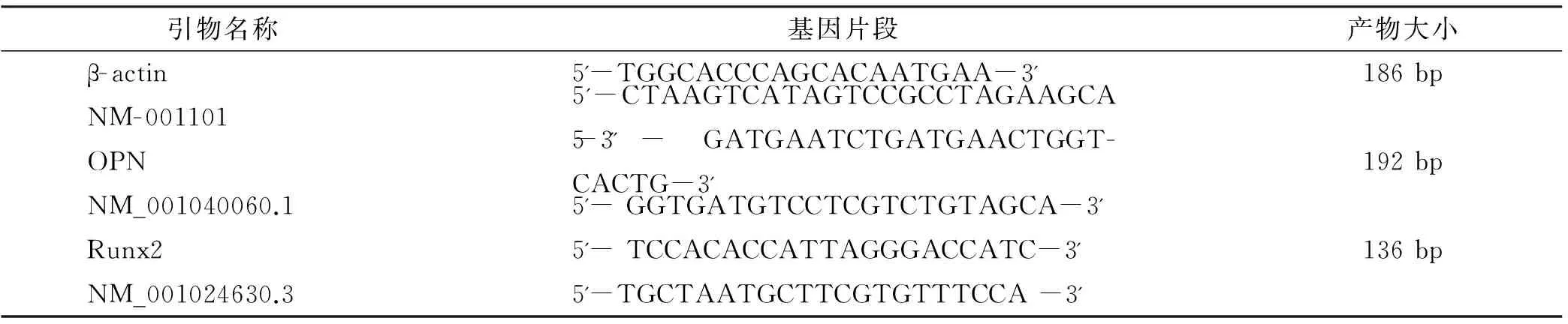
表 1 PCR引物
1.3 两步法进行进行Real-time PCR反应
预变性95 ℃ 30 s,PCR反应95 ℃ 5 s,60 ℃ 20 s,40 个循环。反应结束后对结果曲线进行确认并绘制标准曲线。
2 结 果
2.1 hUCWJMSCs、hPDLSCs增殖能力
MTT法绘制hUCWJMSCs和hPDLSCs的增殖曲线,显示:前两天细胞处于潜伏期,3~6 d处于对数生长期,7 d细胞数达到最高值进入平台期。hUCWJMSCs进入对数期时间早于hPDLSCs且增殖速度较快(图 1)。
2.2 hUCWJMSCs和hPDLSCs体外成骨分化能力比较
2.2.1 ALP半定量检测 通过对hUCWJMSCs、hPDLSCs成骨诱导前、诱导1 、3、5 、7 、14、21 d进行ALP半定量检测。结果表明hUCWJMSCs、hPDLSCs成骨诱导组相对于对照组均高表达;同时hPDLSCs成骨诱导后ALP分泌明显高于hUCWJMSCs且具有统计学意义(P<0.05,图 2)。
2.2.2 茜素红染色及矿化结节半定量检测 分别对hUCWJMSCs和hPDLSCs成骨诱导14、21 d后进行茜素红染色,结果显示,2 种细胞成骨诱导14 d后有红色被染矿化基质形成,21 d后阳性被染颗粒明显增多,而对照组则无明显红色被染颗粒形成。同时可见hPDLSCs组21 d后茜素红染色矿化结节形成明显多于hUCWJMSCs(图 3)。矿化结节半定量比较也得出相似的结论(图 4)。
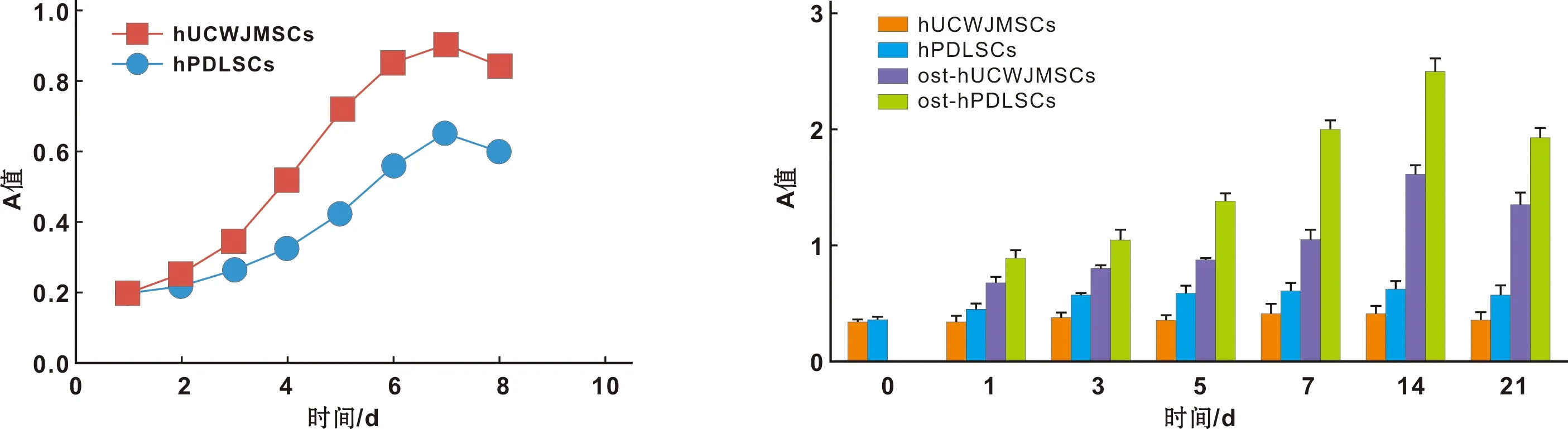
图 1 hUCWJMSCs和hPDLSCs的增殖曲线 图 2 各组细胞ALP表达水平
Fig 1 Growth curves of hUCWJMSC and hPDLSCs Fig 2 ALP expression of the cells
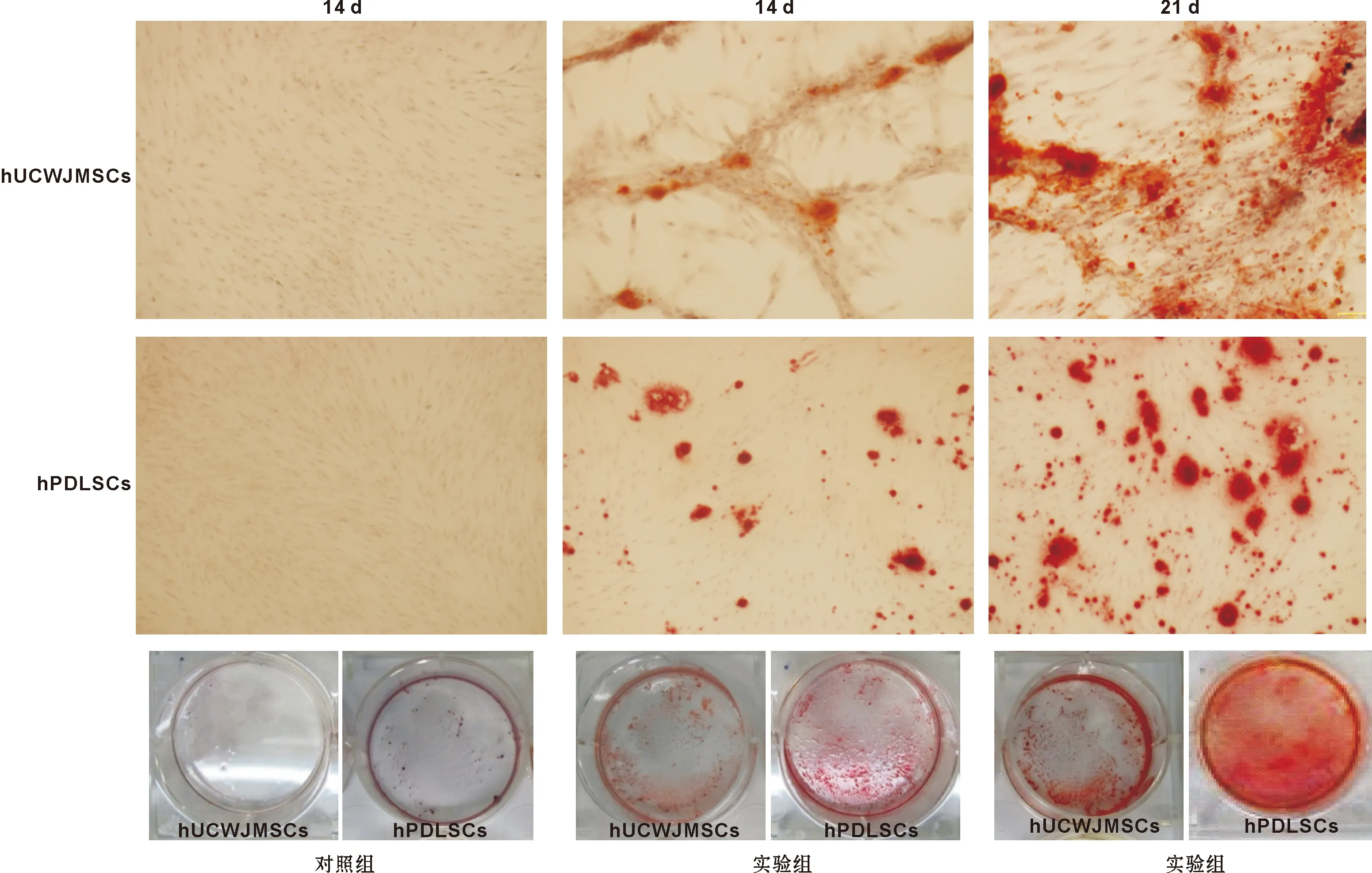
图 3 茜素红染色结果(-129 μm)
Fig 3 Alizarin red staining results(-129 μm)
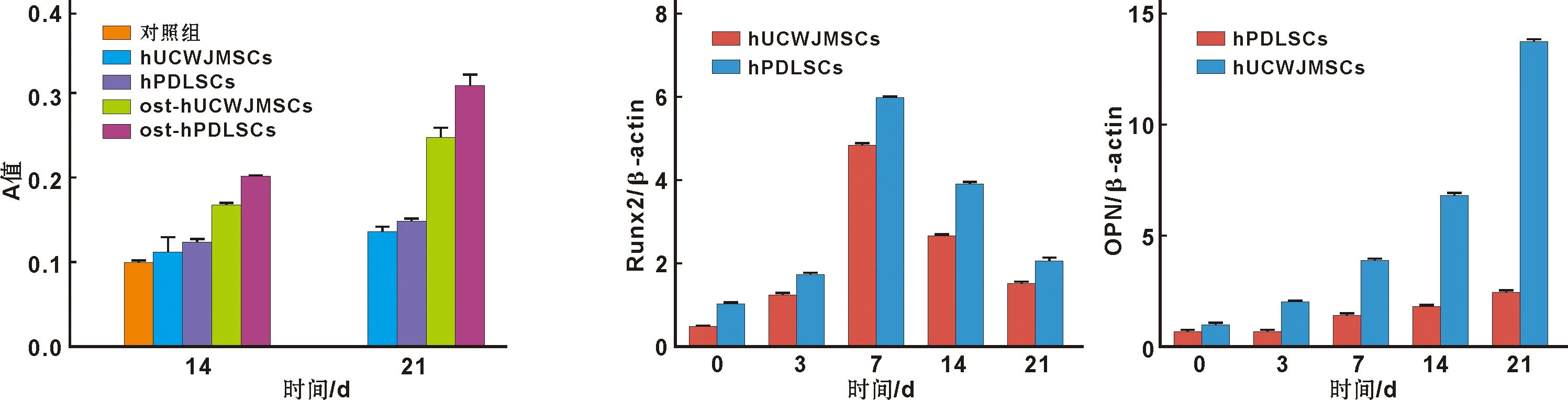
图 4 各组细胞矿化水平比较 图 5 Runx2和OPN mRNA在细胞中的表达
Fig 4 Comparison of the minerialization level of the cells Fig 5 mRNA expression of Runx2 and OPN in the cells
2.2.3 成骨诱导后Real-time PCR比较成骨基因表达
提取RNA后进行纯度及含量测定,结果显示各组A260/A280比值均1.8,提示无蛋白质污染,RNA纯度可满足实验要求。hUCWJMSCs和hPDLSCs进行成骨诱导后分别于3、7、14、21 d后采用Real-time PCR检测相关成骨基因OPN和Runx2的表达,结果表明成骨诱导后,此2 种基因均有表达。其中Runx2在hPDLSCs中表达高于hUCWJMSCs(P<0.05);而OPN在hUCWJMSCs成骨诱导组高于hPDLSCs(P<0.05,图 5)。
3 讨 论
近几年,关于hUCWJMSCs应用于牙周组织修复的研究引起了口腔医生的高度关注。付云等[6]利用跨室培养装置研究hUCWJMSCs定向分化为hPDLSCs的可能性,研究表明,在一定条件下可定向分化为hPDLSCs;将hUCWJMSCs用于自体牙移植后牙周修复的研究,结果显示在牙本质表面形成被纤维样组织包绕的牙骨质样结构,提示hUCWJMSCs可用于自体牙移植后牙周组织的愈合[7]。大量的实验结果提示hUCWJMSCs可作为牙周再生的种子细胞进行更深入的研究。
hUCWJMSCs和hPDLSCs的成骨分化能力分别被诸多实验证明[8-9],同时也分别比较与其他成体干细胞成骨分化能力。Wen等[10]比较了hUCWJMSCs与骨髓干细胞(hBMSCs)、脂肪干细胞(hAD-MSCs)成骨分化能力,hBMSCs较hUCWJMSCs、hAD-MSCs表达更多的ALP阳性被染颗粒,hUCWJMSCs、hAD-MSCs较hBMSCs表达更多的COL-1和Runx2,hUCWJMSCs高表达OPN且有骨结构形成,说明hUCWJMSCs可作为骨组织缺损修复的种子细胞。研究表明,在炎症状况下hBMSCs骨形成能力明显高于hPDLSCs,说明hPDLSCs免疫调节能力较弱[11]。但是关于hUCWJMSCs和hPDLSCs两种干细胞成骨分化能力的研究尚缺乏。
本实验结果显示hUCWJMSCs较hPDLSCs增殖能力更强,扩增用时更短,结果与其他学者研究相似[12],hUCWJMSCs细胞倍增的时间为22.23 h,hPDLSCs为27.51 h;其与牙髓干细胞增殖能力较hBMSCs与hAD-MSCs高[13]。本实验通过体外对2 种干细胞进行成骨诱导,检测成骨分化过程中与成骨相关的特异性蛋白和胞外基质,比较2 种干细胞成骨分化能力。hPDLSCs表达ALP明显高于hUCWJMSC,且较hUCWJMSCs形成的矿化结节量更多,具有统计学意义(P<0.05)。
Runx2是转录因子家族Runx中重要的一员,成骨细胞的增殖和分化有密切的联系,是成骨分化过程的早期基因[14]。本实验Runx2表达诱导随时间的增加,表达呈现递增趋势,最高峰为7 d,后呈现递减趋势。Hsieh等[15]通过对骨髓间充质干细胞成骨诱导,检测Runx2表达变化,得出了相似的结果。同时,hPDLSCs较hUCWJMSCs组Runx2要高表达,说明在相同的条件下hPDLSCs早期表达更多的Runx2以参与干细胞成骨分化过程。Ciavarella等[16]研究表明Runx2可通过促进成骨特异性基因如骨钙蛋白(Osteocalcin,OCN)、骨桥蛋白( Osteopontin,OPN)以及其他骨涎蛋白(bone Sialoproteins)的表达,同时也表达于牙周韧带纤维细胞中,故其除参与细胞成骨分化过程外也存在于牙周组织中,故进一步解释了hPDLSCs表达高于hUCWJMSCs的原因。OPN是一种成骨细胞在钙三醇的刺激下表达的成骨相关基因,对骨的重塑、细胞迁移、肿瘤转移以及免疫调节都具有多方面的作用[17]。本实验中hUCWJMSCs较hPDLSCs高表达,说明在相同的条件下hUCWJMSCs表达更多的OPN以参与干细胞生理作用。OPN对干细胞的影响是多方面的,在干细胞成骨分化过程中发挥着重要的作用,关于其调节成骨分化的机制尚不是很清楚,需要进一步研究[18]。
关于两者成骨分化能力差异的原因,可能是hUCWJMSCs来源为胚胎干细胞,其表达更多较为原始的基因。相关研究显示hPDLSCs较hUCWJMSCs拥有更多的促进成骨细胞分化和骨形成且可抑制破骨细胞形成的基因如SATB1、SATB2和TNFRSF11B[19-20],hUCWJMSCs则拥有更多与胚胎发育相关基因和促进细胞增殖的基因,如HOXC8其在促进细胞增殖的同时可抑制细胞的沉骨分化[21],故hUCWJMSCs较hPDLSCs有更强的增殖能力,而成骨能力却没有明显优势。
综上,本实验通过化学诱导方法对hUCWJMSCs和hPDLSCs 2 种干细胞进行诱导,并通过ALP、茜素红染色和半定量以及成骨相关表达基因OPN和Runx2的检测,比较2 种细胞成骨分化能力。研究结果显示hUCWJMSCs和hPDLSCs都具有明显的成骨分化能力,但未修饰的hUCWJMSCs不能直接用于牙周骨组织修复,需进行相关成骨基因的修饰后方可应用。
[1] 李波, 刘杨, 杨鹏. 间充质干细胞应用进展[J]. 临床军医杂志, 2016, 44(2): 205-208.
[2] 赵铮, 赵春雨. 骨组织工程应用于口腔颌面部骨组织缺损修复研究进展[J]. 继续医学教育, 2015, 29(9): 77-79.
[3] Biazar E. Use of umbilical cord and cord blood-derived stem cells for tissue repair and regeneration[J]. Expert Opin Biol Ther, 2014, 14(3): 301-310.
[4] 吕鹏飞, 张光武. 脐带间充质干细胞在骨组织工程中的研究进展[J]. 中华临床医师杂志(电子版), 2013, 7(10): 4433-4435.
[5] Wang B, Huang S, Pan L, et al. Enhancement of bone formation by genetically engineered human umbilical cord-derived mesenchymal stem cells expressing osterix[J]. Oral Surg Oral Med Oral Pathol Oral Radiol, 2013, 116(4): e221-229.
[6] 付云, 洪迅, 刘佳. 人脐带间充质干细胞诱导为牙周韧带样细胞的实验研究[J]. 中华口腔医学杂志, 2009, 44(10): 584-587.
[7] Li Y, Hou R, Wang Y, et al. Fundamental study of application of umbilical cord mesenchymal stem cells to the periodontium to aid healing after autotransplantation of teeth[J]. Br J Oral Maxillofac Surg, 2014, 52(6): 501-506.
[8] Su F, Liu SS, Ma JL, et al. Enhancement of periodontal tissue regeneration by transplantation of osteoprotegerin-engineered periodontal ligament stem cells[J]. Stem Cell Res Ther, 2015, 6: 22.
[9] Alvarez R, Lee HL, Wang CY, et al. Characterization of the osteogenic potential of mesenchymal stem cells from human periodontal ligament based on cell surface markers[J]. Int J Oral Sci, 2015, 7(4): 205-212.
[10]Wen Y, Jiang B, Cui J, et al. Superior osteogenic capacity of different mesenchymal stem cells for bone tissue engineering[J]. Oral Surg Oral Med Oral Pathol Oral Radiol, 2013, 116(5): e324-332.
[11]Zhang J, Li ZG, Si YM, et al. The difference on the osteogenic differentiation between periodontal ligament stem cells and bone marrow mesenchymal stem cells under inflammatory microenviroments[J]. Differentiation, 2014, 88(4-5): 97-105.
[12]Yu S, Long J, Yu J, et al. Analysis of differentiation potentials and gene expression profiles of mesenchymal stem cells derived from periodontal ligament and Wharton’s jelly of the umbilical cord[J]. Cells Tissues Organs, 2013, 197(3): 209-223.
[13]Abu Kasim H, Govindasamy V, Gnanasegaran N, et al. Unique molecular signatures influencing the biological function and fate of post-natal stem cells isolated from different sources[J]. J Tissue Eng Regen Med, 2015, 9(12): E252-266.
[14]Stein GS, Lian JB, Van Wijnen AJ, et al. Runx2 control of organization, assembly and activity of the regulatory machinery for skeletal gene expression[J]. Oncogene, 2004, 23(24): 4315-4329.
[15]Hsieh JY, Fu YS, Chang SJ, et al. Functional module analysis reveals differential osteogenic and stemness potentials in human mesenchymal stem cells from bone marrow and Wharton’s jelly of umbilical cord[J]. Stem Cells Dev, 2010, 19(12): 1895-1910.
[16]Ciavarella S, Dammacco F, De Matteo M, et al. Umbilical cord mesenchymal stem cells: Role of regulatory genes in their differentiation to osteoblasts[J]. Stem Cells Dev, 2009, 18(8): 1211-1220.
[17]Wang KX, Denhardt DT. Osteopontin: Role in immune regulation and stress responses[J]. Cytokine Growth Factor Rev, 2008, 19(5-6): 333-345.
[18]Chen Q, Shou P, Zhang L, et al. An osteopontin-integrin interaction plays a critical role in directing adipogenesis and osteogenesis by mesenchymal stem cells[J]. Stem Cells, 2014, 32(2): 327-337.
[19]Zhang J, Tu Q, Grosschedl R, et al. Roles of SATB2 in osteogenic differentiation and bone regeneration[J]. Tissue Eng Part A, 2011, 17(13-14): 1767-1776.
[20]Vidal C, Formosa R, Xuereb-Anastasi A. Functional polymorphisms within the TNFRSF11B(osteoprotegerin) gene increase the risk for low bone mineral density[J]. J Mol Endocrinol, 2011, 47(3): 327-333.
[21]Kim YJ, Bae SW, Yu SS, et al. miR‐196a regulates proliferation and osteogenic differentiation in mesenchymal stem cells derived from human adipose tissue[J]. J Bone Miner Res, 2009, 24(5): 816-825.
TheosteogenesisabilityofhumanumbilicalcordWharton’sJelly-derivedmesenchymalstemcellsandperiodontalmesenchymalstemcells
HUANGYinli,ZHOUHong,SUXiaoxia,ZHONGTianyu.
710004,DepartmentofOrthodontics,StomatologicalHospitalofXi'anJiaotongUniversity,China
Objective: To compare the osteogenesis ability between human umbilical cord Wharton’s Jelly-derived mesenchymal stem cells(hUCWJMSCs) and human periodontal ligament mesenchymal stem cells(hPDLSCs)invitro.MethodshUCWJMSCs and hPDLSCs wereinvitrocultured. The cell proliferation capacity was examined by MTT assay. After osteogenesis induction culture, ALP activity of the cells was determined, minerialization was observed by alizarin red staining, OPN and Runx2 mRNA expression was analyzed by Real-time PCR.ResultshUCWJMSCs grew faster than hPDLSCs. After osteogenic differentiation induction, hPDLSCs group showed higher ALP level, more mineralized nodule formation and higher Runx2 expression compared with hUCWJMSCs group(P<0.05); while the OPN expressed higher in hUCWJMSCs than in hPDLSCs(P<0.05).ConclusionhUCWJMSCs and hPDLSCs have osteogenesis differentiation potential, hPDLSCs are more osteogenetic.
HumanumbilicalcordWharton’sJelly-derivedmesenchymalstemcells(hUCWJMSCs);Humanperiodontalligamentmesenchymalstemcells(hPDLSCs);Osteogenicdifferentiation
陕西省“13115”科技创新工程重大科技专项计划项目(编号: 2008ZDKG-65)
710004, 西安交通大学口腔医学院正畸科
周洪 029-87281409 E-mail: zhouhong@mail.xjtu.edu.cn
R329.2
A
10.3969/j.issn.1001-3733.2017.05.021
(收稿: 2017-03-30 修回: 2017-04-26)

