烟道气固碳脱硫与海水脱钙的耦合研究
赵颖颖,冯 娜,吴梦凡,李 丹,马倩薇,袁俊生
(河北工业大学 海洋科学与工程学院,天津 300130)
烟道气固碳脱硫与海水脱钙的耦合研究
赵颖颖,冯 娜,吴梦凡,李 丹,马倩薇,袁俊生
(河北工业大学 海洋科学与工程学院,天津 300130)
利用海水和碱源的碱性与烟道气中二氧化碳和二氧化硫的酸性,实现了海水脱钙和烟道气固碳脱硫两者的耦合.加入碱源氧化镁,向海水中通入模拟烟道气,控制每次实验的通气时间,每次实验结束后研究溶液中等离子的变化趋势,并结合固相XRD图谱分析推测实验过程中的反应机理.结果表明:随着通气时间的增加,Ca2+浓度逐渐减小,脱钙率高达87.6%,固碳率先增加后降低,最高可达48.2%,通过离子的变化趋势并结合XRD峰图可推测出,Ca2+先与CO2反应生成CaCO3,而MgO与水结合生成Mg(OH)2,随CO2的通入,Mg(OH)2不断提供OH-促进二氧化碳的电离.但随着CO2继续增多,少量CaCO3会转换为Ca(HCO3)2而溶解,使脱钙率下降.
海水脱钙;烟道气;脱硫;固碳;新型碱源
0 引言
21世纪以后,环境问题日益严重.首先,碳排放总量日益增长[1];其次,雾霾现象严重,雾霾的重要元凶之一是燃煤污染排放的烟道气;同时,随着海水淡化工厂的不断扩张,淡水需求随人口的增加而增长,而海水淡化过程中的结垢问题则造成清洗成本增加、生产周期变长、产量减少等问题[2-3].因此,如何有效的控制二氧化碳的排放[4],减缓烟道气的固碳脱硫对大气污染等环境问题,解决海水脱钙问题具有重要意义[5-9].
国内已有学者对烟道气中CO2海水脱钙过程进行了研究,如袁俊生、赵颖颖等利用废弃烟道气中的CO2来脱除海水中的钙离子[10];其后,分别在海水脱钙装置、采用碱厂废弃白泥代替氢氧化钠作为碱源等方面进行研究[11-16],不仅降低了脱钙预处理成本,而且实现了较高的海水脱钙效率.而且进一步研究发现CO2脱钙后海水中的HCO-3含量明显增加,这也导致了海水体系的碱性增强,在HCO-3含量增加的情况下,SO2的溶解度大幅增加,且钙离子的浓度变化对SO2溶解性能无影响[17].这表明海水脱钙与烟气固碳脱硫工艺耦合是具有可行性的.因此提出设想,将烟道气固碳脱硫和海水脱钙耦合研究.
本论文开展新型价廉化学品作为碱源实现烟气固碳脱硫、海水脱钙的耦合研究,实现海水淡化处理与工业废气利用相结合,缓解海水利用过程中的结垢问题;将两者耦合后,可以实现工业多元化、低碳、高效的海水软化技术和烟道气处理技术,不仅提高了脱硫率,而且提高了工艺关联度,将资源物尽其用.为中国实现低碳技术的原始创新与推广应用提供重要思路和机理研究基础,有助力于我国大气污染防治和节能环保产业发展.
1 实验装置及流程
1.1 实验装置
实验装置如图1所示,利用恒温加热磁力搅拌器将碱源MgO活化,加热至80℃,控温误差为±0.1℃,并不断搅拌使碱源充分水解.而后模拟烟道气(成分见表2)由储气瓶经减压器减压,经过截止阀,由流量计调节一定流量并稳定后,经由曝气头进入反应装置三口烧瓶.而曝气头可使模拟烟道气以微小且较均匀的气泡通入海水中,增加了烟道气与人工海水反应的接触面积且相对减小了气体的流速,从而使海水与烟道气充分反应.同时烟气分析仪实时检测尾气中SO2含量,最终由NaOH溶液吸收处理尾气.
1.2 实验流程
设定恒温加热磁力搅拌器温度及转速,使海水预热到80℃.当温度达到80℃后,根据海水钙的含量按照钙镁1∶4的物质的量之比,加入碱源MgO,搅拌活化1 h.然后向海水中通入模拟烟道气,并开始计时.每次实验结束后,立即过滤,测定滤液中Ca2+、Mg2+、CO23-、HCO-3离子的含量,80℃恒温烘干滤渣,对所得固体进行X射线衍射分析,检测沉淀成分.实验反应时间间隔1 min,共考查10 min以内的反应过程.
实验所用初始模拟海水成分参照文献 [13]数据配置,具体配比参照表1所示,模拟烟道气成分如表2所示.
2 实验结果与讨论
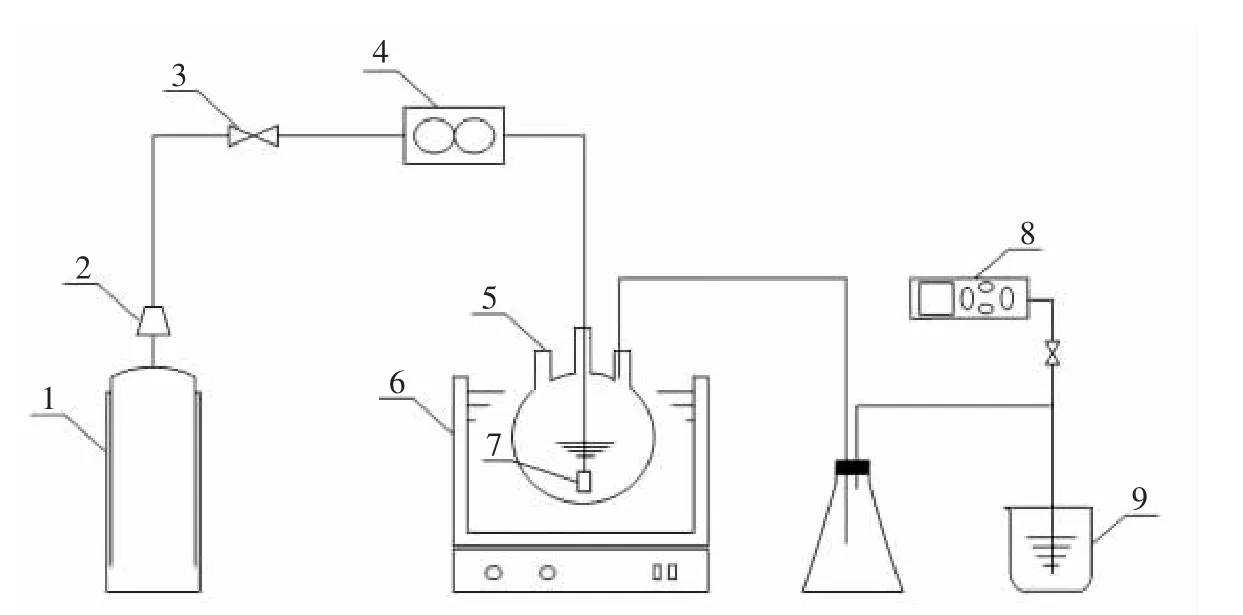
图1 实验装置图Fig.1 Experimental unit

表1 初始模拟海水成分Tab.1 Initial simulated seawater compositions
通气结束后,迅速过滤并水浴冷却至25℃,测定滤液中Ca2+、Mg2+、CO23-、HCO-3离子浓度.采用EDTA容量法测定钙镁离子浓度,分析方法参考国标GB/T13025.6-91.测定碳酸根、碳酸氢根离子浓度时,利用酸碱中和反应,用盐酸标准溶液滴定,第1步以酚酞作指示剂,滴定至溶液由红色变成无色,记录消耗体积V1,第2步再加入甲基橙试剂,滴定至橙色,记录消耗体积V2.
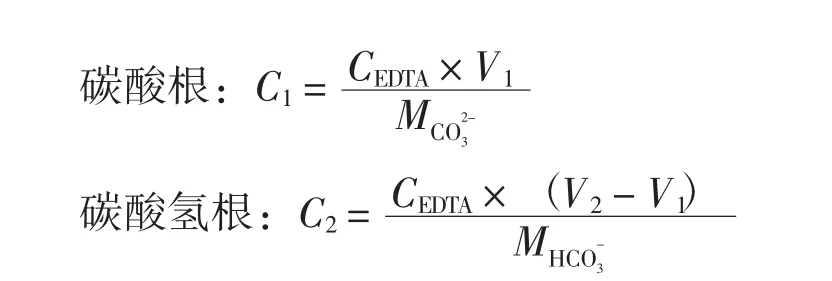

表2 模拟烟道气成分Tab.2 Simulated flue gas compositions
式中:C1为浓度,mol/L;C2为 HCO-3浓度,mol/L;CEDTA为标准溶液浓度,mol/L;而消耗盐酸标准溶液的体积,L;V2为连续滴定CO23-、HCO-3而消耗盐酸标准溶液的总体积,L;相对分子质量,g/mol;的相对分子质量,g/mol.
2.1 钙镁离子浓度
不同反应时间后母液中钙镁离子浓度变化趋势如图2所示.由图可知,随着通气时间的增加,钙离子逐渐减少并趋于稳定但又稍有增加.钙离子在5 min时达到最小值,此脱钙率高达87.6%.而镁离子浓度缓慢增加并趋于稳定,镁离子的浓度最终趋于一定1.81 g/L,经过计算发现,此时溶液中镁离子的含量正好等于原初始模拟海水中的镁离子和加入的碱源氧化镁中镁的含量之和.因此,通过反应母液后钙镁离子的浓度分析可知,固体产物中的钙含量逐渐增高,但镁的含量逐渐减少,直至仅是钙的沉淀物,可获得无镁离子掺杂的沉淀物.但是随着烟道气通入时间的继续延长,少量碳酸钙会溶解,使溶液中的钙离子含量又上升,脱钙率下降.
2.2 碳酸根、碳酸氢根离子浓度
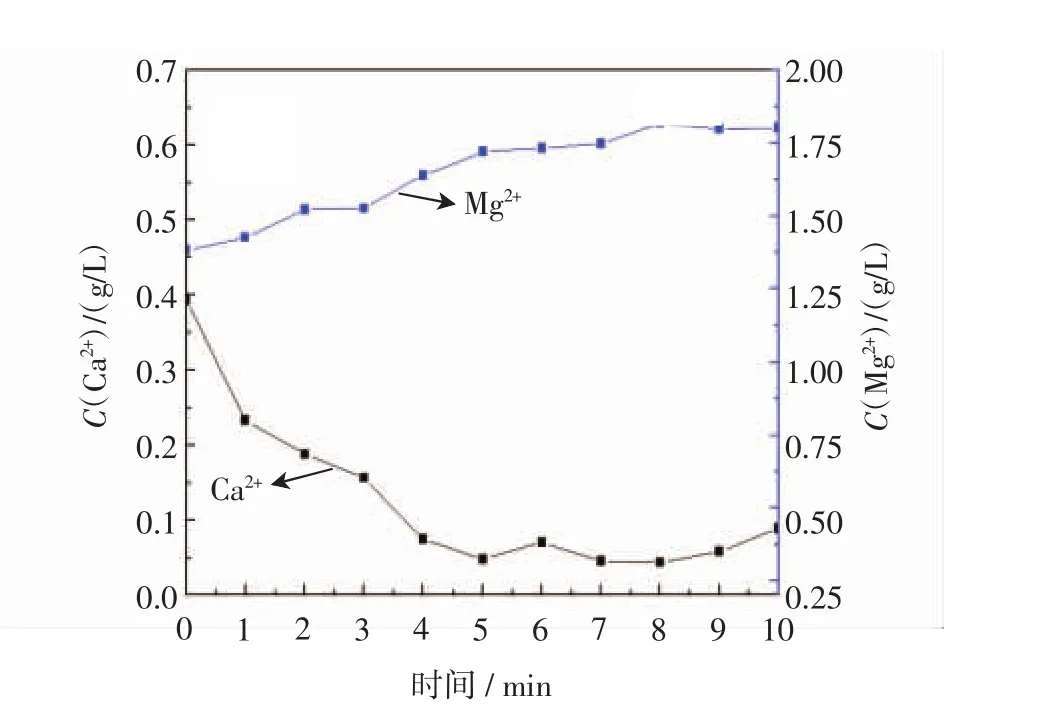
图2 不同反应时间后母液中钙、镁离子浓度Fig.2 Calcium concentration and magnesium concentration vs reaction time
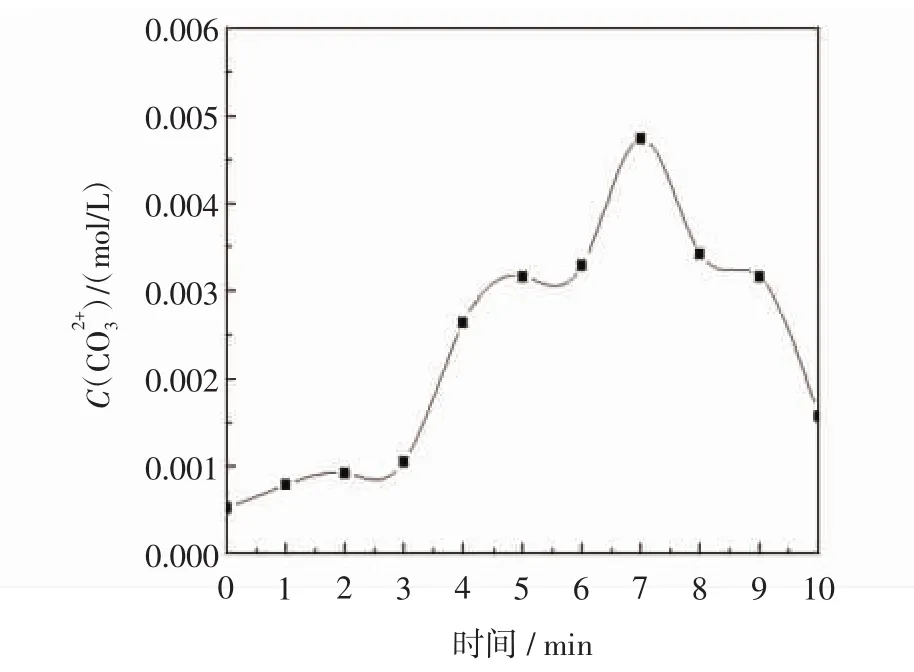
图3 不同反应时间后母液中碳酸根离子浓度变化Fig.3 The concentration ofvs reaction time
图3和图4分别显示了不同反应时间后母液中的碳酸根离子、碳酸氢根离子浓度变化,由图可知,碳酸根整体呈先增加后减小的趋势,碳酸氢根整体为增加趋势,但其中存在波动,且同比阶段碳酸氢根浓度高于碳酸根浓度.图3中,碳酸根整体呈先增加后减小的趋势:0~3 min碳酸根离子缓慢增加至0.001 mol/L,3~7 min迅速增加,7 min碳酸根离子浓度达到最大值0.004 74 mol/L,7 min后碳酸根离子浓度呈减小趋势;图4中,碳酸氢根离子浓度变化趋势:碳酸氢根0~3 min由初始浓度0.003 16 mol/L先减小,后增加至0.003 69 mol/L,而其迅速增加是从4 min开始,即在碳酸根增加之后,4~6 min增加至极大值0.01 mol/L,7~10 min增加至0.014 37 mol/L.由此可推测,碱源MgO活化搅拌1 h后,向人工海水中通入模拟烟道气,此时的溶液环境呈碱性,因此烟道气中的二氧化碳优先与氢氧根结合形成碳酸氢根,即在前3 min,二氧化碳的电离提供碳酸氢根是反应控制因素,碳酸氢根随后在氢氧根作用下转化为碳酸根.在4 min以后,二氧化碳的电离速度迅速增加,使碳酸根的量不仅足以和钙离子结合,而且溶液中碳酸根的量也在不断增加.但7 min以后,溶液中的碳酸根的含量逐渐降低,推测原因是碱源量下降,溶液中的氢氧根有限,继续通气致使反应碳酸氢根和氢氧根离子的结合受到限制.因此7 min前,碳酸氢根、碳酸根浓度均增大,且碳酸氢根浓度高于碳酸根,而7 min后,碳酸根浓度减小而碳酸氢根浓度继续增大.而结合图2所示溶液中镁离子含量的变化,发现溶液中镁离子含量的增加是在1~7 min之后,7 min以后镁离子含量不再变化,与对于碳酸根含量变化的推测一致.
2.3 固碳率及脱硫率
图5表示固碳量和固碳率随反应时间的变化趋势,图6表示脱硫率随反应时间的变化趋势.由图5可知,通气时间由1 min增加至10 min时,固碳量整体呈增加趋势,而其中1~6 min增长速率比6~9 min增长速率大,即单位时间内1~6 min固碳量大于6~9 min的固碳量,这与图3~图4中碳酸根和碳酸氢根含量的变化一致.因单位时间内通入的烟道气中的CO2含量均匀稳定,所以固碳率呈先增加后降低的趋势,1~5 min固碳率增加,5~10 min固碳率减小,固碳率在5 min时达到最大值,此时固碳率达到48.2%;根据仪器测量,可知模拟烟道气中二氧化硫的初始含量为0.465 2%,经过实验,由图6可知,随着通气时间的增长,脱硫率先稍有增加并趋于稳定,通过烟气分析仪实时测量尾气中SO2含量,可得出脱硫率超过99.9%.
2.4 固体产物成分分析
固体产物的成分通过XRD谱图进行分析,由谱图可知,固体产物成分由 CaCO3、MgO、Mg(OH)2、MgCO3.由图7和图8可知,1~6 min时Mg(OH)2的峰强度逐渐减小,MgO的峰强度逐渐减小,而CaCO3的峰强度逐渐增大,MgCO3的峰强度逐渐增大,6~10 min时CaCO3的峰强度逐渐减小,而Mg(OH)2、MgO则消失不见.
2.5 反应机理推测
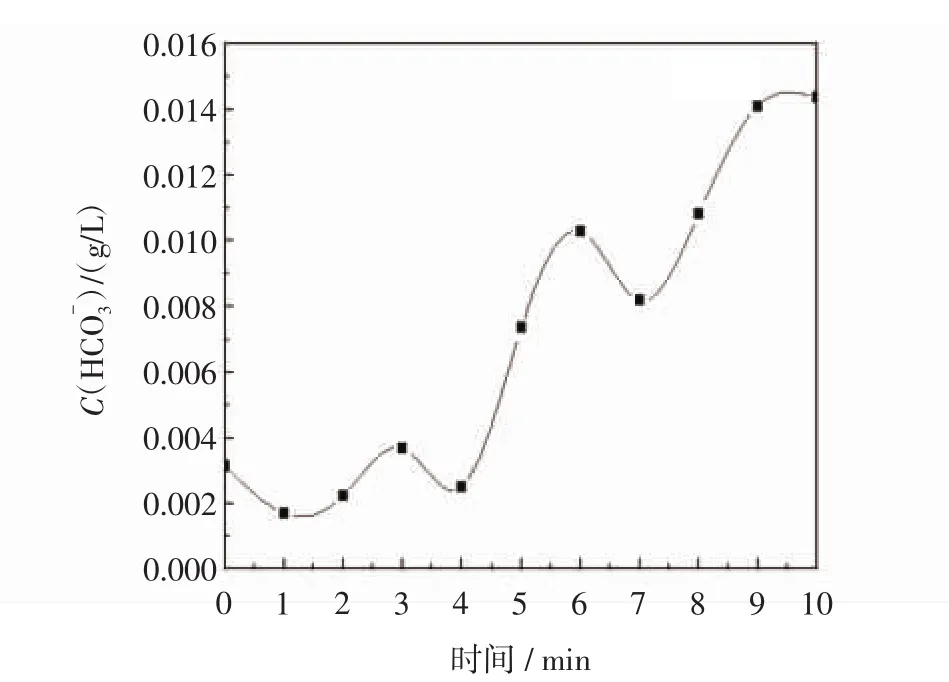
图4 不同反应时间后母液中碳酸氢根离子浓度变化Fig.4 The concentration of HCO-3vs reaction time
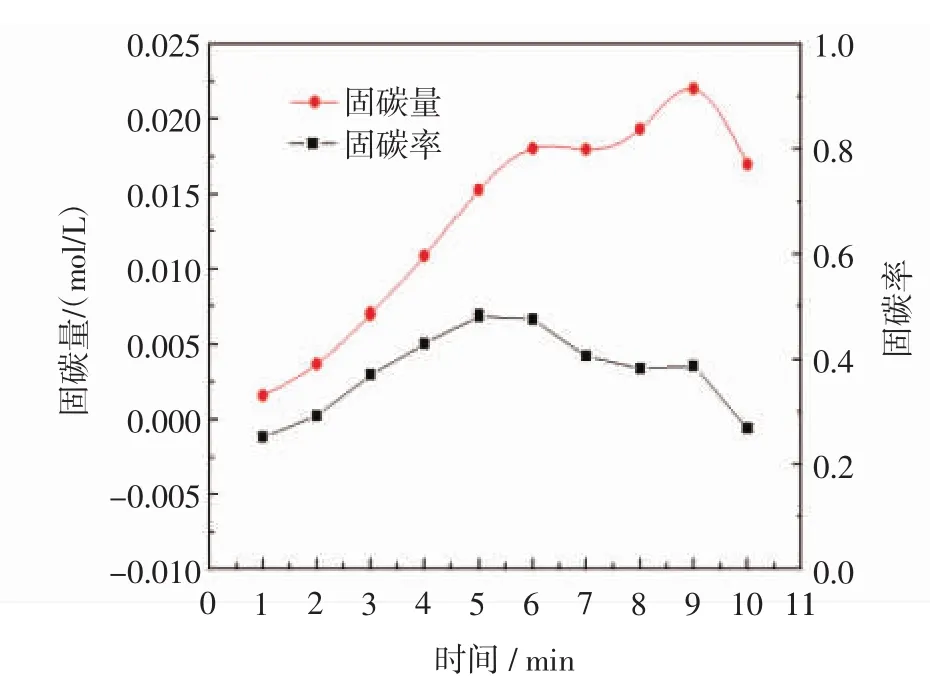
图5 固碳量、固碳率随反应时间的变化Fig.5 Carbon sequestration and carbon sequestration rate vs reaction time
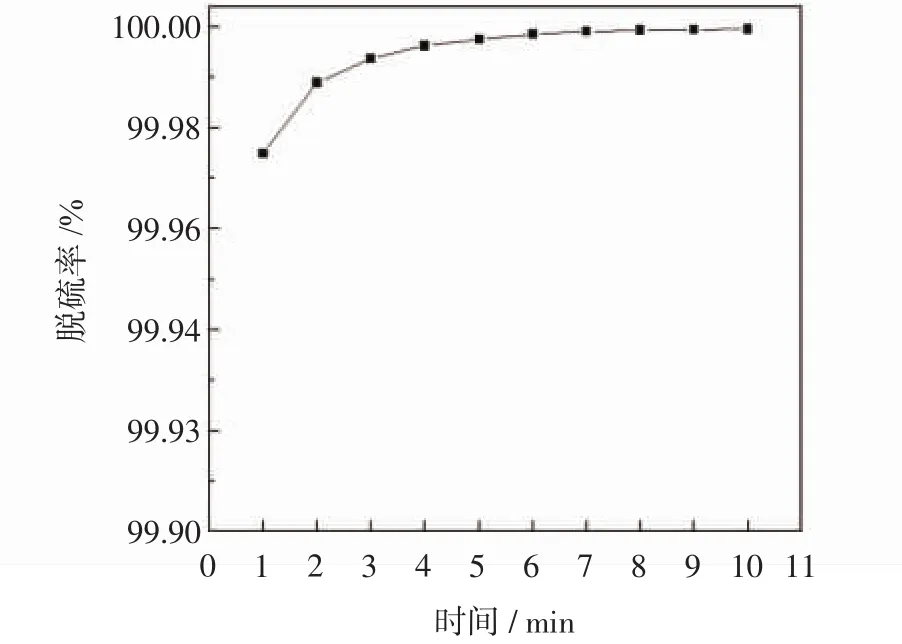
图6 脱硫率随反应时间的变化Fig.6 Desulfurization rate vs reaction time
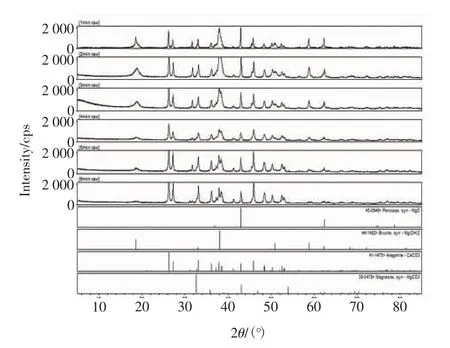
图7 1~6 min滤渣XRD谱图Fig.7 The XRD spectrum of precipitates from 1 min to 6 min

图8 6~10 min滤渣XRD谱图Fig.8 The XRD spectrum of precipitates from 6 min to 10 min
在1~6 min时,随着通气时间的增加,固碳量是增加的;Ca2+浓度减小;Mg2+浓度增大;同时据XRD图可知,CaCO3和MgCO3的含量增多.在6~10 min时,其中6~9 min阶段固碳量仍增加,9~10 min阶段固碳量减少;Ca2+浓度趋于稳定甚至稍有增加;Mg2+浓度稍有增大;CaCO3含量减少.因此推测该反应过程中Ca2+先与CO2反应生成CaCO3,而导致溶液中钙离子浓度随反应逐渐下降.随着CO2增多,部分CaCO3可转化为Ca(HCO3)2而使溶液中钙离子浓度增加且CaCO3含量减少.而反应过程中MgO一直在逐渐溶解并为二氧化碳的吸收提供氢氧根,因此镁离子浓度呈上升趋势,且固体成分中Mg(OH)2、MgO含量减少.二氧化硫的脱除率一直保持99.9%以上,而固体产物中并无硫酸化物的存在.因此推测海水脱硫的过程是气态的二氧化硫与水结合电离为亚硫酸氢根、硫酸根和氢离子,氢离子与溶液中的氢氧根或碳酸氢根结合.因此具体反应过程如下:

3 结论
本文研究了海水脱钙与烟道气固碳脱硫耦合时,固碳率、脱钙率和脱硫率的处理能力,并结合不同通气时间下的XRD谱图,探索实验过程中的反应机理,得出以下结论:
1) 随着通气时间的增加,脱硫率先稍有增加并趋于稳定,且脱硫率高达99%以上.
2) 随着通气时间的增加,钙离子逐渐减少并趋于稳定但又稍有增加,且在5 min时脱钙率最大,高达87.6%.
3) 随着通气时间的增加,固碳率整体呈先增加后减少的趋势.
4) 反应过程中,Ca2+先与CO2反应生成CaCO3,随着CO2增多,少量CaCO3溶于水生成Ca(HCO3)2.
研究表明,将烟道气固碳脱硫和海水脱钙耦合研究,可同时实现海水脱钙、烟道气固碳脱硫,其中脱硫效果尤其明显.两者耦合研究不仅减缓了海水淡化中的结垢问题,而且为减少烟道气的碳硫排放开辟了新的途径.本研究实现了废物结合利用,该工艺绿色环保.
[1] 宋师忠,焦艳霞.二氧化碳用途综述与生产现状[J].化工科技市场,2003(12):12-15.
[2] Betts K.Technology solutions:desalination,desalination everywhere[J].Environ Sci Techno1,2004,38(13):246A-247A.
[3] Shannon M A,Bohn P W,Elimelech M,et al.Science and technology for water purification in the coming decades[J].Nature,2008,452(7185):301-310.
[4] 张京亮,赵杉林,赵荣祥,等.现代二氧化碳吸收工艺研究[J].当代化工,2011,40(1):88-91.
[5] 万季霖.我国燃煤火电厂烟气脱硫脱硝技术发展现状分析[J].科技资讯,2014(11):104.
[6] 王文善.国内外脱硫技术的发展状况及需要研究的问题[J].氮肥技术,2006,27(2):1-5.
[7] 万建军,于博,刘安双.国内烟道气的综合利用[J].盐业与化工,2013,42(1):1-14.
[8] 陆诗建,向平,李清方,等.烟道气二氧化碳分离回收技术进展[J].应用化工,2009,38(8):1207-1209.
[9] 王娜.中小型燃煤炉烟气脱硫问题及节能技术分析[J].资源节约与环保,2014(9):18.
[10]袁俊生,赵颖颖,张继军,等.用烟道气进行脱钙的方法:CN,ZL201210199641.5[P].2012-06-18.
[11]袁俊生,赵颖颖,刘杰,等.一种烟道气海水脱钙的装置:CN,ZL201320129585.8[P].2013-03-21.
[12]袁俊生,赵颖颖,纪志永,等.一种烟道气固碳海水脱钙的新方法:CN,ZL201410306491.2[P].2014-06-30.
[13]Zhao Yingying,Yuan Junsheng,Zhang Jijun,et al.A different approach for seawater decalcification pretreatment using carbon dioxide as precipitator[J].Desalination,2013,322:151-158.
[14]Zhao Yingying,Cao Hainan,Xie Yinghui,et al.Mechanism studies of a CO2participant softening pretreatment process for seawater desalination[J].Desalination,2016,393:166-173.
[15]Zhao Yingying,Zhang Yan,Liu Jianlu,et al.Trash to treasure:Seawater pretreatment by CO2mineral carbonation using brine pretreatment waste of soda ash plant as alkali source[J].Desalination,2017,407:85-92.
[16]王伟,赵颖颖,袁俊生,等.利用立体旋液式并流塔进行烟道气海水脱钙研究[J].水处理技术,2014,(12):74-78,82.
[17]谢英惠,曹海楠,赵颖颖,等.二氧化硫在脱钙后海水体系中的溶解平衡[J].化工进展,2016,35(4):1012-1016.
On the coupling of flue gas desulfurization and carbon sequestration with sea water decalcification
ZHAO Yingying,FENG Na,WU Mengfan,LI Dan,MA Qianwei,YUAN Junsheng
(School of Marine Science and Engineering,Hebei University of Technology,Tianjin 300130,China)
According to the characteristics of sea water and flue gas,the coupling of flue gas desulfurization and carbon sequestration with seawater decalcification was studied.Not only the concentration changes ofwere studied,but also the mechanism of the experimental process was speculated with XRD spectrum.Simulated flue gas was added into sea water,varying from 1 min to 10 min,after adding new alkali source——MgO.It is found that the concentration ofgradually decreases while carbon fixation rate increases first and then decreases.Combined with the concentration changes ofand XRD spectrum,it is speculated that firstly the reaction between Ca2+and CO2produces CaCO3while MgO reacts with the water to give Mg(OH)2which continually provides OH-to promote the ionization of carbon dioxide, and then a little CaCO3turns into Ca(HCO3)2with continuous influx of CO2.
seawater decalcification;flue gas;desulfurization;carbon sequestration;new alkali source
TQ95
A
1007-2373(2017) 05-0045-06
10.14081/j.cnki.hgdxb.2017.05.008
2017-04-24
中国博士后科学基金(2017M611142);国家科技支撑计划(2015BAB09B00);天津市自然科学基金(14JCYBJC20700);河北省科技支撑计划(17273101D)
赵颖颖(1985-),女,副教授,luckyzhaoyy@126.com.
[责任编辑 田 丰]

