力竭运动过程中大鼠纹状体抗坏血酸的动态变化及对胞外Glu含量的调节
李真真,王志锋,康道峰,徐 丹,乔德才
(1.哈尔滨师范大学体育科学学院,黑龙江哈尔滨150025;2.北京师范大学体育与运动学院,北京100875;3.无锡市蠡园中学,江苏无锡214000;4.太原工业学院体育系,山西太原030008)
力竭运动过程中大鼠纹状体抗坏血酸的动态变化及对胞外Glu含量的调节
李真真1,2,王志锋2,康道峰3,徐 丹4,乔德才2
(1.哈尔滨师范大学体育科学学院,黑龙江哈尔滨150025;2.北京师范大学体育与运动学院,北京100875;3.无锡市蠡园中学,江苏无锡214000;4.太原工业学院体育系,山西太原030008)
目的:揭示运动性疲劳发生、发展过程中纹状体脑区抗坏血酸(AA)动态变化规律及其对胞外Glu浓度的调节作用,进一步阐明AA抗运动性疲劳的中枢机制。方法:以雄性Wistar大鼠为实验对象,实验分为AA检测组(AAT)、AA补充组(AAG)和对照组(SG),采用微透析—电化学联用检测技术,动态观察一次性力竭运动过程中大鼠纹状体细胞外AA浓度的变化;采用微透析—高效液相色谱联用技术,动态观察外源性补充AA对纹状体胞外Glu含量的影响。结果:AAT大鼠纹状体胞外AA浓度在运动初期未见著改变,运动后期与安静状态相比显著升高(P<0.01),恢复90 min时仍显著高于安静水平(P<0.05)。补充AA后,力竭性运动过程中大鼠纹状体胞外Glu与对照组的变化趋势相似,但Glu峰值出现的时间较对照组推迟约30 min,且大鼠运动至力竭的时间也显著延长(P<0.05)。结论:大鼠在力竭运动过程中纹状体胞外AA浓度升高可能是对自身抗氧化能力降低的一种代偿反应;运动前适当补充AA可以降低纹状体Glu浓度异常升高所产生的兴奋性毒性作用,延缓运动疲劳的发生,其机制可能与AA的抗氧化和对纹状体胞外Glu的调节作用有关。
运动性疲劳;大鼠;纹状体;抗坏血酸;谷氨酸;神经调节
抗坏血酸(ascorbic acid,AA)又称维生素C(Vc),是体内重要的抗氧化物质。新近研究发现,它在中枢神经系统中具有较高浓度,且与脑内神经元密度呈正相关[1]。高浓度的AA不仅参与脑能量代谢[2]和神经元电活动调节[3],同时还参与谷氨酸(glutamate,Glu)神经递质释放的调节[4]。Glu是中枢神经系统中分布最广泛的兴奋性神经递质[5]。在正常生理状态下,皮层Glu纤维末梢可投射至纹状体,通过释放Glu调节纹状体神经元的兴奋性[6]。有研究证实,纹状体内Glu含量异常升高可影响纹状体投射神经元的兴奋性,致使纹状体运动调控的直接通路和间接通路兴奋性失衡[7]。本实验前期研究发现,大鼠在力竭性运动过程中纹状体神经元胞外Glu浓度出现不同程度升高[8],推测这可能是通过影响大鼠纹状体神经元胞外AA含量间接调节Glu释放,最终影响大鼠的运动能力,但未见相关报道。为此,本研究拟采用活体微透析—电化学检测联用技术,动态观察大鼠在力竭性运动过程中纹状体细胞外液AA浓度的变化;并采用微透析—高效液相色谱联用技术,同步观察补充AA对力竭运动大鼠纹状体胞外Glu含量的调节作用和运动能力的影响,以期为进一步揭示力竭性运动过程中大鼠纹状体胞外AA的变化规律及AA对纹状体Glu释放的调节作用提供实验依据。
1 材料与方法
1.1 实验动物
选用清洁型雄性Wistar大鼠24只,体重(250± 10)g,由北京维通利华实验动物技术有限公司提供〔许可证号:SCXK(京)2012-0001〕。动物常规分笼饲养,自由饮水和进食,自然光照,动物房温度为(20±3)℃,相对湿度为40%~60%。动物在实验室喂养1~2天后进行3 d适应性跑台训练。
实验前将动物随机分为AA检测组(AAT)、AA补充组(AAG)和对照组(SG),每组8只。其中AAG组在运动前腹腔注射500 mg/kg的AA(溶剂为生理盐水1ml)[7],SG组注射同等剂量的生理盐水。
1.2 实验方法
1.2.1 实验仪器与试剂 主要仪器:微量注射泵(BAS,MD-1001),1 mL微量注射器(BAS,MD-0100P),微透析探针(BAS,MD-2204),微透析探针套管(BAS,MD-2251),一次性无菌过滤器(德国赛多利斯公司,直径:0.2μm),三维立体定位仪(日本成茂,SN-3N),电化学检测系统(中国科学院化学研究所生命分析化学实验室,CH18326),单道大鼠跑台(杭州段式,DSPT-208-1)。
主要试剂:抗坏血酸钠盐(Sodium L-ascorbate)和Glu标准品购自sigma公司;NaCl、KCl、KH2PO4、MgCl2、NaHCO3、Na2SO4、CaCl2等分析纯购自北京化学试剂公司。
1.2.2 相关溶液的配制 人工脑脊液(aCSF)的配制[9]:NaCl 126 mM/L,KCl 2.4 mM/L,KH2PO40.5 mM/L,MgCl20.85mM/L,NaHCO327.5mM/L,Na2SO40.5mM/L和CaCl21.1 mM/L,待药品充分溶解于超纯水后,将pH调至7.4,然后用直径0.2μM的无菌过滤器过滤,4℃下冷藏备用。AA标准溶液:配置1 mmol/L的AA标准溶液1mL作为母液,并将其逐级稀释成1μmol/L、5μmol/L、10μmol/L、30μmol/L、50μmol/L和100μmol/L 6个浓度梯度的AA标准溶液。
Glu标准溶液:称取Glu标准品,配置成0.4 mmol/L的Glu标准溶液;衍生试剂:精密称取邻苯二甲醛(OPA)125 mg,用2.5 ml甲醇溶解后,加入25mL浓度为0.4mol/L的硼酸缓冲液(pH 9.5),涡旋混匀,再加入100μLβ-巯基乙醇。
1.2.3 微透析探针套管植入手术 腹腔注射1%的戊巴比妥钠(5.1 mL/kg)麻醉大鼠,取其俯卧位固定于脑立体定位仪(SN-3N,日本成茂)上。沿大鼠头顶正中线做矢状切口,双氧水清除颅骨表面软组织,暴露颅骨前、后囟及冠、矢状缝等骨性标志,调整门齿高度,使前后囟在同一水平。依据Paxinos&Watson大鼠脑立体定位图谱[10],在左侧纹状体(P:0.2,L:3.0,H:-3.2)对应的颅骨部位钻孔,除去硬脑膜,使用微推进器(PC-5N,日本成茂)以50μm/s的速度将探针导管(BAS,MD-2251)植入到大鼠左侧纹状体(P:0.2,L:3,H:3.2),并用小螺钉和牙科水泥固定。术后恢复4~5 d,大鼠饮食和行为活动恢复正常后开始进行恢复训练,当大鼠能以20 m/min的速度持续运动30 min且未见不良反应时,开始进行正式实验。
1.2.4 一次性力竭运动方案 采用本实验室前期根据Bedford方法改建的递增负荷跑台一次性力竭运动方案[11],负荷分为3级,坡度均为0°:Ⅰ级负荷:8.2 m/min,15 min;II级负荷:15 m/min,15 min;III级负荷:20m/min,运动至力竭(图1)。判断大鼠力竭状态的标准为:大鼠跑动姿态由蹬地式变为伏地式,并滞留在跑道末端不能继续跑动,用声音、光照等刺激均不能驱使其继续维持运动。
1.3 AA浓度的电化学检测
大鼠纹状体内AA浓度的检测采用中科院化学所毛兰群等[12]建立的电化学检测方法。该检测系统主要包括单壁碳纳米管修饰的薄层玻碳电极和电化学工作站(CHI832b),依据系统对不同浓度AA反应的电流强度检测AA浓度(图2)。
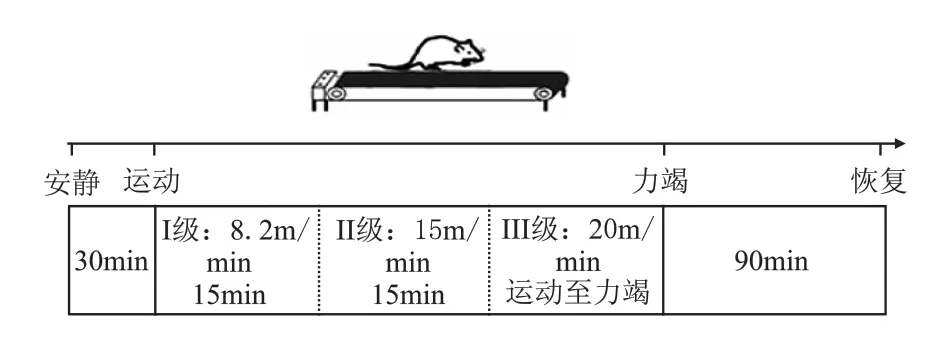
图1 大鼠力竭运动方案
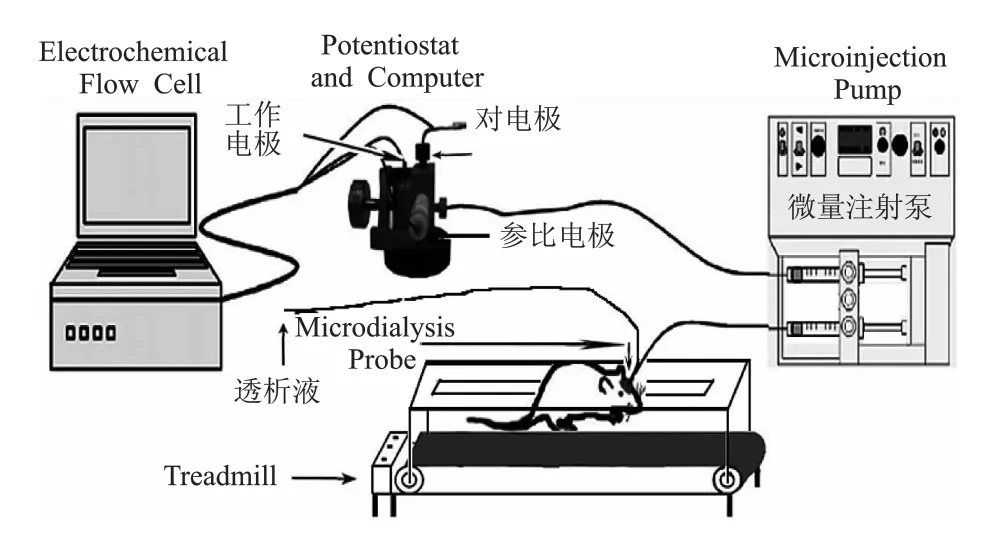
图2 大鼠跑台与微透析-电化学联用活体在线检测系统
在正式实验前先将前期配制的6个不同浓度的AA标准溶液按照由低到高的浓度梯度,依次注入电化学检测系统进行检测(图3下)。对所得结果进行计算,得出AA标准曲线方程:Y=0.2071X-7.1024,式中Y为AA浓度(单位:μmol/L),X为电化学响应电流(单位:nA),r=0.9985(图3上)。
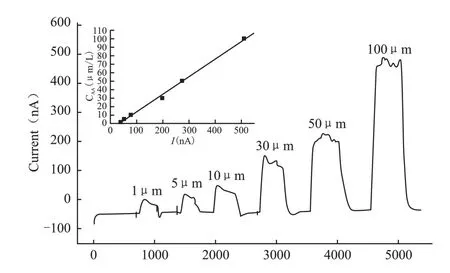
图3 AA标准溶液电化学响应及标准曲线
正式实验时先打开电化学检测系统,选择Amperometric i-t Curve程序,将采样频率设置为2次/s,并开启透析灌流系统,调节恒流泵控制其流速为2 μl/min,将微透析探针插入到预先埋藏在大鼠纹状体的探针套管中,并与aCSF灌流系统相接,灌流平衡60 min后大鼠开始在跑台上进行一次性力竭运动,同时将透析液与电化学检测系统相接。以每只大鼠安静状态下透析液中AA的平均浓度作为基础值,以每5 min内检测值的平均数作为一个监测点,用各监测点脑透析液中AA浓度检测值与基础值的百分比来反映力竭运动过程中大鼠纹状体胞外AA浓度的变化。
1.4 Glu浓度的高效液相色谱检测
实验前先准确量取Glu标准品,配制为0.1,0.01,0.001μmol/L的混合液,采用高效液相色谱荧光检测法测定各浓度峰面积,进样量为20μL。以峰面积为横坐标、浓度为纵坐标,计算样品的Glu标准曲线公式:Y=(1.42499e-009)X+(-0.066098)(R=0.9993838)(图4)。
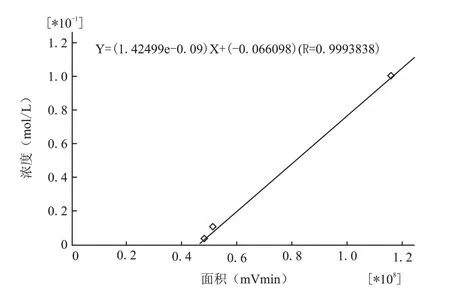
图4 G lu标准溶液的标准曲线
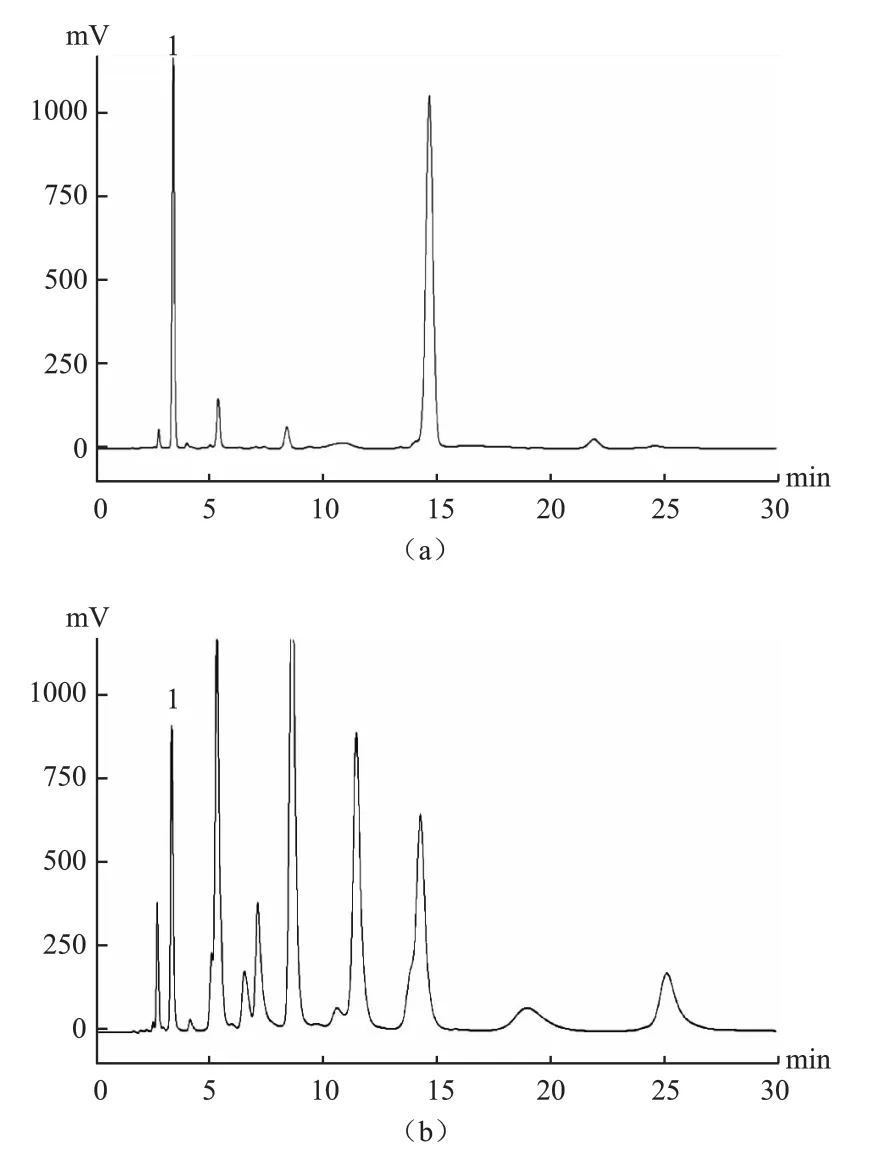
图5 G lu标准品和透析液样品的高效液相色谱检测图
纹状体微透析液采样频率为1次/30 min,每次采集样品量60μl,分别采集大鼠在运动中和恢复期90 min的样本,并及时放入-20℃冰箱中保存待测。待微透析实验全部结束后,取透析液30μl经OPA柱前衍生和梯度洗脱等步骤后开始进行色谱分析[8]。色谱激发波长(Ex)=357 nm、发射波长(Em)=455 nm,柱温箱25℃,之后对大鼠脑透析样品进行检测,并分离Glu(图5)。
1.5 脑组织学鉴定
实验结束以后用10%的水合氯醛(0.35 ml/kg)腹腔麻醉大鼠,然后取仰卧位固定四肢,打开胸腔,并用4%的甲醛溶液经心脏常规灌流固定,取出脑组织,沿冠状面做切片,尼氏染色。对照大鼠脑立体定位图谱确定探针尖端所在的位置(图6),如探针未准确插入纹状体的数据将被剔除。
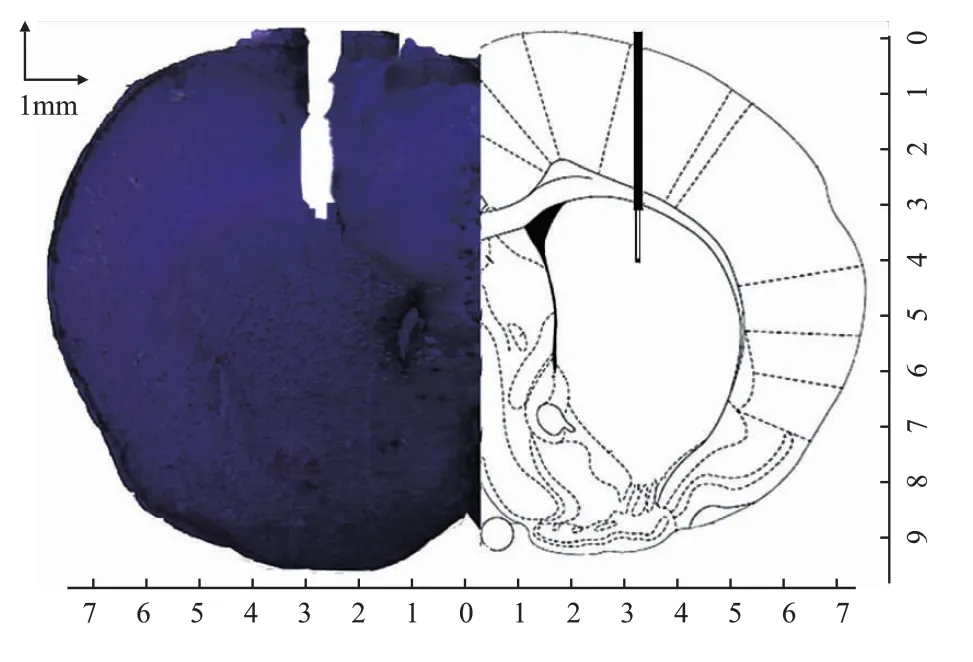
图6 微透析探针定位脑片
1.6 数据统计与分析
所得数据用平均数±标准差(¯X±S)表示,应用SPSS 15.0统计软件对数据进行Repeated measures ANOVA分析,组间力竭时间的比较采用独立样本t检验,P<0.05表示有显著性差异,P<0.01表示有极显著性差异。
2 结果
2.1 力竭运动过程中大鼠纹状体胞外AA的变化特征
由于大鼠力竭运动的时间差别很大(138.63± 21.35)min,为了便于统计对比,可将力竭运动过程划分为4个阶段:安静状态(0~30 min)、运动状态Ⅰ(30~60 min)、运动状态Ⅱ(力竭前60 min—力竭即刻)和恢复状态(力竭即刻—恢复90 min)。通过实验,发现力竭运动过程中大鼠纹状体胞外AA浓度在运动初期没有显著变化,之后开始快速增高,到力竭前60 min达到并维持在较高水平(P<0.01),力竭前开始下降,但仍处于较高水平。在恢复初期有一小幅升高,随后逐渐回落,90 min时仍然高于安静水平(P<0.05)(图7)。

图7 力竭运动过程中大鼠纹状体胞外AA的变化阶段特征
2.2 补充AA后大鼠纹状体胞外Glu含量及运动能力的变化
以大鼠安静状态时透析液中Glu平均浓度为基础值,用不同时间段样品中Glu浓度占基础值的百分比来反映此时Glu浓度变化率。AAG组与SG组大鼠纹状体胞外Glu浓度在力竭运动过程中的动态变化可绘制为图8。
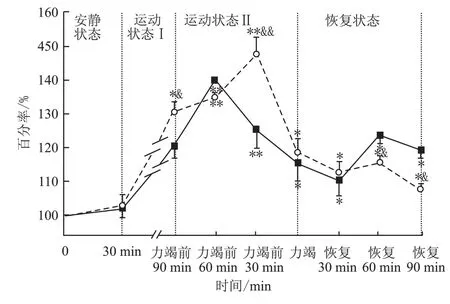
图8 一次力竭运动中SG和AAG大鼠纹状体G lu水平的变化
由图8可见,SG大鼠纹状体胞外Glu浓度在运动初期随运动逐渐升高,力竭前60 min达到最高水平,随后开始逐渐下降,直至力竭。运动后30 min降至最低值,之后出现回升,在整个力竭运动过程中Glu水平均显著高于安静水平(P<0.05或P<0.01)。AAG大鼠纹状体胞外Glu浓度变化与SG相比,其上升趋势基本相同,上升幅度则要平缓一些,出现峰值的时间则推后了约30 min左右,峰值也较SG有所升高(P<0.05),而在运动后60~90 min时显著低于SG(P<0.05)。同时发现AAG大鼠运动至力竭的时间(165.00±21.80)min较SG(137.17±21.43)min平均延长了27.83 min(P<0.05),提高了约20.28%。
3 讨论
躯体运动是在大脑皮层和基底神经节的调控作用下实现的[13]。纹状体是基底节中主要的信息输入核团,通过“基底神经节—丘脑—皮层环路”直接或间接参与随意运动的程序编码与执行,在运动的方向、顺序、速度、幅度等方面具有重要调节作用[14]。临床医学和大量动物实验证实纹状体功能失调是帕金森、亨廷顿和肌张力障碍等疾病后疲劳产生的重要病理机制。本实验室已从神经元电活动、神经递质、能量代谢等方面证实纹状体也是参与运动疲劳中枢调控的重要脑区之一[14-16]。
正常状态下,脑组织依靠自身抗氧化防御体系,使自由基的产生与清除保持动态平衡[17]。但在大强度运动或某些病理条件下,体内自由基生成率大于清除率时,会造成自由基大量堆积,发生脂质过氧化损伤。因此,大强度运动过程中体内产生大量自由基可能是导致运动疲劳的重要因素之一[18]。AA[19]、褪黑激素[20]等抗氧化物质补充对自由基的清除具有一定作用,已被作为抗疲劳补剂广泛应用于运动训练和比赛中。AA属于一种水溶性抗氧化剂,外周AA可经特异性抗坏血酸转运体(SVCT2)逆浓度梯度转运入脑脊液,维持中枢神经组织较高的AA浓度[21],并与外周AA浓度呈逐级递增趋势[22]。有研究发现AA在整个脑组织中的平均浓度约为1~3 mM/L,而在神经细胞中的浓度可达10 mM/L[3],推测维持中枢神经系统中高浓度AA可能对其自身抗氧化系统功能具有重要意义。本研究结果显示,AAT大鼠在跑台运动初期纹状体胞外AA浓度没有显著性变化;但力竭前60 min时,纹状体胞外AA浓度急剧增高,并维持在较高水平。分析其原因这可能是中枢神经系统对自身抗氧化系统功能降低的一种代偿表现。在运动过程中脑组织氧利用率增加,自由基的大量产生,通过释放AA可以加速自由基清除,从而可避免神经细胞膜的氧化损伤。而大鼠在力竭前15 min左右,纹状体胞外AA浓度开始出现下降直至运动力竭,这或许是中枢神经系统自我保护机制降低的一种表现。由此可以认为纹状体胞外AA浓度变化可以在一定程度上反映一次性力竭运动过程中脑组织自由基对神经元的损伤程度。
Glu是中枢神经系统内最主要的兴奋性神经递质之一,参与了皮层——纹状体神经通路兴奋性调节。正常状态下,Glu突触兴奋时释放的Glu进入突触间隙发挥作用后,可被神经细胞或神经胶质细胞重新摄取。在该过程中胞内的AA会溢出,促进胞外的Glu进入胞内,该现象被称作AA与Glu之间的“异型交换”机制[7]。本研究发现,两组大鼠在力竭性运动过程中,纹状体胞外Glu浓度明显增高,都显著高于安静时水平,其原因可能是由于运动过程中皮层—纹状体Glu突触末梢Glu大量释放所至,对于维持神经元的兴奋性具有重要作用[8,23]。但是过高浓度Glu会对神经细胞产生兴奋性毒作用,引起基底神经节直接通路和间接通路功能的失衡,进而诱发运动疲劳[24]。如在运动前适当补充一定剂量的AA后,一方面可以提高大鼠自身抗氧化系统的抗氧化能力,有利于维持纹状体神经细胞膜结构的完整性,延长运动能力;另一方面也有利于胞外AA浓度的维持,促进AA与Glu之间的异型交换,加速神经细胞或神经胶质细胞对胞外Glu的重摄取,降低Glu对神经细胞的兴奋性毒作用,从而推迟大鼠运动疲劳的出现,使其运动能力明显提高,并使纹状体胞外Glu浓度的恢复效率在运动后也得到了一定的改善。
综上所述,通过在运动前补充AA的方法达到了提高大鼠的运动能力、延缓运动疲劳的效果,这可能是AA抗氧化和对纹状体胞外Glu调节共同作用的结果。随着人们对AA参与中枢抗氧化作用调节机制的进一步认识,它将被更广泛地运用于竞技体育的比赛之中。
4 结论
采用微透析—电化学检测和微透析—高效液相色谱联用的活体检测技术,对一次性力竭运动过程中大鼠纹状体神经细胞外液中AA和Glu浓度的动态变化规律进行了实时、在线观察,发现力竭运动过程中纹状体胞外AA浓度升高可能是对自身抗氧化能力降低的一种代偿反应;运动前适当补充AA可起到降低纹状体Glu兴奋性毒性作用、延缓运动疲劳的目的,其机制可能是通过AA的抗氧化和对纹状体胞外Glu的调节作用共同完成的。
[1]Rice ME.Ascorbate regulation and its neuroprotective role in the brain[J].Trends Neurosci,2000,23(5):209-216.
[2]Porras OH,Ruminot I,Loaiza A,Barros LF.Na+-Ca2+cosignaling in the stimulation of the glucose transporter GLUT1 in cultured astrocytes[J].Glia,2008,56(1):59-68.
[3]James J,George V.Ascorbatemodulation of sensorimotor processing in striatum of freely moving rats[J].Brain Res,2006,1092(1):108-116.
[4]Castro MA,Beltrán FA,Brauchi S,et al.A metabolic switch in brain:glucose and lactate metabolism modulation by ascorbic acid[J].JNeurochem,2009,110(2):423-440.
[5]Freeze BS,Kravitz AV,Hammack N,et al.Control of basal ganglia output by directand indirect projection pathway neurons[J].JNeurosci,2013,33(47):18531-18539.
[6]CalabresiP,PicconiB,TozziA,etal.Dopamine-mediated regulation of corticostriatal synaptic plasticity[J].Trends Neurosci,2007,30(5):211-219.
[7]陈巍,乔德才,刘晓莉.纹状体神经元可塑性与帕金森病的运动防治研究进展[J].中国运动医学杂志,2014,33(7):729-734.
[8]乔德才,李许贞,杨东升,等.力竭运动前后活体大鼠纹状体谷氨酸和γ-氨基丁酸水平的动态变化[J].中国运动医学杂志,2011,30(10):921-925.
[9]Kun Liu,Yuqing Lin,Ling Xiang,et al.Comparative study of change inextracellular ascorbic acid in different brain ischemia/reperfusion modelswithin vivo microdialysis combined with on-line electrochemical detection[J].Neurochem Int,2008,52(6):1247-1255.
[10]Paxinos G,Watson C.The rat brain in stereotaxic coordinates[D]. San Diego:Academic Press,1997:22-24.
[11]刘晓莉,罗勇,乔德才.大鼠一次性力竭跑台运动模型的建立与动态评价[J].中国实验动物学报,2012,20(3):25-28.
[12]Zhang M,Liu K,Gong K,etal.Continuouson-linemonitoring of extracellular ascorbate depletion in the rat striatum induced by global ischemia with carbon nanotube-modified glassy carbon electrode integrated into a thin-layer radial flow cell[J].Anal Chem,2005,77(19):6234-6242.
[13]Middleton,FA,Strick PL.Basal ganglia and cerebellar loops:motor and cognitive circuits[J].Brain Res Brain Res Rev,2000,31(2-3):236-250.
[14]侯莉娟,刘宏强,乔德才.纹状体神经细胞分型及其功能构建[J].中国临床康复,2004,8(10):1928-1929.
[15]乔德才,侯莉娟,等.运动疲劳对大鼠新纹状体神经元电活动的影响[J].中国运动医学杂志,2005,24(6):676-680.
[16]杨东升,刘晓莉,乔德才.力竭运动过程中大鼠纹状体葡萄糖/乳酸代谢的实时观察[J].中国运动医学杂志,2009,28(4):384-387.
[17]Arieli Y,Kotler D,Eynan M.Hyperbaric oxygen preconditioning protects rats against CNS oxygen toxicity[J].Respir Physiol Neurobiol,2014,197:29-35.
[18]Ziech D,Franco R,Pappa A,et al.Reactive oxygen species(ROS)-induced genetic and epigenetic alterations in human carcino-genesis[J].Mutat Res,2011,711(1-2):167-173.
[19]Kim DI,Kim KS.Walnut extract exhibits anti-fatigue action via improvement of exercise tolerance in mice[J].Lab Anim Res,2013,29(4):190-195.
[20]Lund Rasmussen C,Klee Olsen M,Thit Johnsen A,et al.Effects of melatonin on physical fatigue and other symptoms in patients with advanced cancer receiving palliative care:A double-blind placebocontrolled crossover trial[J].Cancer,2015,121(20):3727-3736.
[21]Oyarce K,Silva-Alvarez C,Ferrada L,etal.SVCT2 Is Expressed by Cerebellar Precursor Cells,Which Differentiate into Neurons in Response to Ascorbic Acid[J].Mol Neurobiol,2007,10:1-14.
[22]Miele,M,Fillenz M.In vivo determination of extracellular brain ascorbate[J].JNeurosciMethods,1996,70(1):15-19.
[23]Criswell HE,Ming Z,Griffith BL,etal.Comparison of effectofethanol on N-methyl-D-aspartate-and GABA-gated currents from acutely dissociated neurons:absence of regional differences in sensitivity to ethanol[J].JPharmacol Exp Ther,2003,4(1):192-199.
[24]乔德才,刘军,刘晓莉.运动疲劳的中枢机制研究进展—基于基底神经节—皮层环路紊乱的视角[J].北京体育大学学报,2015,37(2):51-58.
Dynamic Changes of Ascorbic Acid in Striatum of Rats During Exhaustive Exercise and Regulation of Extracellular Glu Content
LIZhenzhen1,WANG Zhifeng2,KANG Daofeng3,XU Dan4,QIAO Decai2
(1.College of Physical Education and Science,Harbin Normal University,Harbin 150025,Heilongjiang,China;2.College of P.E.and Sports,Beijing Normal University,Beijing 100875,China;3.Wuxi Liyuan Middle School,Wuxi214000,Jiangsu,China;4.Physical Education Department,Taiyuan Institute of Technology,Taiyuan 030008,Shanxi,China)
Objective:The purpose of this study is to reveal the dynam ic changes of ascorbic acid(AA)in the striatum and the regulation of extracellular Glu concentration during the development of exercise-induced fatigue,and to further clarify the centralmechanism of AA antiexercise fatigue.Male Wistar rats were used as experimental subjects,and divided into AA group(AAT),AA supplementgroup(AAG)and controlgroup(SG).The changes of extracellular AA concentration in striatum of rats in the process of one-time exhaustive exercisewere observed dynamically bym icro dialysis-electrochemical detection technology.The effects of exogenous AA supplementation on the contentof extracellular Glu in striatum were observed by m icro-dialysis and high performance liquid chromatography(HPLC).Results:In the AAT group,the extracellular AA concentration in the striatum did not change in the early stage of exercise,the late stage of exercise was significantly higher than that of quiet state(P<0.01),and the recovery of 90min was still significantly higher than that of the quiet level(P<0.05).A fter supplementing AA,the trend of Glu in the striatum of rats during exhaustive exercise was similar to that in the control group,but the peak value of Glu was delayed by about 30m in compared w ith the control group,and the time of exercise to exhaustion was significantly prolonged(P<0.05).Conclusion:The increase of extracellular AA concentration in the striatum during exhaustive exercise and recovery may be a compensatory response to the decrease of antioxidant capacity.Supplement AA can decrease the excitatory toxic effect caused by the abnormal increase of Glu concentration in the striatum and delay the occurrence of exercise fatigue,whichmay be related to the antioxidation of AA and the regulation of extracellular Glu in the striatum.
exercise-induced fatigue;rat;striatum;ascorbic acid;Glutamate;regulation
G804.7
A
1004-0560(2017)05-0070-06
2017-05-26
2017-06-21
国家自然科学基金资助项目(31571221);北京自然科学基金资助项目(5142012)。
李真真(1982—),女,讲师,硕士,主要研究方向为体育教育训练学。
乔德才(1957—),男,博士,教授,博士生导师,主要研究方向为运动与神经调控,E-mail:decaiq@bnu.edu.cn。
责任编辑:郭长寿

