不同光质对蚂蟥生长和内在品质影响的研究
戴道新 郭巧生 史红专 王嘉 卢鑫
[摘要]50 d实验期内,比较红光(610±10)nm、蓝光(450±10)nm、白光(全光谱)和自然光(full spectrum)对30日龄蚂蟥生长和内在品质的影响。结果表明: 30~40日龄期间,蓝光对蚂蟥的促生长作用最强,红光组和白光组在50 d后表现出明显的促进蚂蟥生长的优势,红光和白光最终质量显著高于蓝光和自然光(P<005);红光下蚂蟥特定生长率(SGR)、增重率、消化酶活力均高于其他各组(P<005);白光下蚂蟥SOD,CAT,ALP酶活性最高,与其他各组相比有显著差异(P<005);不同光质对蚂蟥水分、总灰分、酸不溶性灰分、pH和抗凝血酶活性影响不显著。蚂蟥50日龄后,红光下消化酶活性最高且生长最快,白光下抗逆酶活性最高,光质对蚂蟥内在品质无显著影响。
[关键词]蚂蟥; 光质; 生长; 免疫; 内在品质
[Abstract]In this study, four light color treatments (red blue, white, natural light) were tested to determine effects of light spectrum on the growth of larval Whitmania pigra (30 days old) at the same intensity The experiment lasted for 50 days The specific growth rate (SGR) under blue light condition was significantly higher during 30 days to 40 days At the end of the experiment, specific growth rate (SGR) and weight gain rate under red light condition were higher (P<005) than those under other groups Meanwhile, the enzymes activities of digestive enzymes (protease, amylase and lipase) were higher under red light condition However, the enzymes activities of antioxidant enzymes (SOD, CAT, ALP) were lower under white light condition compared with the other treatments(P<005) In addition, no significant changes were observed for water content, total ash, acid insoluble ash, pH and antithrombin activity in the all treatments After 50 days, the digestive enzymes and growth rate were higher under red light condition but antioxidant enzymes were lower under white light condition Furthermore, light spectrum has no significant effect on the internal quality of Wh pigra.
[Key words]Whitmania pigra; light quality; growth; immune; internal quality
蚂蟥Whitmania pigra Whitman又称宽体金线蛭[1],是《中国药典》2015年版中药材水蛭的主要基原动物,具有破血、逐瘀、通经等功效[2],是治疗心脑血管中成药的主要原料。随着水蛭药材需求的逐年增加和野生资源的枯竭,蚂蟥人工养殖应运而生,通过多年研究获得初步成功。目前蚂蟥主要以 “池塘+网箱”养殖模式为主[3],但室外自然环境中,蚂蟥的生长受到水质、温度、阳光等诸多不可控环境因素影响,导致成活率偏低、生长缓慢等现象,已严重影响到生产和经济效益,因此,蚂蟥室内养殖技术的探究变得极为迫切,目前已有报道在25 ℃室温条件下,蚂蟥室内最适养殖条件为每亩50万尾(1亩≈667 m2)和3 d换水1次[4]。光作为影响蚂蟥生长的重要生态因子,对室内养殖具有重要意义。本课题组前期已经研究了(红、黄、蓝、白、绿)不同光质、光强、光周期对蚂蟥幼苗生长的影响,发现红、白、蓝3种光质能促进蚂蟥幼苗生长,其中蓝光能显著促进45日龄内蚂蟥的生长[5]。由于即使同一光质在动物不同生长时期的作用也不尽相同[6],因此本实验在前期工作基础上进一步探究红、白、蓝3种光质对45日龄后蚂蟥生长的影响,以期为蚂蟥室内养殖提供理论依据和指导。
1材料
11樣品实验用30日龄蚂蟥,由南京农业大学中药材研究所提供,经郭巧生教授鉴定为蚂蟥Wh pigra;实验用螺蛳(采自南京前湖,野生)为梨形环棱螺Bellamya purificata Heude;实验用水为曝气24 h的自来水。
12仪器和试剂5810R离心机(eppendorf)、电子天平(山海精密仪器厂)、756CRT紫外分光光度计(上海精密仪器有限公司)、电热恒温鼓风干燥箱(上海精宏实验设备有限公司)、pH计(青岛昱昌科技有限公司)、FA1104分析天平(上海精科天平)、匀浆机(宁波新芝生物科技股份有限公司)、FW100小型高速粉碎机(天津华鑫仪器厂)、KQ250B超声仪(昆山市超声仪器公司)、HHS型水浴锅(巩义市予华仪器有限责任公司)。endprint
DNS试剂、324 mmol·L-1钼酸铵溶液、福林酚试剂、pNPP溶液、考马斯亮蓝G250、连苯三酚、50 mmol·L-1对硝基苯磷酸二钠等。
2方法
21实验设计本实验在室内进行,养殖容器为容积为2 L的塑料瓶(瓶底面积为133×10-2 m2,实际养殖用水1 L,水深12 cm),实验蚂蟥体质量为(0028±0001)g。设4个光照条件,分别为红光(610±10)nm、蓝光(450±10)nm、白光(全段光谱full spectrum),光强60~80 μmol·m-2·s-1,自然光(室外自然条件下),分别标记为R,B,W,N组,光照时间为6:00—18:00,3 d换水1次,换水量为100%,每个光照处理设置20瓶,每瓶饲养10条蚂蟥,实验时间为50 d,期间保持室温为(25±1) ℃。
22样品的采集和保存实验结束后每组选取6~9条健壮蚂蟥(3次重复),固定于冰盘内解剖,取出整个消化道,剔除附着物,用预冷的蒸馏水洗净,吸干组织表面水分,称重,冰浴中进行匀浆,同时加蒸馏水,稀释成含原浆20%的溶液,4 ℃离心15 min(转速为8 000 r·min-1),所得上清液为酶液,置于4 ℃冰箱中低温保存,并于24 h 内完成测定。余下蚂蟥按照《中国药典》2015年版方法加工成人水蛭药材[2]。
23生長性能的测定实验开始前测蚂蟥的体质量,之后每隔10 d测1次蚂蟥的体质量,计算出平均质量,由公式计算特定生长率(SGR)和增重率(WGR)。SGR=(lnWt-lnW0)/t×100%;WGR=(Wt-W0)/ W0×100%,式中W0为实验开始时蚂蟥的平均质量(g),实验天数为t(d),Wt为第t天时蚂蟥的平均质量(g)。
24消化酶活性的测定淀粉酶活力采用3,5二硝基水杨酸比色法[7]测定,在37 ℃条件下,单位体积的酶量1 min 水解淀粉生成1 mg 还原糖的产量为1个淀粉酶活力单位; 脂肪酶活力参照史红专等采用对棕榈酸硝基苯酯(ρNPP) 比色法[8]测定,在37 ℃ 条件下,1 min催化释放1 μmol 对硝基酚的酶量定义为1 个酶活力单位; 蛋白酶活力采用福林酚法[9]测定,每分钟水解干酪素产生1 μg 酪氨酸定义为1 个蛋白酶活力单位。组织匀浆液蛋白含量采用考马斯亮蓝G250比色法[7]测定。
25超氧化物歧化酶、过氧化氢酶和碱性磷酸酶活性的测定SOD 活性测定采用郑碧玉等[9]的方法,25 ℃下,1 mL 反应液中每分钟抑制邻苯三酚自氧化速率达50% 时的酶量定为1 个活力单位(U) 。CAT 活性采用比色法测定[10],每分钟分解1 μmol 的过氧化氢即为1 个酶活力单位(U) 。ALP 活性测定参考芶琳等[11]的方法,30 ℃条件下,每分钟产生1 μmol 的对硝基酚,为1 个酶活力单位(U) 。酶的比活力=酶活力/蛋白含量。
26蚂蟥内在品质的测定水分、总灰分、酸不溶性灰分、pH、抗凝血酶活性的测定参考《中国药典》2015年版一部[2]。
27数据分析采用Microsoft Excel 2013和SPSS 200(Oneway ANOVA,多重比较采用Duncan′s法)进行数据分析。
3结果与分析
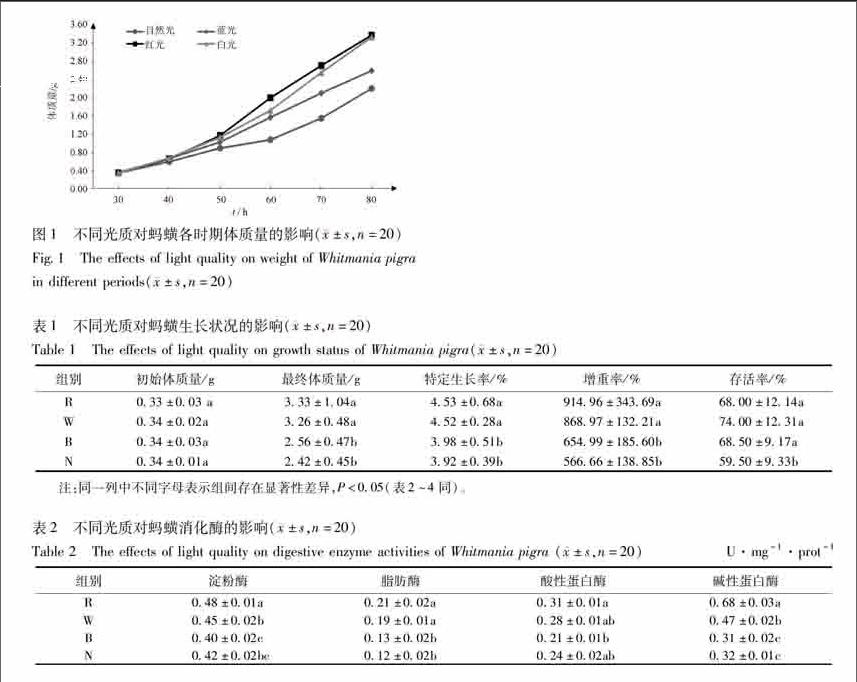
31不同光质对蚂蟥质量增长的影响不同光质对蚂蟥生长的影响见图1,不同光质处理下,蚂蟥生长各个时期质量增长差异显著,蓝光组在40日龄前体重增加最快,红光组和白光组50日龄后蚂蟥的质量均显著高于自然光组(P<005),70日龄后显著高于蓝光组和自然光组(P<005),50日龄后各组质量呈线性增长,线性回归方程红光组(Y=0725 1+0467 5X,R2=0997 1)、白光组(Y=0735 3+0315 0X,R2=0995 9)、蓝光组(Y=0517 3+0502 5X,R2=0999 3)、自然光组(Y=0436 33+0317 3X,R2=0946 3)。
32不同光质对蚂蟥生长性能的影响在50 d实验期内,不同光质对蚂蟥幼苗体重、特定生长率、存活率等生长性能的影响见表1。红光组(R组)最终质量和增重率最高,显著大于其他各组(P<005);自然组(N组)存活率最低,显著低于其他3组(P<005)。
33不同光质对蚂蟥消化酶活性的影响在50 d实验期内,不同光质对蚂蟥消化酶活性的影响见表2。红光组各消化道酶活性均高于其他各组,其中淀粉酶显著高于其他3组(P<005); 脂肪酶:R组和W组显著高于B组和N组(P<005),但R组和W组,B组和N组之间无显著差异。酸性蛋白酶:R组最高,B组显著低于其他各组(P<005)。碱性蛋白酶:R组显著高于其他各组(P<005),B组和N组均显著低于W组(P<005)。
34不同光质对蚂蟥抗逆酶活性的影响在50 d实验期内,不同光质对蚂蟥抗逆酶活性的影响见表3。白光组抗逆酶活性最高,其中除SOD活性与R组无显著差异外,CAT,ALP与各组均有显著性差异(P<005)。
35不同光质对蚂蟥内在品质的影响在50 d实验期内,不同光质对蚂蟥内在品质的影响见表4。蚂蟥的水分、总灰分、酸不溶性灰分、pH和抗凝血酶活性受光质的影响不大。
4讨论
41不同光质对蚂蟥生长的影响光是一切生物的生命之源,是影响水生生物生长、发育、存活的重要外源性环境因子之一,生物在其长期的进化过程中,通过行为、形态、生理应答等多方面对光照条件的变化产生适应机制。对光的适应过程中,不同物种对光的敏感性不同,水生动物的生长一般具有其最适波段,如银鲈幼鱼和金鲈幼鱼对黄橙光波较为
敏感[12],中国明对虾在蓝光下平均耗氧率显著高于黄光、绿光及自然光[13]。有研究表明软体动物对光非常敏感[14],其生长和摄食活动受光照的影响很大[15]。本实验结果表明红光、白光、蓝光对蚂蟥生长的促进作用显著优于自然光(P<005),其中在红光和白光下的生长优于蓝光。研究发现同一物种在生长的不同阶段对光的敏感性也不相同[16],研究endprint
显示相对于其他光质,蓝光对45日龄内蚂蟥有明显的促生长作用[5],本研究结果提示30~40日龄期间,蓝光对蚂蟥的促生长作用确实最强,与上述结果相符合;但40~50日龄开始发生变化,尤其50日龄后蓝光后期对蚂蟥的促生长作用逐渐减弱,而红光组和白光组40日龄开始已经出现快速促进蚂蟥生长的趋势,尤其50 d后表現出明显的促进蚂蟥生长的优势,与其他组别相比有显著性差异(P<005),这和郭玲玲等[17]发现水母幼体21 d后白光与红光下均显著高于蓝光的结果相类似。
尽管水生动物对光有不同的敏感或适应波段,但均能与其生活的水域形成良好的适应关系。自然界中光谱各波段在水中的分布不同,长波长的红、橙光几乎难以穿透较深水层,较少分布于 40 m 以下水层,短波长的蓝、绿、青光一般在水层深度超过 80 m分布较多。研究发现多分布于近岸水深 1~20 m区域的皱纹盘鲍对长波长的红、橙光有明显的选择趋向性,而在短波长的蓝、绿、紫光下则表现出明显的逃避行为[18]。自然界中蚂蟥较少出现在 2 m 水深以下区域,因此红、橙2种光质对蚂蟥可能是比较适宜的,蓝、绿、青光对蚂蟥可能会产生胁迫作用,这与本实验结果一致。在实际养殖过程中,由于幼苗期间蚂蟥不喜欢强阳光照射,一般采用遮阴处理,这也符合45日龄前蓝光效果较好的实验结果。
42不同光质对蚂蟥消化酶活性的影响消化酶活性是衡量动物消化能力的重要指标,其活性变化反映出动物在环境中的生理状态和对环境的适应性[19],有研究表明光对水生动物消化酶的影响很显著,对中国明对虾的研究发现,其在蓝光和黄光下的脂肪酶活力显著高于其他光质[13]。本研究结果显示红光、白光、蓝光下蚂蟥幼苗消化道淀粉酶、脂肪酶均显著高于自然光(P<005),同时红光组和白光组各消化酶活性显著高于蓝光组,与许燕等[20]发现红光对日本沼虾的摄食量远大于蓝光的结果相类似。在大部分情况下,摄食与消化酶活力有一定的关系,摄入的食物刺激消化系统分泌消化酶,而消化酶的分泌又促进生物体发生摄食行为[21]。不同光照对蚂蟥消化酶的变化趋势和生长呈正相关,可能是红光、白光和蓝光增加了消化酶的分泌和活性,提高了蚂蟥的摄食能力和消化吸收的机能,所以体重增加比自然光高,自然光组是在自然条件下养殖,昼夜温差、温度不稳定等因素影响其生理代谢机能,导致消化酶活性降低,影响其摄食和消化吸收能力,所以生长情况最差。本实验结果提示光照对促进蚂蟥生长有重要作用,是非常重要的外源性诱导因子。
43光质对蚂蟥抗逆酶活性的影响环境因素对水生动物免疫系统具有显著的影响,消化酶活力高低不仅反映了机体对营养物质的消化吸收能力,同时也反映了机体的免疫状态[2224]。Migaud 等[25]发现鱼类突然处于特定光谱成分光的刺激下会产生短暂的应激反应,陈婉情[26]研究发现绿色光能增强豹纹鳃棘鲈幼鱼抗氧化酶活性,本研究表明蚂蟥SOD,CAT,ALP活性在白光下最高,红光次之,自然光下蚂蟥抗逆酶活性整体偏弱。也有研究指出SOD,CAT酶活性升高表示机体中有大量的氧自由基等待清除[27],提示机体可能会发生病变,但结合蚂蟥生长情况来看光照组无病变发生的可能,推断白光组和红光组具有提高幼苗抗氧化酶活性和机体免疫活性的功效。
此外白光和自然光光谱成分都比较全面,出现自然光组生长和免疫能力均低于白光组这一现象,可能与自然光是在室外自然条件进行,相对于稳定的室内环境而言,养殖温度不稳定、昼夜温差大等因素导致了蚂蟥整体免疫力降低。
44光质对蚂蟥内在品质的影响本实验的结果表明,蚂蟥的内在品质受光质的影响不显著,各个光照处理下蚂蟥的水分、总灰分、酸不溶性灰分等含量均低于2015年版《中国药典》的标准,抗凝血酶活性均高于2015年版药典标准,各组之间无显著差异,说明室内不同光质下无土养殖的蚂蟥杂质含量低、内在品质好。
45小结本实验研究结果表明,蚂蟥40日龄前蓝光下生长较快,之后促进生长作用减慢,而红光和白光在40日龄后显示出较好的促生长和提高免疫的作用。本实验结果可为蚂蟥室内规模化养殖提供指导意见。
[参考文献]
[1]杨潼.中国动物志·环节动物门蛭纲[M].北京: 科学出版社,1996: 136.
[2]中国药典.一部[S].2015:83.
[3]刘飞, 杨大坚 中国水蛭人工养殖的现行模式调研[J]. 世界科学技术——中医药现代化, 2014 (10):2170.
[4]李蒙蒙,郭巧生,史红专,等. 不同养殖密度和换水频率对蚂蟥生长和内在品质影响的研究[J]. 中国中药杂志,2016,41(6):995.
[5]Wang J, Guo Q, Shi H, et al Effects of light spectrum and intensity on growth, survival and physiology of leech (Whitmania pigra) larvae under the rearing conditions[J]. Aquac Res, 2017,48:3329.
[6]周显青,牛翠娟,李庆芬 光照对水生动物摄食、生长和存活的影响[J]. 水生生物学报,2000,24(2):178.
[7]胡琼英,秦春,陈敏 生物化学与分子生物学实验技术[M].3 版 北京: 化学工业出版社,2014: 28.
[8]史红专,郭巧生,朱再标,等. 不同温度和pH 对蚂蟥消化道酶活性影响的初步研究[J]. 中国中药杂志,2012,37(17) :2538.
[9]郑碧玉.改良的连苯三酚自氧化测定超氧化物歧化酶活性的方法[J]. 生物化学与生物物理进展,1991,18(2):163.
[10]桂远明.水产养殖学专业实验实习教材水产动物机能学实验[M].北京:中国农业出版社,2004:124.endprint
[11]芶琳,单志.生物化学实验[M]成都:西南交通大学出版社,2010:103.
[12]Gehrke P G Influence of light intensity and wavelength on phototactic behaviour of larval silver perch Bidyanus bidyanus and golden perch Macquana ambigua and the effectiveness of light traps[J]. J Fish Biol, 1994, 44(5):741.
[13]劉伟,王芳,钟大森,等. 光色对中国明对虾(Fenneropenaeus chinensis)耗氧率昼夜变化节律的影响[J]. 海洋湖沼通报,2011,3(2):27.
[14]Nakamura K, Archdale M V Activity patterns of abalone under experimental conditions[J]. Aquaculture,2001,32(3):169.
[15]武模戈 光照对水生动物的影响[J]. 河南教育学院学报:自然科学版,2001,10(2):38.
[16]陈永进,徐东坡,施炜纲 水生动物对环境因子行为偏好研究进展[J]. 中国农学通报,2015,31(20):18.
[17]郭玲玲,赵文,杨为东,等. 光照对马来沙水母幼体生长的影响[J]. 大连海洋大学学报,2012,27(1):18.
[18]Gao X L, Zhang M, Zheng J M, et al Effect of LED light quality on the phototaxis and locomotion behaviour of Haliotis discus hannai[J]. Aquaculture,2015,47(11):1.
[19]倪小英,张永普,贾守菊,等.pH和温度对小荚蛏淀粉酶和纤维素酶活性的影响[J].海洋湖沼通报,2009(1):151.
[20]许燕,袁维佳,赵云龙,等. 不同波长光照对日本沼虾视觉的影响[J]. 上海师范大学学报:自然科学版,2003,32(3):75.
[21]郑明刚, 毕元兑, 王玲, 等. 皱纹盘鲍肝、肾表达序列标签及神经肽 Y(NPY)受体基因的克隆与分析[J]. 海洋湖沼通报, 2011(1): 94.
[22]Hong M L, Chen L Q, Sun X J, et al Metabolic and immune responses in Chinese mittenhanded crab (Eriocheir sinensis) juveniles exposed to elevated ammonia[J]. Comp Biochem Phys C,2007, 145(3):363.
[23]王林桂, 王小兵, 黄勃 耳鲍消化酶活力的研究[J]. 海洋科学, 2012, 36(6): 78.
[24]吴永沛, 蔡慧农 金属离子和pH 值对九孔鲍几种消化酶活力的影响[J]. 海洋科学, 2003, 27(5): 66.
[25]Migaud H, Cowan M, Taylor J, et al The effect of spectral composition and light intensity on melatonin, stress and retinal damage in postsmolt Atlantic salmon, Salmo salar[J]. Aquaculture, 2007, 270:390.
[26]陈婉情,刘志明,吴亮,等. 光色对豹纹鳃棘鲈(Plectropomus leopardus)幼鱼生长及血液生化指标的影响[J]生态学杂志,2016,35(7) : 1889.
[27]Parihar M S,Tarangini J,Taruna H,et al.Responseof superoxide dismutase,glutathione peroxidase and reduced glutathione antioxidant defenses in gills of the freshwater catfish (Heteropneustes fossilis) toshortterm elevated temperature[J]. J Therm Biol,1997,22(3):151.
[责任编辑吕冬梅]endprint

