采后ABA处理促进‘陇薯3号’马铃薯块茎愈伤形成
李雪,吴觉天,王毅,姜红,毕阳,司敏,张静荣,徐洁
采后ABA处理促进‘陇薯3号’马铃薯块茎愈伤形成
李雪,吴觉天,王毅,姜红,毕阳,司敏,张静荣,徐洁
(甘肃农业大学食品科学与工程学院,兰州 730070)
研究外源ABA处理对采后‘陇薯3号’马铃薯块茎愈伤效果的影响,分析苯丙烷代谢及抗氧化酶在愈伤中的作用机理。以‘陇薯3号’马铃薯块茎为试材,人工损伤后用不同浓度脱落酸(ABA)处理,评价处理块茎在常温((20±3)℃,湿度(80±5)%)及黑暗条件下的愈伤效果,分析100 mg∙L-1ABA处理后块茎伤口处组织苯丙烷代谢关键酶活性和代谢产物积累以及过氧化物酶和多酚氧化酶的活性变化,扫描电镜观察伤口处愈伤组织的形成过程.不同浓度ABA处理均有效促进了块茎愈伤,其中以100 mg∙L-1的处理效果最好。ABA处理能显著提高块茎伤口处组织苯丙氨酸解氨酶、肉桂酸羟化酶、4-香豆酰-辅酶A-连接酶和肉桂醇脱氢酶的活性,并能使总酚、类黄酮和木质素的含量增加,其中,苯丙氨酸解氨酶的活性呈现双峰型变化,在处理后的第3天和第9天分别高出同期对照253.07%和125.18%。此外,总酚和类黄酮含量在处理后第6天分别较同期对照高出48.60%和50.42%。ABA处理还明显增强了块茎伤口处组织中的过氧化物酶和多酚氧化酶活性。扫描电镜观察结果表明,ABA处理促进了块茎伤口表面愈伤封闭层和周皮的形成。外源ABA处理可通过促进马铃薯块茎伤口处组织的苯丙烷代谢,提高过氧化物酶和多酚氧化酶活性,加速马铃薯块茎愈伤周皮的形成。
马铃薯块茎;愈伤;ABA;苯丙烷代谢;抗氧化酶
0 引言
【研究意义】马铃薯(L.)是重要的粮菜兼用作物,但其块茎在采收及采后过程中易遭受机械损伤[1],表面的伤口为各类致腐病原物的侵染提供了通道,病害发生不仅导致贮藏期间块茎大量损失,而且会在块茎体内积累真菌毒素,造成食用的安全隐患[2]。马铃薯块茎表面的伤口具有自我愈合能力,即在伤口处形成愈伤周皮,从而有效抑制块茎失水、减轻致腐病原物造成的危害[3]。然而,块茎自然愈伤所需的时间偏长,伤口完全愈合通常需要2—3周时间[4],露天存放偏长的时间往往会使块茎受冻,并增加人工看护的成本。生产中多在没有完全愈伤的情况下入贮马铃薯块茎,致使贮藏期间的腐烂率居高不下。因此,缩短愈伤时间、提高愈伤效率是马铃薯贮藏中亟待解决的问题。【前人研究进展】马铃薯块茎的愈伤形成过程包括形成封闭层和形成伤口周皮两个步骤[3],多层栓化细胞构成了致密的保护屏障,从而避免或减轻真菌和细菌病原物侵袭[5-6]。脱落酸(abscisic acid,ABA)是一种重要的植物激素,在提高植物抗逆性中具有积极的作用[7]。有研究表明,马铃薯块茎损伤后ABA代谢相关基因表达量迅速增加[8],内源ABA参与了马铃薯块茎的伤口愈合[9],对上述的两个愈伤步骤均有重要影响[10]。内源ABA还可介导番茄的木栓化,促进果实茎疤组织的形成[11]。此外,外源ABA可诱导马铃薯块茎切片及愈伤组织的木栓化[12-13],促进聚酚软木质的积累,提高块茎的早期愈伤能力[14]。外源ABA促进采后番茄果实的伤口愈合与增强苯丙烷代谢活性,提高超氧化物歧化酶和过氧化物酶活性密切相关[15-16]。【本研究切入点】虽然外源ABA在促进马铃薯块茎愈伤中的作用已有报道,但处理后马铃薯块茎伤口处苯丙烷代谢如何系统参与该过程,过氧化物酶和多酚氧化酶如何在其中发挥作用,以及块茎伤口表面组织结构如何形成尚未见报道。【拟解决的关键问题】以西北地区主栽品种‘陇薯3号’马铃薯为试材,人工模拟创伤后用不同浓度ABA处理,在常温条件下(20—25℃,RH 80±5%)下进行愈伤诱导,研究处理对马铃薯块茎愈伤效果的影响,分析处理对愈伤期间苯丙烷代谢关键酶活性和产物积累,以及过氧化物酶和多酚氧化酶活性的影响,扫描电镜观察处理后块茎伤口表面组织结构的变化,为马铃薯的快速愈伤提供理论和方法依据。
1 材料与方法
1.1 材料
供试‘陇薯3号’马铃薯块茎,2015年10月13日采自甘肃省定西市渭源县会川镇。拣选大小均匀、无损伤且无病虫害的块茎当天运回甘肃农业大学食品科学与工程学院实验室,于(7±2)℃下贮藏待用。ABA购自Sigma公司。
1.2 方法
1.2.1 ABA溶液的配制 分别取ABA 2.5、5、10、20 mg,加少量乙醇溶解后,定容至100 mL,配制成浓度分别为25、50、100和200 mg∙L-1的稳定溶液,在避光低温条件下保存待用。
1.2.2 块茎愈伤及处理 参照姜红等[17]的方法。用自来水清洗块茎表面,在1.5%的次氯酸钠溶液中浸泡3 min,清水冲洗后,于室温下晾干待用。在块茎表皮刮出大小为2 cm×2 cm的伤口,每个块茎3处伤口。
将上述5个浓度的ABA溶液以及蒸馏水对照分别用移液枪吸取20 μL,注在伤口表面,并涂抹均匀,放置10 min直至晾干,装入扎有小孔的大小25 cm×40 cm,厚度0.02 mm的聚乙烯保鲜袋中,置于(20±3)℃,(80±5)% RH的黑暗环境下进行愈伤诱导。
1.2.3 愈伤效果评价 测定不同浓度ABA处理后第6天的木质素含量,以评价块茎愈伤效果。木质素含量的测定参见1.2.5。每个处理用块茎20个,重复3次。
1.2.4 酶活性的测定
1.2.4.1 取样 参照杨志敏等[18]方法。在100 mg∙L-1ABA处理后第0、3、6、9、12天时,分别取块茎伤口处栓化周皮及其下2—3 mm处组织3 g,液氮速冻后,在-80℃下冷冻保存待用。
1.2.4.2 苯丙氨酸解氨酶(phenylalnine ammonia lyase,PAL)的活性测定 参照YIN等[19]方法。称取冷冻组织3 g,加入5 mL提前预冷的硼酸缓冲液(100 mmol∙L-1、pH 8.8)。在研钵中充分研磨后,4℃离心(11 250 r/min 20 min),取上清液4℃保存备用。加入3 mL L-苯丙氨酸和500 µL上清液,于37℃下反应1 h,测定290 nm处的吸光值,空白加500 µL蒸溜水,其余同反应体系。酶活性以每小时内吸光度变化0.01为1个活性单位(U),酶活性表示为U∙mg-1protein。
1.2.4.3 肉桂酸羟化酶(cinnamic acid hydroxylase,C4H)活性的测定 参照LAMB等[20]方法并略作修改。称取冷冻组织3 g,在研钵中充分研磨后,加入5 mL提前预冷的提取液,超声波中反应2 min,用纱布过滤,离心(9 000 r/min 20 min、4℃),分别取上述上清液和缓冲液0.8 mL和2.0 mL混匀。于25℃下振荡反应30 min,再加入100 μL的HCl(6 mol∙L-1)终止反应,离心(9 000 r/min 10 min、4℃),取上清液在340 nm处测定其吸光度。酶活性以每小时变化0.01为一个酶活性单位(U),酶活性表示为U∙mg-1protein。
1.2.4.4 4-香豆酰-辅酶A-连接酶(4-coumaroyl- coenzyme A-ligase,4CL)活性的测定 参照SCHOCH 等[21]方法略作修改。称取冷冻组织3 g,加入提前预冷的Tris-HCl缓冲液5 mL,冰浴下研磨成匀浆,用纱布过滤,离心(11 250 r/min 20 min、4℃),取0.5 mL上清液,加0.45 mL Mg2+(15 μmol∙L-1)、0.15 mL p-香豆酸(5 μmol∙mL-1)、0.15 mL ATP(50 μmol∙mL-1)和0.15 mL CoA(1 μmol∙mL-1)后,在333 nm处测定其吸光度。酶活性以每分钟内变化0.1为1个活性单位(U),酶活性表示为U∙mg-1protein。
1.2.4.5 肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)活性的测定 参照GOFFNER等[22]方法略作修改。称取冷冻组织3 g,加入提前预冷的磷酸缓冲液5 mL,冰浴下研磨成匀浆,4℃离心(12 500 r/min 25 min),取上清液。分别取上清液和反应液(NADP 1 mL、反式肉桂酸1.4 mL)0.6 mL和2.4 mL,37℃温浴30 min,加入200 μL HCl(1 mol∙L-1)终止反应,在340 nm处测定其吸光度。每分钟变化0.001吸光度值为一个酶活性单位(U),酶活性表示为U∙mg-1protein。
1.2.4.6 过氧化物酶(Peroxidase,POD)和多酚氧化酶(polyphenol oxidase,PPO)活性的测定 POD活性的测定参照Bao等[23]方法。称取冷冻组织3 g,加入预冷的磷酸缓冲液5 mL,冰浴下研磨成匀浆,离心(11 250 r/min 20 min、4℃),取上清液。2.5 mL愈创木酚(25 mmol∙L-1),200 μL H2O2(250 m mol∙L-1)和200 μL上清液,反应15 s后记录470 nm处的吸光度变化,测定持续2 min。酶活性以每分钟内吸光度变化0.01为1个活性单位(U),酶活性表示为U∙mg-1protein。
PPO活性的测定参照YIN等[19]方法。称取冷冻组织3 g,加入磷酸缓冲液3 mL,冰浴条件下研磨成匀浆,离心(15 000 r/min 20 min、4℃),取上清液。2 mL磷酸缓冲液(pH 7.5)、100 μL粗酶提取液、0.5 mL邻苯二酚。24℃温育2 min,测定420 nm处的吸光度。酶活性以每分钟内吸光度变化0.01为1个活性单位(U),酶活性表示为U∙mg-1protein。
1.2.4.7 蛋白含量的测定 参照BRADFORD[24]的考马斯亮蓝法,以牛血清蛋白(BSA)为标准蛋白作标准曲线,计算蛋白含量。
1.2.5 总酚、类黄酮及木质素含量的测定 参照包改红等[25]方法。称取冷冻组织3 g,加入提前预冷的HCl-甲醇(1%)6 mL,在研钵中充分研磨后,转入离心管,置于暗处4℃下反应20 min,离心(9 000 r/min 10 min、4℃),取上清液测定吸光值。总酚与类黄酮含量分别表示为OD280∙g-1FW和OD325∙g-1FW。
参照姜红等[17]的方法测定木质素含量。称取冷冻组织3 g,加入提前预冷的乙醇(95%)5 mL,在研钵中充分研磨后,离心去上清,用乙醇冲洗,沉淀在60℃烘箱中干燥24 h,与1 mL溴化乙酰冰醋酸溶液(25%)反应后,70℃温浴30 min,用1 mL NaOH(2 mol∙L-1)中止反应。加入0.1 mL羟胺盐酸(7.5 mol∙L-1)和2 mL冰醋酸,离心,用乙酸定容。木质素含量以OD280∙g-1FW表示。
上述各项测定指标均重复3次。
1.2.6 块茎愈伤表面结构的观察 参照ALBA等[26]方法。用手术刀分离块茎伤口处的愈伤周皮,切成大小为5 mm×5 mm的组织块,乙醇中浸泡10 min后,平铺在含有蒸馏水的培养皿中,用N2轻吹2 h,制片后在扫描电子显微镜下观察并拍照。
1.2.7 数据统计与分析 全部数据采用Excel 2007计算平均值和标准误(±SE),采用SPSS 19.0进行Duncan’s多重差异显著性分析。
2 结果
2.1 不同浓度ABA处理的愈伤效果及100 mg∙L-1ABA处理后块茎伤口处木质素含量的变化
不同浓度ABA处理后可显著促进块茎伤口处的木质素积累。但处理间木质素的含量差异较大,在25—100 mg ∙L-1,处理浓度越高木质素含量越大,当处理浓度为100 mg∙L-1时,处理的木质素含量高出对照48.47%。但随着处理浓度的进一步增加,木质素含量不再继续提高,当浓度高达300 mg∙L-1时,木质素含量反而降低(图1-A)。100 mg∙L-1ABA处理后,块茎伤口处木质素含量的上升趋势与对照基本一致,处理后第9天时达到最大,处理的含量始终高于对照(图1-B)。
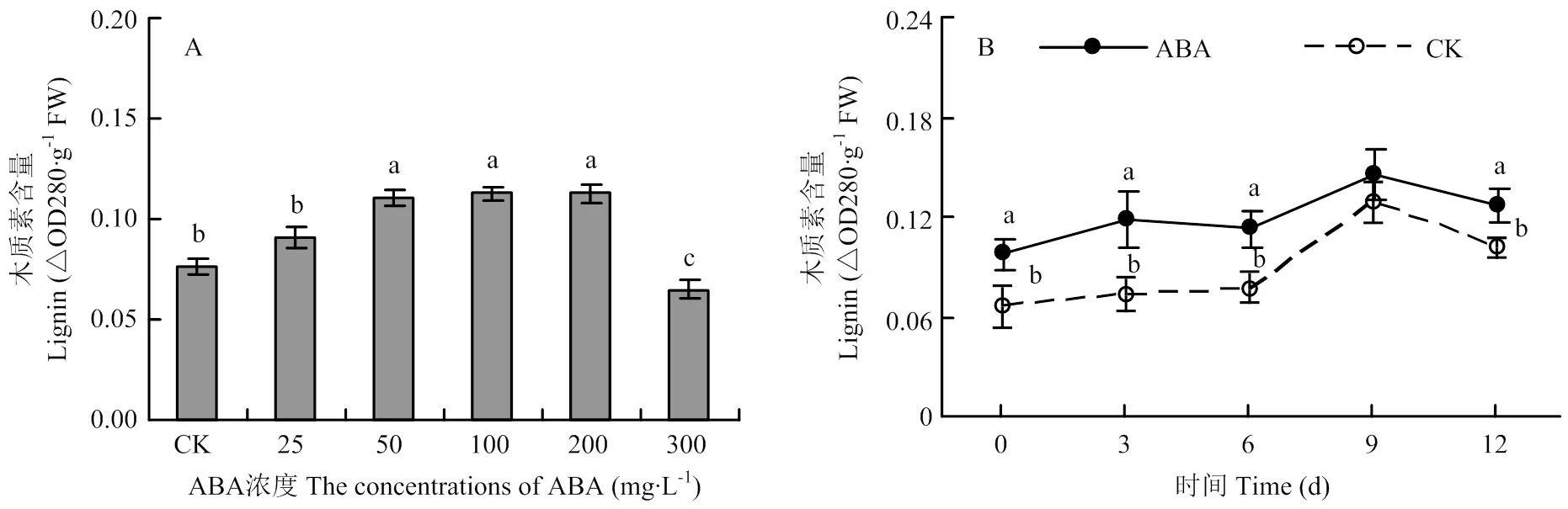
不同字母表示差异显著(P<0.05)。下同 Different letters show significant differences (P<0.05). The same as below
2.2 100 mg∙L-1 ABA处理对块茎苯丙烷代谢关键酶活性及其代谢产物的影响
2.2.1 对PAL、C4H、4CL和CAD活性的影响 愈伤期间,处理和对照块茎伤口处的PAL活性均呈双峰型变化,处理块茎的PAL活性均显著高于对照。在处理后的第3天和第9天分别高出同期对照253.07%和125.18%(图2-A)。处理块茎的C4H活性在愈伤期间显著高于对照,处理后第6天较同期对照提高了1.5倍(图2-B)。ABA提高了伤口处的4CL活性,处理后第9天的活性高于同期对照74.78%(图2-C)。处理块茎的CAD活性在愈伤后期显著高于对照,处理后第9天时高于同期对照46.49%(图2-D)。
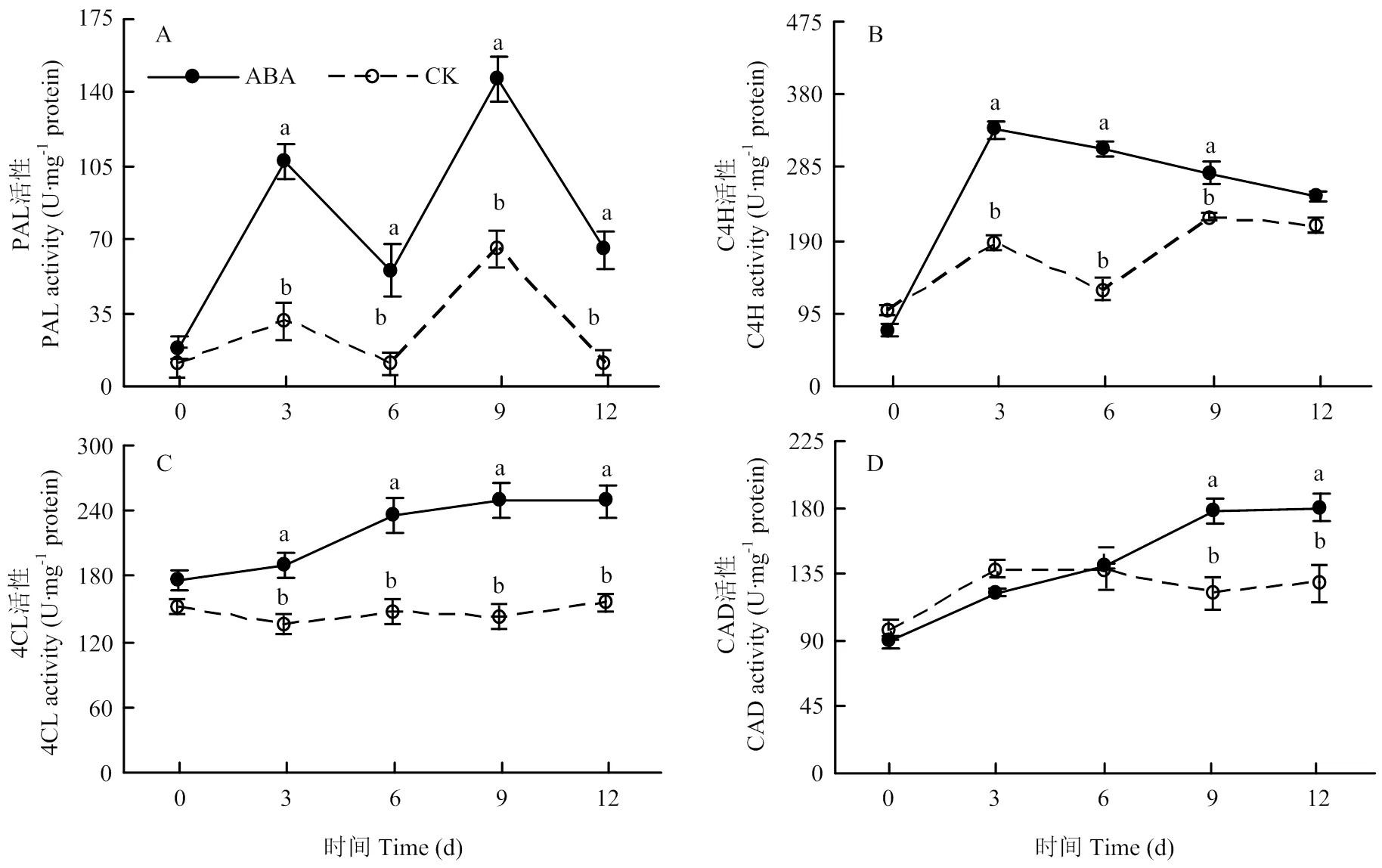
图2 100 mg∙L-1 ABA处理对愈伤期间马铃薯块茎伤口处PAL(A)、C4H(B)、4CL(C)和CAD(D)活性的影响
2.2.2 对总酚和类黄酮含量的影响 处理块茎的总酚含量在愈伤的中后期显著高于对照,处理后第6天高于对照48.60%(图3-A)。同样,处理块茎的类黄酮含量在愈伤期间也高于对照,处理后第6天高出对照50.42%(图3-B)。
2.3 ABA处理对块茎POD和PPO活性的影响
处理块茎的POD活性在愈伤期间显著高于对照,处理后第12天高出同期对照53.23%(图4-A)。同样,处理块茎的PPO活性在愈伤的中后期显著高于对照,处理后第9天为同期对照1.4倍(图4-B)。
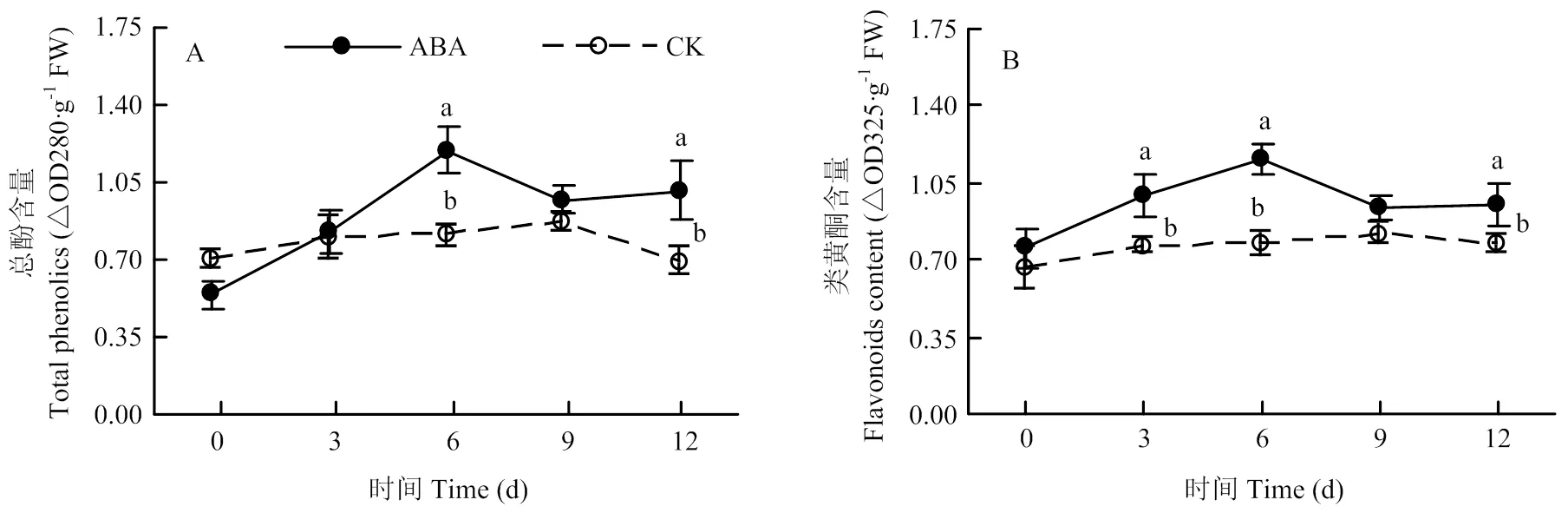
图3 100 mg∙L-1 ABA处理对愈伤期间马铃薯块茎伤口处总酚(A)和类黄酮(B)含量的影响
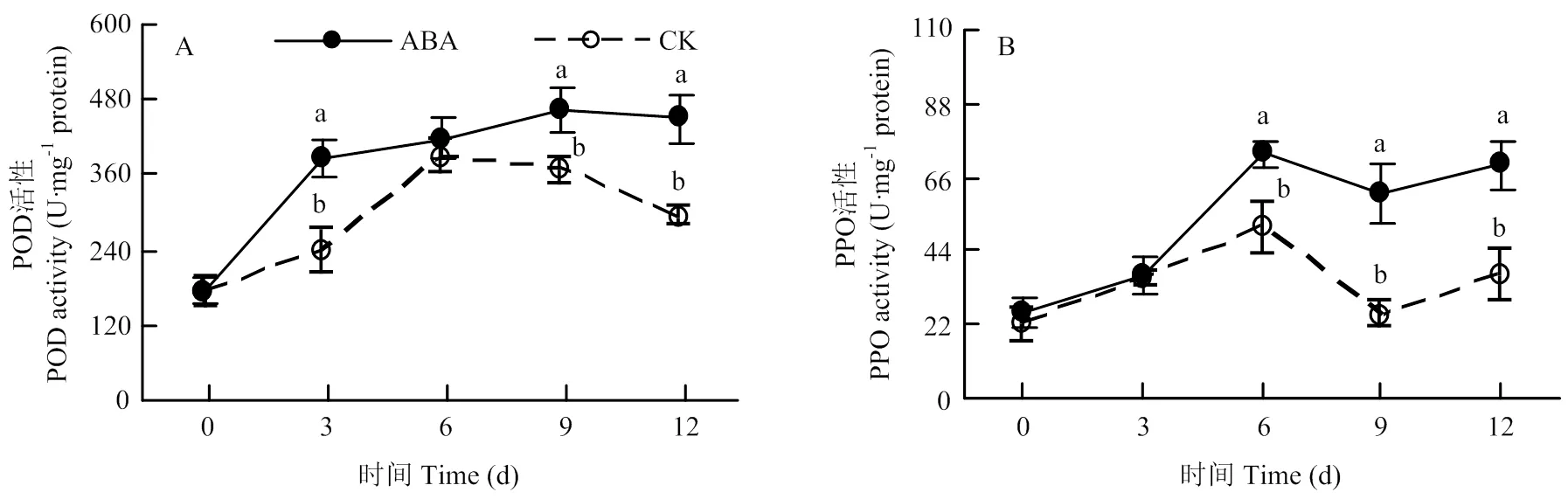
图4 100 mg∙L-1 ABA处理对愈伤期间马铃薯块茎伤口处POD(A)和PPO(B)活性变化的影响
2.4 ABA处理对块茎伤口表面愈伤组织形成的影响
ABA处理明显促进了伤口处的组织愈合(图5)。处理当天,伤口处开放,淀粉粒完全暴露,处理后第3天,伤口处已有明显的网状封闭层,并且还在继续生成新细胞,而此时对照块茎刚可见封闭层;处理后第6天,处理的周皮形成,而同期对照周皮则初步形成;处理后第9天,处理的细胞壁厚度和强度进一步提升,形成致密的保护层,愈伤周皮完全成熟,对照此时也形成了愈伤周皮。
3 讨论
有研究表明,外源ABA可部分调控马铃薯的块茎愈伤[14]。本研究发现,外源ABA处理可促进‘陇薯3号’马铃薯块茎的愈伤,该过程与增强苯丙烷代谢关键酶活性,促进总酚、类黄酮和木质素的积累,提高POD和PPO活性密切相关。本研究也得出苯丙烷代谢和抗氧化酶积极参与外源ABA促进马铃薯块茎愈伤的过程。
苯丙烷代谢在块茎愈伤周皮的形成中具有积极的贡献[27]。PAL是苯丙烷代谢的限速酶,催化苯丙氨酸转化为肉桂酸[28],在愈伤组织的形成中具有关键作用[29]。ABA可通过促进马铃薯基因的表达,加速块茎的木栓化过程[14]。此外,ABA还可有效提高块茎愈伤组织中的PAL活性[13]。ABA处理可显著提高块茎PAL活性,且呈现双峰型变化(图2-A),表明PAL积极参与了块茎愈伤期间封闭层和伤口周皮的形成[3]。该结果与ABA处理后马铃薯块茎愈伤组织中PAL活性增强的结果类似[14]。C4H是苯丙烷代谢途径中向各分支途径转折的关键酶,催化反式肉桂酸转化为对-香豆酸,对-香豆酸对木质素和类黄酮等的合成具有积极的调控作用[30]。本研究所发现的ABA处理显著提高愈伤块茎C4H活性的结果(图2-B),与前人在菊芋块茎愈伤期间C4H活性提高的结果类似[31]。4CL经苯丙烷代谢的最后一步反应,生成相应的硫酯,进入木质素合成途径[32]。CAD是木质素生物合成的关键酶[33]。甘薯在生物和非生物胁迫下的组织特异性木质化中发挥重要作用[34]。本试验中发现的ABA处理提高马铃薯块茎4CL和CAD活性的结果与外源ABA促进采后番茄果实4CL和CAD活性结果类似[16]。木质素可通过形成交织网,使细胞相连,强化细胞壁,从而形成抵御病原物侵染的保护屏障[35-36]。木质素和H2O2的积累参与了甘薯伤口的愈合,通过调节愈伤相关的miR828,抑制和的表达,从而提高木质素和H2O2的积累,促进甘薯伤口的愈合[37]。作为植物的抗菌组分,总酚和类黄酮在提高植物对病原物侵染的抗性中发挥了重要作用[38]。损伤可促进块茎酚类物质的积累,增加抗氧化能力[39]。本研究发现,ABA处理可有效促进块茎愈伤组织中木质素、总酚和类黄酮的积累,该结果与前人采用ABA促进采后番茄愈伤的结果基本一致[16]。

S:淀粉粒;C:封闭层;P:周皮 S: Starch grain; C: Closing layer; P: Periderm
POD是一种血红素蛋白由单一肽链与卟啉构成,能够介导酚酸类物质聚合生成木质素,增强细胞壁强度,抵抗病原物侵入[40],在调控马铃薯块茎愈伤周皮的形成中发挥至关重要的作用[41]。有报道指出,ABA可促进马铃薯块茎的栓化,提高POD活性[13],还能诱导马铃薯和番茄愈伤组织中POD转录物的积累[42]。这些结果与本研究结果基本一致(图4-A)。PPO能够将酚类物质氧化成对病原物毒性更强的醌类物质,降低果蔬被真菌侵染的程度[43]。许多生物、非生物因素都可诱导PPO活性[44],在生长发育过程中马铃薯通过增加PPO mRNA的积累来响应创伤信号[45]。ABA处理可有效促进块茎愈伤期间PPO活性的增加,该结果与前人用ABA处理番茄的研究结果类似[46]。
马铃薯块茎的愈伤过程包括形成封闭层和形成伤口周皮两个步骤,前者是伤口表面细胞的栓化,而后者是在封闭层下形成伤口周皮[6]。封闭层及伤口周皮的形成均会提高块茎对病原物侵染的抗性。在本研究中观察到,ABA处理明显促进了块茎伤口处的组织愈合,ABA处理马铃薯块茎伤口后,网状结构迅速形成并栓化,开始形成封闭层,该阶段不涉及伤口表面的细胞分裂。随着封闭层形成的完成,伤口周皮开始形成,其中出现的具有分生组织活性的木栓形成层可分裂形成多层栓化细胞,进而构成了愈伤组织的木栓层和栓内层(图5-B)。该过程与SABBA等[47-48]观察到的软木脂在细胞壁积累的结果基本类似。
4 结论
外源脱落酸(ABA)处理可有效促进‘陇薯3号’马铃薯块茎的愈伤,最佳处理浓度为100 mg∙L-1。ABA处理能显著提高块茎伤口处组织苯丙氨酸解氨酶、肉桂酸羟化酶、4-香豆酰-辅酶A-连接酶和肉桂醇脱氢酶的活性,促进总酚、类黄酮和木质素的积累,提高块茎伤口处组织的过氧化物酶和多酚氧化酶活性。在ABA的作用下,块茎伤口处组织迅速愈合,封闭层和愈伤周皮迅速形成。由此表明,外源ABA可通过促进马铃薯块茎伤口处的苯丙烷代谢,提高抗氧化酶活性来加速块茎的愈伤形成。
[1] Dastmalchi K, Kallash L, Wang I, Phan V C, Huang W, Serra O, Stark R E. Defensive armor of potato tubers: nonpolar metabolite profiling, antioxidant assessment, and solid- state NMR compositional analysis of suberin-enriched wound- healing tissues., 2015, 63(30): 6810-6822.
[2] Xue H L, Bi Y, Wei J M, Tang Y M, Zhao Y, Wang Y. Effect of cultivars,strains and storage temperature on trichothecenes production in inoculated potato tubers., 2014, 151: 236-242.
[3] LULAI E C, NEUBAUER J D. Wound-induced suberization genes are differentially expressed, spatially and temporally, during closing layer and wound periderm formation., 2014, 90: 24-33.
[4] SCHREIBER L, FRANKE R, HARMANN K. Wax and suberin development of native and wound periderm of potato (L.) and its relation to peridermal transpirations., 2005, 220(4): 520-530.
[5] LULAI E C, FREEMAN T P. The importance of phellogen cells and their structural characteristics in susceptibility and resistance to excoriation in immature and mature potato tuber (L.) periderm., 2001, 88(4): 555-561.
[6] LULAI E C. The canon of potato science: skin-set and wound- healing/suberization., 2007, 50(3/4): 387-390.
[7] ZHANG J H, JIA, W S, YANG, J C, ISMAIL A M. Role of ABA in integrating plant responses to drought and salt stresses.2006, 97(1): 111-119.
[8] SUTTLE J C, LULAI E C, HUCKLE L L, NEUBAUER J D. Wounding of potato tubers induces increases in ABA biosynthesis and catabolism and alters expression of ABA metabolic genes., 2013, 170(6): 560-566.
[9] LULAI E C, SUTTLE J C, PEDERSON S M. Regulatory involvement of abscisic acid in potato tuber wound-healing., 2008, 59(6): 1175-1186.
[10] WU J Q, BALDWIN I T. New insights into plant responses to attack from insect herbivores., 2010, 44: 1-24.
[11] LEIDE J, HILDEBRANDT U, HARTUNG W, RIEDERER M, VOGG G. Abscisic acid mediates the formation of a suberized stem scar tissue in tomato fruits., 2012, 194(2): 402-415.
[12] SOLIDAY C L, DEAN B B, KOLATTUKUDY P E. Suberization: inhibition by washing and stimulation by abscisic acid in potato disks and tissue culture., 1978, 61(2): 170-174.
[13] COTTLE W, KOLATTUKUDY P E. Abscisic acid stimulation of suberization., 1982, 70(3): 775-780.
[14] KUMAR G N M, LULAI E C, SUTTLE J C, KNOWLES N R. Age-induced loss of wound-healing ability in potato tubers is partly regulated by ABA., 2010, 232(6): 1433-1445.
[15] TAO X Y, MAO L C, LI J Y, CHEN J Y, LU W J, HUANG S. Abscisic acid mediates wound-healing in harvested tomato fruit., 2016, 118: 128-133.
[16] 陶晓亚, 李家寅, 韩雪源, 黄斯, 茅林春. 脱落酸对采后番茄愈伤次生代谢物质合成的影响. 食品工业科技, 2016(16): 330-334.
Tao X Y, Li J Y, Han X Y, Huang S, Mao L C. Effect of abscisic acid on secondary metabolite production during wound-healing in postharvest tomato fruit., 2016(16): 330-334. (in Chinese)
[17] 姜红, 毕阳, 李昌健, 王毅, 李生娥, 刘耀娜, 王斌. 马铃薯品种‘青薯168’和‘陇薯3号’块茎愈伤能力的比较. 中国农业科学, 2017, 50(4): 774-782.
JIANG H, BI Y, Li C J, WANG Y, LI S E, LIU Y N, WANG B. A comparison of healing ability on potato tuber cultivars ‘Qingshu No. 168’ and ‘Longshu No. 3’., 2017, 50(4): 774-782. (in Chinese)
[18] 杨志敏, 毕阳, 李永才, 寇宗红, 包改红, 刘成琨, 王毅, 王蒂. 马铃薯干腐病菌侵染过程中切片组织细胞壁降解酶的变化. 中国农业科学, 2012, 45(1): 127-134.
YANG Z M, BI Y, LI Y C, KOU Z H, BAO G H, LIU C K, WANG Y, WANG D. Changes of cell wall degrading enzymes in potato tuber tissue slices infected by., 2012, 45(1): 127-134. (in Chinese)
[19] YIN Y, LI Y C, BI Y, CHEN S J, LI Y C, YUAN L, WANG Y, WANG D. Postharvest treatment with β-aminobutyric acid induces resistance against dry rot caused byin potato tuber., 2010, 9(9): 1372-1380.
[20] LAMB C J, RUBERY P H. A spectrophotometric assay for trans-cinnamic acid 4-hydroxylase activity., 1975, 68(2): 554-561.
[21] SCHOCH G A, NIKOV G N, ALWORTH W L, Werck-Reichhart D. Chemical inactivation of the cinnamate 4-hydroxylase allows for the accumulation of salicylic acid in elicited cells., 2002, 130(2): 1022-1031.
[22] GOFFNER D, JOFFROY I, GRIMA P J, HALPIN C, KNIGHT M E, SCHUCH W A M. Purification and characterization of isoforms of cinnamyl alcohol dehydrogenase from., 1992, 188(1): 48-53.
[23] BAO G H, BI Y, LI Y C, KOU Z H, HU L G, GE Y H, WANG Y, WANG D. Overproduction of reactive oxygen species involved in the pathogenicity ofin potato tubers., 2014, 86: 35-42.
[24] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding., 1976, 72(1/2): 248-254.
[25] 包改红, 毕阳, 李永才, 王毅, 王婷, 唐瑛, 马朝玲, 白小东. 硫色镰刀菌接种对抗病/易感品种马铃薯块茎苯丙烷代谢的影响比较. 食品科学, 2015, 36(6): 1002-6630.
BAO G H, BI Y, LI Y C, WANG Y, WANG T, TANG Y, MA C L, BAI X D. Comparison of phenylpropanoid pathway metabolism in slices of susceptible and resistant potato cultivars inoculated with., 2015, 36(6): 1002-6630. (in Chinese)
[26] ALBA C M, DE FORCHETTI S M, TIGIER H A. Phenoloxidase of peach () endocarp: its relationship with peroxidases and lignification., 2000, 109(4): 382-387.
[27] YANG W L, BERNARDS M A. Metabolite profiling of potato (L.) tubers during wound-induced suberization., 2007, 3(2): 147-159.
[28] RIVERO R M, RUIZ J M, GARCA P C, LOPEZ-LEFEBRE L R, SANCHEZ E, ROMERO L. Resistance to cold and heat stress: accumulation of phenolic compounds in tomato and watermelon plants., 2001, 160(2): 315-321.
[29] CAMPOS R, NONOGAKI H, SUSLOW T, SALTVEIT M E. Isolation and characterization of a wound inducible phenylalanine ammonia-lyase gene () from Romaine lettuce leaves., 2004, 121(3): 429-438.
[30] SEWALT V, NI W, BLOUNT J W, JUNG H G, MASOUD S A, HOWLES P A, LAMB C, DIXON R A. Reduced lignin content and altered lignin composition in transgenic tobacco down-regulated in expression of L-phenylalanine ammonia-lyase or cinnamate 4- hydroxylase., 1997, 115(1): 41-50.
[31] BENVENIST I, SALAUN J P, DURST F. Wounding-induced cinnamic acid hydroxylase in Jerusalem artichoke tuber., 1977, 16(1): 69-73.
[32] 赵淑娟, 刘涤, 胡之璧. 植物 4-香豆酸:辅酶A-连接酶. 植物生理学通讯, 2006, 42(3): 529-538.
ZHAO S J, LIU D, HU Z B. 4-Coumarate:coenzyme A ligase in plant., 2006, 42(3): 529-538.(in Chinese)
[33] BOUDET A M. Lignins and lignification: selected issues., 2000, 38(1): 81-96.
[34] KIM Y H, BAE J M, HUH G H. Transcriptional regulation of the cinnamyl alcohol dehydrogenase gene from sweet potato in response to plant developmental stage and environmental stress., 2010, 29(7): 779-791.
[35] WHETTEN R, SEDEROFF R. Lignin biosynthesis., 1995, 7(7): 1001-1013.
[36] 郭光艳, 柏峰, 刘伟, 秘彩莉. 转录因子对木质素生物合成调控的研究进展. 中国农业科学, 2015, 48(7): 1277-1287.
GUO G Y, BAI F, LIU W, BI C L. Advances in research of the regulation of transcription factors of lignin biosynthesis., 2015, 48(7): 1277-1287. (in Chinese)
[37] LIN J S, LIN C C, LIN H H, CHEN Y C, JENG S T. MicroR828 regulates lignin and H2O2accumulation in sweet potato on wounding., 2012, 196(2): 427-440.
[38] JIMEMEZ-AGUILAR D M, GRUSAK M A. Minerals, vitamin C, phenolics, flavonoids and antioxidant activity ofleafy vegetables., 2017, 58: 33-39.
[39] REYES L F, CISNEROS-ZEVALLOS L. Wounding stress increases the phenolic content and antioxidant capacity of purple-flesh potatoes (L)., 2003, 51(18): 5296-5300.
[40] GOLUBENKO Z, AKHUNOV A, KHASHIMOVA N, BERESNEVA Y, MUSTAKIMOVA E, IBRAGIMOV F, ABDURASHIDOVA N, STIPANOVIC R. Induction of peroxidase as a disease resistance response in resistant () and susceptible () species in the family., 2007, 35(4): 401-413.
[41] YANG W L, BERNARDS M A. Wound-induced metabolism in potato () tubers., 2006, 1(2): 59-66.
[42] ROBERTS E, KOLATTUKUDY P E. Molecular cloning, nucleotide sequence, and abscisic acid induction of a suberization-associated highly anionic peroxidase., 1989, 217(2/3): 223-232.
[43] 王云飞, 毕阳, 任亚琳, 王毅, 范存斐, 李大强, 杨志敏. 硅酸钠处理对厚皮甜瓜果实采后病害的控制及活性氧代谢的作用. 中国农业科学, 2012, 45(11): 2242-2248.
WANG Y F, BI Y, REN Y L, WANG Y, FAN C F, LI D Q, YANG Z M. Control of postharvest diseases and potentiation of reactive oxygen species metabolism in muskmelon (.) fruits treated by sodium silicate., 2012, 45(11): 2242-2248. (in Chinese)
[44] 谢春艳, 宾金华, 陈兆平, 莫熙穆. 多酚氧化酶及其生理功能. 生物学通报, 1999, 34(6): 11-14.
XIE C Y, BIN J H, CHEN Z P, MO X M. Polyphenol oxidase and its physiological function., 1999, 34(6): 11-14. (in Chinese)
[45] THIPYAPONG P, HUNT M D, STEFFENS J C. Systemic wound induction of potato () polyphenol oxidase., 1995, 40(3): 673-676.
[46] SONG W W, MA X R, TAN H, ZHOU J Y. Abscisic acid enhances resistance toin tomato seedlings., 2011, 49(7): 693-700.
[47] SABBA R P, LULAI E C. Histological analysis of the maturation of native and wound periderm in potato (L.) tuber., 2002, 90(1): 1-10.
[48] SABBA R P, LULAI E C. Immunocytological comparison of native and wound periderm maturation in potato tuber.2004, 81(2): 119-124.
(责任编辑 赵伶俐)
Postharvest ABA Treatment Promote Wound Healing of Potato ‘Longshu No.3’ Tubers
LI Xue, WU Juetian, WANG Yi, JIANG Hong, BI Yang, SI Min, ZHANG Jingrong, XU Jie
(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070)
The experiment was conducted to study the effects of exogenous abscisic acid (ABA) treatment on wound healing of the potato tubers ‘Longshu No.3’, to analyze the role of phenylpropane metabolism and antioxidant enzymes in wound healing.The potato cultivar ‘Longshu No.3’ was used as materials. The tubers were artificially damaged, then treated with different concentrations ABA, and healed under dark condition ((20±3)℃, RH (80±5)%). The healing ability of treated tubers was evaluated. The changes of activity of phenylpropane metabolism key enzymes, peroxidase and polyphenol oxidase were determined. The content of metabolites was determined at wounded site of tubers treated with 100mg∙L-1ABA during healing. The formation of healing tissue was observed by scanning electron microscopy.ABA treatment at different concentrations effectively promoted wound healing of tubers, the screened optimum concentration was 100 mg∙L-1. ABA treatment at 100 mg∙L-1significantly increased the activity of phenylalnine ammonialyase, cinnamic acid hydroxylase, 4-coumaroyl-coenzyme A-ligase and cinnamyl alcohol dehydrogenase, sped the accumulation of total phenols, flavonoids and lignin at wounded site of tubers. In which,the activity of phenylalanine ammonialyase showed bimodal change, the treatment was 253.07% and 125.18% higher than the control after 3 days and 9 days of healing. The content of total phenols and flavonoids of the treatment showed 48.60% and 50.42% higher than that of the control. Moreover, the activities of peroxidase and polyphenol oxidase were significantly enhanced at wounded site of tubers. Observation of scanning electron microscopy showed that the formation of closing layer and wound periderm of tubers were accelerated after ABA treatment.Exogenous ABA treatment accelerates the formation of wound periderm of potato tubers by promoting the phenylpropane metabolism, and increasing the activities of peroxidase and polyphenol oxidase.
potato tubers; wound healing; abscisic acid; phenylpropane metabolism; antioxidant enzyme
2017-05-12;接受日期:2017-08-22
国家自然科学基金(3157102083)、国家自然科学基金(地区科学基金)(31460412)、马铃薯产业体系(CARS-10-P18)
李雪,Tel:18309472812;E-mail:1641919938@qq.com。通信作者毕阳,Tel:13119421362;E-mail:biyang@gsau.edu.cn

