基于转录组分析苹果水杨酸特异响应基因MdWRKY40的启动子鉴定
邱化荣,周茜茜,何晓文,张宗营,张世忠,陈学森,吴树敬
基于转录组分析苹果水杨酸特异响应基因的启动子鉴定
邱化荣,周茜茜,何晓文,张宗营,张世忠,陈学森,吴树敬
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018)
探明水杨酸(SA)对苹果叶片基因转录调控的影响,鉴定SA信号途径及其调控基因,为研究SA介导的抗病分子机制提供理论依据。生长30 d的‘嘎啦’组培苗叶片用2 mmol∙L-1水杨酸(SA)处理12 h,以CTRL(0.2%乙醇)处理作为对照,利用Illumina HiSeqTM 2000进行转录组测序,通过综合的生物信息学分析(差异基因筛选、条件特异性分析、GO分类及KEGG富集分析等)筛选SA信号途径的调控基因。克隆受SA特异性诱导表达基因的启动子,利用苹果细胞原生质体转化技术,进行启动子活性鉴定,确定对SA进行特异性响应的核苷酸序列。CTRL和SA处理分别获得750 439 459 bp和751 596 153 bp的原始数据,分别有44.77%和43.88%与‘金冠’苹果基因组完全匹配。获得3 329个显著性差异基因,包括苯丙烷类、类黄酮等次生代谢物生物合成途径的相关基因(如木质素合成关键酶CAD、细胞色素P450、真菌抗性相关的β-1,3-葡聚糖酶等),调控植物病原菌互作途径重要功能基因(钙调蛋白CaM、抗病蛋白RPM1、热激蛋白HSP90、WRKY转录因子等)以及33个条件特异性诱导表达基因(NAC转录因子、NIMIN1、WRKY40、ERF转录因子等)。其中1 085个基因上调,2 244个基因下调。差异基因主要涉及细胞过程、代谢过程和基因绑定、催化活性等;根据转录组学的结果,将SA响应基因的启动子序列克隆到含有荧光素酶基因的表达载体中,置于荧光素酶基因的上游,转化苹果原生质体细胞。SA处理的原生质体细胞,荧光素酶的活性为未经SA处理的20.6倍,而脱落酸(ABA)、茉莉酸(JA)、1-氨基环丙烷羧酸(ACC)对荧光素酶的活性没有影响,说明该启动子为苹果中对SA进行特异性响应的启动子序列。不同区段的启动子片段对SA响应能力不同,从翻译起始位点ATG向上游500—1 000 bp只能响应高浓度SA,而对低浓度SA不具有响应能力,1 500 bp片段对高浓度SA响应能力进一步显著增强,对低浓度SA响应也有微弱提高;而长度为2 000 bp的核苷酸片段无论对高浓度SA还是对低浓度SA都具有显著响应能力,且达到最强。与2 000 bp片段相比,2 500 bp的核苷酸片段没有进一步增强启动子片段对SA的响应能力。超表达MdWRKY40蛋白对其自身的转录具有抑制作用。2 mmol·L-1SA处理所影响的基因主要参与了苯丙烷类、类黄酮的生物合成,植物病原菌互作及植物激素信号转导途径。位于开放阅读框上游的2 500 bp核苷酸序列,为对SA进行特异性响应的核苷酸启动子序列。在1 000—1 500 bp及1 500—2 000 bp具有显著提高启动子对SA敏感性的未知核苷酸序列,另外,转录调控存在反馈抑制机制。
SA;苹果;转录组;信号转导;植物病原菌互作
0 引言
【研究意义】苹果是世界上栽培最广泛的水果之一,因其味道鲜美,且富含营养价值,深受人们喜爱。作为多年生木本植物,其产量和果实品质易受生物和非生物胁迫的影响,特别是病原菌侵害,给苹果产业造成巨大的经济损失[1]。水杨酸(salicylic acid,SA)作为一种植物激素,不仅能够调控植物的生长发育和代谢过程,而且在生物和非生物胁迫反应中起到积极的调控作用[2]。研究表明SA在鼠李糖脂诱导的植物抗性反应中处于中心位置,Sanchez等[3]通过对细菌中鼠李糖脂诱导的植物对活体营养型病菌、腐生营养型病菌及兼性寄生菌pv.的抗性研究发现,SA参与了这3种病菌的抗性,而乙烯仅仅参与了和pv.的抗性反应,茉莉酸仅参与了对的抗性。外源SA处理能够增强苹果叶片对炭疽病的抗性[4],在富士苹果中过表达SA信号途径的关键调控因子能够提高对白粉病的抗性[5]。外源SA处理能够诱导辣椒的抗疫病[6],以及水稻幼苗对白叶枯病的抗性[7]。除此之外,SA还能够提高植物对非生物胁迫的抗性,如SA能够诱导黄瓜中冷害响应基因的表达,并减弱冷害胁迫对黄瓜的伤害,增强植物对冷害的抗性[8]。SA信号途径对植物抗病抗逆性调控具有重要作用。虽然根据前人的研究结果,显示SA在植物的抗病抗逆信号转导中具有举足轻重的作用,但是,在苹果这种多年生的高等植物中,SA的信号转导途径一直不清楚。利用RNA-seq探究SA对苹果叶片转录调控的影响,对解析SA信号转导途径具有重要意义。【前人研究进展】尽管SA在模式植物拟南芥中取得了很大的进展,但在苹果中,SA如何进行信号转导,依然知之甚少,苹果SA 信号通路目前尚不明确。张计育等[9]构建了SA处理湖北海棠的全长cDNA文库,并克隆了与病菌抗性相关的多聚半乳糖醛酸酶抑制蛋白基因全长。不同浓度SA处理对表达产生不同影响,高浓度SA促进苹果叶片中的表达,低浓度SA则抑制其表达[10]。外源SA提高了苹果叶片中过氧化氢酶(CAT)、多酚氧化酶(PPO)、过氧化物酶(POD)及苯丙氨酸解氨酶(PAL)的活性并诱导和的上调表达[11]。罗昌国等[12]克隆了调控富士苹果白粉病抗性的关键基因,该基因表达受SA的强烈诱导。SA通过与靶蛋白互作发挥其功能,目前其调控途径的靶蛋白在很大程度上还未知[13]。SA信号通路主要围绕、转录因子(TGACA元件绑定因子)及病程相关蛋白基因等进行研究。只在SA诱导条件下表达,是调控SA介导的系统获得抗性(SAR)的关键基因。拟南芥突变体无法诱导的表达,增强了对病原菌的感病性[14]。研究表明TGA1-TGA7均可与NPR1互作,调控SA响应基因[15-16]。NPR1增强TGA转录因子与防卫基因启动子as-1元件的结合[17]。目前SA诱导植物抗病性研究主要利用不同植物和病原菌的互作。例如外源SA诱导显著减弱了番茄维管束褐变及叶片黄萎现象,增强对镰刀菌的抗性[18]。【本研究切入点】苹果SA信号途径研究较少,其信号通路和分子机制有待明确。【拟解决的关键问题】RNA-seq是利用高通量测序研究细胞内基因表达的方法,本研究以SA处理的苹果叶片为研究试材,采用RNA-seq的研究方法,以获得在苹果中响应水杨酸的基因,构建能够对SA进行特异性响应的启动子鉴定体系,为深入研究SA信号转导途径奠定基础。
1 材料与方法
1.1 植物材料及处理
供试材料为‘嘎啦’组培苗叶片,组培苗于24℃,12 h/12 h光暗环境下培养30 d,选取长势一致的叶片、将其浸入2 mmol∙L-1SA溶液中,24℃下处理12 h,滤纸吸干表面水分,液氮迅速冷冻,-80℃保存,以备RNA提取;以0.2%乙醇水溶液处理的叶片为对照。重复3次。
1.2 RNA提取及测序
利用天根公司的植物总RNA提取试剂盒(DP424)提取RNA(操作步骤见说明书)。检测合格后,经DNase I处理,用带有Oligo(dT)的磁珠富集mRNA,高温条件下加入适量打断试剂使其片断化,再以片段mRNA为模板合成cDNA,经过磁珠纯化、末端修复、3′末端加碱基A、加测序接头后,进行PCR扩增,完成文库制备。Agilent 2100 Bioanalyzer和ABI StepOnePlusRealTime PCR System进行文库质量和产量检测。测序得到的数据经碱基识别分析后得到原始测序序列,去除含接头、含N比例大于10%、低质量的序列后得到适合分析的数据。使用比对软件BWA[19]和Bowtie[20]将数据比对‘金冠’苹果基因组。
1.3 差异基因筛选、功能分析及条件特异性表达分析
差异基因筛选:利用RSEM工具进行基因表达定量,表达定量结果以FPKM(fragments per kilobase of transcript per million fragments mapped)为单位,FDR(false discovery rate)≤0.001且倍数差异在2倍以上的基因为差异基因。将差异基因与Nr数据库比对后进行注释。
条件特异性表达分析:条件特异性表达分析通过几种不同条件下差异基因的比较,鉴定在某种特定条件下才表达的基因。利用3种植物激素处理苹果叶片进行转录组学研究,对CTRL1(无菌水)、CTRL2(0.2%乙醇)、水杨酸(2 mmol∙L-1SA)、1-氨基环丙烷羧酸(10 μmol∙L-1ACC)、茉莉酸甲酯(100 μmol∙L-1MeJA)这5个处理样品的测序数据进行分析,根据其他两类激素转录组学的研究结果,应用如下统计学研究方法,得到SA特异性诱导表达的基因。其计算公式为:
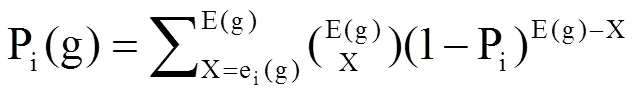
其中,g为基因,i为样品,x=ei(g)为基因g在样品i中的数据数目,E(g)为基因g在所有样品中数据数目。si为样品i中所有数据数目,pi=si/∑isi。p≤0.05的基因定义为条件特异表达基因。
差异基因功能分析:所有SA处理得到的差异基因提交Gene Ontology数据库(http://www.geneontology.org/),用WEGO软件[21]对其进行GO功能分类分析。数据提交KEGG数据库(kyoto encyclopedia of gene and genomes),以KEGG途径为单位,Qvalue≤0.05的途径定义为在差异基因中显著富集的途径,分析差异基因参与的最主要生化代谢途径和信号途径。
1.4 差异基因的qRT-PCR荧光定量分析
采用RevertAid First Strand cDNA Synthesis Kit试剂盒(Thermo公司)对1.2中RNA进行反转录,以SYBRGreen染料进行荧光定量PCR(qRT-PCR)分析。苹果肌动蛋白基因(序列号为GQ339778)作为内参,基因表达倍数通过2-△△Ct法计算。3次重复。差异基因的特异性引物由生工生物工程有限公司合成(详细引物序列见表1)。
1.5 SA信号途径特异性启动子的鉴定及其生物信息学分析
根据qRT-PCR分析结果,选定SA诱导上调最显著的基因以及受SA诱导调控不显著的基因,克隆其启动子序列,将启动子克隆到含有编码荧光素酶基因的表达载体中,并置于荧光素酶基因之前,用以驱动荧光素酶基因。采用PEG法转化苹果愈伤原生质体,常温表达3 h后,利用2 mmol∙L-1SA、100 μmol∙L-1MeJA、10 μmol∙L-1ACC、10 μmol∙L-1ABA、5 mmol∙L-1EGTA(Ca2+螯合剂)分别处理3 h,收集原生质体,加入裂解液,用酶标仪(PerkinElmer公司,型号为VICTOR X4)测定LUC(荧光素酶,luciferase)和GUS值,分析LUC/GUS比值,鉴定SA途径的特异性响应启动子序列。表达载体构建及原生质体分离和转化的详细流程参见He等[22]的方法。
构建该基因的MBP融合表达载体pMAL-gene- 2HA,诱导蛋白表达并进行纯化,用于后续研究。利用PlantCARE数据库(http://bioinformatics. psb.ugent. be/webtools/plantcare/html/)进行启动子顺式作用元件分析。
2 结果
2.1 数据测序质量评估及差异基因、条件特异表达基因的筛选
对照和SA处理分别得到750 439 459 bp和751 596 153 bp测序数据,其中,71.72%和71.29%定位于苹果基因组,44.77%和43.88%的序列与‘金冠’苹果基因组数据[23]中的基因完全匹配(表2)。结果表明:共筛选到3 329个差异表达基因,其中上调基因1 085个,下调基因2 244个(图1)。
在本转录组学的研究中,除对SA进行转录组学研究外,还对ACC(乙烯合成前体物质)、MeJA(茉莉酸甲酯)的转录组学进行对比与统计学计算,筛选到苹果基因组中33个只被SA诱导的特异表达基因(图2),包括转录因子(MDP0000252435)、转录因子(MDP0000263349)、(MDP0000280322)、锌指结构基因(MDP0000289278)、转录因子(MDP0000830129)以及未知功能基因等(表3)。
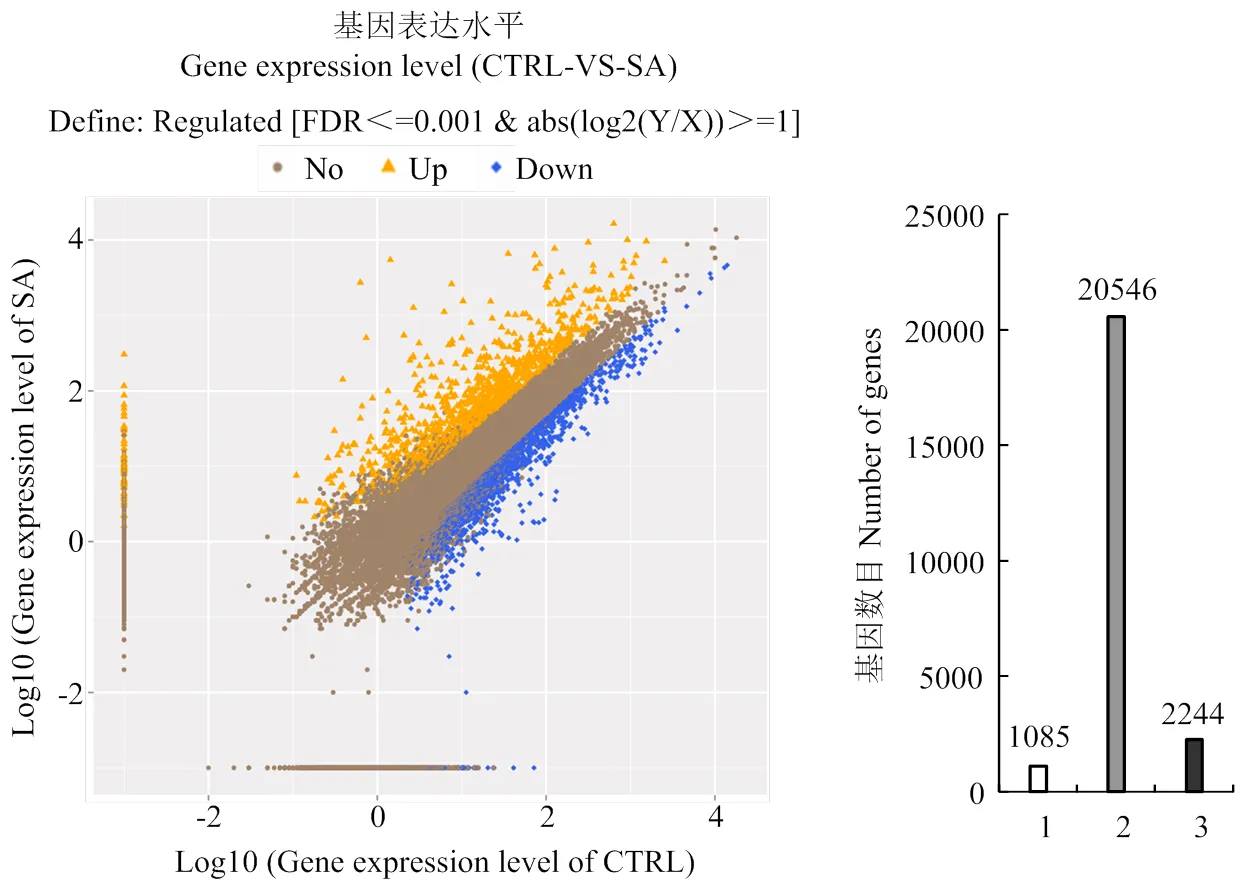
左图:横坐标表示CTRL样品表达量的对数值,纵坐标表示SA样品表达量的对数值。橙色三角代表上调基因,蓝色方块代表下调基因,褐色圆点代表非显著差异基因。右图:1代表上调基因,2代表非显著差异基因,3代表下调基因
表1 用于qRT-PCR分析的基因及引物
2.2 差异基因的GO分类
GO分析将差异基因分为参与生物过程、细胞成分和分子功能3部分(图3)。参与生物过程差异基因分为16类,其中细胞过程(cellular process,54.2%)、代谢过程(metabolic process,78.4%)所占比例最多,其次为单细胞过程(single-organism process,33.6%)。细胞成分中,细胞(cell,64.1%)、细胞组分(cell part,64.1%)所占比例最多,其次为膜结构(membrane,39.6%)以及细胞器(organelle,33%)。分子功能的绑定(binding,55.4%)、催化活性(catalytic activity,77%)差异基因所占比例最多,其次为转运活性(transporter activity,7.2%)、分子转导活性(molecular transducer activity,3.6%)以及核酸绑定转录因子活性(nucleic acid binding transcription factor activity,2.2%)等。

图2 条件特异表达基因的筛选
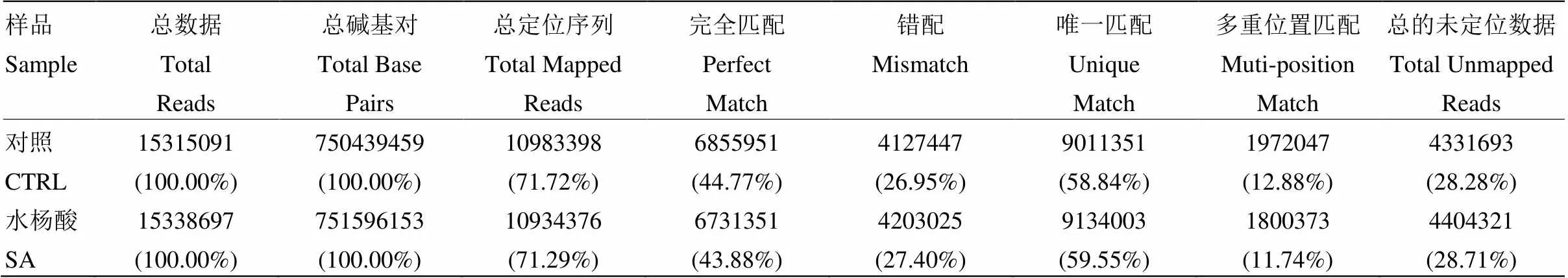
表2 样品与‘金冠’苹果基因组序列的比对结果
表3 SA诱导的条件特异表达基因
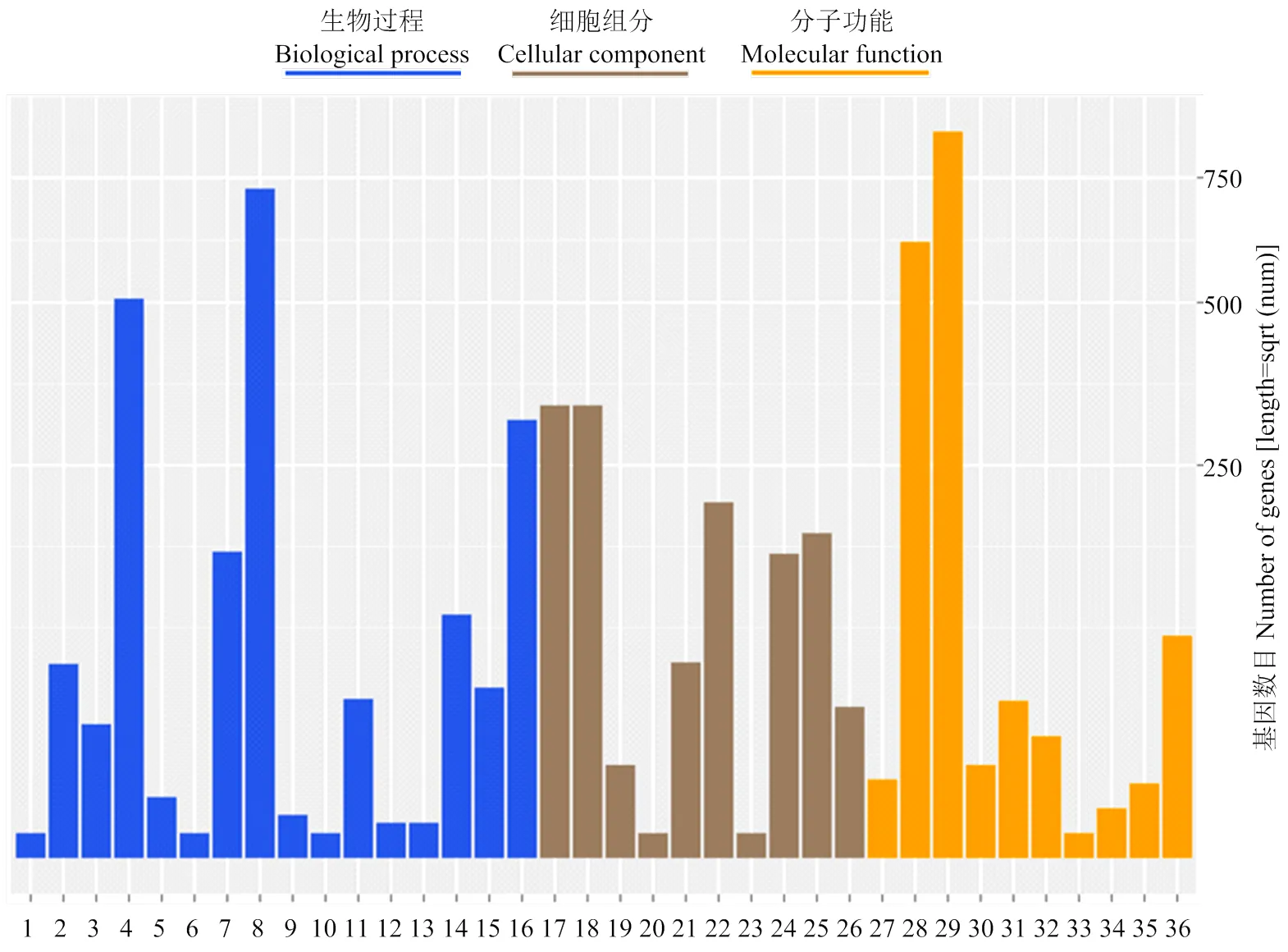
1:生物相;2:生物调节;3:细胞组分组织或生物形成;4:细胞过程;5:发育过程;6:免疫系统过程:;7:定位;8:代谢过程;9:多细胞有机体过程;10:生物过程积极调控;11:生物过程调控;12:复制;13:复制过程;14:刺激反应;15:信号;16:单一生物过程;17:细胞;18:细胞成分;19:胞外区:;20:胞外区部分;21:大分子复合物;22:膜;23:膜附着腔;24:膜组分;25:细胞器;26:细胞器部分;27:抗氧化活性;28:绑定;29:催化活性;30:酶调节器活性;31:分子转导活性;32:核酸绑定转录因子活性;33:蛋白绑定转录因子活性;34:受体活性;35:结构分子活性;36:转运蛋白活性
2.3 差异基因KEGG富集分析及受SA影响的次生代谢基因
通过KEGG富集分析,确定差异基因参与的最主要生化代谢途径和信号途径。根据≤0.01,找到30个与整个基因组背景相比显著富集的途径(图4)。KEGG分析的结果发现差异基因显著富集途径主要有4个,其中代谢途径差异基因608个,占29.49%;次生代谢物质合成途径411个,占19.93%;植物-病原菌互作途径235个,占11.4%;植物信号转导途径182个,占8.83%。
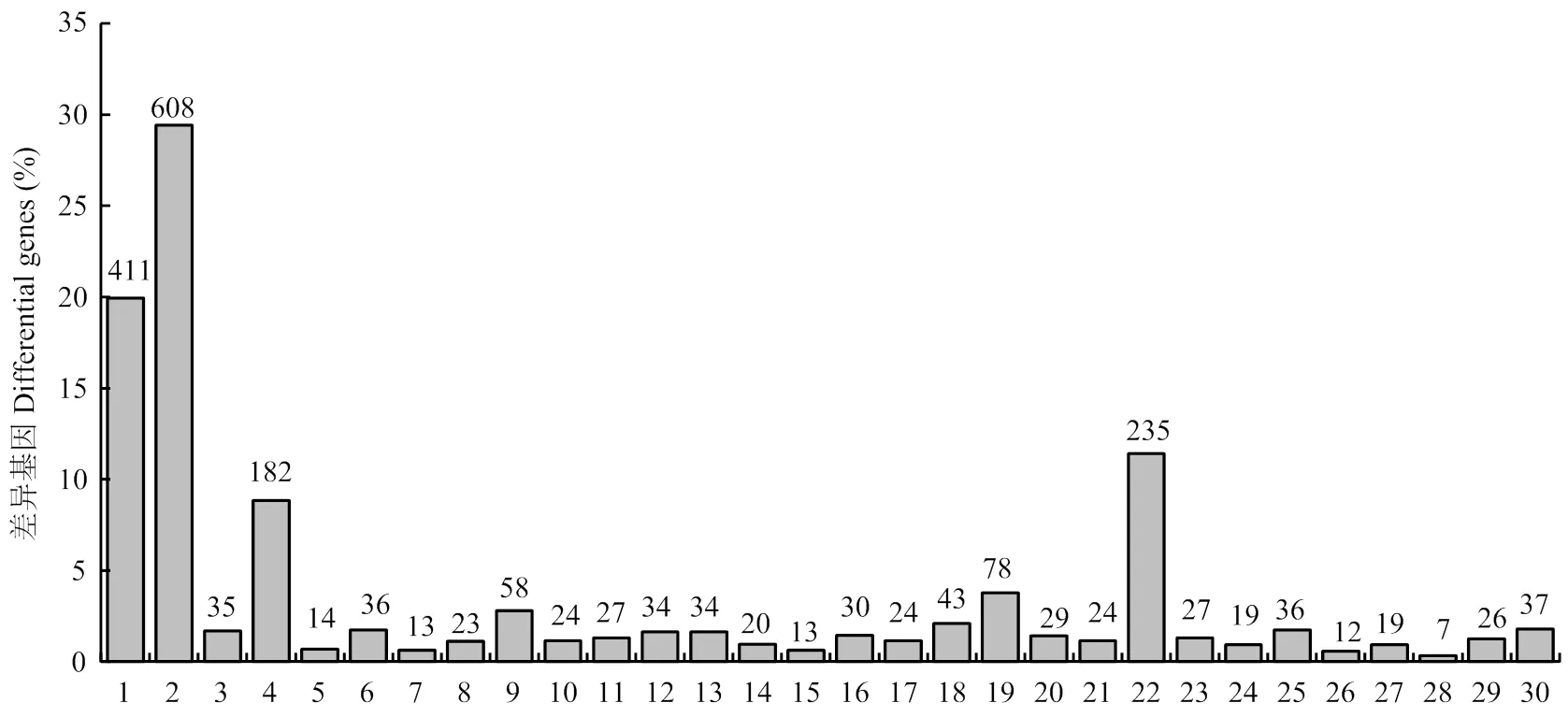
1:次生代谢的生物合成;2:代谢途径;3:果糖和甘露醇代谢;4:植物激素信号转导;5:维生素B6代谢;6:昼夜节律;7:光合作用-天线蛋白;8:脂肪酸代谢;9:类黄酮生物合成;10:卟啉和叶绿素代谢;11:甘油酯代谢;12:类胡萝卜素生物合成;13:丙酮酸代谢;14: 缬氨酸、亮氨酸和异亮氨酸退化;15:油菜素内酯生物合成;16:谷胱甘肽代谢:17:半乳糖代谢:18:糖酵解和糖质新生;19:苯丙素的生物合成;20:亚麻酸代谢;21:维生素C代谢;22:植物-病原菌互作;23:其他多糖降解;24:萜类化合物生物合成;25:ABC转运蛋白;26:糖胺聚糖降解;27:二羧酸代谢;28:类单萜生物合成;29:半胱氨酸和蛋氨酸代谢;30:氨基糖和核苷酸糖代谢
1:代谢途径;2:次生代谢生物合成;3:植物病原菌互作;4:植物激素信号转导
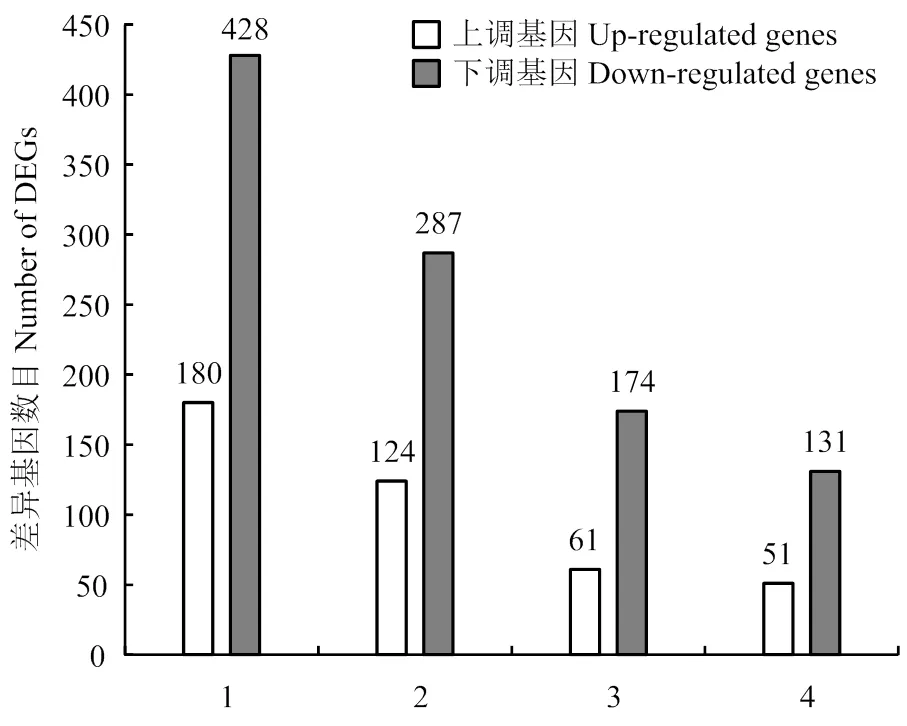
植物次生代谢途径在植物抵抗生物与非生物胁迫反应中起重要的调控作用。本研究发现在次生代谢合成途径中,SA上调基因124个,下调基因287个(图5)。在24个上调比率≥5的基因中(表4),5个苯丙烷生物合成途径基因,8个类黄酮合成途径基因,3个花青苷生物合成途径基因,4个维生素代谢途径涉及基因,说明SA主要调控苯丙烷和类黄酮生物合成途径。涉及苯丙烷生物合成途径的基因包括羟基脯氨酸富集糖蛋白(MDP0000180381),甘露醇脱氢酶(MDP0000164361、MDP0000609114)和肉桂醇脱氢酶CAD(MDP0000448602、MDP0000858930),其中甘露醇脱氢酶通过调节甘露醇的合成增强植物的抗性[24],其上调表达为研究SA增强抗性的分子机制提供理论依据。木质素是植物细胞壁的一部分,增强了细胞壁的韧性,同时增强植物对胁迫反应的抵抗能力。肉桂醇脱氢酶CAD作用于整个木质素合成途径的最后一步,在木质素合成中起到关键作用[25]。本研究中SA诱导CAD的上调表达,间接表明SA增强植物抵抗胁迫反应的能力,为研究SA诱导植物抗性的分子机制奠定了基础。苯丙氨酸解氨酶PAL是苯丙烷代谢途径的关键酶和限速酶,参与植物木质素、类黄酮等次生代谢物质的生物合成,其活性在SA诱导下呈现先上升后下降的趋势[26]。本研究中SA未诱导PAL(MDP0000787168,-3.03)的上调,与前人研究结果不一致[11],很可能是因为SA处理时间过长,导致PAL活性下降。在类黄酮生物合成途径中,莨菪碱双加氧酶(MDP0000472462、MDP0000183313、MDP0000229093),细胞色素P450家族(MDP0000221432、MDP0000196375),异黄酮羟化酶(MDP0000138677、MDP0000165503),黄酮醇合成酶(MDP0000130244)被SA诱导显著上调。其中细胞色素P450一方面参与植物次生代谢的生物合成,一方面参与代谢解毒功能。维生素代谢途径中的醛酮类还原酶(MDP0000804510、MDP0000046192、MDP0000158194、MDP0000246999)在SA诱导下表达量显著提高,它们也是植物中重要的解毒酶,在植物的非生物胁迫反应中发挥重要作用[27]。SA调控花青苷的生物合成,其中3-氧-葡萄糖苷5-氧-葡萄糖基转移酶(MDP0000229280、MDP0000545122、MDP0000506825)在SA诱导下显著上调。β-1,3-葡聚糖酶降解真菌细胞壁,有直接攻击病原真菌的潜在能力[28],在本研究中,SA诱导β-1,3-葡聚糖酶(MDP0000254363)的显著上调,同时SA诱导上调细胞色素P450(MDP0000196375),该基因调控油菜素内酯的生物合成。
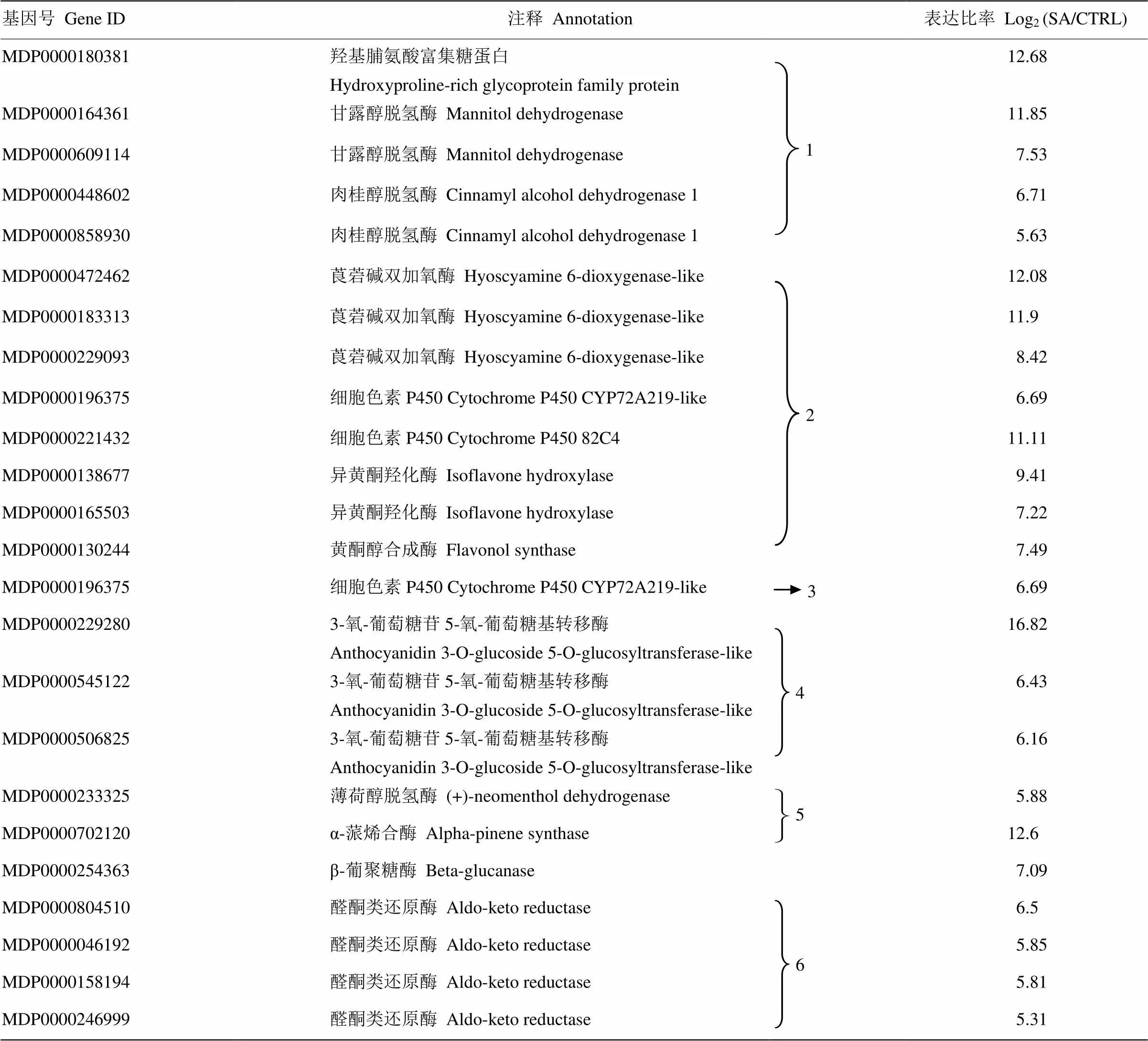
表4 次生代谢生物合成途径中的上调基因(表达比率≥5)
1:苯丙烷生物合成;2:类黄酮生物合成;3:油菜素内酯生物合成;4:花青苷生物合成;5:萜类生物合成;6:维生素代谢
1: Phenylpropanoid biosynthesis; 2: Flavonoid biosynthesis; 3: Brassinosteroid biosynthesis; 4: Anthocyanin biosynthesis; 5: Terpenoid backbone biosynthesis; 6: Vitamin metabolism
2.4 植物病原菌互作途径中受SA影响的抗病相关基因
在进化过程中,植物与病原菌的较量也在自然选择过程中不断改进,使植物形成了复杂的防御机制。植物的抗性分为基础抗性和主动抗性。基础抗性在病原菌入侵前就已存在,是植物抵抗病原菌的第一道防线,如植物本身的气孔、皮孔、角质层等。主动抗性是病原菌突破基础抗性后激发的第二道防御系统,即免疫反应,激活一系列防卫相关基因的表达,此过程需要转录因子等重要抗性功能基因的调控。其中植物与病原菌互作途径在早期抵抗病原菌入侵中发挥重要作用。
本研究植物-病原菌互作途径中被SA诱导61个基因上调,174个基因下调(图5)。分析得到了该途径中调控幅度较大的抗病相关基因(表5)。其中MAPK级联反应在植物与病原菌互作过程中具有重要意义。MPK4能够负调控植物的系统获得抗性(SAR)。研究表明拟南芥突变体SA合成量提高,表达增强,表现出组成性的系统获得抗性(SAR),提高了植物对病原菌的抗性[29]。利用外源SA对丹参处理2 h后能够诱导及MAPK级联途径上游基因上调表达[30],拟南芥被SA诱导且负调控SA介导的植物抗病反应[31]。本研究中SA诱导MAPK级联途径上游基因(MDP0000431417)上调,但对下游基因的转录水平无影响。调控下游的转录因子,促进或抑制转录因子与下游靶蛋白启动子结合,调控防卫基因表达以及植物抗毒素的积累[32]。本研究SA对无影响,但下游转录因子被SA显著诱导表达,包括与调控防卫基因相关的转录因子MDP0000754989、MDP0000228304、MDP0000175240、MDP0000767097等。与MPK3/6相比,MPK4下游的转录因子MDP0000263349、MDP0000253189、MDP0000300712调控比率较大(表5)。由此推测,SA更侧重于调控MPK4下游转录因子的表达。
植物病原菌互作途径中上调趋势较为明显的还有抗病蛋白受体基因(MDP0000774112),(MDP0000300920),热激蛋白基因(MDP0000254260),此外,钙调蛋白(MDP0000785886)同样被SA诱导上调表达。
热激蛋白HSP90是一种高度保守且在胁迫反应中大量积累的蛋白,通常以分子伴侣的形式与靶蛋白形成复合物调控生物抗性反应[33]。核酸绑定和寡聚化域类受体(NLRs)感知不同病原菌的受体蛋白,病原菌受体的识别触发植物防卫反应,伴随一系列细胞程序性死亡,即过敏反应[34]。RPM1属于NLRs家族成员,拟南芥中HSP90对于NLRs的积累是必需的[35]。

表5 植物病原菌互作途径调控基因(表达比率≥3)
HSP90与抗病蛋白RPM1结合,可通过改变分子伴侣活性改变RPM1的分子功能。本研究SA处理诱导(MDP0000254260)和(MDP0000774112)的上调,为研究SA增强植物抗病性的调控机制提供理论依据。
2.5 差异基因qRT-PCR荧光定量分析
选定24个差异表达基因(15个上调基因,9个下调基因)进行qRT-PCR分析。如图6所示,15个上调基因中,除(MDP0000868782,1.7倍)诱导表达倍数较弱,其他基因均被SA诱导显著上调。(MDP0000263349,4 615倍)、(MDP0000226971,3 241倍)、钙调蛋白(MDP0000785886,3 219倍)和类固醇还原酶(MDP0000383328,1 293倍)上调倍数最显著,其次为(MDP0000280322,572倍)、(MDP0000254260,359倍)等,抗病蛋白基因(MDP0000774112,128倍)、(MDP0000300920,112倍)也被SA诱导上调。9个下调基因中,(MDP0000277999)、(MDP0000711379)、(MDP0000138686)、(MDP0000256492)下调趋势较明显。(MDP0000710349)、(MDP0000247896)和(MDP0000232344)虽然调控趋势不明显,但转录组分析其调控比率均≤1.5,表明SA对这3个基因的调控较弱。综上所述,qRT-PCR结果表明各基因表达与转录组分析结果一致,只是在差异倍数上与转录组数据有所差别。
2.6 苹果中SA特异性响应启动子的鉴定
为进一步研究苹果对SA的响应机制,本研究利用启动子驱动的荧光素酶活性进行分析。选定SA特异性响应基因作为研究对象,克隆了该基因的启动子序列:从该基因开放阅读框起始位点ATG,向上游2 500 bp的核苷酸序列(图7)。以苹果中对SA不敏感的基因(MDP0000710349)的启动子(图8)及拟南芥中对细菌鞭毛蛋白进行响应的(At2g19190)的启动子(图9)[36]为参考对照,检测启动子驱动的荧光素酶活性。
荧光素酶活性分析表明,能够对SA进行响应(图10-A)。结果表明,经SA处理,其荧光素酶活性为未经SA处理的20.6倍;也能够被SA诱导激活,但是,诱导倍数显著低于;而另一基因(MDP0000710349)启动子驱动的荧光素酶,经SA处理后其活性仅为未处理的2.29倍,说明该片段对SA不具有或仅具有微弱的响应能力。
对基因的启动子序列进行生物信息学分析,发现序列中存在ABA/MeJA/GA/SA响应顺式作用元件、病菌响应元件、防卫胁迫响应元件等(图7)。但是,进一步应用该启动子序列的研究表明,除SA外,其他激素不能够引起该启动子片段的响应(图10-B),说明该片段是对SA进行特异性响应的启动子序列。同时,对和的启动子序列进行分析发现,启动子序列含有4个SA响应元件位点(图9),而启动子序列中不含SA响应元件(图8)。
为进一步精细区分界定启动子中对SA响应的顺式作用元件,分别克隆了从开放阅读框的翻译起始位点ATG向上游500 bp、1 000 bp、1 500 bp、2 000 bp的核苷酸序列,并构建到表达载体中置于荧光素酶编码基因的上游,转化原生质体,检测对SA的响应能力。研究表明,500 bp、1 000 bp的核苷酸序列,不具有对低浓度SA(0.2 mmol∙L-1)的响应能力,而在1 500 bp时,对SA表现出微弱响应,但与1 000 bp相比,二者在统计学上差异不显著;而长度达到2 000 bp时,显著提高了荧光素酶活性,为未用SA处理的4.1倍,分别是500 bp、1 000 bp时SA处理条件下荧光素酶活性的2.3倍、3.3倍。说明,在1 000 bp—2 000 bp间具有显著提高SA响应能力的核苷酸序列。而2 000 bp、2 500 bp的核苷酸序列在响应SA的水平上,不具有显著差异(图10-C,左)。
应用高浓度的SA处理,同样证明了这一结论。用0.5 mmol∙L-1SA处理原生质体细胞,发现500 bp、1 000 bp的核苷酸序列即具有对SA的响应能力,荧光素酶活性分别为未用SA处理的4.2倍、3.3倍,500 bp、1 000 bp二者响应能力处于同一水平。而长度为1 500 bp时,荧光素酶活性进一步升高,为未用SA处理的7.4倍,与1 000 bp、500 bp核苷酸序列相比,具有显著差异。核苷酸序列长度增加到2 000 bp时,对SA响应能力进一步增强,荧光素酶活性升高倍数为11.5倍,与1 500 bp核苷酸序列相比,具有显著差异。该研究结果说明,在1 000 bp—1 500 bp及1 500—2 000 bp,具有增强SA响应能力的顺式作用元件。而2 000—2 500 bp,在对SA响应的荧光素酶活性变化上,没有进一步提高(图10-C,右)。
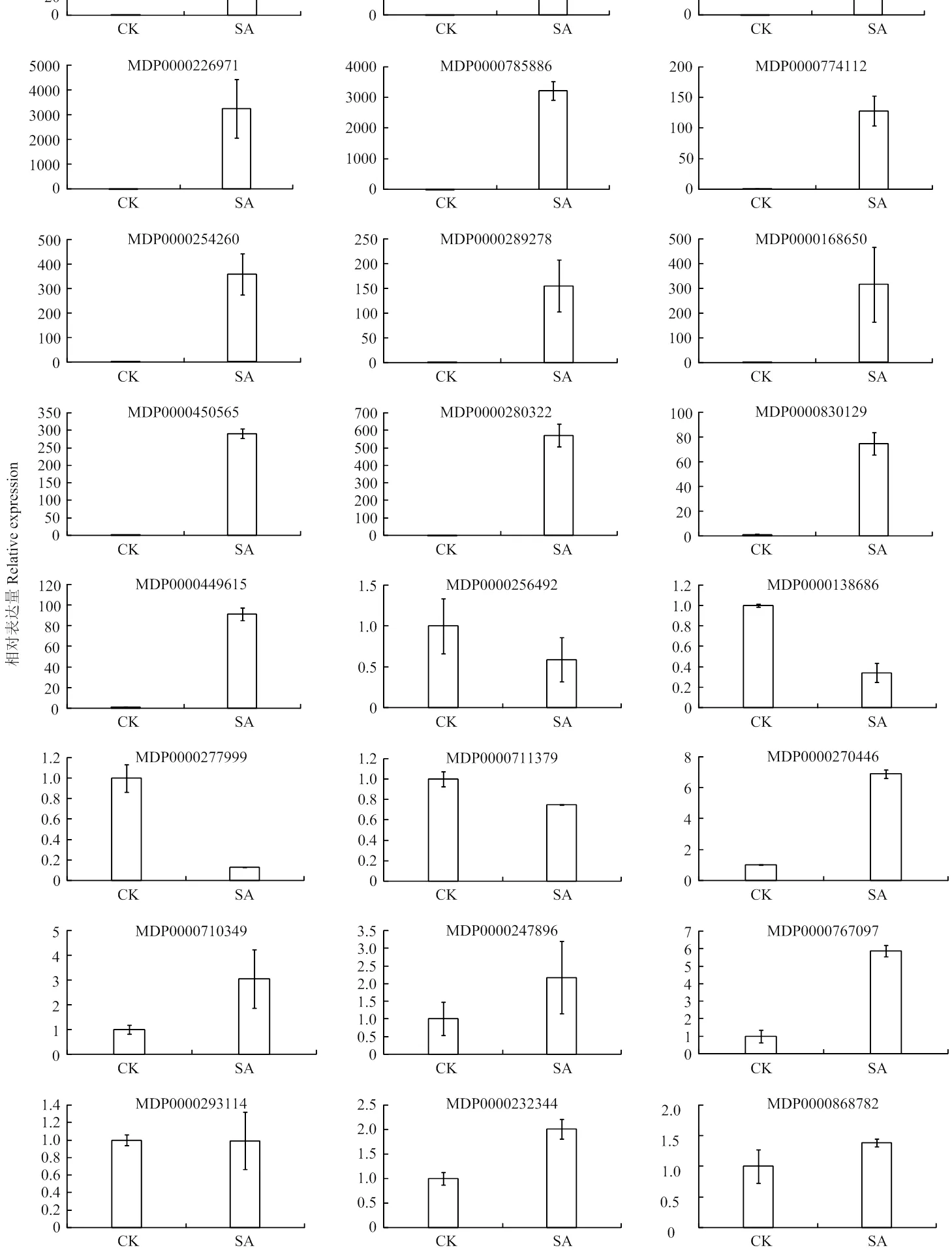
图6 差异基因的qRT-PCR分析

图7 MdWRKY40启动子序列的生物信息学分析
结合低浓度(0.2 mmol∙L-1)与高浓度(0.5 mmol∙L-1)SA的研究结果可以看出,从ATG开始向上游500 bp的核苷酸序列已具有对SA的响应能力,但是,该区段不能响应低浓度SA,而在1 000—1 500 bp及1 500—2 000 bp,尤其是后者,具有显著增强苹果细胞对SA敏感性的未知核苷酸序列。
2.7 MdWRKY40转录调控存在反馈抑制机制
研究表明,一些重要的转录因子存在自我催化或反馈抑制的转录调控机制,以达到快速响应外界信号或及时阻抑过高表达的目的,前者如调控苹果果实着色的重要转录因子[37]与欧芹[38],后者如拟南芥中调控植物衰老进程的重要转录因子[39]。
为探究是否存在自我调控机制,将35S启动子驱动的MdWRKY40蛋白与Promoter- WRKY40-Luciferase在原生质体中进行共转化。共转后的荧光素酶活性仅为对照的35%,Western blot显示MdWRKY40蛋白在原生质体中成功表达,其分子量为37 kD(图10-D),说明MdWRKY40蛋白的表达对其自身RNA水平的转录具有反馈抑制作用。

图8 MdChiB-1启动子序列的生物信息学分析
在本研究中,还克隆了的开放阅读框序列,构建到含有MBP融合蛋白表达载体中,转化大肠杆菌BL21,成功得到WRKY40诱导蛋白(MBP蛋白分子量为40 kD,加上WRKY40后,总的蛋白分子量约为77 kD,图10-E),为解析该蛋白在SA信号途径的功能奠定了生化基础。
3 讨论
3.1 转录组数据分析筛选到SA介导抗病信号途径的重要功能基因
由于SA调控苹果抗病的分子机制尚不明确,SA信号途径的关键基因尚未找到,本研究利用外源SA处理苹果叶片,构建SA诱导的转录组文库,并进行转录组测序分析,探讨SA处理后差异表达基因、基因富集通路的变化,寻找SA调控抗病反应的关键基因。对照和SA处理测序数据可靠,覆盖率高,适合用于数据分析。(nonexpressor of PR genes 1)是SA信号途径的关键调控因子[40]。拟南芥和小麦过量表达能够增强二者对病原菌的抗性[41]。Chai等[42]的研究表明,利用0.1 mmol∙L-1SA处理拟南芥离体叶片2 d,转录水平表达倍数为对照的3倍,处理4 d,的表达提高到9倍,而在本研究中,未检测到SA处理后苹果(MDP0000292425)基因表达的变化,一方面可能与SA处理浓度(2 mmol·L-1)与取样时间(12 h)有关;另一方面,在SA信号转导中,作为SAR(系统获得抗性)的分子开关,其泛素化降解启动SAR信号转导过程,而旁系同源基因和作为SA的受体,介导了泛素化降解[43]。在本研究中(MDP0000868782)被SA处理诱导表达(表达比率为1.7)。因此,推测在表达水平上不受调控,而主要发生在蛋白水平上。表达与SA处理浓度及时间的关系,以及与SA信号转导的关系,需要进一步研究。
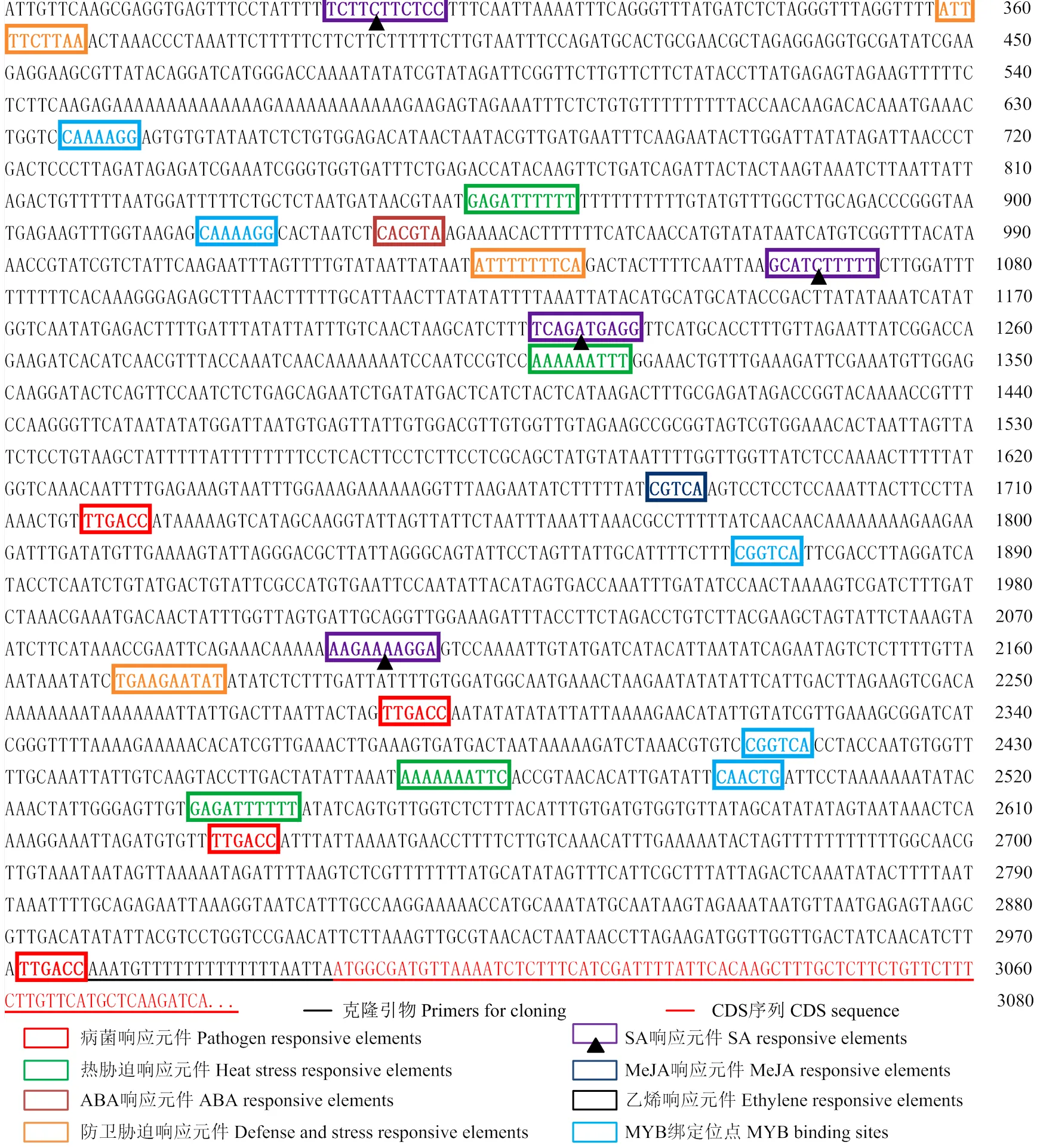
图9 FRK1启动子序列的生物信息学分析
NIMIN1(MDP0000280322)是NPR1的互作蛋白,负调控表达[44-45]。本研究(MDP0000280322)被SA诱导显著上调(其表达比率为6.56),是SA诱导的条件特异表达基因之一,且(MDP0000711379,-1.14)的转录水平同时降低,因此推测苹果与拟南芥负调控的分子机制一致。其在苹果中的具体功能尚不清楚,需要进行后续研究。
在本研究中,一些调控次生代谢的基因也能够被SA诱导上调,其中包括葡萄糖基转移酶,该基因在烟草中同样被SA所诱导表达[46-47]。研究表明,病菌通过分泌甘露醇到质外体来抑制活性氧介导的的宿主防卫反应,植物中的甘露醇脱氢酶通过将病菌分泌的甘露醇转变为甘露糖,从而增强植物的抗病反应,本研究中甘露醇脱氢酶基因被SA诱导上调表达,这与Cheng等[48]的研究一致。肉桂醇脱氢酶(CAD)是木质素合成的关键酶,对转录组数据进行分析后发现,SA上调CAD的表达,在甘薯和茶树中同样证实了这一观点[49-50]。表明不同物种之间SA响应次生代谢途径的保守性很强。SA对次生代谢的调控,是调控植物抗性的一个非常重要的方面。

A:SA处理各启动子的LUC/GUS比值;B:各种激素处理MdWRKY40启动子的LUC/GUS比值;C:MdWRKY40启动子的不同区段对不同浓度SA处理的LUC/GUS比值,0.2 mmol∙L-1 SA(左)、0.5 mmol∙L-1 SA(右);D:MdWRKY40蛋白超表达对LUC/GUS比值的影响;E:MdWRKY40诱导蛋白表达。*表示P<0.05,**表示P<0.01,***表示P<0.001
研究中还发现了参与活性氧途径代谢的基因,在植物防卫反应中,还有一种重要的次生代谢产物活性氧(ROS),对触发过敏反应至关重要[51]。呼吸爆发氧化酶(Respiratory burst oxidase homologues,Rboh)是植物活性氧(ROS)的主要生产者[52],PTI(pattern triggered immunity)和ETI(effector triggered immunity)均能调控植物防卫反应,但ETI能够更强更快速的引起局部过敏反应[53]。SA处理下调呼吸爆发氧化酶(Rboh)的转录水平,表明PTI途径中由ROS引发的过敏反应被抑制,同时SA诱导苹果中(MDP0000254260)和(MDP0000774112)的上调,激发ETI途径中抗病基因介导的过敏反应,对于SA诱导苹果抗病性的调控机制指明了研究方向。SA对非生物胁迫起到正面调控作用。研究表明SA处理显著降低苹果幼苗内ROS水平,提高抗氧化酶活性,降低膜脂过氧化水平,从而减轻低氧胁迫对植株的伤害,其调控机制尚不明确[54]。本研究中SA诱导呼吸爆发氧化酶Rboh下调,为SA能够增强苹果对低氧胁迫的抗性提供了分子证据。
研究表明持续的MAPK级联途径的激活有助于激发SA诱导的大部分响应基因的表达[55]。本研究SA诱导了苹果MAPK级联途径顶端基因的上调,同时诱导下游转录因子的表达,但对及则无转录水平的影响。对差异基因进行条件特异表达分析发现SA特异性诱导了33个差异基因的表达,包括转录因子、、、转录因子等,这在之前苹果转录组数据分析中未见报道。33个特异表达基因为揭示SA途径的特异性生物过程提供了理论依据,其中的转录因子及植物病原菌互作相关蛋白,在SA诱导的植物抗病反应中发挥重要作用。Pandey等[56]的研究表明水稻中多种转录因子参与抗病反应,例如、和在稻瘟病菌的侵染过程中表现为差异性表达,白叶枯菌能够诱导和的特异性表达,并与和互作从而负调控XA21介导的抗病反应[57-58],本研究诱导的转录因子在苹果抗病反应的具体功能尚不清楚,仍需进行深入研究。
从本研究转录组的数据可以看出,SA显著调控,次生代谢合成基因,活性氧代谢基因以及转录因子家族基因表达,SA广泛参与了对于苹果系统抗性中各个过程的调控,其中,对每一方面的调控方式和作用位点,需要在本研究基础上,进一步应用分子以及生化手段进行揭示。
3.2 原生质体转化技术与SA信号途径
启动子负责对外界诱导条件的响应,在本研究中只克隆了2 500 bp的核苷酸序列,有可能在上游序列中,仍然含有进一步提高对SA进行响应的特异性元件。为拟南芥中对细菌鞭毛蛋白flg22的22个氨基酸序列进行强烈诱导表达的基因,是细菌鞭毛蛋白响应的指示性基因[36],在苹果基因组中并未找到的同源基因,但是,将-LUC转化于苹果细胞中,经SA处理,发现升高10.1倍,说明在苹果细胞中启动子序列仍然能够被识别,这不仅表明苹果细胞与拟南芥细胞中,信号转导途径的保守性,同时也说明,在苹果细胞中,SA信号途径具有影响PTI信号转导的能力,说明SA在植物抗病信号转导中,具有重要的作用。在的启动子中,发现了对SA进行响应的4个序列元件,暗示的启动子除了能够对细菌鞭毛蛋白flg22进行响应外,还能够对SA进行响应,而试验结果也表明的启动子可以响应SA,与生物信息学分析结果相一致。
启动子序列通常包含多种顺式作用元件,确定对信号应激反应起关键作用的顺式作用元件对理解细胞的信号转导极为重要。在本研究中,通过不同区段克隆的方式,发现在1 000—2 000 bp,存在增强SA信号响应能力的作用元件。生物信息学分析表明,在1 000 bp以内,存在3个响应SA的顺式作用元件,其中500 bp以内含有2个,500—1 000 bp含有1个(图7),这与500 bp的核苷酸序列已具有对SA的响应能力的试验结果相一致,但是,500 bp、1 000 bp对SA的响应能力没有区别,说明这3个顺式元件可能功能上具有重叠。同时,该区段不能响应低浓度SA,而当核苷酸序列长度增长到2 000 bp时,具有了对低浓度SA的响应能力,说明,在1 000—2 000 bp,含有进一步增强SA信号转导能力的作用元件。将这一区段一分为二,即1 000—1 500 bp、1 500—2 000 bp,发现这两个区段在高浓度SA时,都能够显著增强SA信号转导的功能,说明在这两个区段中,分别具有提高对SA敏感性的作用元件,而在低浓度SA时,只有从1 000 bp增加到2 000 bp时,才能显著提高苹果细胞对SA的敏感性,说明这两个区段的SA顺式作用元件具有累积与加和效应。在启动子的研究中,经常发现,多个元件具有累积效应,元件拷贝数目的不同会对启动子响应的强度和诱导性产生不同的影响[59]。生物信息学分析表明,在1 000—1 500 bp存在2个茉莉酸甲酯响应元件(TGACG),1 500—2 000 bp存在3个病菌响应元件(ACGTG)、2个生长素响应元件(AACGAC)和1个W-box(TTGAC),并未预测到SA的响应元件,说明在这一区段中,可能存在增强细胞对SA敏感性的未知核苷酸序列。
在植物中一些具有重要功能的转录因子具有自我催化或自我抑制机制。研究发现,MdWRKY40蛋白能够抑制自身基因的转录,这种自我抑制模式与拟南芥中调控衰老的关键基因的表达模式相同。Robatzek等[39]发现,将WRKY6蛋白在拟南芥细胞中超表达,其自身的转录活性降低12倍。这种反馈抑制机制可能有效阻止了由自身基因的过量表达而导致的植物早衰。在本研究中发现能够快速高效响应SA,说明是抗性信号物质SA信号转导中的一个重要基因,该基因的反馈抑制作用,可能及时阻止了自身过量表达对植物带来的危害。笔者实验室已经构建植物稳定超表达载体,进行转化苹果愈伤和苹果植株,对其基因功能进行进一步研究。
原生质体转化技术广泛应用于植物的基因功能、亚细胞定位、蛋白互作及瞬时表达等方面,可以高效准确的解析植物细胞信号转导途径,是分子生物学和生物化学研究的有效手段[60]。不同植物原生质体技术的成功应用,促进了植物基因组学及蛋白质组学功能的研究。例如,水稻中利用原生质体转化技术成功得到了MYBS3的亚细胞定位性质[61]。拟南芥中利用原生质体研究了不同基因的表达、信号转导途径[62]及蛋白互作情况[63]等。本研究利用苹果愈伤的原生质体转化技术首次鉴定了在苹果中对SA进行特异性响应的启动子序列,即(MDP0000263349)的启动子序列,为苹果这种多年生木本植物中开展相关激素信号转导途径的研究提供了稳定的鉴定体系,也为以后获得更多特异途径的靶标基因与调控基因提供了可能。大肠杆菌中成功诱导WRKY40蛋白的表达,为研究WRKY结构域的结合元件以及鉴定下游的靶基因奠定了生化基础。的启动子序列中包含各种激素响应元件、防卫胁迫响应元件等,表明可能调控多种激素和胁迫反应过程。作为SA信号途径的特异性启动子,SA响应元件在诱导表达过程中占主导地位,图8中3个位点的SA响应元件对于是否存在功能冗余,可对3个SA响应元件进行缺失突变,利用原生质体转化技术进一步鉴定其关键调控元件。
SA调控的途径复杂而精细,在植物抗性反应中起到显著作用[64-66]。目前苹果中关于SA诱导抗病的分子机制尚不完善。与模式植物相比,苹果中SA诱导的途径更为复杂,是苹果抗病的重要机制之一。分析SA诱导苹果叶片转录水平的基因表达差异,利于更好的理解SA信号途径与植物病原菌互作的分子机制。本研究的转录组学数据及启动子的克隆,为SA在苹果中信号转导途径的深入研究奠定了基础。
4 结论
利用RNA-Seq技术获得了水杨酸(SA)诱导苹果叶片转录水平的差异基因,包括次生代谢、植物病原菌互作途径相关基因以及33个条件特异表达基因。利用原生质体转化技术鉴定了SA特异性响应基因(MDP0000263349)的启动子序列,在1 000—1 500 bp及1 500—2 000 bp具有显著提高启动子对SA敏感性的未知核苷酸序列,另外,MdWRKY40转录调控存在反馈抑制机制,为苹果中SA信号途径的研究奠定了基础。
[1] 国立耘, 李金云, 李保华, 张新忠, 周增强, 李广旭, 王英姿, 李晓军, 黄丽丽, 孙广宇, 文耀东. 中国苹果枝干轮纹病发生和防治情况. 植物保护, 2009, 35(4): 120-123.
GUO L Y, LI J Y, LI B H, ZHANG X Z, ZHOU Z Q, LI G X, WANG Y Z, LI X J, HUANG L L, SUN G Y, WEN Y D. Investigations on the ccurrence and chemical control ofcanker of apple in China., 2009, 35(4): 120-123. (in Chinese)
[2] KUMAR D. Salicylic acid signaling in disease resistance., 2014, 228(11): 127-134.
[3] SANCHEZ L, COURTEAUX B, HUBERT J, KAUFFMANN S, RENAULT J H, CLEMENT C, BAILLIEUL F, DOREY S. Rhamnolipids elicit defense responses and induce disease resistance against biotrophic, hemibiotrophic, and necrotrophic pathogens that require different signaling pathways inand highlight a central role for salicylic acid., 2012, 160(3): 1630-1641.
[4] ZHANG Y, SHI X, LI B, ZHANG Q, LIANG W, WANG C. Salicylic acid confers enhanced resistance to Glomerella leaf spot in apple., 2016, 106(9): 64-72.
[5] CHEN X K, ZHANG J Y, ZHANG Z, DU X L, DU B B, QU S C. Overexpressing, 2012, 39(8): 8083-8089.
[6] 毛爱军, 王永健, 冯兰香, 耿三省, 许勇. 水杨酸等4种诱导剂诱导辣椒抗疫病作用的研究. 中国农业科学, 2004, 37(10): 1481-1486.
MAO A J, WANG Y J, FENG L X, GENG S X, XU Y. Study on the resistance induced by salicylic acid againstin Pepper., 2004, 37(10): 1481-1486. (in Chinese)
[7] 刘凤权, 王金生. 水杨酸诱导水稻幼苗抗白叶枯病研究. 植物保护学报,2000, 27(1): 48-52.
LIU F Q, WANG J S. Preliminary study on resistance of rice seedling to leaf blight induced by salicylic acid., 2000, 27(1): 48-52. (in Chinese)
[8] DONG C J, LI L, SHANG Q M, LIU X Y, ZHANG Z G. Endogenous salicylic acid accumulation is required for chilling tolerance in cucumber (L.) seedlings., 2014, 240(4): 687-700.
[9] 张计育, 渠慎春, 董畅, 高志红, 乔玉山, 章镇. 水杨酸诱导湖北海棠全长cDNA文库的构建及应用. 西北植物学报, 2010, 30(8): 1527-1533.
ZHANG J Y, LIANG S C, DONG C, GAO Z H, QIAO S Y, ZHANG Z. Utility and construction of full-length cDNA library ofpost-introduced with salicylic acid., 2010, 30(8): 1527-1533. (in Chinese)
[10] 瞿振芳, 符聪慧, 杨婷斐, 张军科. SA诱导对苹果叶片中基因表达的影响. 西北植物学报, 2013, 22(3): 103-109.
QU Z F, FU C H, YANG T F, ZHANG J K. The effects of SA induction on the expression ofgene in apple leaves., 2013, 22(3): 103-109. (in Chinese)
[11] 张颖, 李保华, 董向丽, 梁文星, 李桂舫, 王彩霞. 不同品种苹果叶片对外源水杨酸的生理响应. 核农学报, 2016, 30(5): 1005-1012.
ZHANG Y, LI B H, DONG X L, LIANG W X, LI G F, WANG C X. Physiological response of apple leaves from different cultivars to exogenous salicylic acid., 2016, 30(5): 1005-1012. (in Chinese)
[12] 罗昌国, 袁启凤, 裴晓红, 吴亚维, 郑伟, 章镇. 富士苹果基因克隆及其对白粉病的抗性分析. 西北植物学报, 2013, 33(12): 2382-2387.
LUO C G, YUAN Q F, PEI X H, WU Y W, ZHENG W, ZHANG Z. Cloning ofgene in Fuji apple and its response to powdery mildew stress., 2013, 33(12): 2382-2387. (in Chinese)
[13] MAGALI M, TIMOTHY W, GIULIO Z, GEORGE P, MIAOYING T, CHRISTOS N , SORINA P. Theoligopeptidasesandare salicylic acid targets that modulate SA-mediated signaling and the immune response., 2013, 76(4): 603-614.
[14] KINKEMA M, FAN W, DONG X. Nuclear localization ofis required for activation ofgene expression., 2000, 12(12): 2339-2350.
[15] NDAMVKONG I, ABDALLAT A A, THUROW C, FODE B, ZANDER M, WEIGEL R, GATZ C. SA-inducible Arabidopsis glutaredoxin interacts with TGA factors and suppresses JA-responsivetranscription., 2007, 50(1): 128-139.
[16] 田义, 张彩霞, 康国栋, 李武兴, 张利益, 从佩华. 植物转录因子研究进展. 中国农业科学, 2016, 49(4): 632-642.
TIAN Y, ZHANG C X, KANG G D, LI W X, ZHANG L Y, CONG P H. Progress ontranscription factors in plant., 2016, 49(4): 632-642. (in Chinese)
[17] CHARLES D, CATHERINE D, SARAH G, ENWU L, PIERRE R F. The/protein enhances the DNA binding activity of a subgroup of thefamily oftranscription factors., 2000, 12(2): 279-290.
[18] MANDAL S, MALLICK N, MITRA A. Salicylic acid-induced resistance tof. sp.in tomato., 2009, 47(7): 642-649.
[19] LI H, DURBIN R. Fast and accurate short read alignment with burrows-wheeler transform., 2009, 25(14): 1754-1760.
[20] LANGMEAD B, TRAPNELL C, POP M, SALZBERG S L. Ultrafast and memory-efficient alignment of short DNA sequences to the human genome., 2009, 10(3): 25-34.
[21] YE J, FANG L, ZHENG H, ZHANG Y, CHEN J, ZHANG Z, WANG J, LI S, LI R, BOLUND L, WANG J. WEGO: A web tool for plotting GO annotations., 2006, 34(7): W293-297.
[22] HE P, SHAN L B, SHEEN J. The use of protoplasts to study innate immune responses., 2007, 354: 1-9.
[23] VELASCO R, ZHARKIKH A, AFFOURTIT J, DHINGRA A, CESTARO A, et al. The genome of the domesticated apple (Borkh)., 2010, 42(10): 833-839.
[24] 谭国飞, 王枫, 贾晓玲, 李岩, 熊爱生. 芹菜甘露醇脱氢酶基因的分离与表达分析. 园艺学报, 2013, 40(11): 2189-2198.
TAN G F, WANG F, JIA X L, LI Y, XIONG A S. Isolation and expression of mannitol dehydrogenase gene in celery., 2013, 40(11): 2189-2198. (in Chinese)
[25] 刘威, 陈昊, 靳亚忠, 齐红岩. 高等植物醇脱氢酶及其基因家族研究进展. 植物生理学报, 2014, 50(10): 1479-1493.
LIU W, CHEN H, JIN Y Z, QI H Y. Advances in alcohol dehydrogenase enzymes and their gene families in higher plants., 2014, 50(10): 1479-1493. (in Chinese)
[26] 宋修鹏, 黄杏, 莫凤连, 田丹丹, 杨丽涛, 李杨瑞, 陈保善. 甘蔗苯丙氨酸解氨酶基因()的克隆和表达分析. 中国农业科学, 2013, 46(14): 2856-2868.
SONG X P, HUANG X, MO F L, TIAN D D, YANG L T, LI Y R, CHEN B S. Cloning and expression analysis of sugarcane phenylalanin ammonialyase () gene., 2013, 46(14): 2856-2868. (in Chinese)
[27] PENNING T M. Introduction and overview of the aldo-keto reductase superfamily., 2004, 865(12): 3-20.
[28] 左豫虎, 康振生, 杨传平, 芮海英, 娄树宝, 刘惕若. β-1,3葡聚糖酶和几丁质酶活性与大豆对疫霉根腐病抗性的关系. 植物病理学报, 2009, 39(6): 600-607.
ZUO Y H, KANG ZH S, YANG C P, RUI H Y, LOU S B, LIU X R. Relationship between activities of β-1, 3-glacanase and chitinase and resistance to phytophthora root rot in soybean., 2009, 39(6): 600-607. (in Chinese)
[29] PETERSEN M, BRODERSEN P, NAESTED H, ANDREASSON E, LINDHART U, JOHANSEN B, NIELSEN H B, LACY M, AUSTIN M J, PARKER J E, SHARMA S B, KLESSIG D F, MARTINSSEN R, MATTSSON O, JENSEN A B, MUNDY J.MAP kinase 4 negatively regulates systemic acquired resistance., 2000, 103(7): 1111-1120.
[30] ZHANG X, DONG J, LIU H, WANG J, QI Y, LIANG Z. Transcriptome sequencing in response to salicylic acid in., 2016, 11(1): e0147849.
[31] FRYE C A, TANG D, INNES R W. Negative regulation of defense responses in plants by a conserved MAPKK kinase., 2001, 98(1): 373-378.
[32] MAO G, MENG X, LIU Y, ZHENG Z, CHEN Z, ZHANG S. Phosphorylation of atranscription factor by two pathogen- responsive MAPKs drives phytoalexin biosynthesis in Arabidopsis., 2011, 23(4): 1639-1653.
[33] HUBERT D A, TORNERO P, BELKHADIR Y, KRISHNA P, TAKAHASHI A, SHIRASU K, DANGL J L. Cytosolicassociates with and modulates thedisease resistance protein., 2003, 22(21): 5679-5689.
[34] LI M, MA X, CHIANG Y H, YADETA K A, DING P, DONG L, ZHAO Y, LI X, YU Y, ZHANG L, SHEN Q H, XIA B, COAKER G, LIU D, ZHOU J M. Proline isomerization of the immune receptor-interacting protein RIN4 by a cyclophilin inhibits effector-triggered immunity in., 2014, 16(4): 473-483.
[35] HUANG S, MONAGHAN J, ZHONG X, LIN L, SUN T, DONG OX, LI X. HSP90s are required for NLR immune receptor accumulation in., 2014, 79(3): 427-439.
[36] HE P, SHAN L B, LIN N C, MARTIN GREGORY B, KEMMERLING B, NÜRNBERGER T, SHEEN J.Specific bacterial suppressors of MAMP signaling upstream of MAPKKK ininnate immunity., 2006, 125(3): 563-575.
[37] ESPLEY R V, BRENDOLISE C, CHAGNE D, KUTTY-AMMA S, GREEN S, VOLZ R, PUTTERILL J, SCHOUTEN H J, GARDINER S E, HELLENS R P, ALLAN A C.Multiple repeats of a promoter segment causes transcription factor autoregulation in red apples., 2009, 21(1): 168-183.
[38] TURCK F, ZHOU A, SOMSSICK I E. Stimulus-dependent, promoter- specific binding of transcription factorto its native promoter and the defense-related gene-in parsley., 2004, 16(10): 2573-2585.
[39] ROBATZEK S, SOMSSICH I E. Targets ofregulation during plant senescence and pathogen defense., 2002, 16(9): 1139-1149.
[40] CAO H, GLAZEBROOK J, CLARKE J D. The Arabidopsisgene that controls systemic acquired resistance encodes a novel protein containing ankyrin repeats., 1997, 88(1): 57-63.
[41] 周淼平, 杨学明, 姚金保, 张鹏, 余桂红, 马鸿翔. 过量表达拟南芥基因提高小麦纹枯病的抗性. 分子植物育种, 2012, 10(6): 655-661.
ZHOU M P, YANG X M, YAO J B, ZHANG P, YU G H, MA H X. Over-expression ofenhances resistance to wheat sharp eyespot in transgenic wheat., 2012, 10(6): 655-661. (in Chinese)
[42] CHAI J, LIU J, ZHOU J, XING D. Mitogen-activated protein kinase 6 regulatesgene expression and activation during leaf senescence induced by salicylic acid., 2014, 65(22): 6513-6528.
[43] FU Z Q, YAN S P, SALEH A, WANG W, RUBLE J, OKA N, MOHAN R, SPOEL S H, TADA Y, ZHENG N, DONG X N.andare receptors for the immune signal salicylic acid in plants., 2012, 486(7402): 228-232.
[44] ZWICKER S, MAST S, STOS V, PFITZNER A J, PFITZNER U M. Tobacco NIMIN2 proteins control PR gene induction through transient repression early in systemic acquired resistance., 2007, 8(4): 385-400.
[45] DELANEY T P, FRIDRICH L, RYALS J A.signal transduction mutant defective in chemically and biologically induced disease resistance., 1995, 92(14): 6602-6606.
[46] FRAISSINET T L, BALTZ R, CHONG J, KAUFFMANN S, FRITIG B, SAINDRENAN P. Two tobacco genes induced by infection, elicitor and salicylic acid encode glucosyltransferases acting on phenylpropanoids and benzoic acid derivatives, including salicylic acid., 1998, 437(3): 319-323.
[47] TAGUCHI G, YAZAWA T, HAYASHIDA N, OKAZAKI M. Molecular cloning and heterologous expression of novel glucosyltransferases from tobacco cultured cells that have broad substrate specificity and are induced by salicylic acid and auxin., 2001, 268(14): 4086-4094.
[48] CHENG F Y, ZAMSKI E, GUO W W, PHARR D M, WILLIAMSON J D. Salicylic acid stimulates secretion of the normally symplastic enzyme mannitol dehydrogenase: A possible defense against mannitol-secreting fungal pathogens., 2009, 230(6): 1093-1103.
[49] KIM Y H, BAE J M, HUH G H. Transcriptional regulation of the cinnamyl alcohol dehydrogenase gene from sweet potato in response to plant developmental stage and environmental stress., 2010, 29(7): 779-791.
[50] DENG W W, ZHANG M, WU J Q, JIANG Z Z, TANG L, LI Y Y, WEI C L, JIANG C J, WAN X C. Molecular cloning, functional analysis of three cinnamyl alcohol dehydrogenase (CAD) genes in the leaves of tea plant,., 2013, 170(3): 272-282.
[51] XIA X J, ZHOU Y H, SHI K, ZHOU J, FOYER C H, YU J Q. Interplay between reactive oxygen species and hormones in the control of plant development and stress tolerance., 2015, 66(10): 2839-2856.
[52] 孙旭东, 胡向阳, 杨永平. 拟南芥基因家族成员的分子和功能学比较. 植物分类与资源学报, 2015, 37(4): 463-471.
SUN X D, HU X Y, YANG Y P. Molecular and functional comparisons of reactive burst oxygen species gene family in., 2015, 37(4): 463-471. (in Chinese)
[53] USTUN S, BARTETZKO V, BORNKE F.Theeffector XopJtriggers a conditional hypersensitive response upon treatment of.leaves with salicylic acid.,2015, 6: 599.
[54] 白团辉, 马锋旺, 李翠英, 束怀瑞, 韩明玉.水杨酸对根际低氧胁迫八棱海棠幼苗活性氧代谢的影响. 园艺学报, 2008, 35(2): 163-168.
BAI T H, MA F W, LI C Y, SHU H R, HAN M Y. Effects of salicylic acid on reactive oxygen species metabolism inrehd under root-zone hypoxia stress., 2008, 35(2): 163-168. (in Chinese)
[55] TSUDA K, MINE A, BETHKE G, IGARASHI D, BOTANGA C J, TSUDA Y, GLAZEBROOK J, SATO M, KATAGIRI F. Dual regulation of gene expression mediated by extended MAPK activation and salicylic acid contributes to robust innate immunity in., 2013, 9(12): e1004015.
[56] PANDEY S P, SOMSSICH I E. The role oftranscription factors in plant immunity., 2009, 150(4): 1648-1655.
[57] PENG Y, BARHLEY L E, CHEN X, DARDICK C, CHERN M, RUAN R, CANLAS P E, RONALD P C. OsWRKY62 is a negative regulator of basal and Xa21-mediated defense againstpv.in rice., 2008, 1(3): 446-458.
[58] PENG Y, BARTLEY L E, CANLANS P, RONALD P C.transcription factors modulate rice innate immunity., 2010, 3(1): 36-42.
[59] PAUL J R, ANJA R, VOLKER L, BERNADETTE L, IMRE E S, Synthetic plant promoters containing defined regulatory elements provide novel insights into pathogen- and wound-induced signaling., 2002, 14(4): 749-762.
[60] SHEN J, FU J, MA J, WANG X, GAO C, ZHUANG C, WAN J, JIANG L. Isolation, culture, and transient transformation of plant protoplasts., 2014, 63(6): 2.8.1-17. doi: 10.1002/0471143030.cb0208s63.
[61] SU C F, WANG Y C, HSIEH T H, LU C A, TSENG T H, YU S M. A novel MYBS3-dependent pathway confers cold tolerance in rice., 2010, 153(1): 145-158.
[62] SHEEN J. Signal transduction in maize andmesophyll protoplasts., 2001, 127(4): 1466-1475.
[63] XU J, LU H D, CHEN L Q, WANG Y, LIU L L, HE L, WU W H. A protein kinase, interacting with two calcineurin B-like proteins, regulates K+transporter AKT1 in., 2006, 125(7): 1347-1360.
[64] RASKIN I. Salicylate, a new plant hormone., 1992, 99(3): 799-803.
[65] NAZAR R, UMAR S, KHAN N A. Exogenous salicylic acid improves photosynthesis and growth through increase in ascorbate- glutathione metabolism and S assimilation in mustard under salt stress., 2015, 10(3): e1003751.
[66] DONG C J, LI L, SHANG Q M, LIU X Y, ZHANG Z G. Endogenous salicylic acid accumulation is required for chilling tolerance in cucumber (L.) seedlings., 2014, 240(4): 687-700.
(责任编辑 赵伶俐)
Identification ofpromoter Specific Response to Salicylic Acid by Transcriptome Sequencing
QIU HuaRong, ZHOU QianQian, HE XiaoWen, ZHANG ZongYing, ZHANG ShiZhong, CHEN XueSen, WU ShuJing
(College of Horticultural Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology, Tai'an 271018, Shandong)
In order to explain the theoretical basis for disease resistance molecular mechanism mediated by SA, the influence of transcriptional regulation of apple leaves response to salicylic acid was studied, and the SA signaling pathway and its regulated genes were identified.The leaves of tissue culture apple ‘gala’ seedling growing under 24℃ for 30 d were treated with 2 mmol∙L-1SA (0.2% ethanol treatment as control) for 12 h. Then the transcriptome libraries was constructed by using Illumina HiSeqTM 2000 sequencing technique, and the regulated genes of SA signaling pathway were screened by integrated bioinformatics analysis which included differential genes screening, condition specificity analysis, GO classification and KEGG enrichment analysis. The promotor of the gene which was specific response to SA was cloned and promotor activity was identified by using protoplast transformation technique. The specific response of different nucleotide fragment of promotor was verified.The original data of 750 439 459 and 751 596 153 bp sequences was obtained from CTRL and SA treatment samples, Which were 44.77% and 43.88% perfect match with the ‘golden delicious’ apple genome sequence, respectively. The transcriptome data of SA treated samples suggested that 3 329 genes were significantly expressed, including the genes related to biosynthesis of secondary metabolites pathway (the key enzyme of lignin synthetic pathway CAD, cytochrome P450, β-1,3-glucanase related to fungal resistance), the important functional genes involved in plant-pathogen pathway (calmodulin CaM, disease resistance protein RPM1, heat shock protein HSP90, WRKY transcription factors) and 33 condition specificity genes (NAC transcription factors, NIM1, WRKY40, Ethylene responsive factors and so on). Among them, 1 085 genes were up-regulated and 2 244 genes were down-regulated. Differentially expressed genes were participated in cellular process, metabolic process, binding, catalytic activity and so on. According to the transcriptome data, the promotor ofwas cloned into the expression vector and placed in the upstream of the luciferase gene. After transforming the vector to apple protoplasts, the luciferase activity of SA treated samples was 20.6 times of the control samples, and the SA treated samples did not affected by ABA, JA or ACC, only showed the specific response to SA. The results suggested that the promotor sequence was specially response to SA in apple. Different segments of the promoter with different response ability to SA. The region 500-1 000 bp of the promoter, which located in the upstream of the WRKY40 transcription start site ATG, only was response to high concentrations of SA and no response to low concentrations of SA. For 1 500 bp sequence, the response ability to high SA concentrations was enhanced significantly, but just slightly increased with low SA concentration. The length of the 2 000 bp nucleotide fragment had a significant response to both the high and low concentrations of SA and achieved the strongest ability level. Compared to 2 000 bp fragment, the 2 500 bp fragment didn’t show further enhanced response to SA. Overexpression of the MdWRKY40 protein inhibited its own transcription.The DEGs obtained under 2 mmol∙L-1SA treatment in apple leaves were involved in biosynthesis of phenylpropanoid and flavonoid, plant-pathogen interaction and plant hormone signal transduction pathways. The 2 500 bp nucleotide promotor sequence upstream of WRKY40 open reading frame was specific response to SA. There were unknown nucleotide sequences between 1 000-1 500 bp and 1 500-2 000 bp that significantly enhanced the sensitivity of the promoter response to SA, and the transcription regulation ofexisted a feedback suppression mechanism.
SA; apple; transcriptome; signaling transduction; plant-pathogen interaction
2017-05-07;接受日期:2017-08-21
国家自然科学基金(31272132)、山东省泰山学者工程启动基金(tshw20120712)
邱化荣,E-mail:qiu516@126.com。通信作者陈学森,Tel:0538-8249338;E-mail:chenxs@sdau.edu.cn。通信作者吴树敬,Tel:0538-8246220;E-mail:wushujing666@163.com

