外源6-BA对两种氮素水平下小麦幼苗叶片光合性能及内源激素含量的影响
杨东清,董文华,骆永丽,2,宋文挺,蔡铁,李勇,尹燕枰,王振林
外源6-BA对两种氮素水平下小麦幼苗叶片光合性能及内源激素含量的影响
杨东清1,董文华1,骆永丽1,2,宋文挺1,蔡铁3,李勇1,尹燕枰1,王振林1
(1山东农业大学农学院/作物生物学国家重点实验室,山东泰安 271018;2山东农业大学生命科学学院,山东泰安 271018;3西北农林科技大学农学院,陕西杨凌 712100)
在盆栽和大田种植条件下,研究两种氮素水平与喷施外源细胞分裂素(6-BA)对小麦幼苗叶片叶绿素含量、光合参数、叶绿素荧光参数、硝酸还原酶(NR)和谷氨酰胺合成酶(GS)活性和内源激素含量、产量和其构成因素的影响,为外源激素调控苗期小麦生长提供理论依据。选用济麦22(JM22)为试验材料,盆栽种植条件下,设置低浓度氮(0.63 mmol·L-1)、高浓度氮(3.75 mmol·L-1)和叶面喷施清水、30 mg·L-1的6-苄基腺嘌呤(6-BA)及300 mg·L-1的洛伐他汀(Lovastatin)6个喷施组合处理,即高氮下喷清水的对照(HN)、高氮下喷施外源细胞分裂素(HN+6-BA)、高氮下喷施细胞分裂素合成抑制剂(HN+Lov)、低氮下喷清水的对照(LN)、低氮下喷施外源细胞分裂素(LN+6-BA)、低氮下喷施细胞分裂素合成抑制剂(LN+Lov)。处理后每隔3 d,测定叶绿素含量、光合参数、叶绿素荧光参数、GS和NR活性、内源激素含量。大田条件下,设置低施氮量(120 kg·hm-2,N1)、常规施氮量(240 kg·hm-2,N2)、叶面喷施清水、30 mg·L-1的6-BA和300 mg·L-1的Lovastatin 6个喷施组合处理,即N1、N1+6-BA、N1+Lov、N2、N2+6-BA、N2+Lov。于成熟期测定籽粒产量、单位面积穗数、千粒重和穗粒数。盆栽条件下,与对照相比,喷施外源6-BA显著提高了小麦幼苗地上部植株干重;喷施抑制剂Lovastatin则显著降低小麦幼苗地上部植株干重。与对照HN和LN相比,处理后12d,HN+6-BA和LN+6-BA两处理的植株干重分别提高21.39%、43.92%。与对照HN相比,HN+6-BA处理显著提高了叶片气孔导度(s)、蒸腾速率(r)、胞间二氧化碳浓度(i)、净光合速率(n);处理后12 d,HN+6-BA处理的s、r、N、i分别提高68.32%、58.66%、30.72%、51.61%。高氮水平的叶绿素a(Chl a)、叶绿素b(Chl b)分别比低氮水平高103.39%、94.44%。与对照HN相比,HN+6-BA处理显著提高了9—12 d Chl a含量和3—12 d 的叶片Chl b含量。高低氮水平下,喷施Lovastatin均显著降低了Chl a和Chl b含量。高低氮水平下,喷施6-BA显著体高了叶片硝酸还原酶(NR)和谷氨酰胺合成酶(GS)活性,而外喷Lovastatin则显著降低了叶片NR及GS活性。快速叶绿素a荧光诱导动力学分析表明外源6-BA处理改变了OJIP曲线。与对照HN相比,HN+6-BA显著提高了Ψo和PIabs,降低了Wk和Vj值。与对照LN处理相比,LN+6-BA处理的Wk和Vj分别降低22.09%和36.05%。外源6-BA对小麦幼苗叶片内源激素含量影响显著。与对照HN相比,HN+6-BA显著提高了3—12 d 叶片Zt含量和6—12 d叶片IAA含量。喷施6-BA显著降低了叶片ABA含量,而Lovastatin处理则显著提高了叶片ABA含量。大田试验结果表明,与对照N1和N2相比,喷施外源6-BA显著提高了小麦籽粒产量,N1+6-BA和N2+6-BA处理的籽粒产量分别提高10.48%和16.61%。外源6-BA与氮素配合施用,通过提高内源Zt含量,降低内源ABA含量,一方面提高了Chl a及CHl b含量和NR及GS活性,进而改善了叶片氮素同化能力和光能捕获、传递转化能力;另一方面提高了PSII反应中心电子传递链供体侧和受体侧的电子传递能力,进而改善了改善光系统性能,提高叶片光合性能,叶片积累较多的光合产物,从而提高苗期地上部植株干重,最终提高了籽粒产量。
小麦苗期;氮素;激素;光合作用;叶绿素a荧光
0 引言
【研究意义】冬小麦生育时期中幼苗期是形成根、叶片、分蘖等器官的重要时期,是培育壮苗、为夺取小麦高产奠定基础的关键时期,而此阶段也是小麦对土壤氮素含量的敏感期[1-2]。因此,研究小麦壮苗发育的生理机制及其对栽培措施的响应,对小麦品种选育、生育前期栽培管理等具有重要理论参考意义。【前人研究进展】氮素是作物生长发育必需的营养元素,氮肥运筹和施肥技术的改善是获取作物高产的重要措施[3-4]。前人研究表明适当增施氮肥可显著提高作物叶片叶绿素含量,提高抗氧化酶活性,延缓衰老,提高小麦光合性能[5-6]。但近年来研究发现过高的氮肥投入对作物产量提升的作用减弱,不仅使得氮肥利用率降低[7],而且流失的氮素进入水体、大气,造成环境污染[8-9]。此外,过高的施氮量也不利于作物个体的生长发育,研究表明基肥施氮量过大导致小麦苗期分蘖发生增多,生育后期小麦植株个体间相互遮挡,群体中下部透光弱[10],降低植株茎秆木质素含量,导致茎秆细弱抗倒伏能力降低[11]。因此,研究氮肥农艺管理措施对小麦高产高效生产有重要意义[12]。植物激素如细胞分裂素(CTK)、生长素(IAA)、脱落酸(ABA)等在作物生长发育中,尤其在氮素吸收代谢进程中起着重要作用[13-14]。同时,氮素供应也影响内源激素的合成代谢,两者相互作用调控作物发育[15]。增加氮素供给可促进细胞分裂素合成[16],细胞分裂素则增强硝酸还原酶活性,提高叶片氮素同化能力[17]。低氮素下茎中IAA向根系运输,且根系中IAA合成增强,促使根系伸长[18-19]。氮肥和CTK对谷子植株发育有显著交互作用[20]。外源CTK与适量氮肥配合施用可提高小麦花后叶片的光合性能,提高籽粒产量[21]。【本研究切入点】施氮对小麦生长发育影响的研究已有报道,但外源细胞分裂素对不同氮素水平下小麦苗期叶片光合性能、内源激素和产量形成的影响需要深入研究。【拟解决的关键问题】通过分析不同氮素水平与外源6-BA配合对小麦产量及产量构成因素、苗期地上部植株干重、叶片叶绿素含量、硝酸还原酶和谷氨酰胺合成酶活性、荧光参数和内源激素含量等影响,研究两种氮素水平下外源激素改善幼苗光合性能的生理机制,以期为喷施外源激素调控小麦生长提供理论依据。
1 材料与方法
1.1 试验设计
试验包括室外大田试验和室内营养液培养试验。田间试验于2014—2015年在山东省泰安市山东农业大学农学试验农场进行。试验地耕层(0—20 cm)土壤含有机质14.7 g·kg-1、全氮1.24 g·kg-1、速效氮87.2 mg·kg-1、速效磷9.6 mg·kg-1、速效钾85.3 mg·kg-1。选用济麦22(JM22)为试验材料,种植密度为300×104株/hm2。前茬为玉米,籽粒收货后秸秆全部田。采用随机区组设计,以氮肥为主区,喷施激素为副区。试验以尿素作氮源设2个施氮水平,以纯氮计,低施氮量120 kg·hm-2、常规施氮量240 kg·hm-2。于小麦3叶期(GS13[22]),分别于7:00和19:00叶面喷施浓度为30 mg·L-1的人工合成细胞分裂素(6-BA)和300 mg·L-1洛伐他汀(lovastatin)(一种细胞分裂素合成抑制剂),清水为对照,6-BA和lovastatin试剂的溶解及喷施浓度分别参照Xu等[23]和Crowell等[24]的方法。试验共设置6个处理,即N1、N1+6-BA、N1+Lov、N2、N2+6-BA、N2+Lov。为使激素能更好地附着于叶片,激素及清水均含0.5%的吐温-20,连续喷施2 d。试验小区面积9 m2,各小区10行种植,行距0.25 m,行长3 m,随机区组排列。磷肥用量为100 kg P2O5·hm-2,钾肥用量为100 kg K2O·hm-2。播种前基施50%氮肥和全部磷钾肥,拔节期(GS31)追施50%氮肥。其他田间管理同一般高产田。
室内试验的小麦种植于RXZ-500D人工气候培养箱(宁波江南仪器厂,浙江宁波市)。小麦种子用1%次氯酸钠浸泡30 min,再用去离子水冲洗多次去除残留次氯酸钠,在去离子水中浸泡催芽。挑选大小一致露白的种子,以珍珠岩代替土壤,种植于塑料花盆中(高15 cm,直径15 cm),每盆播种10株,花盆放置在塑料盒(50 cm×40 cm×10 cm)中,每盒6盆。每盒倒入1.5 L营养液,每日更换。营养液成分如下:以硝酸铵为氮源,设置高氮(3.75 mmol·L-1)和低氮(0.63 mmol·L-1)两个水平。营养液其他成分分别为4 mmol CaCl2,5 mmol KCl,4 mmol MgSO4,1 mmol KH2PO4,25 μmol Fe–EDTA,0.5 μmol H3BO3,0.74 μmol MnSO4,0.27 μmol ZnSO4,0.001 μmol CuSO4,0.001 μmol CoCl2,0.005 μmol Na2MoO4。气候箱内温湿度及光照变化如图1所示。小麦生长至3叶期时,分别于气候箱设定时间的7:00和19:00叶面喷施浓度为30 mg·L-1的6-BA和300 mg·L-1的lovastatin,以喷施清水为对照,共6个喷施组合处理,即HN、HN+6-BA、HN+Lov、LN、LN+6-BA、LN+Lov。为使激素能更好地附着于叶片,用0.5%Tween20混合于激素溶液中。每处理6盆,3次重复。
1.2 室内试验测定项目和方法
室内试验中每处理选取小麦植株基部全展开叶10片,用于测定叶绿素组分含量、光合参数、荧光参数和内源激素含量。
1.2.1 叶片叶绿素组分测定 参考赵世杰等[25]的方法,测定叶片叶绿素a(Chl a)和叶绿素b(Chl b)含量。
1.2.2 光合参数测定 采用Li-6400便携式光合仪(Li-Cor Inc.,USA)测定叶片净光合速率(n,μmol CO2·m-2·s-1)、气孔导度(s,mmol·m-2·s-1)、胞间CO2浓度(i,μmol·mol-1)和蒸腾速率(r,mmol H2O·m-2·s-1)。测定时使用开放式气路系统,选用红蓝2叶室,叶室温度设定为25°C,光照强度为1 200 μmol·m-2·s-1。
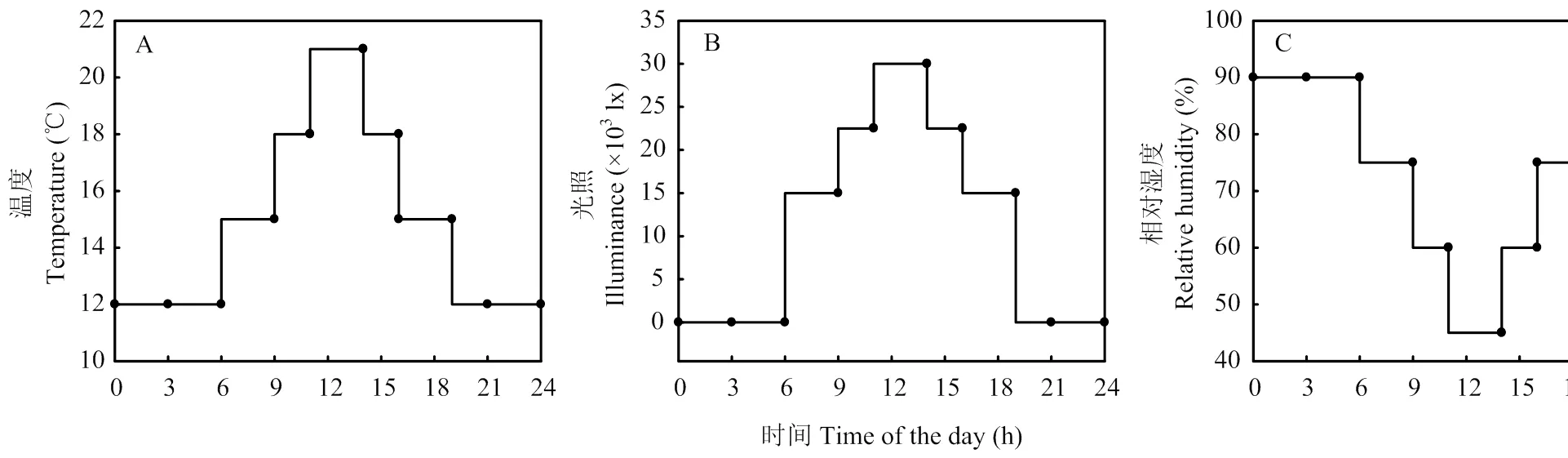
图1 人工气候箱中温度、光照、相对湿度变化
1.2.3 荧光参数测定 参考Strasser[26]和Schansker等[27]的方法测定并计算叶片快速叶绿素荧光动力学参数。测定前夹上夹子,叶片暗适应30 min。然后用Handy-PEA植物效率分析仪(Hansatech, UK)测定叶片快速叶绿素荧光动力学曲线(O-J-I-P曲线)。以下为本试验用到的荧光参数:Fo(20 μs 测得的荧光,O相);Fk(300 μs 时荧光,K 相);Fj(2 ms 时荧光,J 相);Fi(30 ms 时荧光, I 相);Fm(最大荧光, P 相);Vk、 Vj、Vi(K、J、、I相的相对可变荧光);Wk(相对可变荧光Fk占Fj- Fo振幅的比例);Ψo(捕获的激子将电子传递到电子传递链中超过QA的其他电子受体的概率);PIabs(PIabs=RC/ABS×[φPo/(1-φPo)]×[ψo/(1-ψo)],以吸收光能为基础的光化学性能指数)。
1.2.4 叶片内源激素含量测定 采用高效液相色谱法(HPLC)测定叶片中4种内源激素的含量[28]。流动相为甲醇﹕乙腈﹕0.6%乙酸(50﹕45﹕5,v/v),所用分析柱为Symmetry C18(150 mm×4.6 mm,5 μm),柱温为25℃,流动相流速0.6 mL·min-1,检测波长为254 nm。玉米素、赤霉素、生长素、脱落酸标样均购自美国Sigma公司。
1.2.5 植株干重测定 每处理取5株,3次重复,60℃下烘干至恒重。
1.3 大田试验测定项目和方法
成熟期各处理选取不带边行的1 m2小麦,统计穗数、穗粒数,3次重复,收获后脱粒,晾干至恒重称量。
1.4 数据统计分析
用DPS7.05统计分析软件对数据进行方差分析和显著性检验(LSD法),用SigmaPlot 10.0进行作图。
2 结果
2.1 田间条件下喷施外源6-BA及其抑制剂对小麦籽粒产量及其构成因素的影响
由表1可以看出,常规施氮量处理的穗数、穗粒数、千粒重、籽粒产量均显著高于低氮肥处理。与对照N1、N2处理相比,喷施外源6-BA显著提高了小麦籽粒产量,N1+6-BA和N2+6-BA处理的籽粒产量分别提高10.48%和16.61%,这是由于喷施外源6-BA显著提高了产量构成因素中的单位面积穗数和穗粒数;与对照N1、N2处理相比,N1+6-BA和N2+6-BA处理的单位面积穗数分别提高12.74%和12.31%。与对照N1、N2处理相比,喷施抑制剂lovastatin降低了单位面积穗数,显著提高了穗粒数,但对籽粒千粒重和产量无显著性影响。
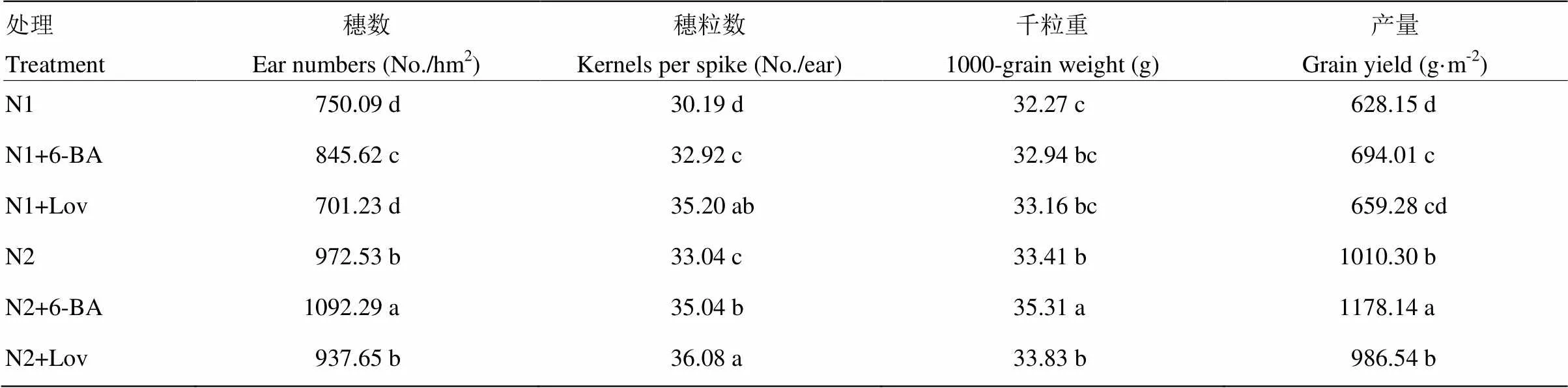
表1 细胞分裂素及其抑制剂对小麦籽粒产量及其构成因素的影响
不同字母表示0.05水平差异显著。下同 Values followed by different letters mean significant at 0.05 level. The same as below
2.2 室内条件下喷施外源6-BA及其抑制剂对小麦植株地上部干重的影响
从图2可知,喷施外源6-BA及其抑制剂lovastatin后,小麦地上部植株干重随着时间推移呈逐渐增加的趋势(图2),高氮水平下的植株干重显著高于低氮水平。与对照HN、LN相比,喷施外源6-BA显著提高了小麦植株干重,HN+6-BA、LN+6-BA处理12 d后的植株干重分别提高21.39%、43.92%,而喷施抑制剂lovastatin显著降低了小麦植株干重,HN+Lov、LN+Lov处理后12 d的植株干重分别降低58.55%、30.69%。由此表明,细胞分裂素可促进小麦植株地上部光合产物的积累。
2.3 喷施外源6-BA及其抑制剂对小麦叶片叶绿素含量的影响
由表2可以看出,高氮水平的叶绿素a(Chl a)、叶绿素b(Chl b)含量均显著高于低氮水平,12 d后Chl a、Chl b含量分别提高103.39%、94.44%。与对照HN处理相比,外源6-BA显著提高了9—12 d Chl a含量和3—12 d Chl b含量;处理后12 d,Chl a和Chl b含量分别提高35.83%和48.57%;与对照LN相比,LN+6-BA处理12 d后Chl a和Chl b含量分别提高35.59%和83.33%。与对照HN、LN相比,喷施lovastatin显著降低了Chl a和Chl b含量,HN+Lov、LN+Lov处理后12 d的Chl a和Chl b含量分别降低45.00%和79.66%、45.71%和88.89%。这表明内源细胞分裂素能促进叶绿素a及叶绿素b的合成,尤其是促进叶绿素b的合成。
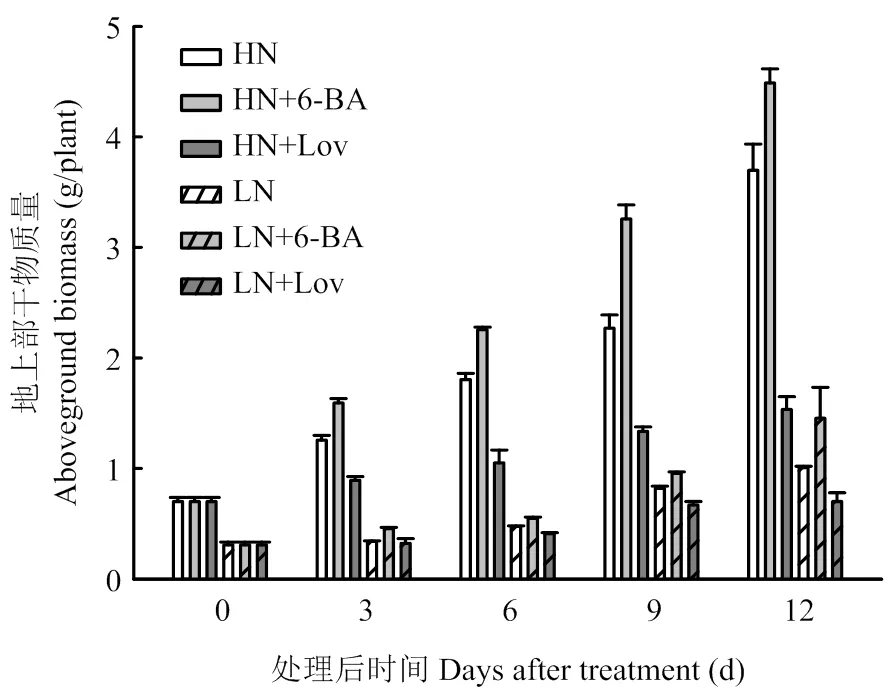
HN、HN+6-BA、HN+Lov、LN、LN+6-BA、LN+Lov分别表示高氮下喷清水的对照、高氮下喷施外源细胞分裂素、高氮下喷施细胞分裂素合成抑制剂、低氮下喷清水的对照、低氮下喷施外源细胞分裂素、低氮下喷施细胞分裂素合成抑制剂
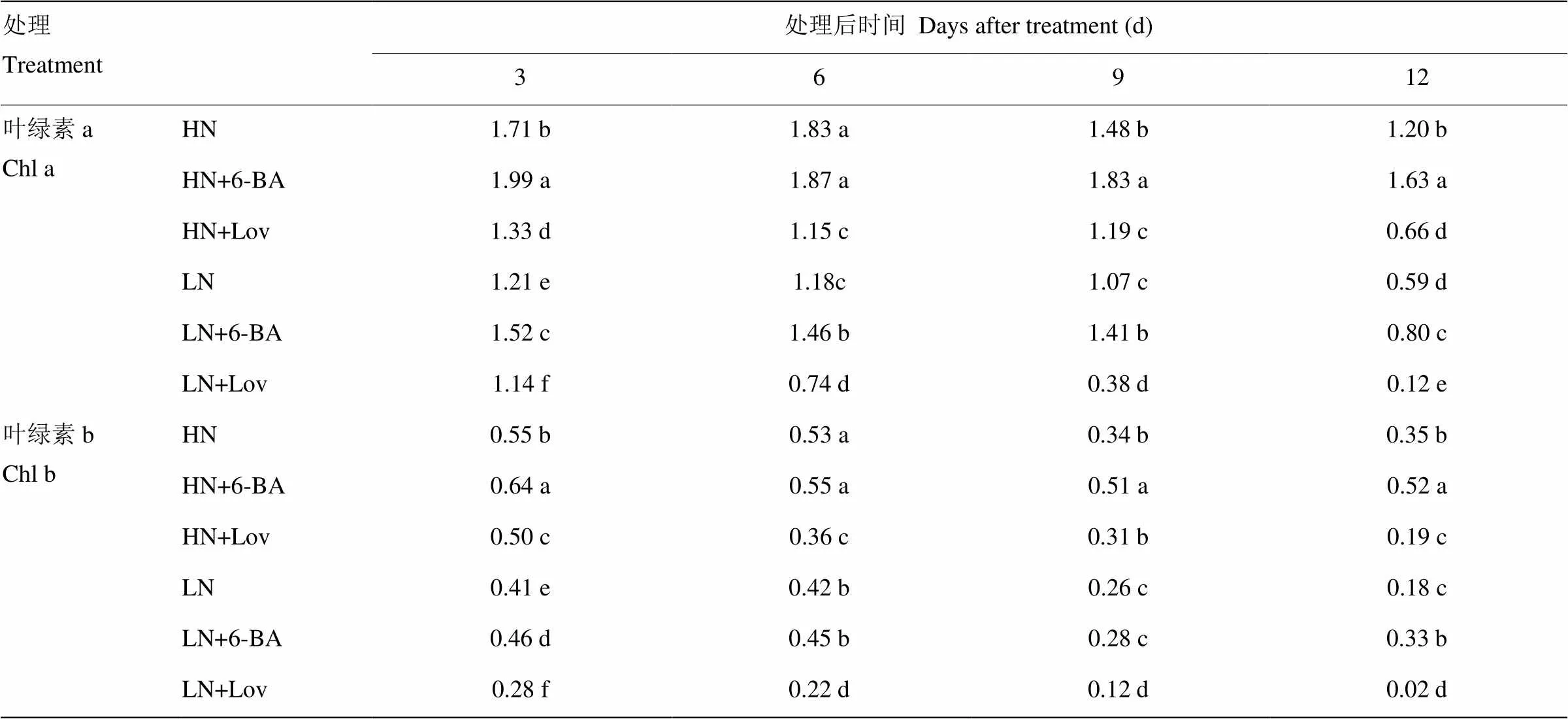
表2 细胞分裂素及其抑制剂对小麦叶片叶绿素组分含量的影响
2.4 喷施外源6-BA及其抑制剂对小麦叶片光合性能的影响
由图3可知,喷施外源6-BA及其抑制剂3—12 d,各处理叶片气孔导度(s)基本不变,而叶片蒸腾速率(r)呈升高趋势。与对照HN处理相比,HN+6-BA处理显著提高了叶片s、r、i、n;处理后12 d,s、r、n、i分别提高68.32%、58.66%、30.72%、51.61%;但与对照LN处理相比,LN+6-BA处理显著降低了叶片的r及i。与对照HN、LN相比,喷施lovastatin显著降低了s、r、n。
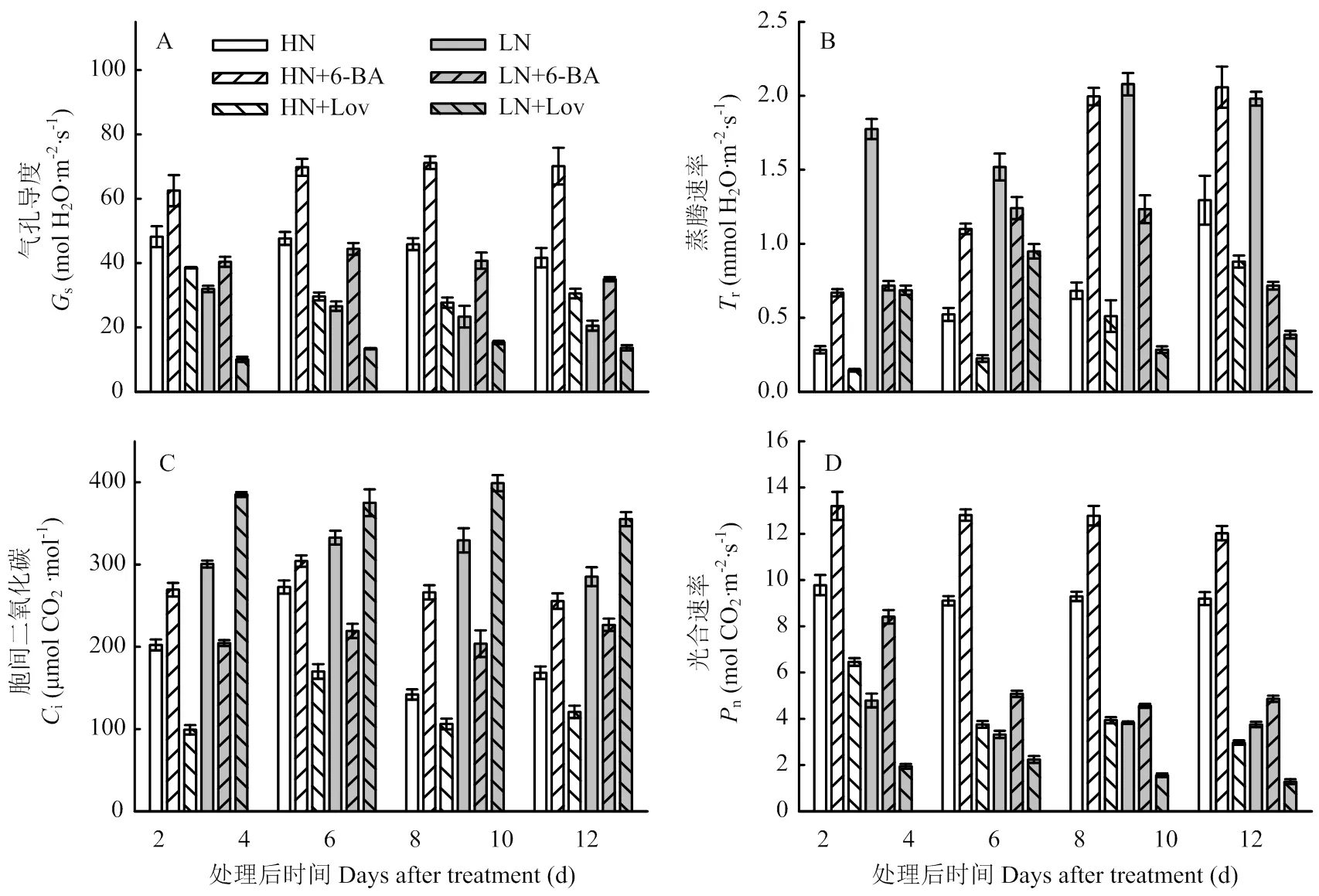
图3 细胞分裂素及其抑制剂对小麦叶片光合参数的影响
2.5 喷施外源6-BA及其抑制剂对小麦叶片荧光特性的影响
2.5.1 快速叶绿素a荧光诱导动力学曲线及拐点的变化 由图4可以看出,与对照HN、LN相比,喷施外源6-BA使OJIP曲线下降,而喷施抑制剂lovastatin处理使OJIP曲线上升,处理后12 d,曲线中出现明显的拐点K(图4-A,C)。以HN+6-BA处理的OJIP曲线作为参照,将其他处理的OJIP曲线标准化,结果表明,低氮水平在J(2 ms)点和I(30 ms)点的荧光强度明显高于高氮水平(图4-B,D)。喷施lovastatin明显提高了叶片J点和I点相对可变荧光值。与HN+6-BA相比,LN+Lov处理的J点和I点荧光值较高。与对照LN相比,LN+6-BA处理明显降低了叶片J点和I点荧光。值得注意的是处理后3 d,与HN+6-BA处理相比,LN+Lov处理的OJIP曲线在30 ms(I点)附近上升最明显,而处理后12 d,LN+Lov处理的OJIP曲线在2 ms(J点)附近上升最明显。各处理相比,J点的荧光强度趋势表现为:LN+Lov>LN>HN+Lov>LN+6-BA>HN>HN+6-BA。
2.5.2 不同处理对荧光参数的影响 处理后0—12 d,各处理捕获的激子将电子传递到电子传递链中QA下游的其他电子受体的概率(Ψo)和以吸收光能为基础的性能指数(PIabs)总体表现为下降的趋势;而K点的可变荧光Fk占振幅Fo- Fj的比例(Wk)和J点的可变荧光Fj占振幅Fo- Fp的比例(Vj)总体表现为上升的趋势(图5)。
与对照HN、LN相比,喷施6-BA显著提高了Ψo和PIabs,显著降低了Wk和Vj值;处理后12 d,HN+6-BA处理的Ψo和PIabs分别提高24.69%和64.82%;Wk和Vj分别降低37.52%和15.46%。处理后12 d,LN+6-BA处理的Ψo和PIabs分别提高42.38%和194.07%;Wk和Vj分别降低22.09%和36.05%。与对照HN、LN相比,喷施lovastatin显著降低了Ψo和PIabs,而显著提高了Wk和Vj。
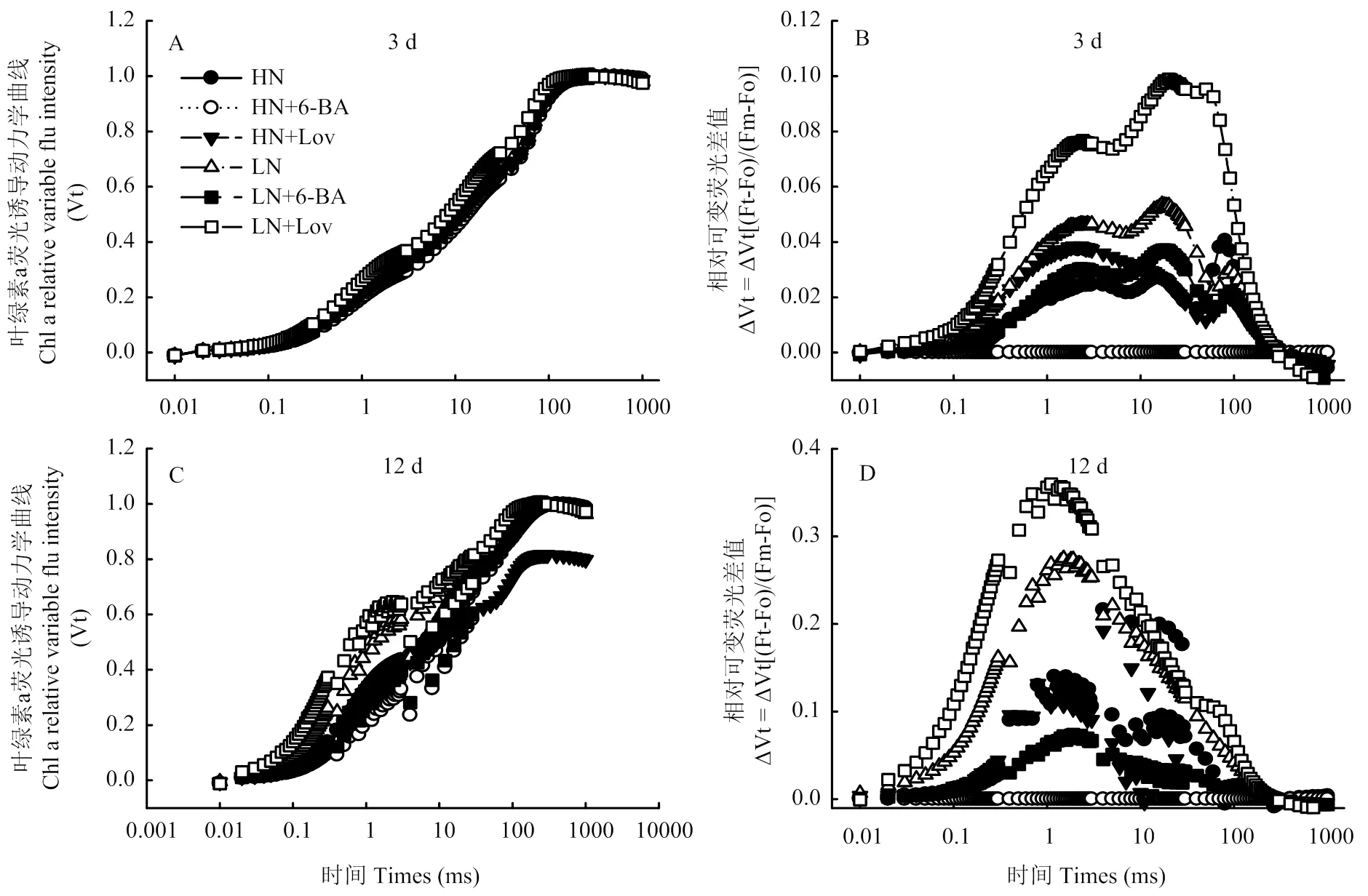
图4 细胞分裂素及其抑制剂对叶片快速叶绿素荧光诱导动力学曲线、相对可变荧光差值(ΔVt)的影响
2.6 喷施外源6-BA及其抑制剂对小麦叶片内源激素含量的影响
处理后0—12 d,叶片内源玉米素(Zt)含量在3 d含量最高,之后呈逐渐降低的趋势(图6-A)。与对照HN、LN相比,喷施6-BA显著提高了3—12 d叶片Zt含量,处理后12 d,HN+6-BA、LN+6-BA处理叶片Zt含量分别提高108.71%和138.50%。与对照HN、LN相比,喷施lovastatin显著降低了内源Zt含量,处理后12 d,HN+Lov和LN+Lov处理叶片Zt含量分别降低59.70%和79.91%。
高氮水平的叶片赤霉素(GA3)含量呈双峰变化趋势,分别在处理后3、9 d有峰值;低氮水平的叶片GA3含量呈先升高后降低趋势,其含量在处理后6 d有最大值(图6-B)。与对照HN、LN相比,喷施6-BA显著降低了3—12 d叶片GA3含量;处理后12 d,HN+6-BA和LN+6-BA处理叶片GA3含量分别降低14.79%和8.03%,喷施lovastatin则显著提高了叶片GA3含量,处理后12 d,HN+Lov和LN+Lov处理叶片GA3含量分别提高73.02%和22.57%。
处理后0—12 d,叶片内源生长素(IAA)含量呈先升高后降低的变化趋势(图6-C)。与对照HN相比,HN+6-BA降低了处理后3 d的叶片IAA含量,但显著提高了其6—12 d含量;与对照LN相比,LN+6-BA降低了处理后3—6 d 叶片IAA含量,但提高了其叶片9—12 d含量;与对照HN、LN相比,喷施lovastatin则显著降低了叶片IAA含量,HN+Lov处理后12 d IAA含量降低14.61%,LN+Lov处理后12 d叶片IAA含量降低18.65%。
处理后0—12 d,叶片内源脱落酸(ABA)含量呈先升高后降低的变化趋势(图6-D)。与对照HN、LN相比,喷施6-BA显著降低了3—12 d叶片ABA含量;处理后12 d,HN+6-BA和LN+6-BA处理叶片ABA含量分别降低25.04%和29.40%。喷施lovastatin则显著提高了叶片ABA含量,处理后12 d,HN+Lov和LN+Lov处理叶片ABA含量分别提高18.32%和20.20%。
2.7 喷施外源6-BA及其抑制剂对小麦叶片硝酸还原酶(NR)与谷氨酰胺合成酶(GS)活性的影响
处理后0—15 d,小麦叶片硝酸还原酶(NR)及谷氨酰胺合成酶(GS)活性呈先上升后下降趋势。与对照HN、LN相比,喷施6-BA显著提高了叶片NR及GS活性;处理后15 d,HN+6-BA和LN+6-BA处理叶片NR、GS活性分别提高40.60%、48.56%和82.90%、43.03%。外喷抑制剂lovastatin则显著降低了叶片NR及GS活性,处理后15 d,HN+Lov和LN+Lov处理叶片NR、GS活性分别降低64.81%、25.47%和57.31%、57.67%(图7)。
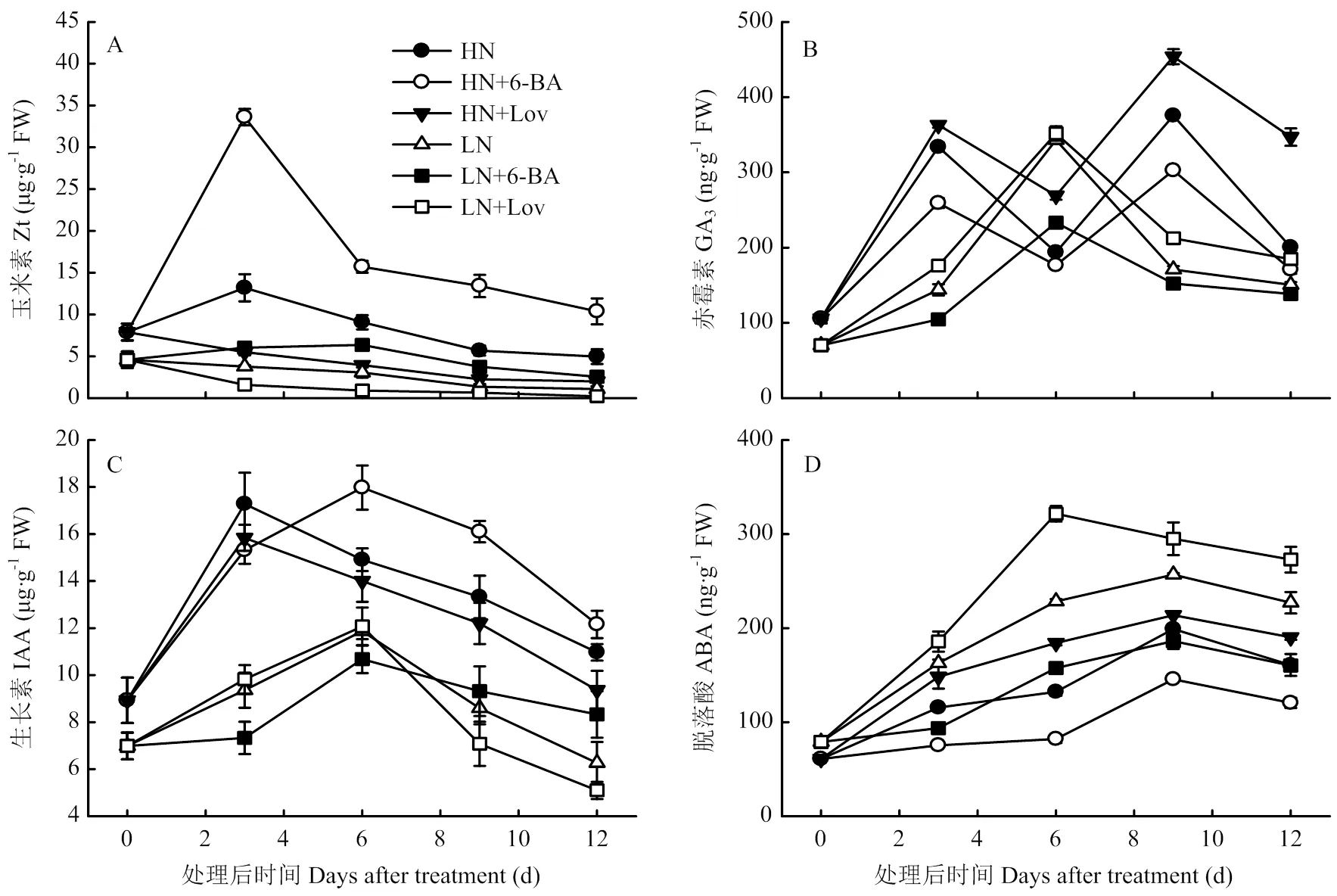
图6 细胞分裂素及其抑制剂对小麦叶片内源激素含量的影响
2.8 小麦叶片内源激素含量与光合参数及综合性能指数的关系
由表3相关分析结果表明,叶片内源玉米素(Zt)含量与净光合速率(n)、气孔导度(s)呈极显著正相关关系,与胞间二氧化碳浓度(i)、蒸腾速率(r)相关性不显著。赤霉素(GA3)含量与i呈显著负相关关系,与n、s、r无显著性相关关系。生长素(IAA)含量与n、s呈极显著正相关关系,脱落酸(ABA)含量则与n、s呈极显著负相关关系,与i呈显著性正相关关系。综合性能指数(PIabs)是反映植物光合机构活性最敏感的指标,相关分析结果表明PIabs与叶片内源Zt、IAA含量呈极显著正相关关系;PIabs与ABA含量呈极显著负相关关系,与GA3含量的相关不显著(图8)。这表明提高内源Zt、IAA含量,降低ABA含量,有利改善小麦幼苗期叶片光合机构活性,提高叶片光合速率。
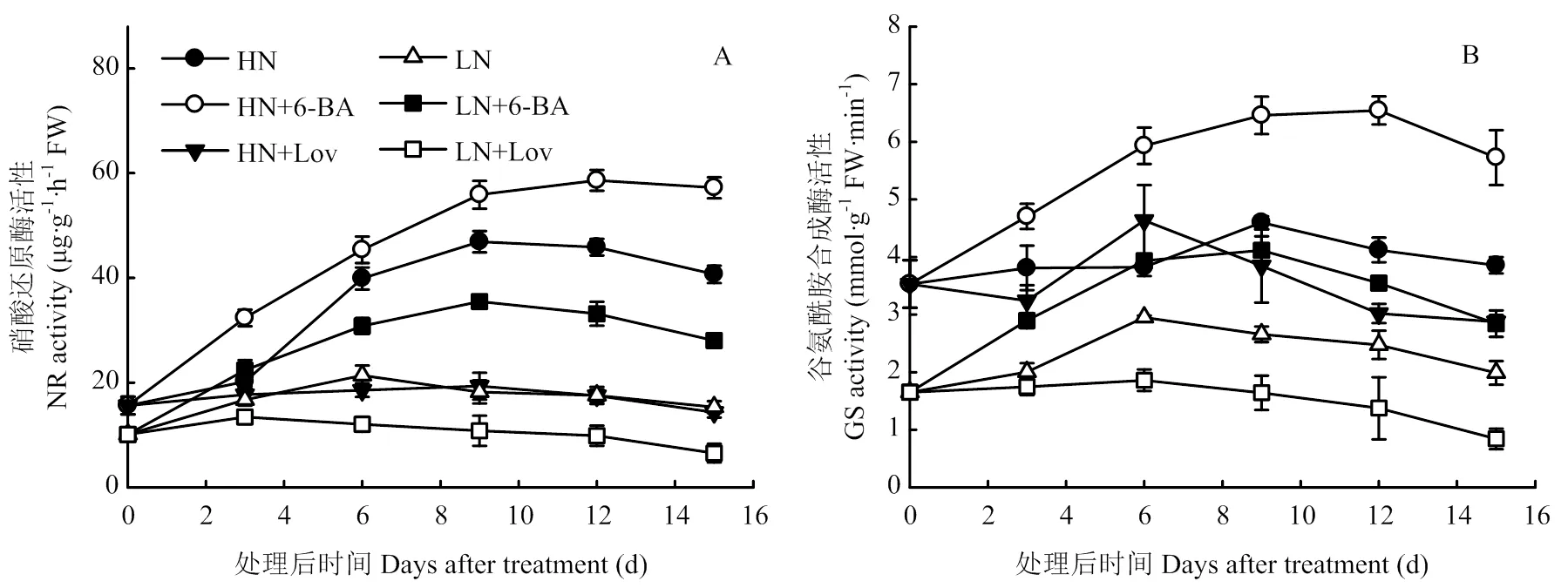
图7 细胞分裂素及其抑制剂对小麦叶片NR及GS活性的影响
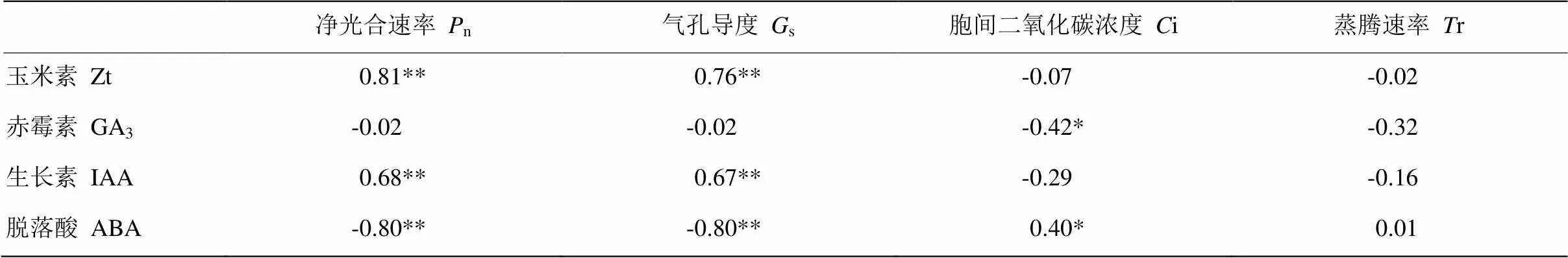
表3 叶片内源激素含量与光合参数的相关性
*,0.05水平差异显著;**,0.01水平差异显著
*, ** represent significant differences at 0.05 and 0.01 levels
2.9 小麦叶片内源激素含量与硝酸还原酶(NR)与谷氨酰胺合成酶(GS)活性关系
相关分析结果表明,叶片内源Zt、IAA含量与硝酸还原酶(NR)、谷氨酰胺合成酶(GS)活性呈显著或极显著正相关关系(图9);GA3含量与NR、GS活性相关关系不显著;内源脱落酸ABA含量与NR、GS活性呈二次曲线相关关系且达显著水平。由此说明,提高叶片内源Zt或IAA含量,有利叶片氮素合成代谢,而叶片ABA含量过高不利叶片氮素合成代谢。

图8 叶片内源激素与综合性能指数的相关关系
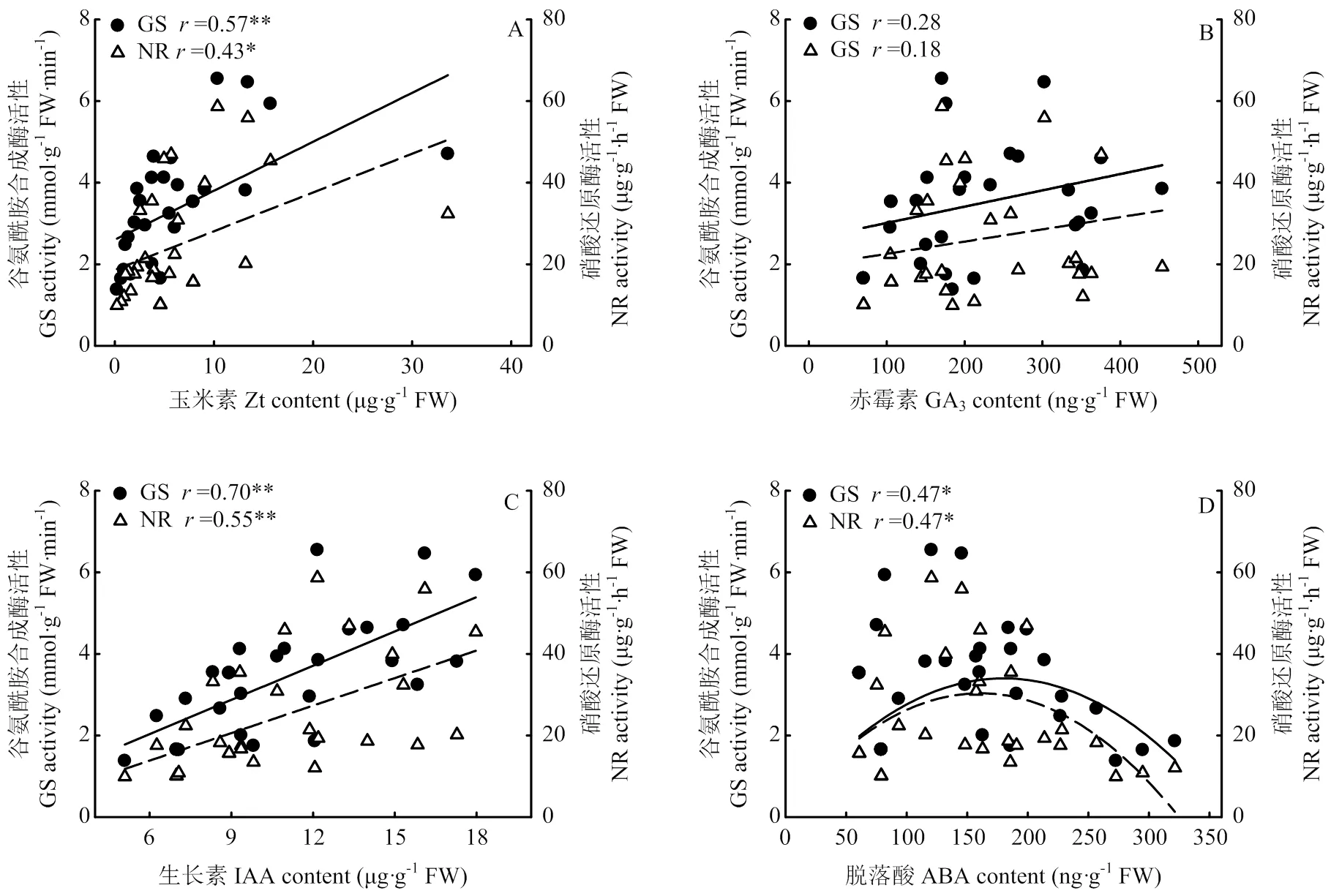
图9 小麦叶片内源激素含量与谷氨酰胺合成酶及硝酸还原酶活性的关系
3 讨论
3.1 喷施外源6-BA对小麦籽粒产量的调控效应
小麦苗期的植株生长情况是生育中后期生长的基础,调控苗期植株发育对中后期植株个体和群体的发展起决定作用。前人研究表明产量三要素中粒重、穗粒数、单位面积穗数可被氮肥运筹和外源生长调节剂等的栽培措施调控[4, 10, 21]。本研究中与低施氮量相比,常规施氮量显著提高了小麦单位面积穗数、穗粒数和千粒重,显著提高籽粒产量。一方面,前人研究发现,增施氮肥可促进分蘖节中细胞分裂素的合成,有利分蘖的发生,促进了分蘖的发育成穗,最终提高单位面积穗数[29-30]。另一方面较高的氮肥供应促进了小麦穗高位小花的发育,减少了不孕小穗数,提高结实率,最终穗粒数显著提高[31]。再者,增大施氮量提高了籽粒中淀粉合成酶活性,可促进粒籽粒灌浆,提高籽粒粒重[32]。两种施氮量水平下喷施外源6-BA显著提高了小麦籽粒产量,这是由于外源6-BA显著提高了小麦单位面积穗数和穗粒数。分析原因后认为,外源细胞分裂素可提高分蘖节和分蘖芽中内源细胞分裂素的含量,有利于分蘖芽从休眠转向萌发转换,促进分蘖芽的生长[29]。Zheng等[33]的研究结果表明外源6-BA降低了小麦穗中部和基部小穗的小花退化速率,提高了小花结实率,最终提高了穗粒数。
3.2 喷施外源6-BA对小麦苗期叶片光合和荧光特性的调控效应
植物干物质积累主要来源于叶片的光合作用,而绿色植物则通过光合膜上的叶绿素蛋白复合体利用光能进行光合作用。本试验研究结果表明两种氮素水平下喷施6-BA处理均提高了小麦苗期地上部干物质积累量,喷施抑制剂降低了地上部干物质积累量。这是由于外源6-BA处理的叶片气孔导度较高,且净光合速率高于对照处理,叶片制造的光合产物较多地积累在植株中。叶片较高的叶绿素含量有利于光合作用[34],两种氮素水平下喷施外源6-BA提高了叶绿素a(Chl a)和叶绿素b(Chl b)含量。一方面细胞分裂素可促进叶绿素循环及PSII相关关键基因的上调表达,维持色素蛋白复合体的稳定,减少叶绿素降解[35]。另一方面细胞分裂素可提高叶绿素合成中间产物5-氨基酮戊酸的合成速率,进而有利叶绿素的合成[36]。
Chl a和Chl b是叶绿素的两种重要组分。Chl a 可吸收和传递光能,少数激发态Chl a 具有光化学活性,能将光能转化为电能[37]。Chl b 不具有光化学活性,但可吸收和传递光能,调控捕光天线大小及维持其稳定[38]。适量增加氮肥供应可提高PSII的活性和光化学最大效率,提高表观光合作用电子传递速率,降低非辐射能量耗散,使叶片所吸收的光能较充分地用于光合作用[39]。本研究采用快速荧光动力学分析方法,结果表明与低氮水平相比较,高氮水平的Chl a 荧光诱导动力学曲线发生改变,低氮水平的J点和I点相对可变荧光值升高,而高氮水平则降低了Wk和Vj数值,提高了Ψo值,这说明提高氮素供应可减弱放氧复合体损伤,显著提高PSII反应中心电子传递链供体侧和受体侧的电子传递能力。前人研究认为植物光合机构的发育与功能维持都有细胞分裂素的参与调控[40]。提高内源细胞分裂素含量可阻止光合蛋白复合体的降解[41]。低氮素条件下喷施外源6-BA也可降低Wk和Vj数值,提高Ψo和PIabs值,表明喷施外源细胞分裂素可修复因氮素供应减少导致的放氧复合体损伤,提高PSII反应中心电子传递链供体侧和受体侧的电子传递能力。相关性分析表明内源Zt含量与净光合速率、气孔导度、光系统性能指数PIabs呈极显著正相关,ABA含量与净光合速率、气孔导度、PIabs呈极显著负相关关系。喷施抑制剂lovastatin降低了内源Zt含量,提高了ABA含量,这进一步证明了喷施外源6-BA能提高叶片内源Zt含量,降低ABA含量,有利于改善叶片光系统性能,提高叶片光合能力。
3.3 喷施外源6-BA对小麦苗期叶片谷氨酰胺合成酶(GS)和硝酸还原酶(NR)活性的调控效应
硝酸还原酶(NR)和谷氨酰胺合成酶(GS)是氮素同化的关键酶[42]。较高的氮素同化酶活性有利于叶片保持较高的光合性能[43]。Krouk[44]研究认为氮素与激素信号通路之间是双向连接的关系,氮素依赖其浓度影响植物发育进程,而激素可反馈调控植物对氮素的转运和积累。有研究认为细胞分裂素(CTK)、生长素(IAA)、脱落酸(ABA)参与了硝酸盐信号系统调控植株整体水平的发育[45]。有研究表明较高的氮素供应可促进细胞分裂素合成关键基因的上调表达,从而促进细胞分裂素的合成[46]。施用外源细胞分裂素则可提高氮素高亲和力转运系统相关基因的表达,促进氮素由根系向地上部运输[47]。有研究认为氮素浓度对根、茎内源ABA含量无显著性影响,且氮素信号系统是否与内源ABA含量变化有关尚不明确,然而,近年来,越来越多的证据表明ABA参与了氮素信号系统[13]。Signora等[48]研究发现ABA在参与调控氮素影响植物根系发育中起重要作用。本研究发现两种氮素水平下喷施外源6-BA显著提高了GS和NR活性,喷施抑制剂lovastatin则显著降低了两种酶活性。两种氮素平下喷施6-BA提高了叶片内源Zt含量,降低ABA含量,喷施抑制剂lovastatin则降低了叶片内源Zt含量,提高了ABA含量。相关性分析表明叶片Zt和IAA含量均与GS和NR活性呈极显著或显著性线性正相关关系,内源ABA含量则与GS和NR活性呈显著性二次曲线关系,这表明内源Zt、IAA和ABA含量变化在氮素同化中起重要作用。喷施外源细胞分裂素通过调节内源Zt、IAA、ABA含量,进而调控GS和NR活性。
4 结论
喷施外源6-BA处理提高了叶片内源Zt和IAA含量,降低了ABA含量,一方面提高了叶片Chl a、Chl b含量和NR和GS活性,从而提高叶片氮素同化能力和光能捕获、传递转化能力;另一方面提高了PSII反应中心电子传递链供体侧和受体侧的电子传递能力,提高光系统II活性,最终改善叶片的光合性能,幼苗能够积累更多的光合产物,提高地上部植株干重。低氮与外源6-BA配合使用可修复因氮素供应减少而导致的光系统性能降低,提高小麦幼苗植株干重。因此苗期喷施外源6-BA可促进幼苗发育成壮苗,提高小麦穗数和穗粒数,提高籽粒产量。
[1] 翟丙年, 李生秀. 氮素对冬小麦生长发育及产量的亏缺和补偿效应. 植物营养与肥料学报, 2005, 11(3): 308-313.
Zhai B N, Li S X. Response to nitrogen deficiency and compensation on growth and yield of winter wheat., 2005, 11(3): 308-313. (in Chinese)
[2] 翟丙年, 李生秀. 冬小麦水氮配合关键期和亏缺敏感期的确定. 中国农业科学, 2005, 38(6): 1188-1195.
Zhai B N, Li S X. Study on the key and sensitive stage of winter wheat responses to water and nitrogen coordination., 2005, 38(6): 1188-1195. (in Chinese)
[3] 彭少兵, 黄见良, 钟旭华, 杨建昌, 王光火, 邹应斌, 张福锁, 朱庆森, Roland B, Christian W. 提高中国稻田氮肥利用率的研究策略. 中国农业科学, 2002, 35(9): 1095-1103.
Peng S B, Huang J L, Zhong X H, Yang J C, Wang G H, Zou Y B, Zhang F S, Zhu Q S, Roland B, Christian W. Research strategy in improving fertilizer-nitrogen use efficiency of irrigated rice in China., 2002, 35(9): 1095-1103. (in Chinese)
[4] 田纪春, 陈建省, 王延训, 张永祥. 氮素追肥后移对小麦籽粒产量和旗叶光合特性的影响. 中国农业科学, 2001, 34(1): 1-4.
Tian J C, Chen J X, Wang Y X, Zhang Y X. Effects of delayed nitrogen application on grain yield and photosynthetic characteristics in flag leaves of wheat cultivars., 2001, 34(1): 1-4. (in Chinese)
[5] Zhang X C, Yu X F, Ma Y F. Effect of nitrogen application and elevated CO2on photosynthetic gas exchange and electron transport in wheat leaves., 2013, 51(4): 593-602.
[6] Herrera J M, Noulas C, Feil B, Stamp P, Liedgens M. Nitrogen and genotype effects on root growth and root survivorship of spring wheat., 2013, 176(4): 561-571.
[7] Raun W R, Johnson G V. Improving nitrogen use efficiency for cereal production., 1999, 91(3): 357-363.
[8] 张维理, 武淑霞, 冀宏杰, Kolbe H. 中国农业面源污染形势估计及控制对策 I. 21世纪初期中国农业面源污染的形势估计. 中国农业科学, 2004, 37(7): 1008-1017.
Zhang W L, Wu S X, Ji H J, Kolbe H. Estimation of agricultural non-point source pollution in China and the alleviating strategies I. Estimation of agricultural non-point source pollution in China in early 21 century., 2004, 37(7): 1008-1017. (in Chinese)
[9] Zhu Z L, Chen D L. Nitrogen fertilizer use in China– Contributions to food production, impacts on the environment and best management strategies., 2002, 63(2): 117-127.
[10] 肖凯, 张荣铣, 钱维朴. 氮素营养对小麦群体光合碳同化作用的影响及其调控机制. 植物营养与肥料学报, 1999, 5(3): 235-243.
Xiao K, Zhang R X, Qian W P. The effect and regulation mechanism of nitrogen nutrition on canopy photosynthetic carbon assimilation in wheat., 1999, 5(3): 235-243. (in Chinese)
[11] 陈晓光, 石玉华, 王成雨, 尹燕枰, 宁堂原, 史春余, 李勇, 王振林. 氮肥和多效唑对小麦茎秆木质素合成的影响及其与抗倒伏性的关系. 中国农业科学, 2011, 44(17): 3529-3536.
Chen X G, Shi Y H, Wang C Y, Yin Y P, Ning T Y, Shi C Y, Li Y, Wang Z L. Effects of nitrogen and PP333 application on the lignin synthesis of stem in relation to lodging resistance of wheat., 2011, 44(17): 3529-3536. (in Chinese)
[12] Hawkesford M J. Reducing the reliance on nitrogen fertilizer for wheat production., 2014, 59(3): 276-283.
[13] Santner A, Calderon-Villalobos L I, Estelle M. Plant hormones are versatile chemical regulators of plant growth., 2009, 5(5): 301-307.
[14] Kiba T, Kudo T, Kojima M, Sakakibara H. Hormonal control of nitrogen acquisition: Roles of auxin, abscisic acid, and cytokinin., 2011, 62(4): 1399-1409.
[15] Krouk G, Ruffel S, Gutiérrez R A, Gojon A, Crawford N M, Coruzzi G M, Lacombe B. A framework integrating plant growth with hormones and nutrients., 2011, 16(4): 178-182.
[16] Kamada-Nobusada T, Makita N, Kojima M, Sakakibara H. Nitrogen-dependent regulation of de novo cytokinin biosynthesis in rice: The role of glutamine metabolism as an additional signal., 2013, 54(11): 425-432.
[17] Criado M V, Caputo C, Roberts I N, Castro M A, Barneix A J. Cytokinin-induced changes of nitrogen remobilization and chloroplast ultrastructure in wheat ()., 2009, 166(16): 1775-1785.
[18] Ma W Y, Li J J, Qu B Y, He X, Zhao X Q, Li B, Fu X D, Tong Y P. Auxin biosynthetic geneis involved in low nitrogen-mediated reprogramming of root architecture in., 2014, 78(1): 70-79.
[19] Ljung K. Auxin metabolism and homeostasis during plant development., 2013, 140(5): 943-950.
[20] 冯志威, 杨艳君, 郭平毅, 原向阳, 宁娜. 谷子光合特性及产量最优的氮磷肥水平与细胞分裂素6-BA组合研究. 植物营养与肥料学报, 2016, 22(3): 634-642.
FENG Z W, YANG Y J, GUO P Y, YUAN X Y, NING N. Optimum combining rate of N and P fertilizer with 6-BA for highest photosynthetic efficiency and yield in foxtail millet., 2016, 22(3): 634-642. (in Chinese)
[21] 骆永丽, 杨东清, 尹燕枰, 崔正勇, 李艳霞, 陈金, 郑孟静, 王玉竹, 庞党伟, 李勇, 王振林. 外源6-BA和不同用量氮肥配合对小麦花后叶片功能与荧光特性的调控效应. 中国农业科学, 2016, 49(6): 1060-1083 .
Luo Y L, Yang D Q, Yin Y P, Cui Z Y, Li Y X, Chen J, Zheng M J, Wang Y Z, Pang D W, Li Y, Wang Z L. Effects of exogenous 6-BA and nitrogen fertilizer with varied rates on function and fluorescence characteristics of wheat leaves post anthesis., 2016, 49(6): 1060-1083. (in Chinese)
[22] Zadoks J C, Chang T T, Konzak C F. A decimal code for the growth stages of cereals., 1974, 14(6): 451-421.
[23] Xu J X, Zha M R, Li Y, Ding Y F, Chen L, Ding C Q, Wang S H. The interaction between nitrogen availability and auxin, cytokinin, and strigolactone in the control of shoot branching in rice (L.)., 2015, 34(9): 1647-1662.
[24] Crowell D N, Salaz M S. Inhibition of growth of cultured tobacco cells at low concentrations of lovastatin is reversed by cytokinin., 1992, 100(4): 2090-2095.
[25] 赵世杰, 史国安, 董新纯. 植物生理学实验指导. 北京: 中国农业科学技术出版社, 1988: 55-57.
Zhao S J, Shi G A, Dong X C.. Beijing: China Agricultural Science and Technology Press, 1998: 55-57. (in Chinese)
[26] Strasser B J. Donor side capacity of Photosystem II probed by chlorophyll a fluorescence transients., 1997, 52(2): 147-155.
[27] Schansker G, Srivastava A, Govindjee, Strasser R J. Characterization of the 820 nm transmission signal paralleling the chlorophyll a fluorescence rise (OJIP) in pea leaves., 2003, 30(7): 785-796.
[28] Zhao M R, Han Y Y, Feng Y N, Li F, Wang W. Expansins are involved in cell growth mediated by abscisic acid and indole-3-acetic acid under drought stress in wheat., 2012, 31(4): 671-685.
[29] Liu Y, Ding Y, Wang Q S, Meng D X, Wang S H. Effects of nitrogen and 6-benzylaminopurine on rice tiller bud growth and changes in endogenous hormones and nitrogen., 2011, 51(2): 786-792.
[30] Alzueta I, Abeledo L G, Mignone C M, Miralles D J. Differences between wheat and barley in leaf and tillering coordination under contrasting nitrogen and sulfur conditions., 2012, 41(4): 92-102.
[31] Ferrante A, Savin R, Slafer G A. Floret development of durum wheat in response to nitrogen availability., 2010, 61(5): 4351-4359.
[32] 徐云姬, 张伟杨, 钱希旸, 李银银, 张耗, 杨建昌. 施氮量对小麦籽粒灌浆的影响极其生理机制. 麦类作物学报, 2015, 35(8): 1119-1126.
Xu Y J, Zhang W Y, Qian X Y, Li Y Y, Zhang H, Yang J C. Effect of nitrogen on grain filling of wheat and its physiological mechanism., 2015, 35(8): 1119-1126. (in Chinese)
[33] Zheng C F, Zhu Y J, Zhu H J, Kang G Z, Guo T C, Wang C Y. Floret development and grain setting characteristics in winter wheat in response to pre-anthesis applications of 6-benzylaminopurine and boron., 2014, 169: 70-76.
[34] Buttery B R, Buzzell R I. The relationship between chlorophyll content and rate of photosynthesis in soybeans., 1977, 57(1): 1-5.
[35] Talla S K, Panigrahy M, Kappara S, Nirosha P, Neelamraju S, Ramanan R. Cytokinin delays dark-induced senescence in rice by maintaining the chlorophyll cycle and photosynthetic complexes., 2015, 67(6):1839-1851.
[36] Yaronskaya E, Vershilovskaya I, Poers Y, Alawady A E, Averina N, Grimm B. Cytokinin effects on tetrapyrrole biosynthesis and photosynthetic activity in barley seedlings., 2006, 224(3): 700-709.
[37] Katz J J, Norris J R, Shipman L L, Thurnauer M C, Wasielewski M R. Chlorophyll function in the photosynthetic reaction center., 1978, 7(1): 393-434.
[38] 郭春爱, 刘芳, 许晓明. 叶绿素b缺失与植物的光合作用. 植物生理学通讯, 2006, 42(5): 967-973.
Guo C A, Liu F, Xu X M. Chlorophyll-b deficient and photosynthesis in plants., 2006, 42(5): 967-973. (in Chinese)
[39] 张旺锋, 勾玲, 王振林, 李少昆, 余松烈, 曹连莆. 氮肥对新疆高产棉花叶片叶绿素荧光动力学参数的影响. 中国农业科学, 2003, 36(8): 893-898.
Zhang W F, Gou L, Wang Z L, Li S K, Yu S L, Cao L P. Effect of nitrogen on chlorophyll fluorescence of leaves of high-yielding cotton in Xinjiang., 2003, 36(8): 893-898. (in Chinese)
[40] Dani S K G, Fineschi S, Michelozzi M, Francesco L. Do cytokinins, volatile isoprenoids and carotenoids synergically delay leaf senescence?, 2016, 39(5): 1103-1111.
[41] Rivero R M, Gimeno J, Van Deynze A, Walia H, Blumwald E. Enhanced cytokinin synthesis in tobacco plants expressing PSARK:: IPT prevents the degradation of photosynthetic protein complexes during drought., 2010, 51(11): 1929-1941.
[42] Lam H M, Coschigano K T, Oliveira I C, Melo-Oliveira R, Coruzzi G M. The molecular-genetics of nitrogen assimilation into amino acids in higher plants., 1996, 47(1): 569-593.
[43] Xu Z Z, Zhou G S. Nitrogen metabolism and photosynthesis inin response to long-term soil drought., 2006, 25(3): 252-266.
[44] Krouk G. Hormones and nitrate: a two-way connection., 2016, 91(6): 599-606.
[45] Foyer C H, Parry M, Noctor G. Markers and signals associated with nitrogen assimilation in higher plants., 2003, 54(382): 585-593.
[46] Sakakibara H, Takei K, Hirose N. Interactions between nitrogen and cytokinin in the regulation of metabolism and development., 2006, 11(9): 440-448.
[47] Collier M D, Fotelli M N, Nahm M, Kopriva S, Rennenberg H, Hanke D E, Gebler A. Regulation of nitrogen uptake by Fagus sylvatica on a whole plant level–interactions between cytokinins and soluble N compounds., 2003, 26(9): 1549-1560.
[48] Signora L, De Smet I, Foyer C H, Zhang H M. ABA plays a central role in mediating the regulatory effects of nitrate on root branching in., 2001, 28(6): 655-662.
(责任编辑 杨鑫浩)
Effects of Exogenous 6-BA on Photosynthetic Characteristics and Endogenous Hormone Content in Wheat Leaves Under Two Nitrogen Application Levels at Seedling Stage
YANG DongQing1, DONG WenHua1,LUO YongLi1, 2, SONG WenTing1, CAI Te3, LI Yong1, YIN YanPing1, WANG ZhenLin1
(1College of Agronomy, Shandong Agricultural University/State Key Laboratory of Crop Biology, Tai’an 271018, Shandong;2College of Life Sciences, Shandong Agricultural University, Tai’an 271018, Shandong;3College of Agronomy, Northwest A&F University, Yangling 712100, Shaanxi)
The purpose of this study was to test the effects of nitrogen concentrations and spraying exogenous cytokinin (6-BA) on photosynthetic characteristics, chlorophyll a fluorescence, nitrate reductase (NR) and glutamine synthetase (GS) activities, changes of endogenous hormones in leaves of wheat at seedling stage and grain yield, and then provide a theoretical basis for improving the development of winter wheat seedlings.Wheat (Jimai 22) was sown in the field and pot culture experiments with two nitrogen levels ( N1, 120 kg·hm-2; N2, 240 kg·hm-2) and modified Hoagland nutrient solutions containing two nitrogen levels (HN, 3.75 mmol·L-1; LN, 0.63 mmol·L-1), respectively. 6-BA (30 mg·L-1) and lovastatin (300 mg·L-1) were sprayed to the whole plants at a rate of 100 mL·m-2at the three-leaf stage. Ten wheat plants were sampled at 3 d intervals to test chlorophyll contents, NR and GS activities, photosynthetic parameters (s,r,iandn), chlorophyll fluorescence parameters (Wk, Vj, Ψoand PIabs), and endogenous hormones. In addition, grain yield, kernels per spike, 1000-grain weight, and ear numbers were determinedat maturity stage.The above ground biomass (AGBM) was significantly increased by exogenous 6-BA treatment in the pot experiment. Conversely, application of lovastatin significantly decreased AGBM. Compared with HN treatment, AGBM under HN+6-BA treatment increased by 21.39% at 12 days after treatment (DAT), and that of LN+6-BA treatment increased by 43.92%, compared with LN treatment. Application of 6-BA significantly increased values ofs,r,iandnunder high nitrogen condition. Especially,s,r,nandiincreased by 68.32%、58.66%、30.72%、51.61% at 12 DAT, respectively. Chl a increased by application of 6-BA at 9 to 12 DAT, while content of Chl b has significantly increased by exogenous 6-BA from 3 to 12 DAT. Conversely, both Chl a and Chl b have significantly decreased by application of lovastatin. Compared with HN treatment, HN+6-BA treatment significantly increased the activity of nitrate reductase (NR) and glutamine synthetase (GS). While application of lovastatin significantly decreased NR and GS activity. Exogenous 6-BA treatments changed the fast chlorophyll fluorescence induction kinetics curves. Application of 6-BA significantly increased Ψoand PIabs, and decreased Wkand Vj. Wkand Vjdecreased by 22.09% and 36.05%, respectively, under LN+6-BA treatment, compared with LN treatment. Application of 6-BA significantly increased Zt content from 3 to 12 DAT, increased IAA content from 6 to 12 DAT, and decreased ABA content. However, spraying exogenous lovastatin obviously increased ABA content. Application of 6-BA significantly increased grain yield in the field experiment. Compared with N1 and N2, grain yield of N1+6-BA and N2+6-BA increased by 10.48% and 16.61%, respectively.Exogenous 6-BA increased aboveground biomass due to increasing the leaf photosynthesis and nitrogen assimilation through regulating endogenous hormones contents to enhance chlorophyll content and NR and GS activity, and to improve the electron transfer capability of both the donor and the acceptor sides at PSII reaction center resulting in improved PSII performance. Grain yield has significantly increased under 6-BA combined with nitrogen application treatments.
wheat seedling; nitrogen; hormone; photosynthetic characteristics; chlorophyll a fluorescence
2017-02-27;接受日期:2017-07-07
国家重点基础研究发展计划(“973”计划)(2015CB150404)、国家重点研发计划(2016YFD0300400)、山东省泰山产业领军人才项目、山东省农业重大应用技术创新课题、山东省高等学校科技计划(J14LF12)、作物生物学国家重点实验室开放课题基金(2016KF04)
杨东清,E-mail:chengyang2364@126.com。董文华,E-mail:whdong105@126.com。杨东清和董文华为同等贡献作者。通信作者王振林,E-mail:zlwang@sdau.edu.cn

