干预FoxM1表达对食管癌细胞增殖、周期及凋亡的影响
陈 洁,严晓娣,张东升,钱红运,陈瑞娇,周方正
干预FoxM1表达对食管癌细胞增殖、周期及凋亡的影响
陈 洁1,严晓娣2,张东升1,钱红运3,陈瑞娇3,周方正1
目的探讨干预FoxM1表达对食管癌细胞增殖、细胞周期及凋亡的影响。方法选择FoxM1高表达食管癌细胞株,构建FoxM1-shRNA干扰质粒转染食管癌细胞,观察干预FoxM1表达对食管癌细胞增殖、细胞周期及凋亡的影响。结果成功转染后细胞中FoxM1蛋白水平表达明显降低(t=13.17,P<0.01),细胞增殖明显受抑并呈时间依赖性,72 h抑制效果最显著(68.0%±6.4%,P<0.05);干预组细胞增殖周期发生G1期阻滞(59.14%±1.69%vs40.51%±1.45%,t=14.23,P<0.01)、细胞凋亡增加(2.48%±0.49%vs35.37%±0.56%,t=76.56,P<0.01)。结论干预FoxM1表达使细胞周期发生G1期阻滞并能促进细胞凋亡,从而抑制TE1细胞增殖,FoxM1可能是食管癌基因治疗潜在的有效靶点。
食管癌;叉头框转录因子M1;基因沉默;细胞增殖;细胞凋亡
食管癌是最常见的恶性肿瘤之一,列肿瘤相关死亡因素第三位,全球每年新发病例约48万,死亡病例约40万,且发病率呈逐年上升的趋势[1]。我国是全球食管癌高发地区之一,以食管鳞癌(esophageal squamous cell carcinoma,ESCC)占绝大多数[1, 2]。尽管采取积极手术、放化疗等多途径联合治疗,但绝大多数患者仍死于肿瘤局部复发及远处转移[3]。
新近研究发现叉头框转录因子M1 ( forkhead box protein M1, FoxM1)作为一种增生相关的转录因子,在食管癌细胞中表达具有一定特异性及敏感性,被认为是食管癌特异性治疗的潜在靶点[4]。本文采用RNA干扰(RNA interference, RNAi)技术,以特异性shRNA下调FoxM1表达,观察其对食管癌细胞增殖、周期等生物学活性的影响,探讨其靶向治疗价值,为食管癌靶向治疗提供理论依据。
1 材料与方法
1.1 细胞株来源与细胞培养 正常食管上皮细胞株(HEEC)及食管癌细胞株(Eca109、TE1、TE7、TE2)均购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。用含10%胎牛血清的DMEM培养基培养液(美国Invitrogen公司),在孵箱(37 ℃、5%CO2)中贴壁培养,细胞基本铺满瓶底时传代。
1.2 细胞转染及筛选 依据GenJetTM DNA In Vitro Transfection Reagent (美国SignaGen公司)试剂说明书进行转染。细胞密度达到80%左右时,将细胞分为空白组(Untreated)、阴性组(shRNA-Neg)及干预组(shRNA),以GenJetTM转染试剂分别将FoxM1-shRNA或neg-shRNA转染至食管癌细胞。转染48 h后在倒置荧光显微镜下计算转染效率并收集细胞备用。
1.3 蛋白质印迹法 收集足够数量细胞依据试剂说明书进行蛋白抽提。每泳道加50 μg蛋白,在10%SDS 聚丙烯酰胺凝胶电泳,转膜,封闭,加入兔抗人FoxM1(1∶500)或β-actin抗体(1∶1000),β-actin为内参,4 ℃过夜,辣根过氧化物酶标记的羊抗兔IgG二抗(1∶1000) 37 ℃孵育1 h,洗涤后ECL显色并拍照。
1.4 CCK-8法检测细胞增殖 细胞转染48 h后收集细胞,分别接种于96孔板(n=5),每组分调零、空白、阴性及干预孔,每组含复孔5个,分别在规定的时间点添加CCK-8试剂(日本同仁化学研究所),培养4 h,脱色摇床1 min,酶标仪检测A450值。
1.5 细胞周期分析 转染48 h后,换新鲜完全培养液继续培养24 h后收集细胞,在-20 ℃ 70%预冷乙醇固定过夜,用预冷PBS洗涤沉淀后加0.5 ml碘化丙啶染色,避光温浴30 min(37 ℃),再冰浴避光存放;流式细胞仪检测红色荧光(488 nm波长),利用Multicycle软件(Beckman Coulter公司)收集、存储和分析数据。
1.6 Annexin V-PE/7-ADD双染检测细胞凋亡 转染48 h后换新鲜完全培养液继续培养24 h后收集细胞,加入500 μl缓冲液悬浮细胞,再加1 μl Annexin V-PE混匀,室温避光反应15 min;最后加5 μl 7-ADD,轻轻混匀,室温避光反应15 min后用流式细胞仪检测分析结果。

2 结 果
2.1 FoxM1蛋白在不同食管癌细胞株中表达情况 FoxM1/β-actin灰度强度比值分别为0.15±0.04、0.61±0.11、0、0.03±0.09及0.48±0.05;FoxM1蛋白在正常食管上皮细胞株中几乎不表达,在食管癌细胞株(Eca109、TE1、TE2、TE7)中呈不同程度表达(图1),其中TE1细胞株中表达水平最高,选择TE1细胞株用于后续研究。

图1 Western blotting分析不同食管癌细胞中FoxM1蛋白表达(n=3)
2.2 FoxM1-shRNA转染食管癌细胞 倒置荧光显微镜下成功转染的细胞带绿色荧光(图2),转染效率为93%(n=5)。
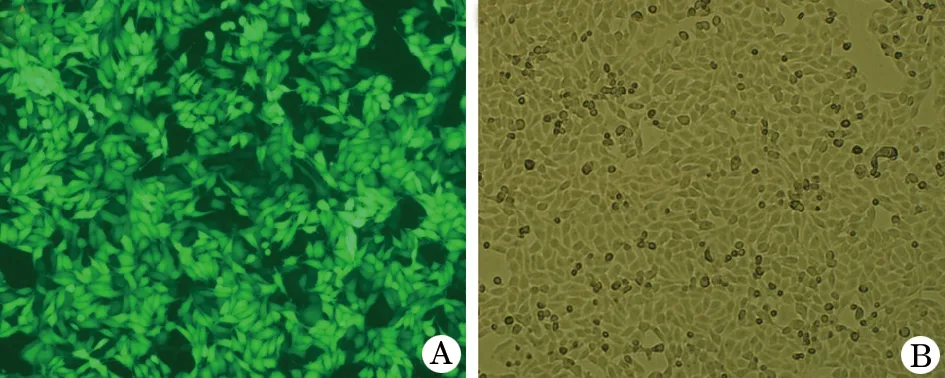
图2 FoxM1-shRNA转染食管癌细胞后普通光镜与荧光显微镜图(×200)
2.3 FoxM1-shRNA下调食管癌细胞FoxM1表达水平 空白组(Untreated)、阴性组(shRNA-Neg)及干预组(shRNA)FoxM1/β-actin灰度强度比值分别为0.39±0.07、0.41±0.02和0.07±0.04(t=13.17,P<0.01),阴性组与空白组间未见统计学差异(t=0.48,P>0.05),见图3。

图3 shRNA下调食管癌细胞中FoxM1蛋白表达水平(n=3)
2.4 FoxM1-shRNA抑制食管癌细胞增殖 FoxM1-shRNA组24 h、48 h及72 h生长抑制率分别为(49.0±6.3)%、(56.0±4.5)%及(68.0±6.4)%,抑制作用呈时间依赖性,72 h作用最显著。
2.5 FoxM1-shRNA影响食管癌细胞增殖周期 干预组G1期细胞明显增多(t=14.23,P<0.01),S期细胞减少(t=14.08,P<0.01),G2期改变无统计学差异,阴性组与空白组间未见明显差异。

表1 流式细胞术分析细胞周期含量改变 (n=3;;%)
注:与空白组比较,①P<0.01;与阴性组比较,②P<0.01
2.6 FoxM1-shRNA促进食管癌细胞凋亡 空白组、阴性组及干预组细胞凋亡率分别为(2.48±0.49)%、(2.56±0.71)%及(35.37±0.56)%,干预组细胞凋亡率显著增高(t=76.56,P<0.01),阴性组与空白组间未见统计学差异。
3 讨 论
手术及放、化疗是食管癌的主要治疗手段,但是其高复发率及转移率,导致ESCC预后极差。寻找更加有效的早期诊断及治疗方法是当前亟待解决的问题。
ESCC发生发展是一个复杂的多阶段过程,但其具体分子机制尚不完全清楚。FoxM1是增生相关的转录因子,通过对多种基因转录调控实现G1/S转换及G2/M转换,促进有丝分裂进行,同时涉及DNA损伤修复、染色体组装、蛋白合成等生物学过程,在生命现象中发挥重要作用[3, 5]。FoxM1在肺癌、乳腺癌、结肠癌、卵巢癌等多种恶性肿瘤中异常过度表达并与肿瘤发生及转移密切相关[6-10],提示FoxM1可能在肿瘤增殖过程中扮演癌基因的角色。已有研究发现FoxM1在食管癌细胞中表达具有一定特异性及敏感性,被认为是食管癌特异治疗的潜在靶点,本文采用RNAi技术[11, 12]构建FoxM1-shRNA质粒,特异性抑制食管癌细胞FoxM1表达,研究对细胞增殖、细胞周期及凋亡等生物学行为的影响,初步探讨其应用于靶向治疗的可能。
FoxM1蛋白在4种食管癌细胞株(Eca109、TE1、TE2及TE7)中呈差异表达,其中TE1细胞株中表达水平最高,选择TE1细胞株用于后续研究,与课题组前期研究FoxM1在食管鳞癌组织中呈高表达而在癌周正常组织不表达结果相一致。构建特异性干扰序列FoxM1-shRNA成功转染至TE1细胞,干预组FoxM1蛋白水平降低,提示该质粒在体外能够干预FoxM1表达,符合设计要求,用于后续实验。
观察干预FoxM1表达对TE1细胞增殖、周期及凋亡等生物学行为的影响。干预组细胞增殖受到抑制,呈时间依赖性,提示干预FoxM1能够抑制TE1细胞增殖,该作用呈时间依赖性,与文献[4]相关报道一致。为探讨干预FoxM1所产生的生长抑制效应是否涉及细胞凋亡及细胞周期进程的改变,利用流式细胞仪检测干预后细胞DNA含量分布,干预组G1期细胞增多,S期细胞减少,G2期改变不明显,提示细胞增殖周期发生G1期阻滞;利用流式细胞仪检测干预后细胞分布,干预组细胞凋亡率显著增高。
关于FoxM1在其他恶性肿瘤中的研究发现过表达FoxM1分子的肿瘤细胞,在敲除FoxM1后,肿瘤细胞增殖、抗凋亡及侵袭能力显著受抑[13-16]。研究发现呼吸道上皮细胞中FoxM1的表达是肺癌形成及TOPO-2α表达的关键因素,在MCA/BHT诱导肿瘤形成之前,选择性敲除FoxM1基因的转基因小鼠FoxM1-/-的肺癌数量及体积均显著下降,这可能与TOPO-2α(调节肿瘤细胞增殖的关键因子)基因表达下调有关,FoxM1识别其启动子序列,结合并诱导其表达,间接促进肿瘤细胞的增殖;后续研究证实肺部肿瘤形成后FoxM1缺失可延缓肿瘤的进展,进一步叙述了FoxM1促进肿瘤发生发展的机制[17]。应用RNA干扰技术使乳腺癌的MDA-MB-231细胞系的癌细胞内转入PEI相关的物质后可导致癌细胞内FOXM1表达水平下调,同时癌细胞内蛋白表达水平下降,并且Cdc25B的mRNA的水平亦下降。本研究结果提示:在敲除FoxM1后,肿瘤细胞的增殖、抗凋亡及侵袭能力显著受抑,表明调控FoxM1的表达水平,或许能控制肿瘤的生长。
综上所述,干预FoxM1表达使细胞周期发生G1期阻滞并促进细胞凋亡,从而抑制TE1细胞增殖,FoxM1可能是食管癌基因治疗潜在的有效靶点。
[1] Lam E W, Brosens J J, Gomes A R,etal. Forkhead box proteins: tuning forks fortranscriptional harmony [J]. Nat Rev Cancer,2013, 13(7): 482-495.
[2] Koo C Y, Muir K W, Lam E W. FOXM1: from cancer initiation to progression andtreatment [J]. Biochim Biophys Acta, 2012, 1819(1): 28-37.
[3] Wierstra I, Alves J. FoxM1, a typical proliferation associated transcription factor [J]. Biol Chem, 2007, 388(12): 1257-1274.
[4] 盖 领,茅国新,刘 军,等.叉头框转录因子M1蛋白在食管鳞癌细胞和组织中的表达及意义[J]. 中华肿瘤杂志, 2016,38(3):179-184.
[5] Wu X, Gu X, Han X,etal. A novel function for FoxM1 in interkinetic nuclear migration in the developing telencephalon and anxiety-related behavior [J]. J Neurosci, 2014, 34(4): 1510-1522.
[6] Huang C, Xie D, Cui J,etal. FOXM1c promotes pancreatic cancer epithelial to mesenchymal transition and metastasis via upregulation of expression of the urokinase plasminogen activator system [J]. Clin Cancer Res, 2014, 20(6): 1477- 1488.
[7] Xia L, Huang W, Tian D,etal. Overexpression of forkhead box C1 promotes tumor metastasis and indicates poor prognosis in hepatocellular carcinoma [J]. Hepatology, 2013, 57(2): 610-624.
[8] Kong F F, Qu Z Q, Yuan H H,etal. Overexpression of FOXM1 is associated with EMT and is a predictor of poor prognosis in non-small cell lung cancer [J]. Oncol Rep, 2014, 31(6): 2660-2668.
[9] Arora R, Yates C, Gary B D,etal. Panepoxydone targets NF-kB and FOXM1 to inhibit proliferation, induce apoptosis and reverse epithelial to mesenchymal transition in breast cancer [J]. PLoS One, 2014, 9(6): e98370.
[10] Wen N, Wang Y, Wen L,etal. Overexpression of FOXM1 predicts poor prognosis and promotes cancer cell proliferation, migration and invasion in epithelial ovarian cancer [J]. J Transl Med, 2014, 12(134): 1-13.
[11] Cheng A L, Kang Y K, Chen Z,etal. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial [J]. Lancet Oncol, 2009, 10(1): 25-34.
[12] Lee Y L, Ahn B C, Lee Y,etal. Targeting of hepatocellular carcinoma with glypican-3 targeting peptide ligand [J]. J Pept Sci, 2011, 17(11): 763-769.
[13] Li X R, Chu H J, Lv T,etal. miR-342-3p suppresses proliferation, migration and invasion by targeting FOXM1 in human cervical cancer [J]. FEBS Lett, 2014, 588(17): 3298-3307.
[14] Zhou J, Wang Y, Wang Y,etal. FOXM1 modulates cisplatin sensitivity by regulating EXO1 in ovarian cancer [J]. PLoS One, 2014, 9(5): e96989.
[15] Miao L, Xiong X, Lin Y,etal. Down-regulation of FoxM1 leads to the inhibition of the epithelial-mesenchymal transition in gastric cancer cells [J]. Cancer Genet, 2014, 207(3): 75-82.
[16] Chen T, Xiong J, Yang C,etal. Silencing of FOXM1 transcription factor expression by adenovirus-mediated RNA interference inhibits human hepatocellular carcinoma growth [J]. Cancer Gene Ther, 2014, 21(3): 133-138.
[17] Wang I C, Meliton L, Ren X,etal. Deletion of Forkhead Box M1 transcription factor from respiratory epithelial cells inhibits pulmonary tumorigenesis [J]. PLoS One, 2009,4(8):e6609.
Effectsofdown-regulationofFoxM1expressionsonproliferationandapoptosisofesophagealsquamouscellcarcinomacells
CHEN Jie1, YAN Xiaodi2, ZHANG Dongsheng1, QIAN Hongyun3, CHEN Ruijiao3, and ZHOU Fangzheng1.
1.Oncology Department of Suizhou Central Hospital, Affiliated Hospital of Hubei University of Medicine, Suizhou 441300, China;2.Tumor Radiotherapy Department of Affiliated Hospital of Nantong University, Nantong 22600, China; 3. Clinical Medicine Department of Hubei University of Medicine, Shiyan 442000, China
ObjectiveTo investigate the effects of down-regulation of forkhead box protein M1 (FoxM1) expressions by shRNA on proliferation and apoptosis of esophageal squamous cell carcinoma (ESCC) cells.MethodsPlasmid that highly expressed FoxM1-shRNA was successfully constructed and transfected with TE1 cell line. FoxM1 was analyzed by Western blot. Cell proliferation was tested by cell counting kit-8 while cell cycle and apoptosis were analyzed by flow cytometry and Annexin-V-PE/7-AAD staining kit.ResultsFoxM1 expressions in ESCC cells transfected with specific shRNA were significantly down-regulated at the protein level and cell proliferation was inhibited in a time-dependent manner. The inhibition rate was 68.0%±6.4% (P<0.05), with cell cycle arrested at G1phase arrest (59.14%±1.69%vs40.51%±1.45%,t=14.23,P<0.01)and the apoptosis rate of TE1 cells reached 35.37% (2.48%±0.49%vs35.37%±0.56%,t=76.56,P<0.01).ConclusionsInterventions with FoxM1 gene expressions can inhibit the proliferation and apoptosis of ESCC cells, suggesting that FoxM1 can be a novel therapeutic target for ESCC.
esophageal squamous cell carcinoma; forkhead box protein M1; gene silencing; cell proliferation; apoptosis
2016年湖北省教育厅科学研究计划指导性项目(B2016120),2015年随州市科研立项(2015SMR003),2016年随州市科研立项(2016SZ32005)。
陈 洁,硕士,住院医师。
1.441300, 湖北医药学院附属随州医院 随州市中心医院肿瘤科;2.226001, 南通大学附属医院放疗科;3. 422000 十堰,湖北医药学院临床医学系
周方正,E-mail: 918771802@qq.com
R735.1
(2017-06-02收稿 2017-07-16修回)
(责任编辑 武建虎)

