巴西橡胶树6个PP2C家族基因成员分子信息学与抗旱功能分析
张 冬 李晓娜 肖厚贞 陆燕茜 张 宇* 王 萌
(1.海南省热带生物资源可持续利用重点实验室,海南大学热带农林学院,海口 570228; 2.中国热带农业科学院科技信息研究所,海口 570228; 3.海南大学材料与化工学院,海口 570228)
巴西橡胶树6个PP2C家族基因成员分子信息学与抗旱功能分析
张 冬1李晓娜2肖厚贞3陆燕茜1张 宇1*王 萌1
(1.海南省热带生物资源可持续利用重点实验室,海南大学热带农林学院,海口 570228;2.中国热带农业科学院科技信息研究所,海口 570228;3.海南大学材料与化工学院,海口 570228)
PP2C是一类丝氨酸/苏氨酸残基蛋白磷酸酶,在高等植物ABA信号途径中起着重要的作用。为阐明巴西橡胶树中PP2C基因的结构与功能,本研究通过生物信息学方法,从橡胶树转录组数据库中鉴定并获得6个PP2C家族基因,均含有PP2CD、F1和F2亚族。通过qRT-PCR技术对6个PP2C家族基因进行了干旱处理下的差异表达分析,发现6个基因都不同程度上响应橡胶树干旱胁迫。本研究为探究PP2C基因在橡胶树抗干旱反应机制提供了理论依据。
巴西橡胶树;PP2C基因;生物信息学;表达分析;干旱
巴西橡胶树(HeveabrasiliensisMull.Arg.)原产于亚马逊森林,是一种优质天然橡胶资源。作为“工业原料和战略物资”[1],天然橡胶在国民经济发展中起重要作用。在中国,巴西橡胶树主要栽植于海南等地,自海南省种植橡胶树以来,承担生产天然橡胶的主要任务,为中国的经济建设和社会发展作出显著贡献[2]。但是长期的适应过程使其形成了怕强风干旱和低温的生长习性,每年11月至次年4月为海南的旱季,即使是雨季,因降水时空分布不均,也会导致夏旱和秋旱,一些年份甚至全年干旱[3~4]。干旱是限制我国橡胶发展的主要原因之一,大量的实验表明,干旱胁迫抑制橡胶树可溶性蛋白合成和光合生理[5],导致次生根数量减少。当植胶区面临干旱威胁时,橡胶树叶片形态结构发生变化,胶树生长迟缓[6],胶产量下降[7],引发死皮病虫害,严重时致死[8]。干旱对我国的天然橡胶产业发展有着巨大的威胁,影响宏观经济,所以,研究橡胶树抗旱机制对橡胶产业以及经济发展意义重大。然而橡胶树干旱胁迫的应答机制尚不清楚,目前已在拟南芥[9]、番茄[10]、黄花蒿[11]和玉米[12]等植物中发现了PP2C基因响应干旱胁迫,笔者推测PP2C基因在橡胶树抗旱过程中也存在作用。
PP2C(PP2C-typeproteinphosphatase)是一类单体丝氨酸/苏氨酸残基蛋白磷酸酶[13~14],其活性依赖于Mg2+或Mn2+等离子,进化保守[15],广泛存在于古细菌、细菌、真菌、植物和动物中[16]。相较于其他生物,植物中PP2C类蛋白数量最大[17]。大部分植物PP2C蛋白包含3个基序,1个具有保守催化结构域的C末端,1个具有功能各异的膜定位信号序列延伸区的N端,还有1个类似受体激酶互作结构域[18]。研究发现,拟南芥中有80个PP2C基因,水稻中90个[9],二穗短柄草中86个[16]。拟南芥的80个PP2C候选基因被分为13个亚类:A-D、Ea、Eb、F1、F2、G-J亚族[9]。其中,A亚族调控脱落酸(abscisic acid,ABA)信号途径,胡杨PeHAB1基因[19]、拟南芥ABI1,ABI2和AtPP2CA基因属于A亚族[20],是ABA信号途径中的调控基因[21~22],ABA诱导PYL-PP2C相互作用,激活SnRK2蛋白激酶,从而调控下游转录因子促使基因表达。B亚族在蛋白激酶MAPK途径起作用,拟南芥中B亚族PP2C基因AP2C1,在病原体应激、受到机械伤害后,影响MPK4或MPK6基因,抑制MAPK活性[23]。苜蓿中B亚族PP2C(MP2C)受逆境胁迫诱导,是MAPK途径中的负调控因子[24~25]。C亚族与花器官发育有关[26],而关于PP2C基因其他亚族的研究并不多。
本研究利用生物信息学和分子生物学手段,鉴定橡胶树6个PP2C家族基因,并分析其在干旱处理下的差异表达,以期为探究PP2C家族基因参与干旱胁迫分子机制提供理论依据,为培育抗旱橡胶树品种提供候选基因。
1 材料与方法
1.1 材料与处理
巴西橡胶树(HeveabrasiliensisMull.Arg)品种‘热研7-33-97’芽接苗由海南大学热带农林学院儋州校区种植基地提供。
选取两组长势一致的同龄橡胶芽接苗,一组对照,一组实验,每组3个重复。干旱处理采用方法如下:对两组苗持续10 d饱和浇水后,实验组做断水处理,对照组正常浇水,持续观测橡胶树表型变化直至叶片干枯,在第0、1、3、6、9 d采取同一时段的实验组和对照组橡胶芽接苗叶片,所有采集的样品迅速保存于液氮中备用。
1.2 巴西橡胶树生物信息学分析
1.2.1 巴西橡胶树6个PP2C基因家族成员的鉴定
PP2C基因家族成员序列来源于橡胶树转录组数据库。使用NCBI ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)看基因的开放阅读框(ORF)是否完整,预测基因的氨基酸序列。利用SWTSS-PROT数据库中ExPASyProteomics Sever(http://expasy.org/)对PP2C蛋白氨基酸序列进行分子量、等电点的预测;通过NCBI Conserved Domains数据库(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和Pfam database(http://pfam.xfam.org/)在线分析其保守结构域。在MEME的Multiple Em for Motif Elicitation(http://meme-suite.org/)分析保守元件。NCBI在线BLAST(Basic Local Alignment Search Tool)(https://blast.ncbi.nlm.nih.gov/Blast.cgi)分析HbPP2Cs与其他物种间的相似序列。通过DNAman 6.0软件分析了橡胶树与其他物种的PP2C氨基酸序列。
1.2.2 巴西橡胶树6个PP2C基因家族成员分类
从拟南芥信息资源(TAIR)数据库(http://www.arabidopsis.org/)下载拟南芥全序列,导入本地PowerBlast,对比找出橡胶树PP2C基因同源性最高的拟南芥基因;利用NCBI Basic Local Alignment Search Tool(https://blast.ncbi.nlm.nih.gov/Blast.cgi)找出与橡胶树PP2C基因同源性最高的水稻(OryzasativaL.)基因,分析比对它们的氨基酸序列。ClustalX(1.83)程序多重序列比对拟南芥、水稻PP2C基因和橡胶树6个PP2C基因,对比结果利用软件MEGA6构建邻接法(Neighbor-Joining,NJ)进化树,bootstrap值设置为1 000。
1.3 实验方法
1.3.1 总RNA提取和cDNA合成
用天根的多糖多酚植物总RNA提取试剂盒提取橡胶芽接苗叶片总RNA,Thermo公司的RevertAidTM第一链cDNA合成试剂盒进行反转录。
1.3.2 实时荧光定量qRT-PCR分析
使用Primer 6.0设计6个PP2C基因实时荧光定量PCR的特异性引物,以巴西橡胶树Actin为内参基因,分析各基因相对表达量。设计的引物见表1。
表1橡胶树6个PP2C基因qRT-PCR引物序列
Table1PrimerssequenceofsixPP2CgenesinRubbertreeforqRT-PCR
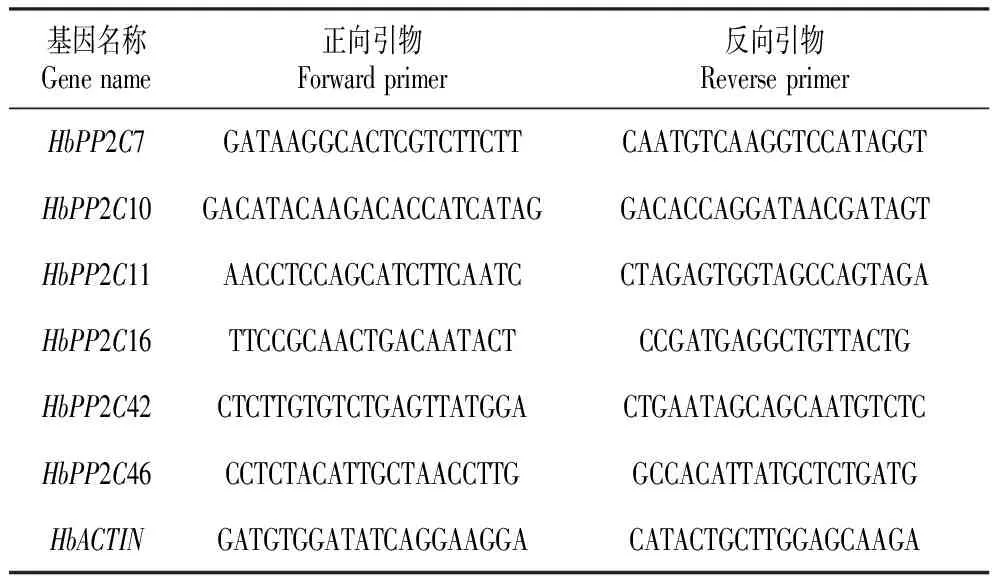
基因名称Genename正向引物Forwardprimer反向引物ReverseprimerHbPP2C7GATAAGGCACTCGTCTTCTTCAATGTCAAGGTCCATAGGTHbPP2C10GACATACAAGACACCATCATAGGACACCAGGATAACGATAGTHbPP2C11AACCTCCAGCATCTTCAATCCTAGAGTGGTAGCCAGTAGAHbPP2C16TTCCGCAACTGACAATACTCCGATGAGGCTGTTACTGHbPP2C42CTCTTGTGTCTGAGTTATGGACTGAATAGCAGCAATGTCTCHbPP2C46CCTCTACATTGCTAACCTTGGCCACATTATGCTCTGATGHbACTINGATGTGGATATCAGGAAGGACATACTGCTTGGAGCAAGA
1.4 数据统计与分析
基因表达的数据是3次生物重复和3次技术重复的平均值±标准误差。利用SAS 9.1.3软件进行统计分析,单因素方差分析和Duncan检验分析不同处理之间的差异显著性。使用Origin2015和Adobe Photoshop CS5绘图。
2 结果与分析
2.1 巴西橡胶树6个PP2C基因的生物信息学分析
利用生物信息学方法,从橡胶树转录组中鉴定获得6个具有完整ORF的候选PP2C基因家族成员,分别是CL10879.Contig2、CL224.Contig3、CL4996.Contig1、CL10902.Contig1、CL2659.Contig3和CL10104.Contig2。根据与拟南芥同源性将橡胶树6个PP2C基因分别命名为HbPP2C7、HbPP2C10-11、HbPP2C16、HbPP2C42和HbPP2C46。NCBI Consered Domains和Pfam database的分析结果显示,6个橡胶树PP2C家族基因均含有PP2C保守结构域(图2B)。利用ExPASy在线分析得出,这6个HbPP2C基因家族成员中,蛋白质编码最长的545 aa,最短的241 aa,等电位范围从4.71~8.7(表2)。

表2 橡胶树6个PP2C家族基因信息
使用NCBI的在线BLAST分析核酸序列得出,HbPP2C7与蓖麻(RicinuscommunisL.,XM_002514049.2)相似性83%,麻风树(JatrophacurcasL.,XM_012221592.1)相似性86%;HbPP2C10与麻风树XM_012212487.1相似性81%,蓖麻XM_002513878.2相似性86%;HbPP2C11与麻风树XM_012210755.1相似性90%,蓖麻XM_015719900.1相似性89%;HbPP2C16与蓖麻XM_002521322.2相似性83%,麻风树XM_012213539.1相似性88%;HbPP2C42与麻风树XM_012228710.1相似性86%,蓖麻XM_015719271.1相似性83%;HbPP2C46与蓖麻XM_015726275.1相似性89%,麻风树XM_012233075.1相似性89%。橡胶树PP2C基因与蓖麻和麻风树等物种的相似性较高。将橡胶树6个PP2C基因的氨基酸序列与水稻、拟南芥、蓖麻和麻风树中部分PP2C基因对比(图1),发现PP2C家族成员绝大多数含有高度保守的PP2C结构域,证明6个HbPP2C基因是PP2C基因家族成员。
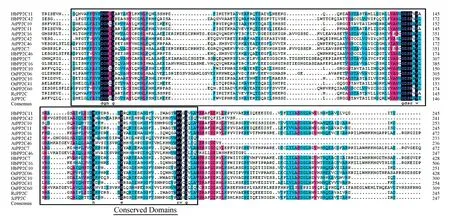
图1 橡胶树PP2C基因与其他植物PP2C基因蛋白序列多重比对Fig.1 Multiple protein sequence alignment of Rubber tree PP2Cs with other PP2C proteins

图2 6个橡胶树PP2C基因的系统进化树(A)、保守结构域(B)和保守元件(C)分析Fig.2 Phylogenetic tree(A),conserved domains(B) and conserved motifs(C) of 6 Rubber tree PP2Cs

图3 6个橡胶树PP2C基因的保守元件模型Fig.3 The conserved motif logoof the 6 Rubber tree PP2Cs
2.2巴西橡胶树6个PP2C基因的系统进化分析与分类
为探究6个橡胶树PP2C基因蛋白系统进化关系,本研究构建了6个橡胶树PP2C基因的系统进化发育树(图2A),6个PP2C基因在进化发育树中形成3个分支。为了进一步确定橡胶树PP2C基因基因间的关系,用MEME软件构建了保守元件结构图(图2C)。可看出6个PP2C基因具有11个保守元件,这导致功能的多样性。尽管橡胶树PP2C基因的蛋白长度有241~545个氨基酸,但MEME保守元件结构图表明,聚类在一起的橡胶树PP2C基因拥有相同蛋白基序位置。同时,从橡胶树PP2C基因的保守元件模型(图3)可看出,橡胶树PP2C基因的进化是保守的。
将巴西橡胶树6个PP2C基因在NCBI在线BLAST,同时与拟南芥全序列进行本地PowerBlast,结果表明,HbPP2Cs分别与拟南芥中的AtPP2C10、16、79、11、42、7同源性最高,与水稻中的OsPP2C41、6、60、10、60、6同源性最高。将HbPP2Cs与拟南芥和水稻中同源性最高的基因进行进化树构建,根据拟南芥和水稻PP2C基因的分类,HbPP2Cs可被分为4个亚族:A、D、F1、F2亚族(图4)。HbPP2C7和HbPP2C16属于A亚族,HbPP2C42和HbPP2C46属于D亚族,HbPP2C10属于F1亚族,HbPP2C11属于F2亚族。
2.3巴西橡胶树6个PP2C基因在干旱处理下的表达分析
干旱处理橡胶树芽接苗后,叶片表型变化如图5。橡胶树芽接苗在第6 d时表现出受害症状,叶片变黄;在干旱处理第9 d时,叶片完全枯萎。所以,本研究取对照组与干旱处理下0、1、3、6和9 d的橡胶树芽接苗叶片,分析巴西橡胶树6个PP2C基因在干旱处理下的表达量变化情况。

图4 巴西橡胶树、拟南芥和水稻PP2C基因进化关系Fig.4 Phylogenetic relationship of Hevea brasiliensis,Arabidopsis and Oryza sativa PP2C genes

图5 干旱对橡胶树叶片影响的表型图Fig.5 The phenotypic map of rubber tree after non-irrigation treatment
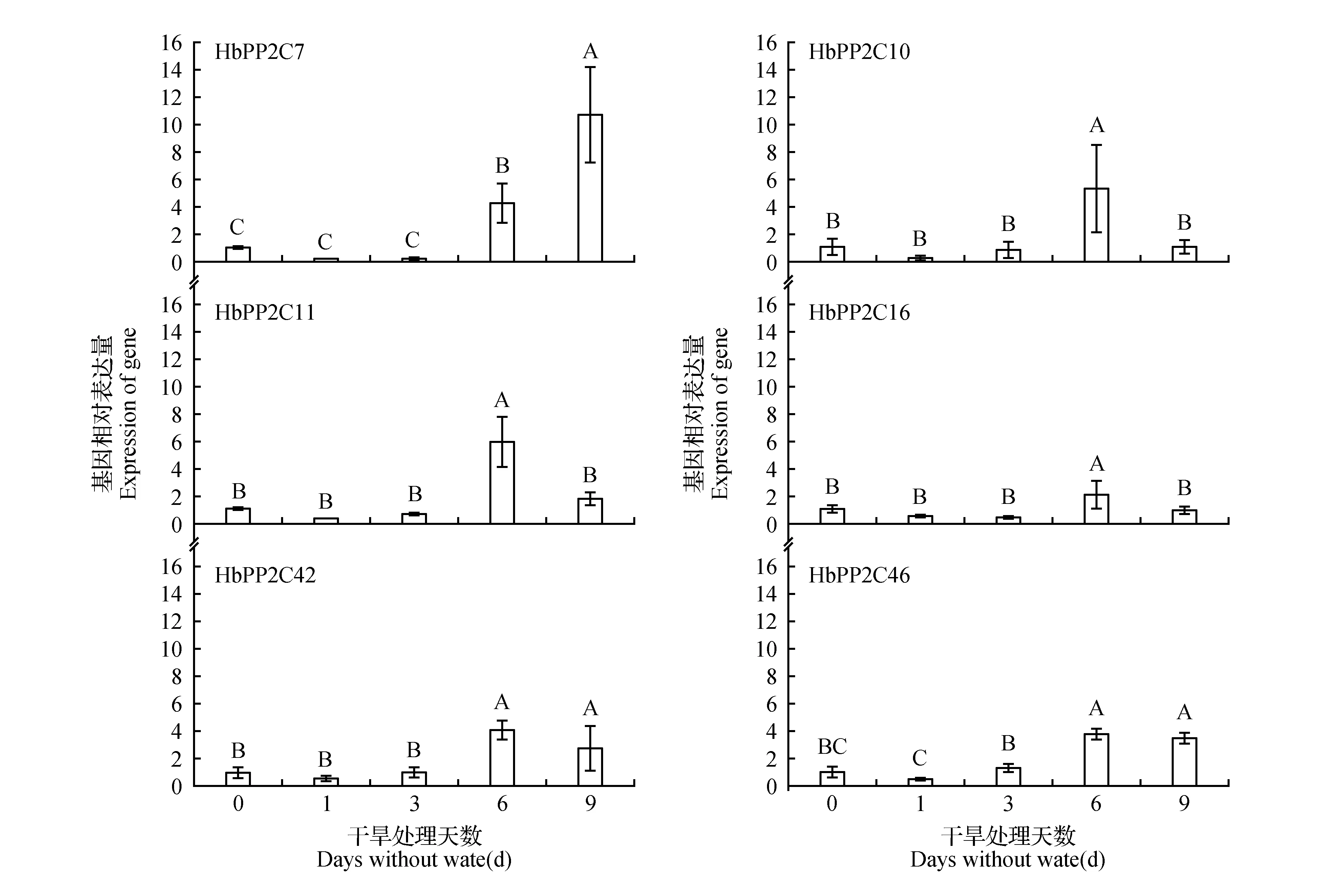
图6 橡胶树叶片中HbPP2Cs基因在干旱条件下的表达分析Fig.6 Expression analysis of HbPP2Cs in H.brasiliensis leaves after non-irrigation treatment
巴西橡胶树芽接苗叶片在干旱处理下表达量变化情况如图6,巴西橡胶树6个PP2C基因在干旱处理1~3 d下调,第6 d时上调。HbPP2C7是PP2C家族A亚族基因,在干旱处理6 d后的表达较显著,干旱处理9 d时显著上调表达,是对照处理的12倍,而其他五个基因均呈下调表达,HbPP2C10、11、16下调表达较显著。橡胶树6个PP2C基因在干旱处理6 d时都显著上调,其表达量变化情况说明这6个基因都不同程度地参与了橡胶树干旱胁迫响应机制。由此说明,HbPP2Cs是橡胶树干旱胁迫应答的较为关键的上游基因。
3 讨论
本研究在橡胶树转录组数据库中找出并鉴定了6个具有完整ORF的PP2C基因家族成员,分析蛋白质序列得出,PP2C蛋白C端含有保守的蛋白磷酸酶,橡胶树6个PP2C基因家族成员都有PP2C保守结构域。分析其保守域模型发现,橡胶树6个PP2C基因有相对较高的保守性。将橡胶树6个PP2C基因在线BLAST分析发现,橡胶树PP2C基因与蓖麻、麻风树同源性较高。将橡胶树6个PP2C基因聚类分析,形成3个分支,在分析保守元件时发现橡胶树这各个分支下的基因具有相同的蛋白基序结构和位置,而不同分支的PP2C基因保守元件差异显著。说明PP2C基因家族种类繁多,结构特征、理化性质较特殊,橡胶树中PP2C基因具有多样性。使用本地PowerBlast对橡胶树、水稻和拟南芥进行PP2C基因同源性分析,找出水稻和拟南芥中与橡胶树同源性最高的PP2C基因,与橡胶树6个PP2C基因进一步构建进化树。根据拟南芥和水稻中PP2C基因的分类,将橡胶树6个PP2C基因分为4个亚族:A、D、F1和F2亚族。以上结果为进一步验证PP2C基因家族功能提供依据。
干旱胁迫影响植物表型,改变植物生理[27],是限制作物产量的最普遍环境因素[28~29]。橡胶树的生长情况及胶乳产量也受干旱因素制约[30],解决干旱胁迫对橡胶树的危害对橡胶产业经济发展有着至关重要的作用。植物对干旱胁迫的响应受不同分子及信号通路调控[31],随着分子生物学的发展,研究抗干旱等逆境相关基因的分子表达调控机制已成为培育橡胶树抗干旱品种的基础手段。PP2C是植物中最大的蛋白磷酸酶家族,作为重要的信号分子调控植物逆境信号途径[32~33]。在拟南芥和烟草等植物中研究发现,PP2C酶催化可逆磷酸化作用,反作用于特定蛋白激酶,从而调节ABA信号通路[34~35],充当负调控因子加速植物发育和增强植物对胁迫的耐受性[36]。大量研究发现,PP2C基因调控干旱胁迫。二穗短柄草PP2C基因家族成员中绝大多数受干旱处理上调[16];干旱胁迫条件下,玉米ZmPP2Ca基因在耐旱自交系中下调表达,在不耐旱自交系中上调表达[37]。非洲冰草的PP2C基因家族中Mpc5和Mpc8由干旱条件诱导,但其他Mpcs受干旱胁迫下调[38];山杨树A亚族四个PtPP2Cs均响应干旱、寒冷和高盐胁迫,在干旱处理下的表达量最高[19]。为探究PP2C基因在橡胶树抗旱机制中的作用与机理,本研究利用qRT-PCR技术分析了橡胶树PP2C基因在干旱处理下的表达情况,结果发现:干旱处理橡胶树芽接苗后,橡胶树芽接苗在处理前期(1~3 d)无明显变化,此阶段巴西橡胶树中6个PP2C基因的表达量不变;干旱处理第6 d时橡胶树芽接苗表现出受害症状,叶片变黄,同时巴西橡胶树中6个PP2C基因均上调表达;干旱处理第9 d时,橡胶芽接苗叶片完全枯萎,此间,A亚族HbPP2C7基因的表达量显著上调,其余5个PP2C基因下调表达。同家族不同基因可能存在不同的应答机制,所以基因差异表达结果不尽相同。推测橡胶树PP2C基因响应干旱胁迫,A亚族HbPP2C7基因更具研究价值,而PP2C基因对橡胶树逆境分子调控机制及与其他基因间的协同作用仍有待深入探究。
1.高伟,韦家少,何鹏,等.巴西橡胶树水解酶基因克隆与表达分析[J].中国农学通报,2013,29(19):9-13.
Gao W,Wei G S,He P,et al.Cloning and Expression Analysis of Hydrolase Gene fromHeveabrasiliensisMuell.Arg[J].Chinese Agricultural Science Bulletin,2013,29(19):9-13.
2.钟勇.海南橡胶种植业发展前景分析[J].热带农业科学,2016,36(8):69-75.
Zhong Y.Development Prospects of Rubber Industry in Hainan Province[J].Chinese Journal of Tropical Agriculture,2016,36(8):69-75.
3.李春鸾,陈丽英,郑亚娜天.海南岛暴雨统计分析[J].气象研究与应用,2008,29:57-58.
Li C Y,Chen L Y,Zheng Y N.Statistical analysis of Rainstorm in Hainan Island[J].Journal of Meteorological Research and Application,2008,29:57-58.
4.李海亮,戴声佩,胡盛红,等.海南岛农业干旱综合监测研究[J].中山大学学报:自然科学版,2012,51(6):126-130.
Li H L,Dai S P,Hu S H,et al.Study on Agricultural Drought Comprehensive Monitoring in Hainan Island Based on MODIS Data and Meteorological Data[J].Acta Scientiarum Naturalium Universitatis Sunyatsenii,2012,51(6):126-130.
5.Kumagai T O,Mudd R G,Giambelluca T W,et al.How do rubber(Heveabrasiliensis) plantations behave under seasonal water stress in northeastern Thailand and central Cambodia?[J].Agricultural and Forest Meteorology,2015,213:10-22.
6.Li Y W,Lan G Y,Xia Y J.Rubber trees demonstrate a clear retranslocation under seasonal drought and coldstresses[J].Frontiers in Plant Science,2016,7(e69357):1907.
7.林秀琴,袁坤,王真辉,等.干旱胁迫下橡胶树叶片差异表达蛋白的鉴定与功能解析[J].热带作物学报,2009,30(12):1782-1788.
Lin X Q,Yuan K,Wang Z H,et al.Identification and Functional Analysis of DIfferentially Expressed Proteins inHeveabrasiliensisLeaves during Drought Stress[J].Chinese Journal of Tropical Crops,2009,30(12):1782-1788.
8.Wang L F.Physiological and molecular responses to drought stress in rubber tree(HeveabrasiliensisMuell.Arg.)[J].Plant Physiol and Biochemistry,2014,83(2):243-249.
9.Xue T T,Wang D,Zhang S Z,et al.Genome-wide and expression analysis of protein phosphatase 2C in rice and arabidopsis[J].BMC Genomics,2008,9(1):550.
10.Landi S,Nurcato R,De Lillo A,et al.Glucose-6-phosphate dehydrogenase plays a central role in the response of tomato(Solanumlycopersicum) plants to short and long-term drought[J].Plant Physiology and Biochemistry,2016,105:79-89.
11.Zhang F Y,Fu X Q,Lü Z Y,et al.Type 2C phosphatase 1 ofArtemisiaannuaL. is a negative regulator of ABA signaling[J].BioMed Research International,2014,2014:521794.
12.Wei K F,Pan S.Maize protein phosphatase gene family:identification and molecular characterization[J].BMC Genomics,2014,15(1):773.
13.Stern A,Privman E,Rasis M,et al.Evolution of the metazoan protein phosphatase 2C superfamily[J].Journal of Molecular Evolution,2007,64(1):61-70.
14.Xing Y N,Xu Y H,Chen Y,et al.Structure of protein phosphatase 2A core enzyme bound to tumor-inducing toxins[J].Cell,2006,127(2):341-353.
15.Fuchs S,Grill E,Meskiene I,et al.Type 2C protein phosphatases in plants[J].FEBS Journal,2013,280(2):681-693.
16.Cao J M,Jiang M,Li P,et al.Genome-wide identification and evolutionary analyses of thePP2Cgene family with their expression profiling in response to multiple stresses inBrachypodiumdistachyon[J].BMC Genomics,2016,17(1):175.
17.阮海华,徐朗莱.2C类蛋白磷酸酶的结构与功能研究进展[J].南京农业大学学报,2007,30(1):136-141.
Ruan H H,Xu L L.Progress in the structure and function of PP2C type protein phosphatases[J].Journal of Nanjing Agricultural University,2007,30(1):136-141.
18.胡晓丽,李德全.植物蛋白磷酸酶2C(PP2C)及其在信号转导中的作用[J].植物生理学通讯,2007,43(3):407-412.
Hu X L,Li D Q.Protein Phosphatase 2C in Plants and Its Functions of Signal Transduction[J].Plant Physiology Communications,2007,43(3):407-412.
19.Chen J H,Zhang D Z,Zhang C,et al.A putative PP2C-encoding gene negatively regulates ABA Signaling inPopuluseuphratica[J].PLoS One,2015,10(10):e0139466.
20.Cui M H,Yoo K S,Hyoung S,et al.An Arabidopsis R2R3-MYB transcription factor,AtMYB20,negatively regulates type 2C serine/threonine protein phosphatases to enhance salt tolerance[J].FEBS Letters,2013,587(12):1773-1778.
21.Leung J,Merlot S,Giraudat J.The Arabidopsis ABSCISIC ACID-INSENSITIVE2(ABI2) and ABI1genes encode homologous protein phosphatases 2C involved in abscisic acid signal transduction[J].The Plant Cell,1997,9(5):759-771.
22.Gosti F,Beaudoin N,Serizet C,et al.ABI1 protein phosphatase 2C is a negative regulator of abscisic acid signaling[J].The Plant Cell,1999,11(10):1897-1909.
23.Schweighofer A,Kazanaviciute V,Scheikl E,et al.The PP2C-type phosphatase AP2C1,which negatively regulates MPK4 and MPK6,modulates innate immunity,jasmonic acid,and ethylene levels inArabidopsis[J].The Plant Cell,2007,19(7):2213-2224.
24.Meskiene I,Baudouin E,Schweighofer A,et al.Stress-induced protein phosphatase 2C is a negative regulator of a mitogen-activated protein kinase[J].Journal of Biological Chemistry,2003,278(21):18945-18952.
25.郭鹏,张士刚,邢鑫,等.欧美杨PdPP2C基因的克隆与功能分析[J].北京林业大学学报,2015,37(2):100-106.
Guo P,Zhang S G,Xing X,et al.Cloning and Function analysis ofPdPP2CfromPopululusdeltoises[J].Journal of Beijing Forestry University,2015,37(2):100-106.
26.闵东红,薛飞洋,马亚男,等.谷子PP2C基因家族的特性[J].作物学报,2013,39(12):2135-2144.
Min D H,Xue F Y,Ma Y N,et al.Characteristics ofPP2CGene Family inFoxtailMillet(Setariaitalica)[J].Acta Agronomica Sinica,2013,39(12):2135-2144.
27.Vurukonda S S K P,Vardharajula S,Shrivastava M,et al.Enhancement of drought stress tolerance in crops by plant growth promoting rhizobacteria[J].Microbiological Research,2016,184:13-24.
28.Basu S,Ramegowda V,Kumar A,et al.Plant adaptation to drought stress[J].F1000Research,2016,5:1554.
29.Chaves M M,Pereira J S,Maroco J,et al.How plants cope with water stress in the field? Photosynthesis and growth[J].Annals of Botany,2002,89(7):907-916.
30.李国尧,王权宝,李玉英,等.橡胶树产胶量影响因素[J].生态学杂志,2014,33(2):510-517.
Li G Y,Wang Q B,Li Y Y,et al.A Review of Influencing Factors on Latex,Yeild ofHeveabrasiliensis[J].Chinese Journal of Ecology,2014,33(2):510-517.
31.Xu Z Z,Zhou G S,Shimizu H.Plant responses to drought and rewatering[J].Plant Signaling & Behavior,2010,5(6):649-654.
32.Rodriguez P L.Protein phosphatase 2C(PP2C) function in high plants[J].Plant Molecular Biology,1998,38(6):919-927.
33.Moorhead G B G,Trinkle-mulcahy L,Ulke-lemée A.Emerging roles of nuclear protein phosphatases[J].Nature Reviews Molecular Cell Biology,2007,8(3):234-244.
34.Bhalothia P,Sangwan C,Alok A,et al.PP2C-like promoter and its deletion variants are induced by ABA but not by MeJA and SA inArabidopsisthaliana[J].Frontiers in Plant Science,2016,7:547.
35.Thomashow M F.Plant cold acclimation:freezing tolerance genes and regulatory mechanisms[J].Annual Review of Plant Physiology and Plant Molecular Biology,1999,50:571-599.
36.Tähtiharju S,Palva T.Antisense inhibition of protein phosphatase 2C accelerates cold acclimation inArabidopsisthaliana[J].Plant Journal for Cell & Molecular Biology,2001,26(4):461-470.
37.何亮,李富华,沙莉娜,等.玉米2C型丝氨酸/苏氨酸蛋白磷酸酶(PP2C)活性与耐旱性的关系[J].作物学报,2008,34(5):899-903.
He L,Li F H,Sha Li Na,et al.Activity of Serine/Threonine Protein Phosphatase Type-2C(PP2C) and Its Relationships to Drought Tolerance in Maize[J].Acta Agronomica Sinica,2008,34(5):899-903.
38.Miyazaki S,Koga R,Bohnert H J,et al.Tissue- and environmental response-specific expression of 10 PP2C transcripts inMesembryanthemumcrystallinum[J].Molecular and General Genetics MGG,1999,261(2):307-316.
The National Natural Science Fund(31660187,31660204);The earmarker fund for China Agriculture Research System(CARS-34-BC1);Innovative research project of Hainan graduate students(Hys2016-25)
introduction:ZHANG Dong(1992—),female,master,molecular botany research.
date:2017-04-20
BioinformaticsandDroughtToleranceofPP2CGeneFamilyMembersinHeveabrasiliensisMuell.Arg.
ZHANG Dong1LI Xiao-Na2XIAO Hou-Zhen3LU Yan-Xi1ZHANG Yu1*WANG Meng1
(1.Hainan Key Laboratory for Sustainable Utilization of Tropical Bioresource,Institute of Tropical Agriculture and Forestry,Hainan University,Haikou 570228;2.Institute of Scientific and Technical Information Catas,Haikou 570228;3.College of Materials and Chemical Engineering,Hainan Univeersity,Haikou 570228)
PP2Csare a group of monomeric serine/threonine protein phosphatases, which play an important role in ABA signaling pathway in higher plants. In order to elucidate the structure and function ofPP2Cgene in rubber tree,we used a bioinformatics approach to get sixPP2Cgenes members from rubber tree transcription database, sixHbPP2Csall contain PP2C conserved domains.By sequence alignment and phylogenetic analysis,sixHbPP2Cswere divided into four subfamilies: subfamily A, D, F1 and F2. Different expression analysis of sixPP2Cfamily genes under drought stress by qRT-PCR showed that they all response to drought stress in varying degrees.Our study provides a theoretical basis for exploring the mechanism ofPP2Cgenes in drought resistance of rubber tree.
HeveabrasiliensisMuell.Arg.;PP2Cgenes;bioinformatics;expression analysis;drought
国家自然科学基金(31660187,31660204);现代农业产业技术体系建设专项资金资助(CARS-34-BC1);海南省研究生创新科研课题(Hys2016-25)
张冬(1992—),女,硕士研究生,主要从事分子植物学研究。
* 通信作者:E-mail:yuzhang_rain@hainu.edu.cn
2017-04-20
* Corresponding author:E-mail:yuzhang_rain@hainu.edu.cn
S794.1
A
10.7525/j.issn.1673-5102.2017.05.013

