大连地区岛屿与大陆玉竹种群遗传多样性的ISSR分析
郝久程 贾 鑫 穆晓红 张恒庆
(辽宁师范大学生命科学学院,大连 116081)
大连地区岛屿与大陆玉竹种群遗传多样性的ISSR分析
郝久程 贾 鑫 穆晓红 张恒庆*
(辽宁师范大学生命科学学院,大连 116081)
选取大连地区大陆与海岛共有植物玉竹为研究对象,采用ISSR分子标记技术对来自5个海岛和4个大陆种群的262个玉竹个体进行遗传多样性的比较和分析。从10个筛选出的ISSR引物扩增得到120个位点信息,其中多态性条带百分率为91.67%,Nei’s基因多样性指数(h)为0.346 0,Shannon信息指数(I)为0.510 8。其遗传分化系数(Gst)为0.117 4,基因流(Nm)为3.758 5。研究结果表明玉竹天然种群的遗传多样性较为丰富,种群间基因交流较为频繁,遗传距离与地理距离具有一定的相关性。通过海岛与大陆种群遗传多样性的比对发现,海岛种群的遗传多样性略高于大陆种群,表明在孤立的生境和更为复杂的选择压力下,海岛玉竹种群可能会积累更多的遗传变异从而形成较高的遗传多样性水平。本文研究结果将为进一步探讨隔离生境中天然植物种群遗传进化规律提供证据。
ISSR-PCR;玉竹;遗传多样性;遗传结构
玉竹(Polygonatumodoratum)是百合科(Liliaceae)黄精属(Polygonatum)多年生草本植物。野生玉竹生于凉爽、湿润、无积水、土壤肥沃的林下或山野阴坡地,宜温暖湿润气候,喜阴湿环境,较耐寒[1]。
大连位于辽宁省辽东半岛南端,气候适宜,植物资源丰富。玉竹在我国分布较广,属于欧亚大陆温带地区广布种,在大连地区的分布范围也比较广泛,在采样过程中发现北至庄河仙人洞国家级自然保护区南至旅顺蛇岛均有玉竹种群的分布。国内外关于玉竹方面的研究很多,主要集中于易混种鉴定[2]、化学成分[3]、药理作用[4]、栽培技术及应用开发等方面。
简单重复序列间扩增即ISSR(inter-simple sequence repeat)是自加拿大蒙特利尔大学的Zietkiewicz等[5]于1994年创建的,它是一种建立在PCR反应基础上的新型的分子标记,具有操作简单、多态性丰富、试验重复性好的特点。国外关于玉竹遗传多样性方面的研究还未见报道。国内有对玉竹遗传多样性方面的研究,但全部集中于大陆间的不同省份之间或不同栽培品种间的玉竹遗传多样性比较,路放[6]利用ISSR分子标记技术对吉林地区8个品系的栽培玉竹品种进行分析,发现不同品系玉竹种间存在较高的多态性,遗传多样性较为丰富;卜静等[7]通过对我国5个省份共11个种群的野生玉竹和1个种群的栽培玉竹进行了ISSR分析,发现不同产地野生玉竹种间遗传多样性较为丰富,对环境变化的适应能力强,野生玉竹的遗传多样性高于栽培居群的遗传多样性。对于玉竹在海岛隔离生境的遗传多样性研究还没有报道,也没有相关学者对辽宁省地区内野生玉竹遗传多样性进行研究。虽然我国玉竹分布广泛,但是随着人们不断的采挖野生玉竹根茎进行栽培,野生玉竹的资源也在减少,遗传多样性会逐渐丧失。
本实验采用ISSR分子标记技术对辽宁省大连市的6个县市(区)共9个玉竹天然种群(其中5个为海岛种群,4个为大陆种群)的遗传多样性进行了比较和分析,获取9个种群的遗传学数据,在物种水平和种群水平上揭示玉竹种群遗传多样性的高低,揭示玉竹种群的遗传结构并探讨其形成的原因。同时,比较研究海岛和大陆玉竹种群的遗传结构、遗传多样性水平、遗传分化的特点,其结果将为探讨隔离生境中天然植物种群遗传进化规律提供证据。
1 实验材料
实验材料于2016年5~6月分别采自于大连地区9个不同的地点,分单株采集,样品间距离不少于20 m,采样时记录周边环境,折断茎部整株采集,采集后带回实验室进行二次鉴定,确保采集样品的准确性,然后将材料的嫩叶采集后用封口带单株封装,保存于实验室-20℃冰柜中备用,详细的采集信息见表1。
表1玉竹样品数量及采集地
Table1ThesamplesizeandlocationofP.odoratumpopulation
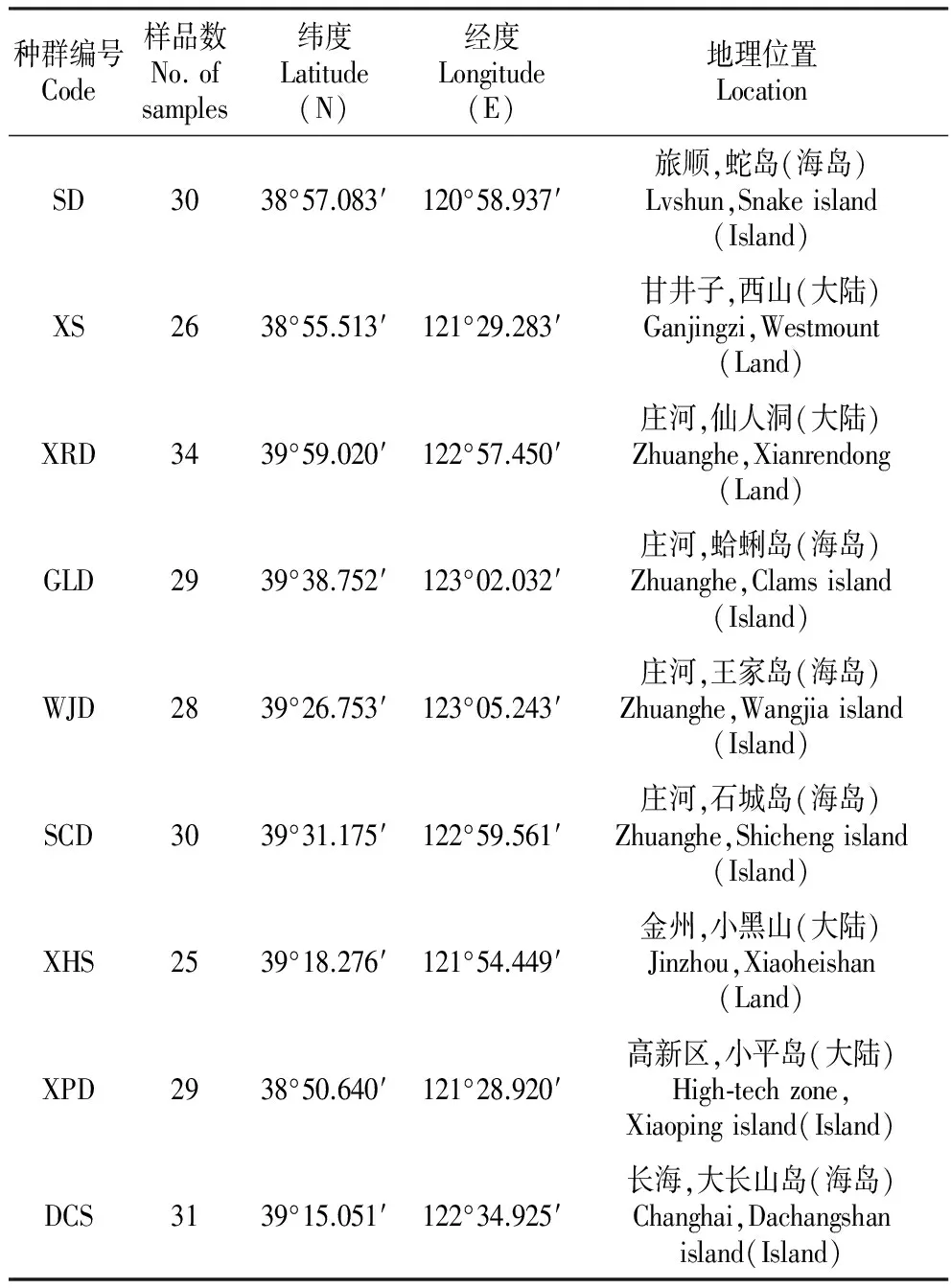
种群编号Code样品数No.ofsamples纬度Latitude(N)经度Longitude(E)地理位置LocationSD3038°57.083′120°58.937′旅顺,蛇岛(海岛)Lvshun,Snakeisland(Island)XS2638°55.513′121°29.283′甘井子,西山(大陆)Ganjingzi,Westmount(Land)XRD3439°59.020′122°57.450′庄河,仙人洞(大陆)Zhuanghe,Xianrendong(Land)GLD2939°38.752′123°02.032′庄河,蛤蜊岛(海岛)Zhuanghe,Clamsisland(Island)WJD2839°26.753′123°05.243′庄河,王家岛(海岛)Zhuanghe,Wangjiaisland(Island)SCD3039°31.175′122°59.561′庄河,石城岛(海岛)Zhuanghe,Shichengisland(Island)XHS2539°18.276′121°54.449′金州,小黑山(大陆)Jinzhou,Xiaoheishan(Land)XPD2938°50.640′121°28.920′高新区,小平岛(大陆)High⁃techzone,Xiaopingisland(Island)DCS3139°15.051′122°34.925′长海,大长山岛(海岛)Changhai,Dachangshanisland(Island)
2 实验方法
2.1 DNA的提取
玉竹DNA的提取采取张恒庆等[8]改良的CTAB法。粗提DNA样品进一步纯化处理后,进行琼脂糖凝胶电泳,用美国冷泉港P41G型凝胶成像系统照相。采用Gel Pro1.1软件对比样品条带与DL15000分子量标准的含量,确定DNA的含量和分子量,用双蒸水稀释成统一浓度后作为PCR反应的模板。
2.2 引物的筛选
ISSR引物为上海生工生物工程公司合成,稀释成10 μmol·L-1备用。在合成的27个引物中进行了筛选,选取扩增条带稳定、清晰、数量适中的10个引物作为本研究的引物,对全部样品进行扩增。具体引物名称及退火温度见表2。
表2引物名称、扩增位点数及最佳退火温度
Table2NumberofpolymorphiclociandoptimalannealingtemperatureofISSRprimer
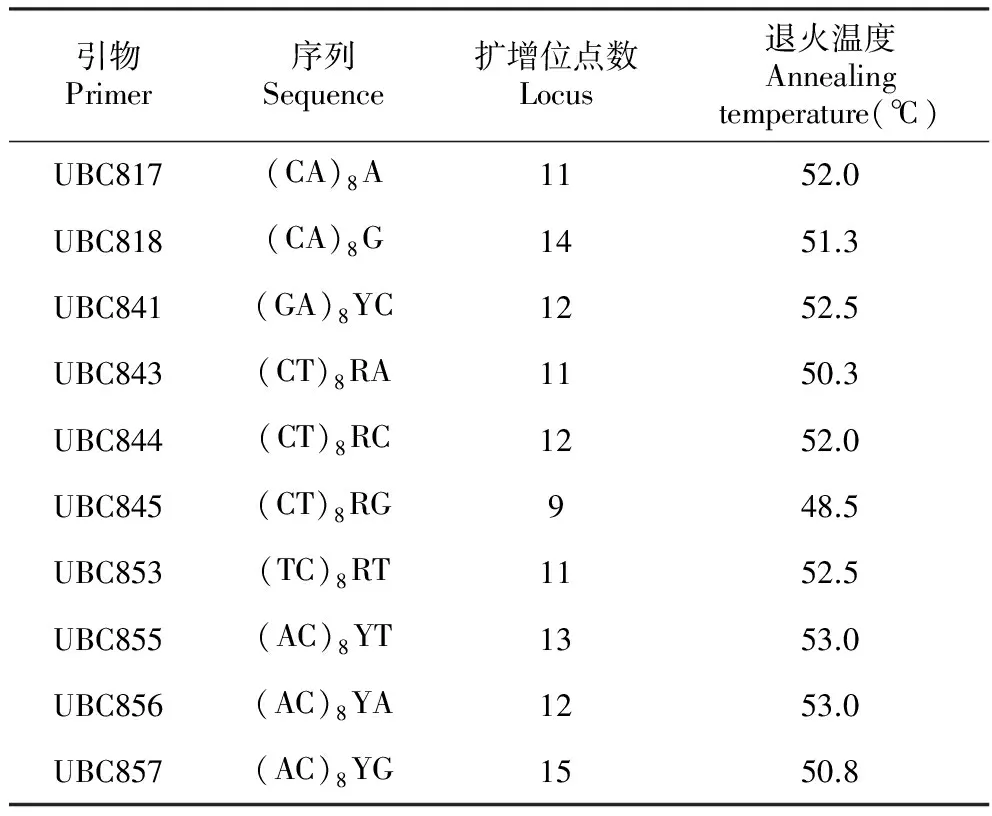
引物Primer序列Sequence扩增位点数Locus退火温度Annealingtemperature(℃)UBC817(CA)8A1152.0UBC818(CA)8G1451.3UBC841(GA)8YC1252.5UBC843(CT)8RA1150.3UBC844(CT)8RC1252.0UBC845(CT)8RG948.5UBC853(TC)8RT1152.5UBC855(AC)8YT1353.0UBC856(AC)8YA1253.0UBC857(AC)8YG1550.8
2.3 ISSR反应体系及PCR扩增
本实验参考陈玉秀等[9]的优化结果,并通过各组成成分的梯度实验,最终确定反应体系如下:总体积25 μL,包括10 ng模板DNA,0.4 μmol·L-1ISSR引物,10×PCR buffer 2.5 μL,0.2 mmol·L-1dNTP混合物,2.0 mmol·L-1MgCl2,1.0 UTaqDNA聚合酶,最后加ddH2O补齐至25 μL。
使用英国TECHNE TC-512型PCR循环仪进行PCR扩增,玉竹的ISSR-PCR反应程序为:94℃ 5 min进行预变性,35个循环,条件为94℃变性45 s,48.5~53.0℃退火45 s(退火温度因引物不同),72℃延伸90 s,最后在72℃保持7 min使扩增的片段充分延伸。
2.4 扩增产物检测及数据统计分析方法
PCR反应结束后,采用水平板琼脂糖凝胶电泳来检测扩增结果。具体操作为:1×TBE电泳缓冲液,凝胶浓度为1.2%,以DL2000作为分子量标准,80 V稳压电泳2.5 h。电泳结束后用凝胶成像系统照相,记录电泳结果。
根据电泳结果,选取多个位点记录不同物种的同一位点上的条带分布情况。记录时只记录那些电泳条带清晰,并能在重复实验中稳定出现的位点,有带的记为“1”,无带的记为“0”,不确定的记为“.”,最后形成数据库,经POPGENE1.32软件[10]进行遗传多样性分析,得出多态性条带百分率(PPB)、Nei’s基因多样性指数(h)、Shannon信息指数(I)、群体总基因多样性(Ht)、群体内基因多样性(Hs)、遗传分化系数(Gst)和基因流(Nm)等,同时利用软件对玉竹种群进行聚类分析。
3 实验结果
3.1 玉竹ISSR-PCR扩增结果及遗传多样性分析
本实验用筛选出的10个引物对大连地区的9个玉竹天然种群共262个个体进行了PCR扩增,选出的10个引物共检测到120个位点,每个引物检测到的位点数介于9~15个,扩增的DNA片段长度在150~2 000 bp,平均每个引物检测到12个位点。在检测到的120个位点中多态位点为110个,其种内多态位点比率为91.67%,9个种群内多态位点比率在69.17%~87.50%,其中多态位点比率最高的是SCD(石城岛)种群,最低的是XHS(小黑山)种群(表3),引物UBC845的部分扩增结果见图1。
表3在种群和物种水平上玉竹遗传多样性ISSR分析结果
Table3GeneticdiversityinP.odoratumdeterminedbyISSRmarkersatpopulationandspecieslevel

种群名称Population扩增位点数Locus多态位点比率PercentageofpolymorphismlociNei’s指数Nei’sgenediversity(h)Shannon指数Shannon’sinformationindex(I)WJD9680.000.3163(0.1853)0.4625(0.2583)XHS8369.170.2524(0.1987)0.3746(0.2809)XS8974.170.2771(0.1972)0.4085(0.2765)SCD10587.500.3308(0.1673)0.4880(0.2270)SD9579.170.3011(0.1814)0.4448(0.2546)XPD10184.170.3215(0.1748)0.4737(0.2402)GLD9982.500.3103(0.1767)0.4585(0.2463)DCS9780.830.3120(0.1816)0.4589(0.2525)XRD10184.170.3206(0.1754)0.4718(0.2427)Specieslevel11091.670.3460(0.1532)0.5108(0.2039)

图1 部分玉竹种群ISSR电泳图谱 M. DL2000Fig.1 ISSR electrophorogram of P.odoratum populations M. DL2000
3.2 玉竹种群间的遗传分化
根据POPGENE1.32软件计算,9个玉竹种群的遗传分化计算结果为玉竹种群的Ht为0.345 2,Hs为0.304 7,遗传分化系数Gst=0.117 4,说明有11.74%的遗传变异发生在种群间,玉竹的遗传变异主要发生在种群内,占总的遗传变异的88.26%。基因流(Nm)较大为3.758 5,说明种群间基因交流比较频繁。
3.3 玉竹的种群遗传距离和聚类分析
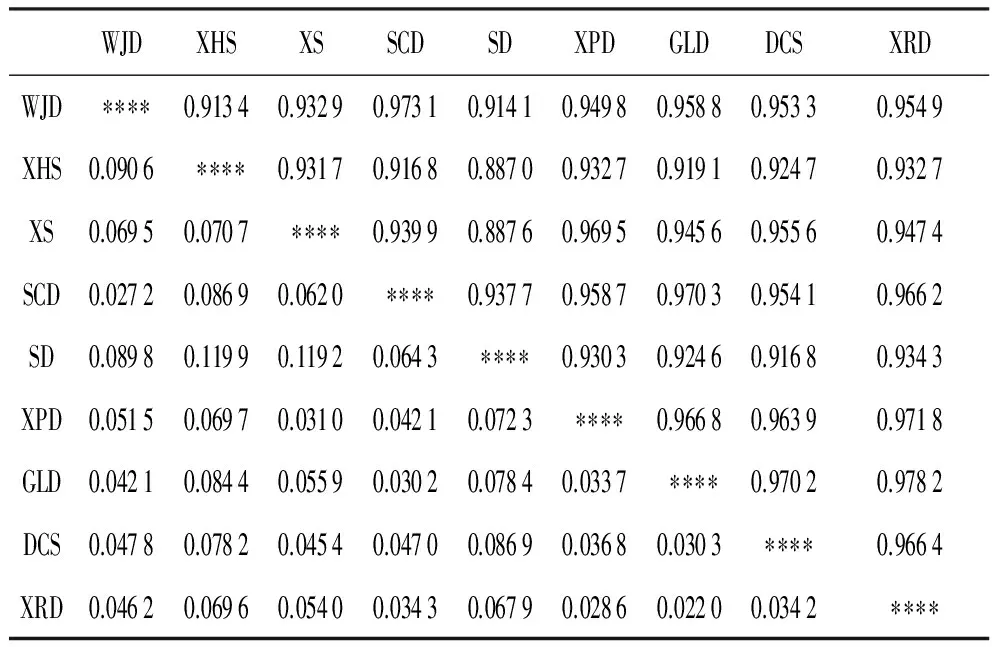
遗传距离(D)和遗传一致度(I)是衡量玉竹种群间的遗传差异和遗传相似性的重要指标,本研究运用POPGENE1.32软件进行计算,得到9个玉竹种群间的遗传距离(D)和遗传一致度(I),如表4所示,我们可以看到,GLD与XRD的遗传一致度最高,为0.978 2;XHS与SD的遗传一致度最低,为0.887 0。
根据所得到的Nei’s遗传距离(D)的数据,利用POPGENE1.32软件,采用非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA),对9个玉竹种群的进行聚类分析,从而得到种群间的遗传关系聚类图(图2)。从图2中可以看出,9个玉竹种群被分为4个主要集群,其中SD和XHS种群为独立的两个集群,XS和XPD聚为一个集群,其他种群构成一个集群。

图2 玉竹种群的UPGMA聚类图Fig.2 Dendrogram obtained by UPGMA cluster analysis based on Nei’s genetic distance(D) among P.odoratum populations
表4玉竹种群的遗传距离(斜线下)与遗传一致度(斜线上)
Table4Geneticdistance(undertheobliqueline)andgeneticidentity(ontheobliqueline)amongP.odoratumpopulations
WJDXHSXSSCDSDXPDGLDDCSXRDWJD∗∗∗∗0.91340.93290.97310.91410.94980.95880.95330.9549XHS0.0906∗∗∗∗0.93170.91680.88700.93270.91910.92470.9327XS0.06950.0707∗∗∗∗0.93990.88760.96950.94560.95560.9474SCD0.02720.08690.0620∗∗∗∗0.93770.95870.97030.95410.9662SD0.08980.11990.11920.0643∗∗∗∗0.93030.92460.91680.9343XPD0.05150.06970.03100.04210.0723∗∗∗∗0.96680.96390.9718GLD0.04210.08440.05590.03020.07840.0337∗∗∗∗0.97020.9782DCS0.04780.07820.04540.04700.08690.03680.0303∗∗∗∗0.9664XRD0.04620.06960.05400.03430.06790.02860.02200.0342∗∗∗∗
4 讨论
4.1 玉竹种群遗传多样性水平
遗传变异的程度直接表达了遗传多样性水平的高低,高水平的遗传多样性是维持物种长期生存和进化的基础条件。遗传多样性越高或遗传变异越丰富,植物适应生存环境变化的能力就越强,而遗传多样性的降低将会导致植物的适应能力下降,甚至会有灭绝的风险。本研究利用ISSR分子标记揭示了大连地区9个野生玉竹种群的在物种水平上的多态性条带比率(PPB)为91.67%,Nei’s基因多样性指数(h)为0.346 0,Shannon信息指数(I)为0.510 8。说明了玉竹种群的遗传多样性较为丰富,这与卜静等[6]通过对我国5个省份共11个种群的野生玉竹和1个种群的栽培玉竹进行ISSR分析(PPB=94.13%,h=0.432 1,I=0.619 7)所得到的结论基本一致。
本研究得到的玉竹遗传多样性较高的原因可能与玉竹自身的繁育系统有关,植物的繁育系统是决定植物遗传多样性的最主要的因素[11]。玉竹的繁殖方式为有性繁殖和无性繁殖两种方式并存。有性繁殖的遗传信息来源于亲本双方,这样更有利于基因的重组和突变,从而加大遗传变异几率,人们也普遍接受这一观点,但近年来研究[12]表明无性繁殖的种群也可以保持较高水平的遗传多样性。因而玉竹的两种繁殖方式使得其遗传多样性水平较高。通过结果我们也可以看到XHS种群的多态性条带比率(PPB)最低,为69.17%。这可能与强烈的人为干扰有关,XHS种群采集地位于森林公园的人行道旁,经常会有人在其种群分布范围内活动,强烈的人为干扰可能会导致其遗传多样性下降。人为干扰等外部因素通过某种间接方式(如影响植物的交配系统、瓶颈效应等)使等位基因数目或频率发生改变,最终使植物群体的遗传多样性水平和遗传结构发生变化[13]。
4.2 玉竹种群的遗传结构
本研究得到玉竹种群总体的遗传分化系数为0.117 4,基因流为3.758 5。表明了玉竹种群间基因交流较为频繁,种群间的分化程度较低。基因流主要通过花粉扩散和种子传播两种形式来实现,玉竹种群之所以基因流较大,这可能与玉竹种群在大连地区分布较广以及大陆种群及个别海岛种群间地理距离较近有关,XS与XPD种群地理距离较近,XRD和GLD之间,GLD与SCD、WJD之间的地理距离也较近,各岛屿间的人员流动增大了基因交流的可能性,岛屿一般在玉竹的开花期风比较大,加速了花粉的传播,间接的促进了基因的交流,岛屿的片段化生境并没有完全阻止基因流。同时玉竹又是欧亚地区广布种,在大连地区分布也较广,也是导致玉竹具有较大基因流的原因。
通过对遗传距离和UPGMA聚类分析的对比可以发现,XRD和GLD的遗传距离为0.022 0,说明二者的亲缘关系最近,而这两个种群的地理距离较近,可以进行基因交流,GLD虽然是一个岛屿,但其离岸距离很近,且有一条大坝与大陆相连,海水的隔离并不会对基因交流产生影响。SD与XHS的遗传距离最大,为0.119 9,说明了二者的亲缘关系最远,有较大的遗传背景差异,SD种群位于渤海海域,其它岛屿种群均来自黄海海域,较远的地理距离以及海水的阻隔阻止了与其他种群的基因交流,从而导致SD与其他种群的遗传差异较大。
UPGMA聚类图可以直接反映出各种群的亲缘关系,聚类结果与地理分布上具有一定的相关性,DCS种群与XRD、GLD的地理距离较远,但也聚为一类,表明地理距离在玉竹天然种群的遗传分化中可能并非唯一的主导因素,可能还受到周边生境及人为干扰等影响,具体原因还有待于更多岛屿种群并结合玉竹的生殖生物学与生态学方面的研究作出科学的评价。
4.3 玉竹海岛种群与大陆种群遗传多样性的比较
一般来说,一个物种的海岛种群遗传多样性由于奠基者效应或自然选择等原因会低于大陆种群的遗传多样性[14]。分析本研究所得结果,发现在玉竹的9个种群中,从总体上看海岛种群的遗传多样性略高于大陆种群。李丽等[15]利用SSR标记技术对来自海南、广东、广西的19个美丽鸡血藤野生种群的遗传多样性进行比较,发现海南种质较内陆种质拥有更高的遗传变异,推测可能由于美丽鸡血藤在岛屿生存面临较之大陆更为复杂的环境,而进化了较高的遗传多样性。分析玉竹形成海岛种群的遗传多样性略高于大陆种群的原因,一方面可能与种群规模和人为干扰有关,大陆种群中XRD种群采集地建有国家级自然保护区,XPD种群位于密林深处,很少受到人为干扰,玉竹的栖息地也保存的较好,使得这两个种群的遗传多样性相对较高;XHS种群受到人为干扰程度较大,在野外调查时还发现有人直接采挖玉竹根茎,对种群的破坏较大;XS种群规模较小。而海岛种群虽然会受到地理隔离和生境片段化的影响,但是其种群规模较大,同时海岛种群受到的人为干扰程度适中。导致大陆种群的遗传多样性差异较大且略低于海岛种群。另一方面,海岛种群也面临着海岛上更为复杂多样的气候及生存环境,多变的环境和孤立的生境使玉竹面临更为复杂的选择压力,可能会影响玉竹进化,导致海岛玉竹种群可能会积累更多的遗传变异从而形成较高的遗传多样性水平,用以适应复杂的生态环境。
1.中国科学院中国植物志编辑委员会.中国植物志:第15卷[M].北京:科学出版社,1978.
Editorial Committee Flora of China Chinese Academy of Sciences.Flora of China:vol.15[M].Beijing:Science Press,1978.
2.潘清平,周日宝,陈玉秀,等.玉竹不同品种的ISSR分子鉴定[J].中国现代中药,2008,10(10):28-30.
Pan Q P,Zhou R B,Chen Y X,et al.Identification ofPolygonatumodoratumby ISSR[J].Modern Chinese Medicine,2008,10(10):28-30.
3.竺平晖,陈爱萍.GC-MS法对湖南产玉竹挥发油成分的分析研究[J].中草药,2010,41(8):1264-1265.
Zhu P H,Chen A P.Analysis of volatile oils of PolygonatumOdoratumfrom Hunan by GC/MS[J].Chinese Traditional and Herbal Drugs,2010,41(8):1264-1265.
4.Choi S B,Park S.A steroidal glycoside fromPolygonatumodoratum(Mill.) Druce.improves insulin resistance but does not alter insulin secretion in 90% pancreatectomized rats[J].Bioscience,Biotechnology,and Biochemistry,2002,66(10):2036-2043.
5.Zietkiewicz E,Rafalski A,Labuda D.Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20(2):176-183.
6.路放.玉竹种质资源评价研究[D].长春:吉林农业大学,2014.
Lu F.Study on assessment of germplasm resources ofPolygonatumodoratum[D].Changchun:Jilin Agricultural University,2014.
7.卜静,王冬梅,李登武.不同产地野生玉竹种质资源多样性与亲缘关系的ISSR分析[J].中草药,2012,43(9):1824-1828.
Bu J,Wang D M,Li D W.ISSR analysis on diversity and genetic relationship in germplasm resources of wildPo1ygonatumodoratumfrom different habitats[J].Chinese Traditional and Herbal Drugs,2012,43(9):1824-1828.
8.张恒庆,安利佳,祖元刚.凉水国家自然保护区天然红松林遗传变异的RAPD分析[J].植物研究,2000,20(2):201-206.
Zhang H Q,An L J,Zu Y G.RAPD analysis on genetic variation ofPinuskoraiensisin Liang Shui national natural reserve[J].Bulletin of Botanical Research,2000,20(2):201-206.
9.陈玉秀,周日宝,潘清平,等.玉竹ISSR反应体系的优化[J].湖南中医药大学学报,2008,28(2):37-39.
Chen Y X,Zhou R B,Pan Q P,et al.Optimization for reaction system ofPolygonatumodoratumISSR[J].Journal of TCM University of Hunan,2008,28(2):37-39.
10.Yeh F C,Yang R C,Boyle T B,et al.POPGENE Version 1.32 Microsoft Windows-based freeware for populations genetic analysis.University of Alberta,Edmonton[M].Edmonton:Molecular Biology and Biotechnology Center,University of Alberta,1999.
11.王洪新,胡志昂.植物的繁育系统、遗传结构和遗传多样性保护[J].生物多样性,1996,4(2):92-96.
Wang H X,Hu Z A.Plant breeding system,genetic structure and conservation of genetic diversity[J].Chinese Biodiversity,1996,4(2):92-96.
12.Burd On R D,Aimers H J.Risk management for clonal forestry withPinusradiate-analysis and review.1:Strategic issues and risk spread[J].New Zealand Journal of forestry Science,2003,33(2):156-180.
13.文亚峰,韩文军,吴顺.植物遗传多样性及其影响因素[J].中南林业科技大学学报,2010,30(12):80-87.
Wen Y F,Han W J,Wu S.Plant genetic diversity and its influencing factors[J].Journal of Central South University of Forestry & Technology,2010,30(12):80-87.
14.Muller F,Voccia M,Bă A,et al.Genetic diversity and gene flow in a Caribbean treePterocarpusofficinalisJacq:a study based on chloroplast and nuclear microsatellites[J].Genetica,2009,135(2):185-198.
15.李丽,徐立,李志英,等.不同地理来源美丽鸡血藤遗传多样性的SSR分析[J].广东农业科学,2013,40(22):156-160.
Li L,Xu L,LI Z Y,et al.Genetic diversity ofCalleryaspeciosafrom different geographical origins by SSR markers[J].Guangdong Agricultural Sciences,2013,40(22):156-160.
introduction:HAO Jiu-Cheng(1992—),male,Master,mainly engaged in population genetics.
date:2017-03-04
GeneticDiversitybetweenIslandandMainlandNaturalPopulationsofPolygonatumodoratuminDalianAreabyISSR
HAO Jiu-Cheng JIA Xin MU Xiao-Hong ZHANG Heng-Qing*
(College of Life Sciences,Liaoning Normal University,Dalian 116081)
WithPolygonatumodoratum, a plant on both the mainland and islands in Dalian, we studied the genetic diversity of 262P.odoratumfrom 5 islands and 4 mainland populations by ISSR molecular marker technology. Information of 120 loci was obtained by amplification of 10 ISSR primers that were screened out, where the percentage of polymorphic bands was 91.67%, the gene diversity index of Nei’s was 0.346 0, and Shannon information index was 0.510 8. Its genetic differentiation coefficient was 0.117 4, and its gene flow was 3.758 5. The genetic diversity of natural populations ofP.odoratumwas relatively rich with relatively frequent gene exchange among different populations, and its genetic distance had certain correlation with its geographic distance. By comparison between genetic diversity of populations from the mainland and islands, the genetic diversity of populations from islands was slightly higher than that from the mainland, indicating that under a more isolated ecological environment and more complicated selection pressure, populations ofP.odoratumon islands might accumulate more genetic variation to form high levels of genetic diversity. Our results would provide evidence for further discussion on laws of genetic evolution of populations of natural plants in isolated ecological environments.
ISS-PCR;Polygonatumodoratum;genetic diversity;genetic structure
郝久程(1992—),男,硕士研究生,主要从事种群遗传学方面的研究。
* 通信作者:E-mail:hengqingzhang@163.com
2017-03-04
* Corresponding author:E-mail:hengqingzhang@163.com
Q949.71+8.23
A
10.7525/j.issn.1673-5102.2017.05.010

