甲醇溶剂环境下两种稳定构象α-丙氨酸分子的手性转变机理
方 巍,丁 蕾,杨 庄,朱晓玉,孙建业,王佐成
(1.白城师范学院 化学学院,白城 137000;2.白城师范学 经济管理学院,白城 137000; 3.白城师范学院 物理学院,白城 137000)
甲醇溶剂环境下两种稳定构象α-丙氨酸分子的手性转变机理
方 巍1,丁 蕾2,杨 庄3,朱晓玉3,孙建业3,王佐成3
(1.白城师范学院 化学学院,白城 137000;2.白城师范学 经济管理学院,白城 137000; 3.白城师范学院 物理学院,白城 137000)
采用密度泛函理论的B3LYP方法、微扰理论的MP2方法和自洽反应场(SCRF)理论的smd模型方法,研究了标题反应.势能面计算表明:标题反应的决速步骤均为第2基元反应,决速步能垒来自于质子从手性碳向氨基氮转移的过渡态.甲醇溶剂环境下构象1和2手性转变决速步的吉布斯自由能垒分别为109.8kJ·mol-1和111.0kJ·mol-1,比气相甲醇环境下的决速步能垒134.2kJ·mol-1和130.8kJ·mol-1均有明显降低,比水环境下的决速步能垒122.5kJ·mol-1也明显降低,比裸环境下的决速步能垒266.1kJ·mol-1大幅降低,比限域在SWBNNT(5,5)内的决速步能垒为201.1kJ·mol-1也显著降低.结果表明:甲醇分子簇对α-丙氨酸分子的手性转变具有明显的催化作用,甲醇溶剂效应对质子从手性碳向氨基氮的转移反应具有较好的助催化作用.
甲醇;手性转变;α-Ala;密度泛函理论;微扰理论;自洽反应场;过渡态
α-丙氨酸(α-Alanine,缩写为α-Ala)是一种组成人体蛋白质的重要氨基酸.根据构象和旋光性的不同,分为左旋体(S-α-Ala)和右旋体(R-α-Ala),这两种手性对映体具有不同的功能特性.S-α-Ala有预防肾结石、协助葡萄糖代谢、缓和低血糖等作用.R-α-Ala用于手性药物和手性助剂等领域,有抑菌作用.文献[1-2]的实验研究表明,生命体内有微量的R-α-Ala存在,生命体内过量的R-α-Ala可导致某些疾病和过早衰老,猜测其部分来源于S-α-Ala的旋光异构,但没有给出其手性转变反应机理.
由于生命体内有R-α-Ala存在并且光学纯的α-Ala具有重要作用,人们对α-Ala的结构特性及其旋光异构进行了大量的研究.文献[3-4]对α-Ala两种异构体的理论研究,得到了与实验数据比较吻合的α-Ala分子的构象和红外振动频率.文献[5]利用单晶的中子衍射研究了295K和60K时,α-Ala分子的手性对映体结构特性及其旋光异构的可能性.文献[6-10]的研究表明:α-Ala分子手性转变裸反应可在4个不同的通道实现,以氨基氮为质子迁移桥梁的通道为优势通道,决速步吉布斯自由能垒为266.1kJ·mol-1,来源于质子从手性碳向氨基氮转移的过渡态;在水环境下,该能垒被降到122.5kJ·mol-1.文献[11-12]的研究表明:MOR分子筛和单壁碳纳米管对α-Ala分子手性转变反应具有一定的限域催化作用.文献[13]的研究表明:SWBNNT(5,5)对α-丙氨酸基于氨基做质子转移桥梁的手性转变反应具有较好的催化作用,使决速步吉布斯自由能垒降为201.1·kJ·mol-1.
对α-Ala的旋光异构的研究虽然已经比较深入,研究结果对于解释生命体内右旋α-Ala的存在,对于实验上实现α-Ala的手性转变具有一定的积极作用.但对α-Ala分子手性转变反应溶剂效应的研究还有许多工作尚未开展,甲醇是一种比较重要的溶剂,乙醇中含有少量甲醇,人们在摄入乙醇时,生命体内就会有甲醇存在,文献[14]的研究表明,对7_羟基喹啉质子迁移过程,甲醇溶剂比水溶剂有着更好的助催化作用.基于文献[8,10,13-14]的研究经验,进行了甲醇溶剂环境下α-Ala分子基于氨基作氢迁移桥梁的手性转变机理的研究,为进一步深入研究α-Ala在其他溶剂环境下的手性转变奠定了基础.
1 研究与计算方法
基于密度泛函理论的B3LYP[15-16]方法、微扰理论的MP2方法[17-18],研究α-Ala分子在甲醇溶剂环境下的手性转变过程.对H迁移过程,首先将甲醇视为离散介质,考察甲醇分子作为质子迁移媒介的催化作用,然后再考察甲醇的溶剂效应;对没有H迁移的分子异构过程,直接考察甲醇溶剂环境下的异构反应.计算溶剂效应把甲醇视为连续介质,同时考虑静电和非静电效应,采用自洽反应场(SCRF)理论的smd模型方法[19].在MP2/6-311++G(2df,pd)∥B3LYP/6-31+G(d,p)双理论水平,全优化反应过程中的稳定点和过渡态[20-21],利用Gtotal=ESP+Gtc(Gtotal为热校正的总自由能,ESP为高水平的单点能,Gtc为吉布斯自由能热校正)计算热校正的总自由能,绘制反应势能面.S-α-Ala的构型1记作S-α-Ala_1,S表示该α-Ala为左旋,右旋则用R表示;甲醇溶剂环境下的α-Ala记为α-Ala@methanol;α-Ala分子与2个甲醇分子通过氢键作用形成的络合物分子记为α-Ala·2CH3OH,其余体系的表示法类似.络合物分子的溶剂化总自由能用气相络合物分子的吉布斯自由能热校正与高水平的溶剂化单点能之和表示,单体分子的溶剂化总自由能用甲醇溶剂化的吉布斯自由能热校正与高水平的溶剂化单点能之和表示,通过对过渡态虚频振动模式的分析和内禀反应坐标(IRC)[22]计算,对过渡态的可靠性进行确认.所有计算均由Gaussian09[23]软件完成.
2 结果与讨论
α-Ala分子可以有多种构象存在,由能量最低原理可知,体系能量越低越稳定,由于分子内的氢键可以降低体系能量,所以存在分子内氢键的α-Ala分子构象具有优势.已有研究[24]表明,具有氨基和羧基之间的分子内较强的单氢键以及具有氨基和羧基之间的两条氢键的氨基酸结构相对稳定.基于此,在B3LYP/6-311++G(d,p)理论水平,对具有上述两种氢键的单体S型α-Ala和R型α-Ala的几何构型进行优化,得到图1所示的两对互为对映体的结构.
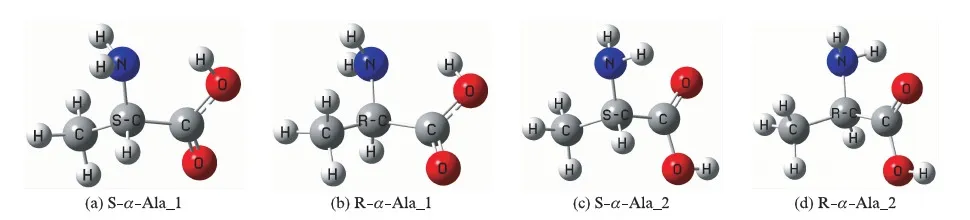
图1 2种稳定构象α-Ala的手性对映体结构Fig.1 Chiral enantiomer structures of two stable geometries of α-Ala
由图1可以看出,氨基作H迁移桥梁,S-α-Ala_1实现手性转变可有两个反应通道.1是手性碳上的质子直接以氨基N为桥从纸面外迁移到纸面里;2是羧基实现从反式平面结构向顺势平面结构的异构后,手性碳上的质子再以氨基N为桥从纸面外迁移到纸面里.前者是质子协同转移机理,后者是质子分步转移机理.已有研究[25-27]表明,分步机理具有绝对优势,因此,对S-α-Ala_1的手性转变只讨论分步机理.而氨基作H迁移桥梁,S-α-Ala_2实现手性转变只有一个反应通道.下面对他们在甲醇环境下基于氨基作氢迁移桥梁的手性转变分别进行讨论.
2.1甲醇催化S-α-Ala_1分子的手性转变机理
研究发现S-α-Ala_1分子的手性转变经历5个基元反应,计算的各驻点结构、过渡态的虚频振动模式见图2,各驻点结构的吉布斯自由能热校正、单点能、总自由能、相对总自由能和过渡态的虚频见表1,根据表1画出的反应势能面见图3.
首先,S-α-Ala_1@methanol经过羧基上的12H绕9C-10O键轴旋转的过渡态S-TS1_1@methanol,异构成中间体S-INT1_1@methanol.从S-α-Ala_1@methanol到S-TS1_1@methanol过程,二面角12H-10O-9C-11O从179.24°变为-90.96°,二面角7H-6N-1C-13H从-27.95°变为-49.02°,二面角6N-1C-4C-9C从123.12°变为123.46°,二面角1C-9C-11O-10O从-178.46°变为174.71°,此过程骨架结构改变很小,无断键,只是羟基和氨基的旋转,所需的形变能量很小,活化能垒只有52.7kJ·mol-1.从S-α-Ala_1@methanol到S-INT1_1@methanol,二面角12H-10O-9C-11O从179.24°变为-1.5°,基本实现了羧基从反式向顺式平面结构的异构;与此同时,二面角7H-6N-1C-13H从-27.95°变为-63.97°,氨基氮的纸面外侧裸露出来,负电荷密度增大,接受来自于纸面外的质子的能力增加,使质子从手性碳向其迁移变得相对容易.

图2 S-α-Ala_1的手性转变过程、驻点结构和过渡态的虚频振动模式Fig.2 The chiral transformation process,the stationary points configuration and transition state imaginary frequency vibration modes of S-α-Ala_1

表1 甲醇环境下S-α-Ala_1手性转变过程各驻点的吉布斯自由能热校正、单点能、总自由能、相对总自由能及过渡态虚频
然后,S-INT1_1与其氨基和手性碳前面的2个CH3OH分子通过氢键作用形成氢键络合物S-INT1_1·2CH3OH,S-INT1_1·2CH3OH经过渡态TS2_1·2CH3OH,实现了以2个甲醇分子簇为媒介,质子从手性碳向氨基氮的迁移过程,异构成氨基质子化的中间体产物络合物INT2_1·2CH3OH(m)(m表示CH3OH分子在INT2_1的前面与INT2_1通过氢键作用络合).此过程中,二面角6N-1C-4C-9C从128.59°变为128.22°,二面角1C-9C-11O-10O从-177.34°变为-175.39°,骨架结构基本没有改变,骨架形变需要的能量很小;7元环结构过渡态TS2_1·2CH3OH的氢键键角1C-13H-15O、15O-25H-21O和21O-19H-6N分别为162.81°,159.82°和164.69°,均接近平角,各个氢键都较强;二面角1C-13H-15O-25H、15O-25H-21O-19H和25H-21O-19H-6N分别为8.95°,0.95°和10.34°,7元环结构接近平面,张力小.因此7元环结构过渡态TS2_1·2CH3OH产生的能垒不会太高,只有134.2kJ·mol-1,比此基元裸反应能垒266.1kJ·mol-1[8]大幅降低.甲醇溶剂效应又使TS2_1·2CH3OH产生的能垒进一步降低到109.8kJ·mol-1,说明甲醇溶剂对甲醇分子催化的氢迁移反应具有较好的助催化作用.接着INT2_1与其后面的2个CH3OH分子通过氢键作用形成中间体反应物络合物INT2_1·2CH3OH(n)(n表示CH3OH分子在INT2_1的后面与INT2_1通过氢键作用络合),INT2_1·2CH3OH(n)经过和TS2_1·2CH3OH基本对称的过渡态TS3_1·2CH3OH,实现了质子在纸面里从质子化氨基向手性碳的迁移,实现手性转变,异构成产物中间体R-INT3_1·2CH3OH.此基元反应相似于第2基元反应的逆过程,TS3_1·2CH3OH的能量同于INT2_1·2CH3OH(n)不很高,而INT2_1·2CH3OH(n)的能量高于S-INT1_1·2CH3OH的能量,因此TS3_1·2CH3OH产生的能垒远远低于TS2_1·2CH3OH产生的能垒,只有7.0kJ·mol-1,甲醇溶剂效应使该能垒变为9.5kJ·mol-1,有微小的升高.然后,R-INT3_1@methanol经过氨基左右翻转的过渡态R-TS4_1@methanol(俯视图),异构成第4中间体R-INT4_1@methanol.最后,R-INT4_1@methanol经和S-TS1_1@methanol相似的过渡态R-TS5_1@methanol,异构成具有氨基和羧基之间的分子内较强的单氢键的产物R-α-Ala_1@methanol.第4和5基元反应只是基团的翻转和键旋转过程,无断键,需要逾越的能垒不高,分别是17.7kJ·mol-1和40.0kJ·mol-1.

图3 甲醇催化S-α-Ala_1分子的手性转变反应吉布斯自由能势能面Fig.3 The free potential energy surfaces diagram of chiral transition reaction of S-α-Ala_1 molecules by methanol catalysis
从图3可以看出:甲醇溶剂环境下S-α-Ala_1分子手性转变反应的决速步能垒是109.8kJ·mol-1,远远小于质子迁移的“极限能垒”167.0kJ·mol-1[28].因此,S-α-Ala_1分子的手性转变反应可以在甲醇溶剂里实现.109.8kJ·mol-1比裸环境下S-α-Ala旋光异构的决速步能垒266.1kJ·mol-1大幅降低[8],比限域在SWBNNT(5,5)内S-α-Ala旋光异构的决速步能垒201.1·kJ·mol-1也显著降低[13],比水环境下S-α-Ala旋光异构的决速步能垒122.5kJ·mol-1也明显降低[10].因此,甲醇分子簇和甲醇溶剂对质子从手性碳向氨基氮迁移反应具有较好的共催化作用,使甲醇溶剂环境下α-Ala分子的手性转变可以实现.
2.2甲醇催化S-α-Ala_2分子的手性转变机理
研究发现S-α-Ala_2分子的手性转变需经历4个基元反应,考虑到后半程与前半程具有对称相似性,并且第2基元反应是决速步,为节省篇幅,这里只讨论前半程,即第1和2基元反应.计算的各驻点结构、过渡态的虚频振动模式见图4,各驻点结构的吉布斯自由能热校正、单点能、总自由能、相对总自由能和过渡态的虚频见表2,根据表1画出的反应势能面见图5.
首先S-α-Ala_2@methanol经过氨基团绕1C-6N旋转的过渡态S-TS1_2@methanol,异构成为第1中间体产物S-INT1_2@methanol.S-α-Ala_2@methanol到S-TS1_2@methanol过程中,二面角8H-6N-1C-9C从-57.66°变为7.71°,氨基团俯视逆时针旋转65.37°,二面角6N-1C-4C-9C从124.45°变为125.46°,骨架结构基本没有改变,氨基团旋转需要的能量很小,只有9.9kJ·mol-1.S-α-Ala_2@methanol到S-INT1_2@methanol过程中,二面角8H-6N-1C-9C从-57.66°变为64.11°,氨基团俯视逆时针旋转121.78°,氨基氮的纸面外侧裸露出来,负电荷密度增大,接受来自于纸面外的质子的能力增加,使质子从手性碳向其迁移变得相对容易.然后,a_S-INT1_2与其氨基和手性碳前面的2个CH3OH分子通过氢键作用形成氢键络合物S-INT1_2·2CH3OH,S-INT1_2·2CH3OH经过渡态TS2_1·2CH3OH,实现了以2个甲醇分子簇为媒介,质子从手性碳向氨基氮的迁移过程,异构成氨基质子化的中间体产物络合物INT2_2·2CH3OH.此过程中,二面角6N-1C-4C-9C从124.70°变为124.47°,二面角1C-9C-11O-10O从179.62°变为176.26°,骨架结构基本没变,骨架形变需要的能量很小;7元环结构过渡态TS2_2·2CH3OH的氢键键角1C-13H-15O、15O-25H-21O和21O-19H-6N分别为164.16°、160.52°和166.05°,均接近平角,各个氢键都较强;二面角1C-13H-15O-25H、15O-25H-21O-19H和25H-21O-19H-6N分别为2.45°、2.36°和15.81°,7元环结构基本共面,张力较小.因此7元环结构过渡态TS2_2·2CH3OH比较稳定,产生的能垒不会太高,只有130.8kJ·mol-1,比此基元裸反应能垒266.1kJ·mol-1[8]大幅降低.甲醇溶剂效应又使TS2_2·2CH3OH产生的能垒进一步降低到111.0kJ·mol-1,说明甲醇溶剂对甲醇分子催化的S-INT1_2的氢迁移反应具有较好的助催化作用.
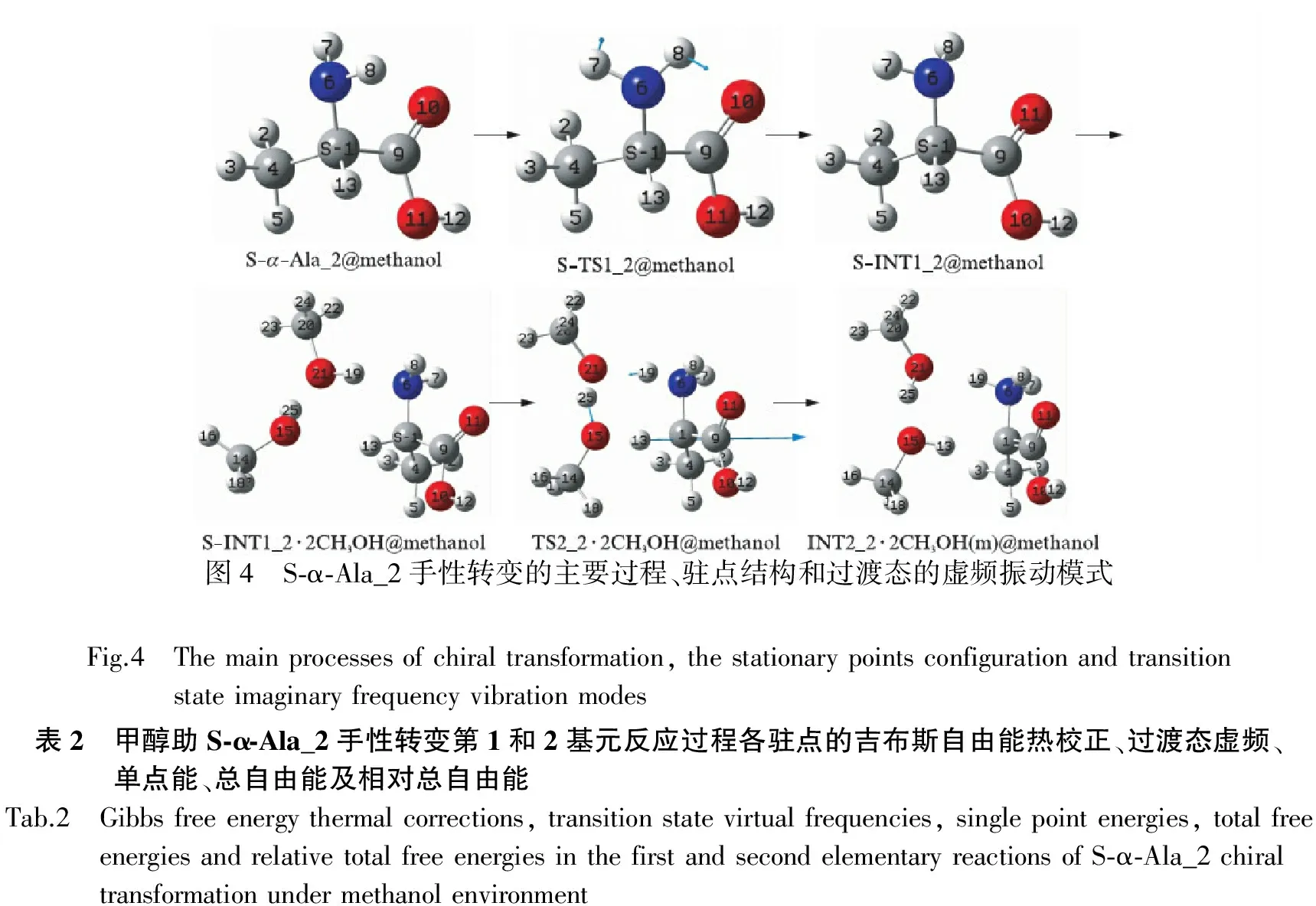

反应环境驻点结构Gtc/(a.u)Esp/(a.u)Gtotal/(a.u)ΔGtotal/(kJ/mol)Ima/cm-1第一基元反应甲醇溶剂效应S⁃α⁃Ala_2@methanol0 07639-323 18008-323 103690 0S⁃TS1_2@methanol0 07661-323 17653-323 099929 9216 73S⁃INT1_2@methanol0 07680-323 17875-323 101954 6第二基元反应甲醇气相S⁃INT1_2·2CH3OH0 16766-554 21588-554 048220 0TS2_2·2CH3OH0 16643-554 16483-553 99840130 8912 88INT2_2·2CH3OH0 17083-554 17331-554 00248120 1甲醇溶剂效应S⁃INT1_2·2CH3OH@methanol0 16766-554 23460-554 066940 0TS2_2·2CH3OH@methanol0 16643-554 19110-554 02467111 0912 88INT2_2·2CH3OH@methanol0 17083-554 19874-554 02791102 5
从图5可以看出:甲醇溶剂环境下S-α-Ala_2分子手性转变反应的决速步能垒是111.0kJ·mol-1,远远小于质子迁移的“极限能垒”167.0kJ·mol-1[28].因此,S-α-Ala_2分子的手性转变反应可以在甲醇溶剂里实现.111.0kJ·mol-1比裸环境下S-α-Ala旋光异构的决速步能垒266.1kJ·mol-1大幅降低[8],比S-α-Ala限域在SWBNNT(5,5)内旋光异构的决速步能垒201.1·kJ·mol-1也显著降低[13],比水环境下S-α-Ala旋光异构的决速步能垒122.5kJ·mol-1也明显降低[10].因此,甲醇分子簇催化和甲醇溶剂助催化的共同作用,使甲醇溶剂环境下可以实现α-Ala分子的手性转变.

图5 甲醇催化S-α-Ala_2分子的手性转变反应主要历程的吉布斯自由能势能Fig.5 The free potential energy surfaces diagram of chiral transition reaction of S-α-Ala_2 molecules by methanol catalysis
势能面研究表明:S-α-Ala_1和S-α-Ala_2手性转变的决速步骤均为第2基元反应,决速步能垒来自于质子从手性碳向氨基氮转移的过渡态.甲醇溶剂环境下,S-α-Ala_1和S-α-Ala_2手性转变决速步的吉布斯自由能垒分别为109.8kJ·mol-1和111.0kJ·mol-1,比气相甲醇环境和水环境下它们手性转变的决速步能垒均有明显降低,比裸环境下的决速步能垒大幅降低,比限域在SWBNNT(5,5)内的决速步能垒也显著降低.结果表明:甲醇分子簇助质子迁移和甲醇的溶剂效应使α-Ala分子的旋光异构可以在水环境下实现.
[1] FISHER G H,D’ANIELLO A,VETERE A,etal.Free D-aspartate and D-alanine in normal and Alzheimer brain [J].BrainResearchBulletin,1991,26(6):983-985.
[2] ROBERT J T,ARCHIE H G,DANIEL A P,etal.Pathogenicity and immunogenicity of a listeria monocytogenes strain that requires D-alanine for growth [J].InfectionandImmunity,1998,66(8):3552-3561.
[3] EMADEDDIN T,JALKANEN K J,SNDOR S.Structure and vibrational spectra of the zwitterion L-alanine in the presence of explicit water molecules:A density Functional Analysis [J].JPhysChemB,1998,102(30):5899-5913.
[4] STEPANIAN S G,REVA I D,RADCHENKO E D,etal.Conformational behavior of α-Alanine matrix-isolation infrared and theoretical DFT and ab initio study [J].JPhysChemA,1998,102(24):4623-4629.
[5] 王文清,刘轶男,龚.手性分子的宇称破缺:D和L Ala的变温中子结构研究 [J].物理化学学报,2004,20(11):1345-1351.
[6] 王佐成,刘凤阁,吕洋,等.孤立条件下α-Ala分子手性转变机制的DFT研究 [J].吉林大学学报(理学版),2014,52(4):825-830.
[7] 王佐成,赵衍辉,梅泽民,等.α-Ala分子手性转变反应通道及水分子作用的理论研究 [J].浙江大学学报(理学版),2015,42(2):189-197.
[8] 李忠,梅泽民,王佐成,等.基于氨基作H转移桥梁单体α-Ala的手性转变机理 [J].复旦学报(自然科学版),2015,54(5):642-647.
[9] 王佐成,佟华,梅泽民,等.水环境下α-Ala分子手性转变机制的理论研究 [J].吉林大学学报(理学版),2015,53(1):134-141.
[10] 王彦全,王佐成,闫红彦,等.水环境下基于氨基作氢迁移桥梁α-丙氨酸的手性转变机制 [J].中山大学学报(自然科学版),2016,55(5):57-65.
[11] 马宏源,王佐成,赵晓波.MOR分子筛12元环孔道对α-Ala手性转变反应的限域影响 [J].复旦学报(自然科学版),2016,55(1):133-144.
[12] 王佐成,梅泽民,闫红彦,等.单壁碳纳米管的尺寸和手性对α-丙氨酸分子手性转变的限域影响 [J].吉林大学学报(理学版),2015,53(4):791-801.
[13] WANG ZUO CHENG,LIU YAN FANG,YAN,HON YAN.etal.Theoretical Investigations of the Chiral Transition of αAmino Acid Confined in Various Sized Armchair Boron—Nitride Nanotubes [J].JPhysChemA,2017,1:1833-1840.
[14] 谭英雄,李来才.醇水催化7羟基喹啉质子迁移过程的反应机理研究 [J].四川师范大学学报(自然科学版),2011,34(1):556-559.
[15] BECKE A D.Density-functional thermochemistry.III.The role of exact exchange [J].JChemPhys,1993,98(7):5648-5652.
[16] PARR R G,YANG W.Density-Functional Theory of Atoms and Molecules[M].Oxford:Oxford University Press,1994.
[17] 徐光宪,黎乐民,王德民.量子化学(中册)[M].北京:科学技术出版社,1985,962-986.
[18] BINKLEY J S,POPLE J A.Moeller-Plesset theory for atomic ground state energies [J].IntJQuantumChem,1975,9(2):229-236.
[19] ALEKSANDR V M,CHRISTOPHER J C,DONALD G T.Universal slovation Mmodel based on solute electron density and on a continuum model of the solvent defined by the bulk dielectric constant and atomic surface tensions [J].JPhysChemB,2009,113(18):6378-6396.
[20] GARRETT B C,TRUHLAR D G.Generalized transition state theory.Classical mechanical theory and applications to collinear reactions of hydrogen molecules [J].JPhysChem,1979,83(8):1052-1079.
[21] GARRETT B C,TRUHLAR D G.Criterion of minimum state density in the transition state theory of bimolecular reactions [J].JChemPhys,1979,70(4):1593-1598.
[22] ISHIDA K,MOROKUMA K,KOMORNICKI A.The intrinsic reaction coordinate.An ab initio calculation for HNC→HCN and H-+ CH4→CH4+ H-[J].JChemPhys,1977,66(5):2153-2156.
[23] FRISCH M J,TRUCKS G W,SCHLEGEL H B,etal.Gaussian 09.Revision E.01 [CP].Pittsburgh,USA:Gaussian,Inc.,Wallingford CT,2013.
[24] 黄志坚.氨基酸的构型和性质研究 [D].合肥:中国科学技术大学,2006:11.
[25] 赵晓波,李晨洁,王佐成,等.基于氨基做质子迁移桥梁亮氨酸的手性转变机理及水溶剂化效应 [J].中山大学学报(自然科学版),2017,56(2):20-27.
[26] 张新,李晨洁,董丽荣,等.基于氨基做质子迁移桥梁苯丙氨酸分子的旋光异构反应机理 [J].复旦学报(自然科学版).2017,56(2):241-250.
[27] 高峰,姜丽莎,闫红彦.基于氨基做质子迁移桥梁蛋氨酸分子的旋光异构机理 [J].吉林大学学报(理学版),2017,55(4):1012-1019.
[28] GORB L,LESZCZYNSKI J.Intramolecular proton transfer in mono-and dihydrated tautomers of guanine:an ab initio post hartree-fock study [J].AmChemSoc,1998,120:5024-5032.
TheChiralTransitionMechanismofTwoStableConformationsofα-AlanineMoleculesinMethanolSolventEnvironment
FANGWei1,DINGLei2,YANGZhuang3,ZHUXiaoyu3,SUNJianye3,WANGZuocheng3
(1.CollegeofChemistry,BaichengNormalUniversity,Baicheng137000,China; 2.CollegeofEconomicManagement,Baicheng137000,China; 3.CollegeofPhysics,BaichengNormalUniversity,Baicheng137000,China)
The chiral conversion mechanism of two kinds of the most stable configurations of α-alanine molecule in methanol solvation were researched by using the B3LYP method of density functional theory,the MP2 method of perturbation theory,and smd model method of self consistent reaction field theory.Calculations of potential energy surface show that the second elementary reaction is step-determining in the title reaction.The step-determining Gibbs free energy barriers are 109.8 kJ·mol-1and 111.0 kJ·mol-1,respectively,which are generated by the transition state of proton transfer from the chiral carbon to the amino N,they are 134.2 kJ·mol-1and 130.8 kJ·mol-1in gaseous methanol.The step-determining Gibbs free energy barrier is 122.5 kJ·mol-1in water and is 266.1 kJ·mol-1in the isolation condition and is 201.1 kJ·mol-1in the SWBNNT(5,5).It shows that methanol clusters have obvious catalytic effect on the chiral transition of α-alanine molecules and the methanol solvent has a better catalytic effect on the proton transfer from chiral carbon to amino nitrogen.
methanol;chiral transition; α-Alanine; density functional theory; perturbation theory; self-consistent reaction field; transtion state
0427-7104(2017)05-0636-09
2017-03-10
吉林省科技发展计划自然科学基金(20130101308JC);吉林省高等学校大学生创新项目(2017第116号)
方 巍(1973—),副教授,E-mail:fangwei1026@163.com;王佐成(1963—),男,副教授,硕士,通信联系人,E-mail:wangzc188@163.com.
O641.12
A

