重组人红细胞生成素对新型支气管肺发育不良早产鼠模型血管内皮生长因子表达的影响
赵日红,白纪红,刘 曼,黄 艳
(桂林医学院附属医院:1.新生儿科;2.研究生科;3.教学管理部,广西桂林 541000)
重组人红细胞生成素对新型支气管肺发育不良早产鼠模型血管内皮生长因子表达的影响
赵日红1,白纪红2△,刘 曼1,黄 艳3
(桂林医学院附属医院:1.新生儿科;2.研究生科;3.教学管理部,广西桂林 541000)
支气管肺发育不良;红细胞生成素,重组;血管内皮生长因子
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是早产儿的一种严重慢性呼吸系统疾病,其病死率及致残率极高,是威胁早产儿健康和生命的重要疾病之一,目前其发病机制尚不清楚。研究表明,血管内皮生长因子(vascular endothelial growth factor,VEGF)相关信号通路的异常在其发病过程中起着重要的作用[1]。根据文献报道及课题组前期研究,发现重组人红细胞生成素(recombinant human erythropoietin,rhEPO)对新型BPD大鼠模型具有保护作用[2-4];而红细胞生成素(EPO)也可刺激血管内皮细胞增殖和血管形成,二者能以协同作用发挥血管效应[5-6]。本实验通过观察rhEPO对新型BPD早产鼠模型肺组织中VEGF表达的影响,初步探讨BPD的发生、发展与VEGF的关系,并为rhEPO的临床应用提供理论依据。
1 材料与方法
1.1材料
1.1.1实验动物 SD雌鼠60只(体质量220~250 g),SD雄鼠20只(体质量250~300 g),均由桂林医学院实验动物中心提供(合格证号:SCXK桂2007-0001)。雌雄鼠按3∶1合笼交配,次日清晨观察雌鼠孕栓或取雌鼠阴道分泌物涂片,镜检见精子,当日记为妊娠第1天。
1.1.2主要药物与试剂 脂多糖(LPS,美国Sigma公司);rhEPO(协和发酵麒麟株式会社);VEGF反转录PCR(RT-PCR)试剂盒(北京艾德莱生物科技有限公司);β-actin、VEGF引物(美国Invitrogen公司)。
1.2方法
1.2.1模型建立及分组[3-4]孕鼠随机分为两组,磷酸盐缓冲液(PBS)组和LPS组,于孕第15天(70%胎龄)给予10%水合氯醛(0.3 m/kg)腹腔麻醉后,打开孕鼠腹腔,LPS组用微量加样器将LPS(30 ng/mL)注射于孕囊内,每个孕囊5 μL;PBS组注入等量PBS。于孕21 d(孕产期为22 d)将早产鼠剖宫娩出,对所有早产鼠进行编号。并于生后6 h内再将所有早产鼠分为以下5组:(1)PBS+空气组,47只;(2)PBS+高氧组,47只;(3)PBS+高氧+rhEPO组,48只;(4)LPS+高氧组,71只;(5)LPS+高氧+rhEPO组,70只。其中每组取14只早产鼠用于生存分析观察,其余早产鼠用于其他指标检测。
1.2.2高氧干预 将早产鼠于出生6 h内连同母鼠及鼠笼一同置于氧箱内,氧浓度维持在60%,氧浓度每天定时监测4次,氧箱内放置钠石灰吸收二氧化碳,无水氯化钙吸收水分。每天定时开箱2 h,更换垫料、钠石灰和无水氯化钙,同时添加饲料和水。空气组早产大鼠与母鼠置于空气中饲养。
1.2.3rhEPO干预 各rhEPO干预组早产大鼠于高氧暴露6 h后开始第1次背部皮下注射rhEPO,剂量1 200 IU/kg,隔天1次,共7次。
1.2.4肺组织标本的处理 将上述5组早产鼠均于生后1、7、14 d分别抽取8只,以5%水合氯醛进行腹腔注射(0.6 mL/100 mg)麻醉。打开胸腔,暴露心肺,分离双肺,电子天平上称质量;做肺组织切片苏木精-伊红(HE)染色,观察肺组织病理变化;收集其余肺组织,置于RNase的Eppendorf管中,液氮速冻,-80 ℃冰箱保存,用于蛋白质印迹法(Western blot)和RT-PCR检测肺组织VEGF表达水平。
1.2.5生存分析 每组大鼠生存率估计使用Kaplan-Meier法,因实验需要处死大鼠,按结尾数据处理。以生存时间为横坐标,日生存率为纵坐标,作生存曲线。
1.2.6肺组织病理观察 肺组织切片经HE染色,具体流程:脱蜡、水化、染色、封片,光学显微镜下观察,每组各时间点分别选取不同的动物组织切片2张,每张切片于光镜下(×200)观察5个视野,进行肺形态结构观察。
1.2.7Western blot检测肺组织VEGF蛋白表达水平 各组分别提取肺组织总蛋白,二喹啉甲酸(BCA)法进行蛋白质定量,再采用Western blot检测肺组织VEGF蛋白表达水平,在暗室中进行化学发光,胶片曝光显影后分析结果。以目的蛋白与β-actin的灰度比值表示蛋白相对表达水平。
1.2.8RT-PCR检测肺组织VEGF mRNA表达水平 严格按试剂盒步骤操作提取肺组织总RNA,反转录成cDNA,PCR扩增。扩增VEGF引物序列:上游5′-GCT CTC TTG GGT GCA CTG GA-3′,下游5′-CAC GCC TTG GCT TGT CAC A-3′;内参β-actin引物序列:上游5′-GGA TTC CTA TGT GGG GGA CG-3′,下游5′-GGA ACC GCT CAT TGC CAA TG-3′。PCR反应条件:95 ℃ 5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。得到的PCR产物用1.0%琼脂糖凝胶电泳,JS-780全自动凝胶成像分析仪凝胶成像(上海培清科技公司),通过SensiAnsys凝胶图像分析软件(上海培清科技公司)读取产物电泳条带的吸光度扫描值,将VEGF条带与内参照β-actin条带吸光度扫描值的比值作为VEGF相对表达水平。
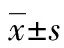
2 结 果
2.1各组早产鼠生存分析 各组生存率分别为:PBS+空气组92.9%,PBS+高氧组64.3%,LPS+高氧组42.9%,PBS+高氧+rhEPO组85.7%,LPS+高氧+rhEPO组57.1%,各组间比较差异有统计学意义(P=0.014),见图1。

图1 各组早产鼠生存曲线
2.2各组早产鼠体质量、肺质量及肺质量/体质量比值的变化 与PBS+空气组比较:PBS+高氧组在生后14 d体质量减轻,肺质量增加(P<0.05);LPS+高氧组在生后1、7、14 d体质量减轻,生后7、14 d肺质量增加(P<0.05);经rhEPO干预后体质量及肺质量变化有所改善,尤其以生后14 d明显改善(P<0.05)。随着日龄的变化肺质量/体质量比值也有明显的降低趋势,PBS+高氧组和LPS+高氧组在生后1 d和7 d降低,但在生后14 d比值增加,经rhEPO干预后肺质量/体质量比值的变化有所改善,尤其以生后14 d明显,但差异无统计学意义(P>0.05),见表1。
2.3肺组织病理形态学改变 PBS+空气组肺泡结构正常,肺泡间隔无水肿、炎症及纤维组织增生,肺泡腔无明显渗出,随日龄的增加,肺泡渐规整,大小趋向均一,终末气腔变小,数量增多,进行性肺泡化。PBS+高氧组和LPS+高氧组早期肺血管增生明显,肺间质水肿,炎性细胞浸润;随着高氧暴露时间延长,肺组织正常结构局灶性破坏,局部肺结构紊乱,肺间隔加宽,小灶或多灶状实变,小肺泡数量更少,肺间质出现少量胶原沉积。上述变化以LPS+高氧组出现更早且更严重。PBS+高氧+rhEPO组和LPS+高氧+rhEPO组上述改变明显减轻,肺组织炎性渗出减少、结构紊乱及肺泡化程度均有所改善,见图2。
2.4Western blot检测各组早产鼠肺组织VEGF蛋白表达水平 随日龄增加,PBS+空气组VEGF蛋白表达水平呈增加趋势,PBS+高氧组和LPS+高氧组出现先升后降的趋势。与PBS+空气组比较,在生后7、14 d,PBS+高氧组和LPS+高氧组VEGF蛋白表达水平均明显降低(P<0.05);PBS+高氧+rhEPO组与PBS+高氧组比较及LPS+高氧+rhEPO组与LPS+高氧组比较,均在生后7 d和14 d VEGF蛋白表达水平明显升高(P<0.05),见表2、图3。

表1 不同时间点各组早产鼠体质量、肺质量和肺质量/体质量比值比较
*:P<0.05,与PBS+空气组比较;#:P<0.05,与PBS+高氧组比较;△:P<0.05,与LPS+高氧组比较

A:PBS+空气组; B:PBS+高氧组;C:LPS+高氧组;D:PBS+高氧+rhEPO组;E:LPS+高氧+rhEPO组
图2各组早产鼠生后14 d肺组织病理学形态(HE染色,×200)

表2 不同时间点各组早产鼠肺组织VEGF蛋白表达水平比较
*:P<0.05,与PBS+空气组比较;#:P<0.05,与PBS+高氧组比较;△:P<0.05,与LPS+高氧组比较

1:PBS+空气组; 2:PBS+高氧组;3:LPS+高氧组;4:PBS+高氧+rhEPO组;5:LPS+高氧+rhEPO组
图3 Western blot检测各组大鼠肺组织VEGF蛋白表达水平

表3 不同时间点各组早产鼠肺组织VEGF mRNA表达水平比较
*:P<0.05,与PBS+空气组比较;#:P<0.05,与PBS+高氧组比较;△:P<0.05,与LPS+高氧组比较
2.5RT-PCR检测肺组织VEGF mRNA表达水平 随日龄增加,PBS+空气组VEGF mRNA表达水平呈增加趋势,PBS+高氧组和LPS+高氧组出现先升后降的趋势。PBS+高氧组与PBS+空气组VEGF mRNA表达水平在生后7、14 d比较,差异均有统计学意义(P<0.05);与PBS+空气组比较,LPS+高氧组在1、7、14 d VEGF mRNA表达水平均明显降低(P<0.05);PBS+高氧+rhEPO组与PBS+高氧组比较及LPS+高氧+rhEPO组与LPS+高氧组比较,均在生后7、14 d VEGF mRNA表达水平明显升高(P<0.05),见表3。
3 讨 论
随着新生儿重症监护技术的改进,以及机械通气和肺泡表面活性物质等的应用,早产儿及极低体质量儿的存活率有了明显提高,BPD的发生率亦在逐渐上升,成为婴儿期最常见的慢性呼吸系统疾病,并可增加成年后患肺部及神经系统疾病的概率[7]。目前认为宫内感染、早产、长时间吸氧及机械通气等是BPD的主要危险因素[8]。因此,课题组前期应用孕囊内注射LPS,于孕21 d(孕产期为22 d)剖宫娩出,并用60%的高氧干预,模拟宫内感染及生后高氧暴露建立新型BPD模型,并在此基础上做进一步的实验研究,取得良好的效果[3-4]。本实验结果显示:高氧损伤及LPS+高氧损伤明显降低了早产鼠的生存率(分别为64.3%和42.9%),病理损伤明显加重,并且以LPS+高氧损伤更为明显;经rhEPO干预后生存率有所提高(分别为85.7%和57.1%),病理损伤减轻。与PBS+空气组比较,PBS+高氧组和LPS+高氧组体质量减轻、肺质量增加(P<0.05);经rhEPO干预后体质量及肺质量变化有所改善,尤其以生后14 d明显(P<0.05)。随着日龄的变化肺质量/体质量比值也有明显的降低趋势,PBS+高氧组和LPS+高氧组在生后1、7 d降低,但在生后14 d比值增加,经rhEPO干预后肺质量/体质量比值的变化有所改善,尤其以生后14 d明显,但差异无统计学意义(P>0.05)。上述结果表明rhEPO能有效改善BPD模型大鼠肺组织损伤及整体变化。
肺是表达VEGF最为丰富的脏器之一。VEGF是诱导肺血管发生的重要因子,作用于血管内皮细胞的有丝分裂原,通过受体介导,对内皮细胞起着迁徙、生存、增殖和分化的作用,在整个胚胎期、胎儿期和出生后肺血管生长与维持中起着至关重要的作用,在建立正常的肺形态和功能中发挥重要作用,参与了新生儿高氧肺损伤的发生[9-10]。
rhEPO受体在多个器官都有表达,肺是其靶器官之一,有抗凋亡、抗炎、抗氧化,以及促进血管生成等多重作用,已成为BPD防治研究的热点之一[2,11]。EPO可刺激血管内皮细胞增殖和血管形成[5,12]。EPO刺激血管形成作用与其促进骨髓内皮前体细胞(endothelial progenitor cells,EPCs)移动,归巢至缺血组织有关[13]。EPO能与VEGF协同作用发挥血管效应[6]。因此,在课题组前期研究的基础上,观察rhEPO对新型BPD早产鼠模型肺组织中VEGF表达的影响。结果显示:随日龄增加,肺组织VEGF蛋白及mRNA的表达水平均呈增加趋势;经高氧和LPS+高氧干预后,与PBS+空气组比较表达水平均明显降低(P<0.05);经rhEPO干预后,在生后7、14 d VEGF蛋白表达水平明显升高(P<0.05)。肺组织VEGF mRNA表达水平与其蛋白表达水平有相应的趋势。
综上所述,VEGF在新生鼠肺发育过程中起着重要的作用。高氧、宫内感染及早产可导致早产鼠肺组织中VEGF蛋白及mRNA表达下降,其表达的减少参与肺损伤的过程。rhEPO可能通过参与或调节VEGF的表达,从而对新型BPD大鼠模型发挥保护作用,减轻肺损伤、提高生存率。
[1]Seedorf G,Metoxen AJ,Rock R,et al.Hepatocyte growth factor as a downstream mediator of vascular endothelial growth factor-dependent preservation of growth in the developing lung[J].Am J Physiol Lung Cell Mol Physiol,2016,310(11):L1098-L1110.
[2]Rayjada N,Barton L,Chan LS,et al.Decrease in incidence of bronchopulmonary dysplasia with erythropoietin administration in preterm infants:a retrospective study[J].Neonatology,2012,102(4):287-292.
[3]张华,赵日红,刘漫君.重组人促红细胞生成素对高氧肺损伤新生大鼠细胞凋亡及蛋白激酶B表达的影响[J].医学研究生学报,2013,26(5):469-472.
[4]岳嗣凤,张华.rhEPO对新型BPD模型肺组织BCL-2和Caspase-9表达的影响及意义[J].安徽医科大学学报,2015,50(7):933-936.
[5]Yan FF,Zhang MM,Meng Y,et al.Erythropoietin improves hypoxic-ischemic encephalopathy in neonatal rats after short-term anoxia by enhancing angiogenesis[J].Brain Res,2016,1651(16):104-113.
[6]Marti HH.Erythropoietin and the hypoxic brain[J].J Exp Biol,2004,207(18):3233-3242.
[7]Walsh MC,Szefler S,Davis J,et al.Summary proceedings from the bronchopulmonary dysplasia group[J].Pediatrics,2006,117(3/2):S52-56.
[8]Niedermaier S,Hilgendorff A.Bronchopulmonary dysplasia-an overview about pathophysiologic concepts[J].Mol Cell Pediatri,2015,2(1):2.
[9]Abman SH.Impaired vascular endothelial growth factor signaling in the pathogenesis of neonatal pulmonary vascular disease[J].Adv Exp Med Biol,2010,661:323-335.
[10]Balasubramaniam V,Mervis CF,Maxey AM,et al.Hyperoxia reduces bone marrow,circulating,and lung endothelial progenitor cells in the developing lung:implications for the pathogenesis of bronchopulmonary dysplasia[J].Am J Physiol Lung Cell Mol Physiol,2007,292(5):L1073-1084.
[11]Kakavas S,Demestiha T,Vasileiou P,et al.Erythropoetin as a novel agent with pleiotropic effects against acute lung injury[J].Eur J Clin Pharmacol,2011,67(1):1-9.
[12]Ashley RA,Dubuque SH,Dvorak B,et al.Erythropoietin stimulates vasculogenesis in neonatal rat mesenteric microvascular endothelial cells[J].Pediatr Res,2002,51(4):472-478.
[13]Heeschen C,Aicher A,Lehmann R,et al.Erythropoietin is a potent physiologic stimulus for endothelial progenitor cell mobilization[J].Blood,2003,102(4):1340-1346.
Effectsofrecombinanthumanerythropoietinontheexpressionofvascularendothelialgrowthfactorinprematureratmodelofthenewtypebronchopulmonarydysplasia*
ZhaoRihong1,BaiJihong2△,LiuMan1,Huangyan3
(1.DepartmentofNeonatology;2.GraduateStudentOffice;3.DepartmentofTeachingManagement,AffiliatedHospitalofGuilinMedicalUniversity,Guilin,Guangxi541000,China)
[Abstract]ObjectiveTo investigate the effects of recombinant human erythropoietin (rhEPO) on the expression of vascular endothelial growth factor (VEGF) protein and mRNA in lung tissue of premature rat model of the new type bronchopulmonary dysplasia (BPD).MethodsLipopolysaccharide (LPS) or PBS was injected into 60 pregnant rats on the 15th day of gestation.The premature rats by cesarean delivery on the 21th day of gestation were divided into 5 groups:PBS+air group,PBS+hyperoxia group,LPS+hyperoxia group,PBS+hyperoxia+rhEPO group,LPS+hyperoxia+rhEPO group.In rhEPO intervention groups,after 6 h exposure to hyperoxia,rhEPO (1 200 IU/kg) was administrated subcutaneously,once every other day for 7 times.The survival rate,body weight,lung weight and lung weight/body weight ratio and pathological changes of lung tissue were observed,the expression levels of VEGF protein and mRNA in the lung tissue were determined by Western blot and RT-PCR at the 1st,7th and 14th day after hyperoxia exposure.ResultsCompared with the PBS+air group,the survival rate and body weight were decreased,the lung weight was increased,the lung pathological damages were more serious,the expression levels of VEGF protein and mRNA in lung tissue were decreased after hyperoxia exposure.These changes were more notable in the LPS+hyperoxia group (P<0.05).The lung weight/body weight ratio showed an increasing tendency (P>0.05).The above indexes were improved after rhEPO intervention (P<0.05).ConclusionrhEPO could increase the survival rate and produce certain intervention and treatment effects by regulating the VEGF relative pathway in BPD model rats.
bronchopulmonary dysplasia;erythropoietin,recombinant;vascular endothelial growth factor
10.3969/j.issn.1671-8348.2017.29.003
广西高校科学技术研究基金资助项目(KY2015LX254);广西自然科学基金资助项目(2014GXNSFAA118152)。
赵日红(1978-),主治医师,硕士,主要从事儿科及新生儿相关疾病的基础与临床研究。△
,E-mail:bjhemail@163.com。
目的观察重组人红细胞生成素(rhEPO)对新型支气管肺发育不良(BPD)早产鼠模型肺组织血管内皮生长因子(VEGF)蛋白及mRNA表达的影响。方法60只定期受孕SD大鼠于孕第15天孕囊内注射脂多糖(LPS)或磷酸盐缓冲液(PBS),孕第21天剖宫娩出早产鼠,早产鼠于生后6 h内分为5组:PBS+空气组、PBS+高氧组、LPS+高氧组、PBS+高氧+rhEPO组、LPS+高氧+rhEPO组。rhEPO(1 200 IU/kg)干预组于高氧暴露6 h后开始第1次背部皮下注射,隔天1次,共7次。分别在高氧暴露第1、7、14天处死早产鼠,观察各组生存率、体质量、肺质量并计算肺质量/体质量比值,观察肺组织病理变化,采用蛋白质印迹法(Western blot)和反转录PCR(RT-PCR)法检测肺组织VEGF蛋白及 mRNA表达水平。结果与PBS+空气组比较,经高氧干预后早产鼠生存率降低、体质量减轻、肺质量增加,病理损伤加重,肺组织VEGF蛋白及mRNA表达水平降低,并且以LPS+高氧组更明显(P<0.05),肺质量/体质量比值增加(P>0.05);rhEPO干预后上述指标得到相应改善(P<0.05)。结论rhEPO可能通过参与调解VEGF相关通路,对BPD模型早产鼠起到一定的干预和治疗作用,提高了生存率。
R722.6
A
1671-8348(2017)29-4040-04
2017-03-19
2017-06-17)

