超声辅助提取榴莲中黄酮工艺探析
楚红英,杨婷珂,娄维高,张振豪,庞宏建,陈西良
(黄河水利职业技术学院,河南 开封 475004)
超声辅助提取榴莲中黄酮工艺探析
楚红英,杨婷珂,娄维高,张振豪,庞宏建,陈西良
(黄河水利职业技术学院,河南 开封 475004)
用超声辅助法提取榴莲中黄酮,设计正交试验寻找提取黄酮的最佳提取工艺,实验结果表明,影响总黄酮提取率因素大小次序为:溶剂浓度>提取温度>提取时间>液料比,最佳提取方案为30%乙醇提取、液料比3︰1、提取时间30min,提取温度为70℃。该工艺使榴莲中总黄酮的提取率为7.91mg/g。
黄酮提取工艺;超声辅助法;榴莲;正交试验;总黄酮提取率;最佳提取方案
0 引言
榴莲,又称韶子,系木棉科长绿乔木,是热带水果,素有“南洋水果之王”的美称[1]。榴莲果中含有大量的糖分、蛋白质、脂肪、碳水化合物、维生素、氨基酸及多种矿物质元素[2],还含有姜黄素、2-甲基丁酸乙酯、丙酸乙酯、乙酸乙酯、丁酸乙酯、3,5-二硫杂庚烷、 二乙基二硫醚、2-甲基丁酸甲酯、3,5-二甲基-1,2,4-三硫环戊烷、乙硫醇、黄酮等化学成分[3~5]。 黄酮类化合物是存在于自然界的一大类化合物,它具有一定的药学性能,具有如降低心肌耗氧量、增加冠状动脉及脑血管流量、降血糖、抗氧化、消除体内自由基、抗衰老、增强机体免疫力等功能[6~7]。 黄酮类成分的提取方法有很多,包括溶剂提取、微波提取、超临界萃取、酶浸渍萃取、超声波提取、半仿生提取、回流、索氏提取、煎煮和渗滤等[8~10]。 超声波辅助提取法具有提取效率高、操作简单方便、无污染、节约能源等优点,适用于提取天然植物中的生物活性成分。笔者试采用超声波辅助法提取榴莲中的黄酮,分析影响其提取率的主要因素,以期得到最佳的提取工艺。
1 实验材料与仪器
1.1 材料与试剂
实验所用榴莲购于开封某超市,乙醇(AR)为天津德恩化学有限公司生产,氢氧化钠(AR)为天津市风船化学试剂有限公司生产,硝酸铝(AR)为天津市德恩试剂有限公司生产,亚硝酸钠(AR)为天津市德恩试剂有限公司生产,芦丁(化学对照品)为中国药
品生物制品检定所生产,实验用水为二次蒸馏水。其
他实验试剂均为分析纯。
1.2 仪器与设备
实验所用仪器和设备有:DZKW-4电子恒温水浴锅(河南智诚科技有限公司生产)、KQ-100E型超声波清洗器(昆山市超声仪器有限公司生产)、8HZD(III)型循环水真空泵(河南智诚科技有限公司生产)、PB1502-L 电子天平、TU-1810紫外可见分光光度计(北京普析通用仪器有限公司生产)、ZRD-8210电热风干燥箱 (上海智诚分析仪器制造有限公司生产)、组织捣碎机(珠海飞利浦家用电器有限公司生产)。
2 实验方法
实验采用 NaNO2-Al(NO3)3-NaOH 体系分光光度法,以芦丁为对照物,对榴莲总黄酮的含量进行测定。
2.1 标准溶液的制备
准确称取芦丁标准品(于105℃下干燥至恒重)16mg,用30%乙醇溶解并定容至50ml,摇匀,得到质量浓度为0.32mg/mL的芦丁标准溶液。
2.2 标准曲线的制作
分别吸取制备的标准溶液0.00mL、1.00mL、2.00mL、3.00mL、4.00mL、5.00mL 于6个50mL的比色管中,均加入2mL浓度(以下为体积浓度)为5%的NaNO2溶液,摇匀,再加入2mL浓度为10%的 Al(NO3)3溶液,放置5min 后,加入10mL浓度为4%的NaOH溶液,再加入浓度为30%的乙醇,摇匀、定容[8]。然后,用紫外分光光度计测量吸光度,扫描波长范围为400~800nm。以空白溶液为参比,溶液在504nm处的吸光度最高。由此确定检测波长为504nm。在此波长下,测定每个标准样的吸光度(A)。以吸光度值为纵坐标,以标准样品的浓度(C)为横坐标,绘制标准曲线,如图1所示。求得线性回归方程为:A=0.2871C+0.0024。 样品浓度在0~9.6mg/L 之间呈良好的线性关系,r=0.9999,n=7。

图1 芦丁标准曲线Fig.1 Rutin standard curve
2.3 榴莲中总黄酮的提取
工艺流程为:剥开榴莲、提取果肉→用组织捣碎机捣碎→超声提取→分离→定容→显色→测定。具体提取方法为:准确称取榴莲鲜果肉5.0000g,放入三角瓶中,加入指定溶剂,按指定的料液比、时间进行超声辅助提取,过滤,并定容至50mL容量瓶中,备用。
2.4 榴莲中总黄酮含量的测定[11~13]
准确移取榴莲中总黄酮提取液1mL于50mL比色管中,加入2mL浓度为5%的NaNO2溶液,摇匀,再加入2mL 浓度为10%的 Al(NO3)3溶液,放置5min后,加入10mL浓度为4%的NaOH溶液,再加入浓度为30%的乙醇,摇匀、定容,测定其吸光度。最后,将吸光度代入回归方程,求得榴莲中总黄酮含量。
3 结果与讨论
3.1 单因素试验
以榴莲肉为原料,以乙醇为溶剂进行黄酮的提取,分别考察溶剂浓度、液料比,提取温度、提取时间对黄酮提取率的影响。
3.1.1 液料比对榴莲中黄酮提取率的影响
准确称取5.0000g榴莲肉,在液料比为1∶1、2∶1、3∶1、4∶1、5∶1,乙醇浓度为30%,超声提取时间为20min,提取温度为40℃的条件下进行提取,然后测定并计算提取率,其结果如图2所示。由图2可以看出,提取率先随着液料比的增大逐渐提高,当液料比达到3∶1以后,再增高料液比,提取率趋于稳定。

图2 液料比对提取率的影响Fig.2 Influence of liquid-to-solid ratio to extraction efficiency
3.1.2 提取温度对榴莲中黄酮提取率的影响
准确称取5.0000g榴莲肉,在液料比为3∶1,乙醇浓度为30%,超声提取时间为20min,提取温度分别为30℃、40℃、50℃、60℃、70℃、80℃、90℃条件下的进行提取,测定并计算提取率,结果如图3所示。由图3可以看出,提取率先随温度的升高而逐渐增大,在温度为70℃时,提取率达到最高,当温度大于70℃时,提取率随温度的升高呈现下降趋势。

图3 温度对提取率的影响Fig.3 Influence of temperature to extraction efficiency
3.1.3 乙醇浓度对榴莲中黄酮提取率的影响
准确称取5.0000g榴莲肉,在液料比为3∶1,超声提取时间为20min,乙醇浓度为0%、10%、30%、50%、70%、90%,提取温度为40℃的条件下进行提取,测定并计算提取率,结果如图4所示。由图4可以看出,提取率先随着乙醇浓度增加而逐渐增大,在乙醇浓度为30%时,提取率达到最高,若再提高乙醇体积浓度,提取率反而下降。下,提取率随着提取时间增加而增大,在提取时间超过40min的条件下,提取率基本保持恒定。

图4 乙醇体积浓度对提取率的影响Fig.4 Influence of ethyl alcohol volume concentration to extraction efficiency

图5 提取温度对提取率的影响Fig.5 Influence of extraction temperature to extraction efficiency
3.1.4 提取超声时间对榴莲中黄酮提取率的影响
准确称取5.0000g榴莲肉, 在液料比为3∶1,超声 提 取 时 间 为10min、20min、30min、40min、50min、60min,乙醇浓度为30%,提取温度为40℃的条件下进行提取,测定并计算提取率,结果如图5所示。由图5可以看出,在提取时间为10~30min的条件
3.2 正交试验
根据单因素实验结果,选取溶剂浓度、液料比、提取时间、提取温度4项作为考察因素,各取3水平,即“4因素3水平”,采用 L9(34)正交试验方法,以确定榴莲肉提取黄酮的最佳条件,结果如表1所示。

表1 正交试验设计及结果Tab.1 Orthogonal test design and its result
由正交试验结果可以得出各因素对黄酮提取率的影响,其次序为A>D>C>B。于是,最佳的方案是A1B3C3D3,即用浓度为30%的乙醇提取,提取温度为70℃,液料比为3∶1,提取时间为30min。
为了确定最终试验方案A1B3C3D3是否为最佳方案,按该试验条件,对榴莲中黄酮的提取方法进行3组试验,其平均提取率为7.91mg/g。
3.3 精密度试验
准确吸取正交试验中6号样品2mL于10mL比色管中,按上述操作方法测定其吸光度。连续测定6次,其吸光度值如表2所示。测得相对标准偏差RSD值为0.39%,说明仪器精密度较高。
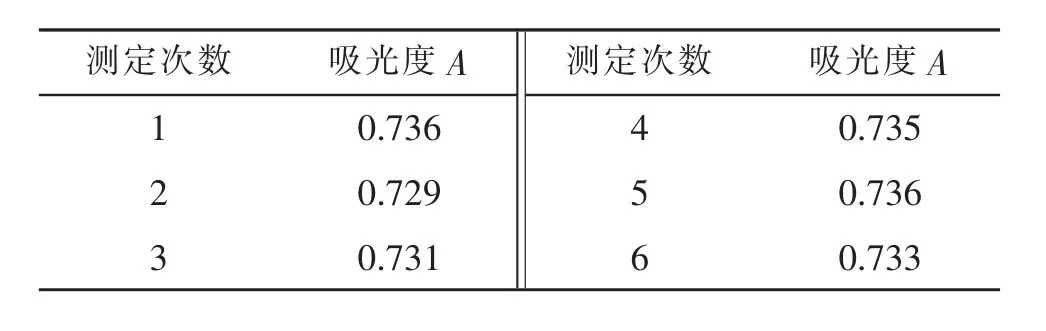
表2 精密度测定结果Tab.2 Measurement results of precision degree
3.4 稳定性试验
准确吸取正交试验中6号样品2mL于10mL比色管中,按上述方法,每隔20min测定1次吸光度。连续测定6次,结果如表4所示。经计算,RSD值为0.12%,即样品溶液在2h内基本稳定。
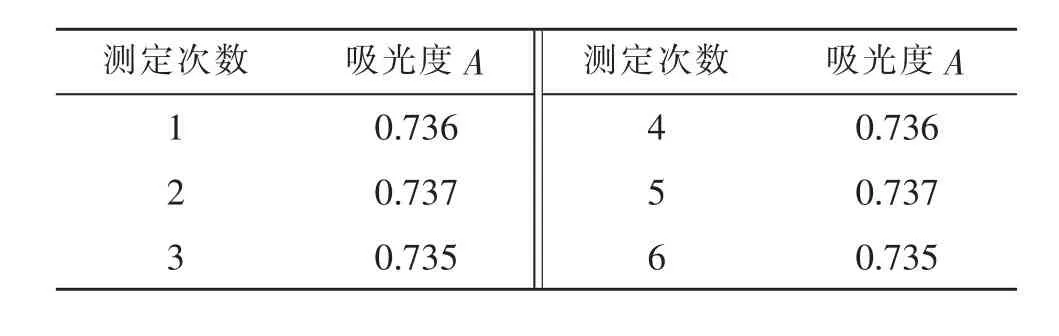
表3 稳定性测定结果Tab.3 Measurement results of stability
3.5 加标回收率试验
准确移取溶液中正交试验6号样品6份,分别加入0.20mL、0.40mL、0.60mL、0.80mL、1.00mL 标液,测其吸光值,结果如表5所示。由表5可知,平均回收率为98.4%,RSD 为1.36%。
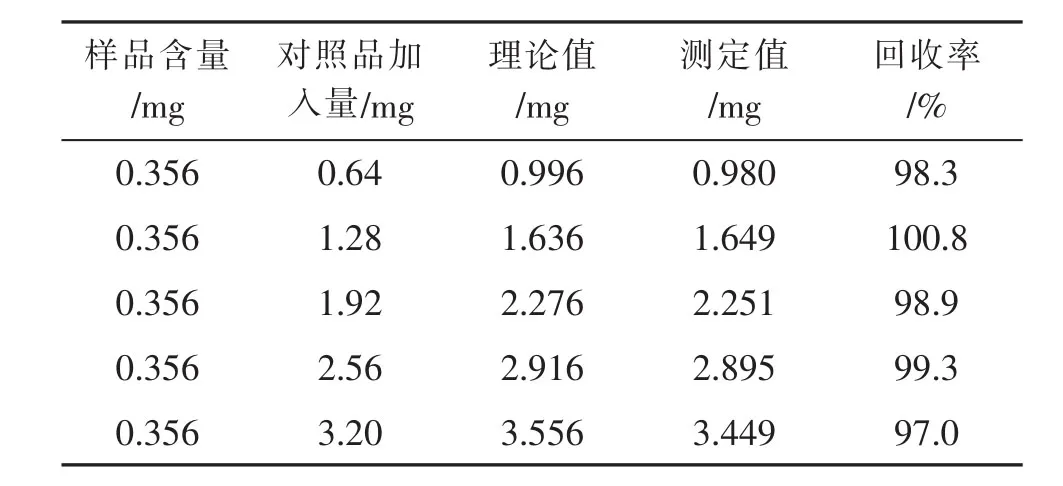
表4 加标回收率试验结果Tab.4 Test results of recovery
4 结语
本项实验,用超声辅助法提取榴莲中的黄酮类化合物,以芦丁为标准,对其含量进行了测定。通过正交试验,分析了各因素对黄酮提取率的影响,其结果为:溶剂浓度>提取温度>提取时间>液料比。实验所得出的最佳提取工艺为:浓度为30%的乙醇提取、液料比为3∶1、提取时间为30min,提取温度为70℃。在此条件下,榴莲中黄酮的提取率可达7.91mg/g。
[1] 李娜,董明,张国庆,等.响应面法优化榴莲皮中总黄酮的提取工艺[J].食品工业科技,2011,32(9):325-332.
[2] 李冬梅,尹凯丹.榴莲的保健价值和加工利用[J].中国食物与营养,2009(3) :32-33.
[3] 李晓雯,李静,顾正健,等.高效液相色谱法测定榴莲中的姜黄素类化合物[J].食品安全质量检测学报,2016,7(12):4955-4959.
[4] 高婷婷,刘玉平,孙宝国.SPME-GC-MS分析榴莲果肉中的挥发性成分[J].精细化工,2014,31(10):1229-1234.
[5] 阮尚全,黄艺,刘艳玲,等.微波协同双水相提取榴莲皮中总黄酮的工艺[J].食品科技,2013,38(10):228-231.
[6] 曹志超,顾翔,苏佩清.黄酮类化合物抗氧化及其作用机制的研究进展[J].实用临床医学,2009,13(7):110-112.
[7] 唐浩国.黄酮类化合物的研究[M].北京:科学出版社,2009:1-5.
[8] 蔡健,华景清.黄酮提取工艺进展[J].淮阴工学院学报,2003,12(5):82-85.
[9] 龚丽霞,丁卓平.葎草及黄酮类化合物的研究进展[J].安徽农业科学,2009,37(4):1618-1620.
[10]李安林,熊双丽.接骨木茎总黄酮的提取及DPPH自由基清除活性[J].中国食品添加剂,2010(5):115-116.
[11]蒋益花.破铜钱总黄酮的提取工艺研究[J].生物质化学工程,2007,41(2):38-40.
[12]楚红英,李瑜,李华北,等.苦菜总黄酮提取与含量的测定[J].安徽农业科学,2012,40(24):17-19.
[13]张亮亮,陈笳鸿,汪咏梅,等.海南蒲桃叶黄酮的提取及抗氧化性研究[J].生物质化学工程,2010,44(2):27-30.
Q946.1
B
10.13681/j.cnki.cn41-1282/tv.2017.04.013
2017-04-10
楚红英(1973-),女,河南开封人,讲师,硕士,主要从事材料工程专业的教学与研究工作。
[责任编辑 杨明庆]

