金属有机骨架MIL-110负载Ru-P纳米粒子:一种水解氨硼烷的高效催化剂
宁红辉,鲁迪,陈锰寰,彭薇薇,高爽,罗城,刘红英,周立群
(有机化工新材料湖北省协同创新中心,湖北大学化学化工学院,湖北 武汉 430062)
金属有机骨架MIL-110负载Ru-P纳米粒子:一种水解氨硼烷的高效催化剂
宁红辉,鲁迪,陈锰寰,彭薇薇,高爽,罗城,刘红英,周立群
(有机化工新材料湖北省协同创新中心,湖北大学化学化工学院,湖北 武汉 430062)
采用NaH2PO2还原法首次将Ru和P负载于高孔隙率的金属有机骨架材料MIL-110(Al)上,得到新颖的金属-非金属双组份负载型催化剂Ru-P@MIL-110.通过一系列表征手段分析该催化剂的结构、粒径分布、元素组成及价态,并在室温下通过催化氨硼烷水解释氢实验研究其催化活性.结果表明,非金属P的加入能显著提高催化活性,Ru-P@MIL-110催化剂对氨硼烷的水解释氢有好的催化活性,其TOF值为8 646 mL H2·min-1(g catalyst)-1,活化能为42.2 kJ·mol-1.经5次循环实验后,该催化剂仍保持结构稳定和高的可耐受性.
Ru-P纳米粒子;MIL-110;多相催化;氨硼烷;释氢
0 引言
氢能被认为是当今最清洁和最具应用前景的能源.为了发展氢能源经济,寻找安全有效的储氢材料是目前最大的挑战[1].储氢材料的种类较多,包括金属氢化物、吸附材料以及化学氢化物[2]等.在众多的化学氢化物中,氨硼烷(NH3BH3,简称AB)备受关注,这得益于它的高氢含量(质量分数为19.6%)、无毒、室温下稳定以及对环境友好[3]等特性.在催化剂的存在下,1 mol的AB室温下水解可产生3 mol的H2.在众多氨硼烷水解的催化剂中,贵金属钌基催化剂被认为是活性最高的一种[4].然而钌价格昂贵并且储量少,其广泛应用受限.在Ru中掺入非贵金属或非金属,形成的多组分产生的协同效应能显著提高催化活性,同时降低生产成本,因而选择合适的掺杂元素,是我们追寻的目标.无支撑体的贵金属单组分或无支撑体的多组分催化剂的活性位点少且在催化过程中易团聚,其催化活性和循环稳定性较差.因此,采用多孔结构的支撑体,特别是金属有机骨架材料(MOFs)负载多元组分形成的催化剂,不仅可以使金属粒子分散均匀、减少粒径,而且还能增加活性位点,为连续催化反应提高稳定性.
MOFs具有大的比表面积和化学可控的孔穴,在气体吸附和储存、药物缓释和非均相催化[5]等领域备受关注.因MOFs狭窄的孔和腔结构能有效控制纳米粒子的生长和分散、限制其迁移以及提供更多反应活性位点,故采用MOFs材料负载纳米粒子能提高催化活性和稳定性.至今为止,一系列的金属纳米粒子@MOFs催化剂被用于氨硼烷的水解实验,例如Ru@MIL-101[6]、Ru@MIL-96(Al)[7]、RhNi@ZIF-8[8]和RuCuCo@MIL-101[9]等等.但对于MIL-110负载Ru-P纳米粒子催化剂的合成至今未见报道,因而研究简单的一步合成法将Ru-P合金纳米粒子负载在MIL-110上得到高活性的氨硼烷水解释氢催化剂具有十分重要的意义.
本文中设计NaH2PO2还原法制备含有贵金属和非金属的Ru-P纳米粒子负载型催化剂Ru-P@MIL-110并用于催化AB水解释氢试验.研究Ru-P@MIL-110的催化活性,比较Ru-P@MIL-110与纯Ru-P纳米粒子之间催化性能并深入探讨Ru与P之间的协同作用以及Ru-P与载体MIL-110的双功能作用对其活性的影响.
1 实验部分
1.1催化剂的制备MIL-110(Al)的制备[10]:将440 mg 均苯三甲酸三甲酯,1 312 mg Al(NO3)3·9H2O,2 mL 4 mol/L NaOH和20 mL去离子水加入50 mL聚四氟乙烯反应釜中在210 ℃反应3 h.冷却抽滤得到MIL-110(Al)白色粉末.进一步纯化过程为:在DMF中150 ℃溶剂热反应5 h,去除未反应的均苯三甲酸三甲酯Me3btc;在H2O中100 ℃冷凝回流12 h,洗去DMF,抽滤后在80 ℃下真空干燥过夜,得到MIL-110白色粉末.
Ru-P@MIL-110催化剂的制备:100 mg MIL-110(Al) 加入30 mL去离子水,超声15 min得到均匀分散的悬浊液.在磁力搅拌下加入5 mL 0.01 mol/L RuCl3溶液.搅拌6 h后滴加1滴NaBH4作为引发剂,再逐滴加入10 mL 0.02 mol/L NaH2PO2溶液.继续搅拌3 h后抽滤并80 ℃真空干燥12 h,得到Ru-P@MIL-110催化剂.
Ru@MIL-110催化剂的制备:100 mg MIL-110和5 mL 0.01 mol/L RuCl3溶液加入到30 mL去离子水中,超声20 min后在持续的搅拌中逐滴加入10 mL 50 mg NaBH4溶液.
纯Ru-P NPs的制备:5 mL 0.01 mol/L RuCl3溶液加入到盛有10 mL去离子水的圆底烧瓶中,超声15 min,滴加10 mL 0.02 mol/L NaH2PO2溶液,反应完全后即得到纯Ru-P纳米粒子.
1.2催化活性和稳定性分析Ru-P@MIL-110水解氨硼烷的催化效率是通过产氢速率测定的.实验过程是在一个一边连接气体检测装置一边接有恒压漏斗的两颈圆底烧瓶中进行,烧瓶中装有5 mg Ru-P@MIL-110和10 mL去离子水,恒压漏斗中装有18.5 mg氨硼烷和10 mL去离子水,当漏斗中的溶液加入到烧瓶中,则氨硼烷水解释氢反应立即发生,此时每间隔30 s记录一次气体的读数.采用水浴控制反应温度为25 ℃.通过重新加入18.5 mg氨硼烷到前一次的反应液中来测试催化剂的可耐受性,重复操作五次.
Ru-P@MIL-110催化剂在不同温度(25,30,35和40 ℃)下进行水解实验可以计算出催化反应的活化能.
2 结果与讨论
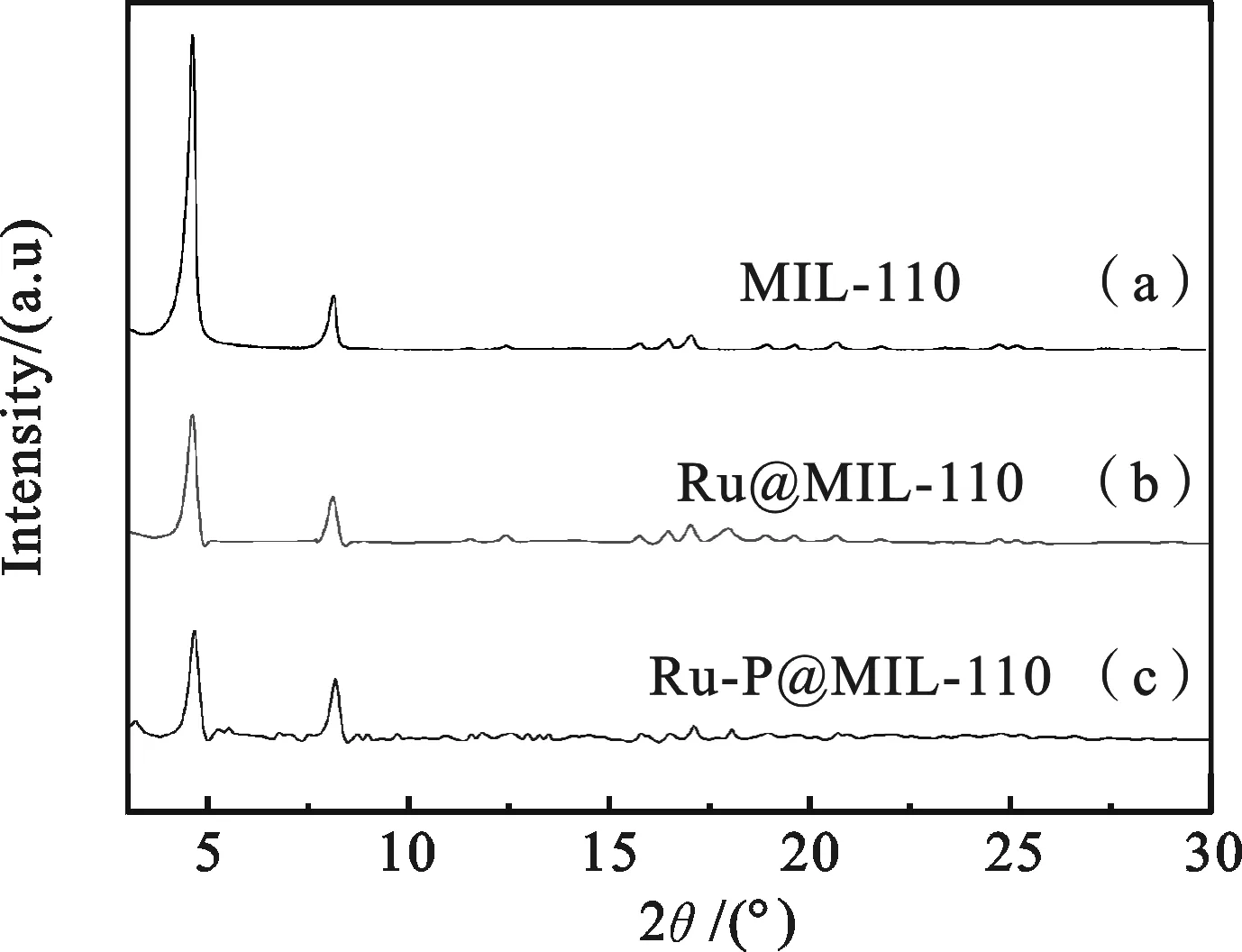
图1 催化剂的粉末XRD 图谱
2.1催化体系的微结构和组成分析利用Bruker D8-Advance型X线衍射计测定催化剂结构,铜靶Kα1(λ=0.154 18 nm),功率40 kV×20 mA.图1中,MIL-110的谱图与文献报道值非常一致[10],证明MIL-110被成功合成.Ru@MIL-110和Ru-P@MIL-110样品的谱图与载体MIL-110保持一致,表明MIL-110骨架结构在催化剂的合成过程中保持不变.峰强度减弱可能是由于表面Ru-P纳米粒子的存在以及它们和骨架原子亲电表面之间的相互作用改变了电荷分布和静电场[11].XRD图谱中Ru和P纳米粒子的衍射峰很弱,可能是由于金属的负载量较小或者Ru和P纳米粒子形成了无定形态[12].
Thermo ESCALAB 250Xi型X线光电子能谱(XPS)用于负载元素电子价态的测定.如图2a所示,图中可以看到C 1s,Ru 3d,Ru 3p,P 2p和O 1s的吸收峰.因284.7 eV处C 1s和Ru 3d峰有很大程度重合,故很难在此处分辨钌的峰.图2b显示在463.8和486.6 eV处的吸收峰为Ru(0)的3p3/2和3p1/2峰[13].图2c显示出P的2p峰出现在133.1 eV[14],表明P是以氧化物的形式存在;同时,在该催化剂中,在130.0 eV处出现了单质P的峰,与红磷(130. 4 eV)相比,降低了0.4 eV,表明P与Ru形成了合金[15].上述结果表明,在Ru-P@MIL-110催化剂中,Ru是非常稳定的,而磷主要以氧化物形式存在,单质P含量较少.
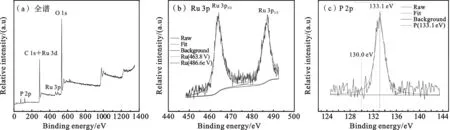
图2 Ru-P@MIL-110的XPS光谱

图3 Ru-P@MIL-110的(a) TEM图和(b)粒径分布图

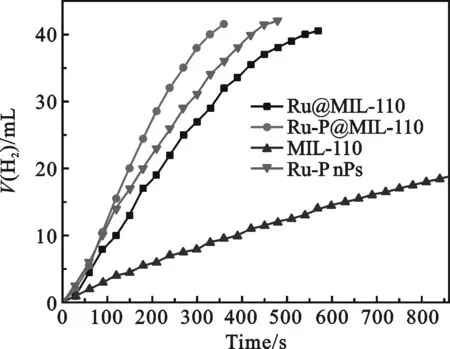
图4 催化水解氨硼烷释氢图(5 mg催化剂,18.5 mg AB,T=25 ℃)
2.2催化活性分析将Ru-P@MIL-110和Ru@MIL-110催化剂用于室温下催化氨硼烷水解释氢测试.图4表明与单金属Ru@MIL-110催化剂相比,双组分Ru-P@MIL-110展示出更高的催化活性.这与Ru-P@MIL-110催化氨硼烷的机理有关.据我们所知,多相催化反应是在金属催化剂的表面发生的,机理包括两步:首先,氨硼烷与Ru-P合金纳米粒子的表面发生相互反应,形成活性过渡态Metal-H,这是水解反应的先决条件.然后,H2O与Metal-H发生反应释放氢气[16].P掺杂,既减小Ru-P合金纳米粒子粒径,使其均匀分散在MIL-110的表面,增大金属纳米粒子与氨硼烷的接触面积,又增加活性过渡态Metal-H的活性位点.因而Ru-P@MIL-110的催化活性显著提高.
纯Ru-P NPs、MIL-110和Ru@MIL-110的催化活性均低于Ru-P@MIL-110,这主要归功于Ru和P纳米粒子之间强烈的协同作用以及Ru-P纳米粒子与MIL-110之间的双功能作用.通过计算得到Ru-P@MIL-110的转化频率为8 646 mL H2·min-1(g catalyst)-1,这个值与报道的金属-非金属催化剂催化氨硼烷水解相比是相当高的(见表1).
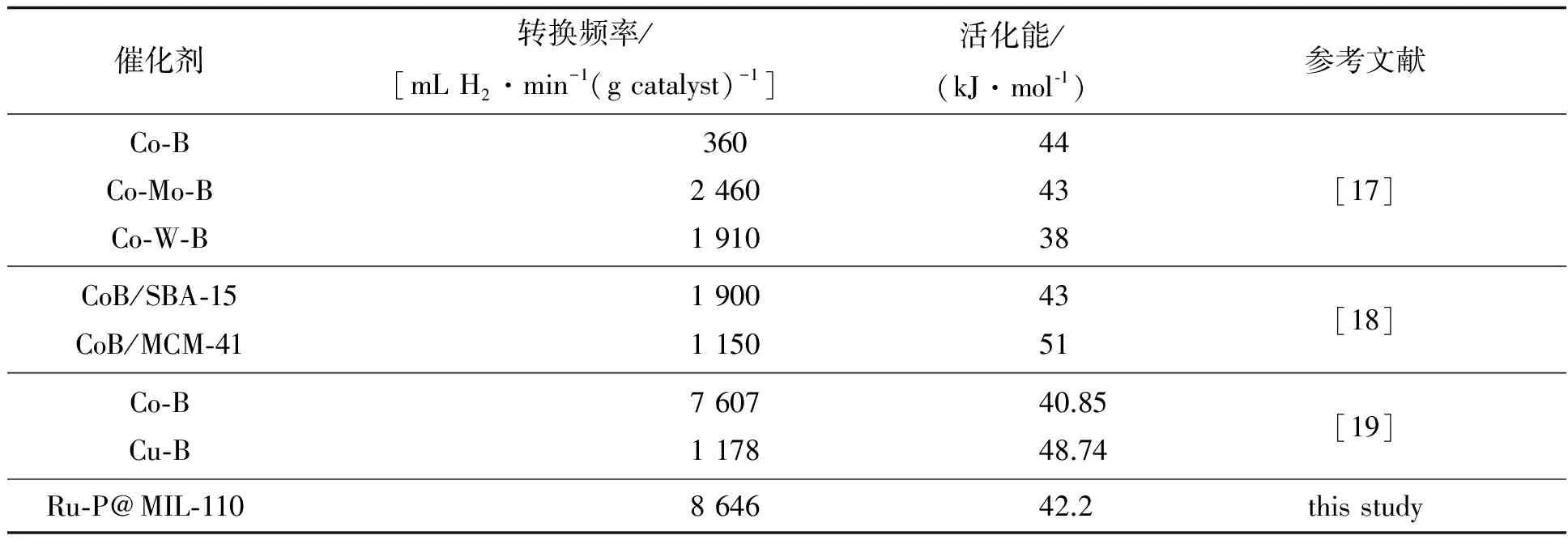
表1 金属-非金属合金催化剂性能比较
Ru-P@MIL-110催化氨硼烷水解释氢反应的活化能是在25-40 ℃范围内进行.图5a表明随反应温度升高速率加快.图5b是催化反应lnK——1/T的阿伦尼乌斯方程曲线,计算得到活化能(Ea)为42.2 kJ·mol-1.由表1所示,这一值低于大部分报道的金属-非金属催化剂,表明Ea越低,反应速率越快,可见该催化剂在催化氨硼烷水解释氢方面有较好的应用前景.
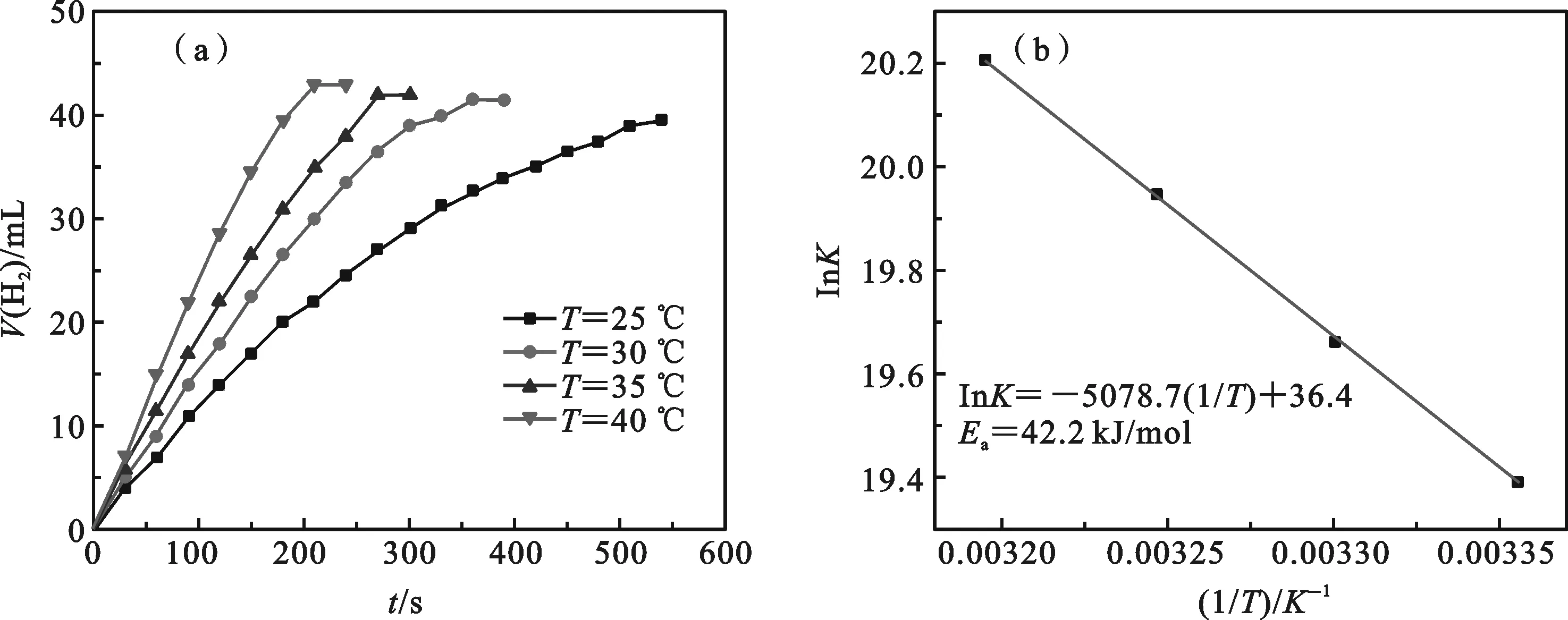
图5 Ru-P@MIL-110催化水解氨硼烷的温度效应(a)和相应的阿伦尼乌斯方程曲线(b)
耐久性是催化剂实际应用的关键.图6a表明Ru-P@MIL-110催化剂经过5次循环反应后仍保留较高催化活性.图6b显示该催化剂经5次循环的催化活性分别为100%、90.8%、80.2%、72.6%和63.5%.这种高的可耐受性归因于MIL-110晶体结构的稳定性以及催化循环后Ru-P纳米粒子仍均匀负载于MIL-110载体表面.而催化活性的降低可能是由于反应溶液的黏度增大,偏硼酸盐浓度增大对氨硼烷的水解有钝化作用[20].
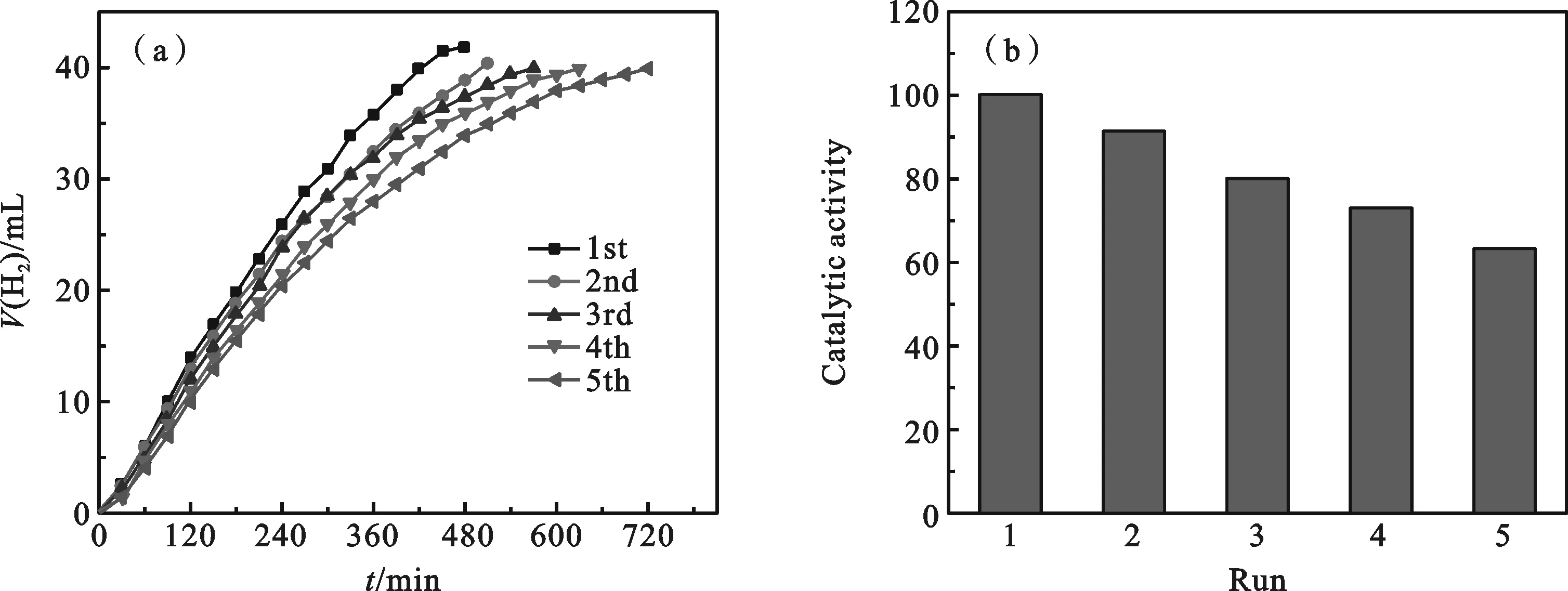
图6 Ru-P@MIL-110催化剂的可耐受性实验(a)和连续催化循环的活性统计(b)
3 结论
通过还原法首次成功制备Ru-P@MIL-110纳米负载型催化剂,并在催化水解氨硼烷性能研究中展现出高的催化活性和可耐受性,其反应活化能和转换频率分别为42.2 kJ·mol-1和8 646 mL H2·min-1(g catalyst)-1.优良的催化性能主要归功于强的双组分协同作用、均匀分散的纳米粒子以及Ru-P纳米粒子与基体MIL-110间的双功能作用.此外,非金属P的加入大大降低催化成本,且显著增强反应活性,这对未来催化产业的可持续发展至关重要.
[1] Bulut A, Yurderi M, Ertas I E, et al. Carbon dispersed copper-cobalt alloy nanoparticles: a cost-effective heterogeneous catalyst with exceptional performance in the hydrolytic dehydrogenation of ammonia-borane[J]. Applied Catalysis B: Environmental, 2016, 180: 121-129.
[2] Yao Q, Lu Z H, Wang Y, et al. Synergetic catalysis of non-noble bimetallic Cu-Co nanoparticles embedded in SiO2nanospheres in hydrolytic dehydrogenation of ammonia borane[J]. The Journal of Physical Chemistry C, 2015, 119(25): 14167-14174.
[3] Mori K, Miyawaki K, Yamashita H. Ru and Ru-Ni nanoparticles on TiO2support as extremely active catalysts for hydrogen production from ammonia-borane[J]. ACS Catalysis, 2016, 6(5): 3128-3135.
[4] Yang K, Zhou L, Yu G, et al. Ru nanoparticles supported on MIL-53 (Cr, Al) as efficient catalysts for hydrogen generation from hydrolysis of ammonia borane[J]. International Journal of Hydrogen Energy, 2016, 41(15): 6300-6309.
[5] Adhikari A K, Lin K S, Tu M T. Hydrogen storage capacity enhancement of MIL-53 (Cr) by Pd loaded activated carbon doping[J]. Journal of the Taiwan Institute of Chemical Engineers, 2016, 63: 463-472.
[6] Cao N, Liu T, Su J, et al. Ruthenium supported on MIL-101 as an efficient catalyst for hydrogen generation from hydrolysis of amineboranes[J]. New Journal of Chemistry, 2014, 38(9): 4032-4035.
[7] Wen L, Su J, Wu X, et al. Ruthenium supported on MIL-96: an efficient catalyst for hydrolytic dehydrogenation of ammonia borane for chemical hydrogen storage[J]. International Journal of Hydrogen Energy, 2014, 39(30): 17129-17135.
[8] Xia B, Liu C, Wu H, et al. Hydrolytic dehydrogenation of ammonia borane catalyzed by metal-organic framework supported bimetallic RhNi nanoparticles[J]. International Journal of Hydrogen Energy, 2015, 40(46): 16391-16397.
[9] Yang K, Zhou L,Xiong X, et al. RuCuCo nanoparticles supported on MIL-101 as a novel highly efficient catalysts for the hydrolysis of ammonia borane[J]. Microporous and Mesoporous Materials, 2016, 225: 1-8.
[10] Haouas M, Volkringer C, Loiseau T, et al. The extra-framework sub-lattice of the metal-organic framework MIL-110: a solid-state NMR investigation[J]. Chemistry A European Journal, 2009, 15(13): 3139-3146.
[11] Yurderi M, Bulut A, Zahmakiran M, et al. Ruthenium (0) nanoparticles stabilized by metal-organic framework (ZIF-8): highly efficient catalyst for the dehydrogenation of dimethylamine-borane and transfer hydrogenation of unsaturated hydrocarbons using dimethylamine-borane as hydrogen source[J]. Applied Catalysis B: Environmental, 2014, 160: 534-541.
[12] El-Shall M S, Abdelsayed V, Abd El Rahman S K, et al. Metallic and bimetallic nanocatalysts incorporated into highly porous coordination polymer MIL-101[J]. Journal of Materials Chemistry, 2009, 19(41): 7625-7631.
[13] Timofeeva M N, Panchenko V N, Abel A A, et al. Rearrangement ofα-pinene oxide to campholenic aldehyde over the trimesate metal-organic frameworks MIL-100, MIL-110 and MIL-96[J]. Journal of Catalysis, 2014, 311: 114-120.
[14] Wang Y, Shi F F, Yang Y Y, et al. Carbon supported Pd-Ni-P nanoalloy as an efficient catalyst for ethanol electro-oxidation in alkaline media[J]. Journal of Power Sources, 2013, 243: 369-373.
[15] Yang G, Chen Y, Zhou Y, et al. Preparation of carbon supported Pd-P catalyst with high content of element phosphorus and its electrocatalytic performance for formic acid oxidation[J]. Electrochemistry Communications, 2010, 12(3): 492-495.
[16] Xu Q, Chandra M. Catalytic activities of non-noble metals for hydrogen generation from aqueous ammonia-borane at room temperature[J]. Journal of Power Sources, 2006, 163(1): 364-370.
[17] Fernandes R, Patel N, Miotello A, et al. Dehydrogenation of ammonia borane with transition metal-doped Co-B alloy catalysts[J]. International Journal of Hydrogen Energy, 2012, 37(3): 2397-2406.
[18] Patel N, Fernandes R, Gupta S, et al. Co-B catalyst supported over mesoporous silica for hydrogen production by catalytic hydrolysis of ammonia borane: a study on influence of pore structure[J]. Applied Catalysis B: Environmental, 2013, 140: 125-132.
[19] Figen A K. Dehydrogenation characteristics of ammonia borane via boron-based catalysts (Co-B, Ni-B, Cu-B) under different hydrolysis conditions[J]. International Journal of Hydrogen Energy, 2013, 38(22): 9186-9197.
[20] Rakap M, Özkar S. Hydrogen generation from the hydrolysis of ammonia-borane using intrazeolite cobalt (0) nanoclusters catalyst[J]. International Journal of Hydrogen Energy, 2010, 35(8): 3341-3346.
Ru-Pnanoparticlessupportedonmetal-organicframeworksMIL-110:ahighlyefficientcatalystsforthehydrolysisofammoniaborane
NING Honghui, LU Di, CHEN Menghuan, PENG Weiwei, GAO Shuang, LUO Cheng, LIU Hongying, ZHOU Liqun
(Hubei Collaborative Innovation Center for Advanced Organic Chemical Materials,
College of Chemistry and Chemical Engineering, Hubei University, Wuhan 430062, China)
The supported catalyst Ru-P@MIL-110(Al) containing Ru and P nanoparticles were firstly synthesized by NaH2PO2reduction of Ru salts into the highly porous and hydrothermally stable metale organic framework MIL-110.And the structure,size,composition and loading metal electronic states of the catalyst were analyzed by a series of characterizations. The catalytic performance was tested in the hydrogen generation from aqueous solution of ammonia borane at room temperature. The results showed that the addition of non-metal P could significantly increase the catalytic activity and the as-synthesized Ru-P@MIL-110(Al) catalyst exhibited the highest catalytic activity, with a total turn over frequency value of 8 646 mL H2·min-1(g catalyst)-1, and the activation energy was determined to be 42.2 kJ·mol-1. Moreover, the catalyst exhibited the great durability and structural stability after five cycles for the hydrolytic dehydrogenation of ammonia borane.
Ru-P nanoparticles;MIL-110;heterogeneous catalysis;ammonia borane;releasing hydrogen
2017-04-07
湖北省教育厅重点实验室项目(2016-KL-007)资助
宁红辉(1996-),女,本科生;周立群,通信作者,教授,E-mail:zhoulq2003@163.com.
1000-2375(2017)06-0662-06
TB383.4
A
10.3969/j.issn.1000-2375.2017.06.018
(责任编辑 胡小洋)

