加拿大一枝黄花对土壤砷污染的生长响应
连加攀,陈宁宁,赵岩,杨兰芳,黄运新,李海波
(湖北大学环境资源学院,湖北 武汉 430062)
加拿大一枝黄花对土壤砷污染的生长响应
连加攀,陈宁宁,赵岩,杨兰芳,黄运新,李海波
(湖北大学环境资源学院,湖北 武汉 430062)
为了认识入侵植物对土壤砷污染的生长响应,进行土壤加砷种植加拿大一枝黄花的盆栽实验,观察一枝黄花的长势、测定一枝黄花的株高、茎粗和生物量.结果表明,高砷对一枝黄花具有毒害作用,其中毒症状为植株矮化,新叶发黄,叶尖焦枯,根系腐烂.与对照相比,当土壤加砷浓度不大于100 mg·kg-1时,一枝黄花的株高和茎粗无显著变化;加砷200 和500 mg·kg-1时,株高分别降低49.9%和89.1%,茎粗分别降低48.4%和58.3%.土壤加砷不大于50 mg·kg-1时,一枝黄花的生物量没有显著变化.土壤加砷水平达到100 mg·kg-1时,一枝黄花的根、茎、叶和总生物量均显著下降.土壤加砷水平达到 500 mg·kg-1时,一枝黄花根、茎、叶和总生物量降低95%以上.相关分析表明,加拿大一枝黄花的根、茎、叶生物量和总生物量均与土壤砷浓度存在显著的指数函数关系.根据指数回归方程计算得到一枝黄花根、茎、叶生物量和总生物量的半衰减浓度分别为119.2、110.3、125.3和126.1 mg·kg-1.综合来看,一枝黄花可以正常适应含砷100 mg·kg-1以下的土壤环境,但高砷环境会抑制其生长并改变其生物量的分配.
加拿大一枝黄花;土壤加砷;生长响应;生物量;半衰减浓度
0 引言
砷是广泛分布于自然界的类金属元素.由于工农业生产中大量使用含砷化学品以及采矿过程中产生大量的含砷废料,土壤砷污染问题日益严重,急需找到有效的治理办法.由于传统的物理化学治理方法具有投资大、破坏土壤结构、引起土壤肥力下降等缺点,而且容易造成二次污染[1],所以探索新的土壤砷污染治理途径具有迫切的意义.
植物修复是一种可能的途径.由于砷的毒性与重金属相似,所以砷污染植物修复的思想与重金属植物修复思想类似.自从1983年美国学者Chaney第一次提出重金属植物修复的思想以来[2],相关研究得到了快速的发展.重金属植物修复的核心是寻找富集植物,特别是超富集植物.到目前为止,有关砷的富集植物的遴选和机理研究一直在探索并取得了一定的进展[3-4].已有研究报道显示某些植物如蜈蚣草[5]、大叶井口边草[6]、粉叶蕨(Pityrogrammacalomelanos)[7]、长夜甘草蕨(Pterislongifolia)[8]、Pterisumhrosa[9]、狭眼凤尾蕨(PterisbiauritaL.)、P.quadriauritaRetz和琉球凤尾蕨 (P.ryukyuensisTagawa)[10]、东方香蒲[11]等具有砷富集能力.机理研究方面也有一些报道[12-14].不过,到目前为止,鲜见有关入侵植物对砷的耐性及富集能力的报道.
加拿大一枝黄花(SolidagocanadensisL.)为菊科(Asteraceae)一枝黄花属多年草本植物,原产于北美,于1935年被作为庭院观赏花卉而引入我国[15-16].目前已演变为一种入侵杂草.加拿大一枝黄花主要分布于我国东部地区,特别是长江中下游省份,近些年南方地区也有发现[17-18].加拿大一枝黄花具有生物量大、繁殖速度快、生命力强等特点[19],是目前我国的主要外来入侵植物之一.现有的研究表明加拿大一枝黄花对某些重金属如锰、镉、铅等具有较强的耐性,具有一定的超富集植物的特性[20].受此启发,本文中通过盆栽实验进一步研究加拿大一枝黄花对砷的生长响应,了解加拿大一枝黄花在不同砷污染条件下的生长反应以及不同部分对砷的敏感性,为土壤砷污染生态修复以及入侵植物综合利用提供科学依据.
1 材料和方法
1.1供试土壤所用土壤为潮土,采自武汉市武昌友谊大道旁的地铁工地.土壤采回后摊开风干,剔除石块和植物残体,过5 mm筛,混合均匀后装入塑料大桶中供盆栽实验之用.再从中取约500 g过1 mm筛,装入塑料瓶中混合均匀,供分析土壤基本理化性质之用,再从过1 mm筛的土样中取约50 g过0.15 mm筛,装入小塑料瓶中,供分析有机质和全量养分之用.土壤碱解氮、速效磷、速效钾含量分别为14.84、6.47和91.92 mg·kg-1,有机质、全氮、全磷和全钾含量分别为5.65、0.471、0.585、16.07 g·kg-1,土壤总砷含量为10.45 mg·kg-1,土壤pH为8.43.
1.2盆栽实验本研究中采用土壤盆栽实验进行.试验所用盆钵为高20 cm,体积为3.2 L的圆台形陶瓷钵,每钵装5 mm筛过的风干土3.0 kg.每公斤土施用150 mg N、80 mg P和100 mg K作为底肥,分别用硫酸铵和磷酸二氢钾配成含N、P、K分别为22.5、12.0、15.0 mg mL-1的溶液,装盆时每盆加入此溶液20 mL混合均匀即可.
本研究中设置土壤加砷水平0、5、20、50、100、200、500 mg·kg-1共7个处理,每处理重复3次.用亚砷酸钠配成含As 0、0.15、0.60、1.50、3.00、6.00 mg mL-1的系列溶液,装盆时,各处理的每盘加入相应的溶液100 mL,与土壤混合均匀后,即得土壤加砷0、5、20、50、100、200、500 mg·kg-1的处理.土壤处理后,存化2周.本研究于2015年4月16日拌土装盆处理,2015年4月30移栽长势一致一枝黄花苗一株,移栽后,由于幼苗较长,从距离土壤表面15 cm处剪掉上部分.将所有盆钵放1.2 m×2.0 m的可移动推车上,雨天将车推进挡雨棚下,非雨天则车推在露天网室下接受自然条件.每天做好水分及其日常管理,待植株出现自然枯黄后,于2015年9月6日收获.
1.3指标测定
1.3.1 株高测定 在植物生长的第18周(2015年9月6日)对植株高度进行测定,用钢卷尺从土面开始到植株最顶端所测量的长度作为一枝黄花的株高.
1.3.2 茎粗测定 在植物生长的第18周对植株茎粗进行测定,使用游标卡尺对加拿大一枝黄花地上5 cm处的茎部分所测得的宽度作为一枝黄花的茎粗.
1.3.3 生物量测定 收获植株时,从土面剪断,就得到地上部分,带回实验室,按茎和叶分开,分别洗干净沥干水分,将叶直接装入纸袋放入箱中.将茎剪成小于0.5 cm的小段,再装于纸袋放进烘箱中.将盆钵中的土壤倒出,挑出根系,根系带回实验室用水洗干净后沥干水分,再剪成小于0.5 cm的小段装入纸袋,放进烘箱中,连同茎、叶一起在70 ℃下烘干,烘干后取出放在干燥器中冷却,分别用百分之一的电子天平称重,即得一枝黄花、根、茎叶的生物量,测定生物量后,将其粉碎过0.5 mm筛,装入塑料瓶中备化学分析之用.
1.4数据处理所有数据用Excel 2003计算平均值、标准差、相关系数和作图,采用SPSS16.0进行方差分析和多重比较以及相关系数检验.
2 结果
2.1砷处理对加拿大一枝黄花长势的影响图1是7月25号的照片,由图可见,在砷水平不超过100 mg·kg-1时,一枝黄花的长势看不出明显差异,而在200 mg·kg-1时,一枝黄花的生长明显受阻,植株变矮,在最高砷水平500 mg·kg-1处理下,植株生长十分迟缓,新叶发黄,叶尖焦枯, 3盆重复中,有两盆植株最后死亡,收获时根系完全腐烂了,没有获得根系生物量.

图1 土壤加砷对一枝黄花长势的影响
2.2砷处理对一枝黄花株高和茎粗的影响图2可见,土壤加砷显著影响一枝黄花的株高和茎粗.随土壤加砷水平的增加,一枝黄花的株高和茎粗呈先略微增加,到一定水平后急剧下降.统计分析表明,在加砷水平不大于100 mg·kg-1时,同对照相比,砷处理对株高无显著影响,而加砷200和500 mg·kg-1则显著降低一枝黄花的株高,分别使株高降低49.9%和89.1%.加砷50 mg·kg-1处理的茎粗显著高于对照,而加砷5、20、100 mg·kg-1的茎粗与对照无显著差异,但是加砷200和500 mg·kg-1则显著降低了茎粗,分别降低了47.6%和58.3%.
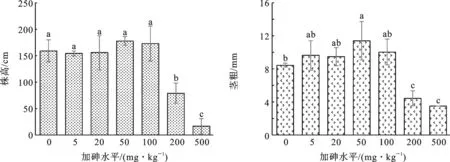
图2 土壤加砷对一枝黄花株高和茎粗的影响
2.3砷处理对加拿大一枝黄花生物量的影响跟对照组(CK)相比,当土壤加砷水平不大于50 mg·kg-1时,根茎叶和总生物量均无显著差异(表1).当土壤加砷水平达到100 mg·kg-1及其以上时,加砷处理显著降低一枝黄花根茎叶和总生物量,而且生物量均随土壤加砷水提高而显著下降.其中加砷100和200 mg·kg-1使根、茎、叶和总生物量分别降低46.9%、29.7%、34.2%、34.1%和71.8%、72.2%、61.5%、68.6%,而加砷500 mg·kg-1则使根、茎、叶和总生物量降低95%以上.
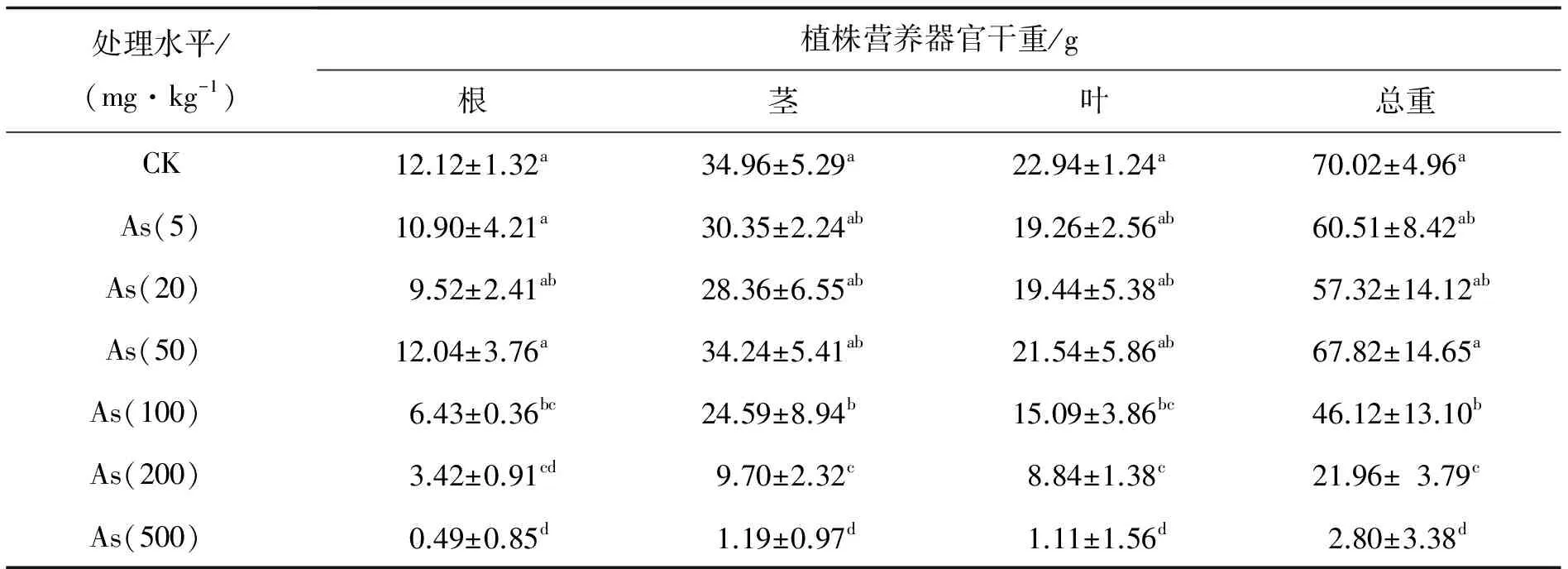
表1 砷处理对一枝黄花生物量的影响
2.4砷处理对加拿大一枝黄花生物量分配的影响由于500 mg·kg-1的高砷水平导致重复中有两盆植株死亡和根系腐烂,从而缺少两个重复的根系生物量,因此分析砷对生物量分配影响时,只用6个处理的数据.结果显示,土壤加砷处理对一枝黄花各部位生物量有一定影响,但是各部位的影响不同(表2).根据生物量占总生物量的比例,虽然有随加砷水平增加而降低的趋势,但是协方差分析表明,相互之间无显著差异(p<0.05).同对照相比,加砷处理对茎和根占总生物量的比例无显著影响,但是加砷200 mg·kg-1的叶生物量占总生物量的比例显著高于对照与其他低砷水平,叶生物量占地上生物量的比例显著高于对照和其他低砷处理,而茎生物量的比例则显著低于对照和其他低砷处理.
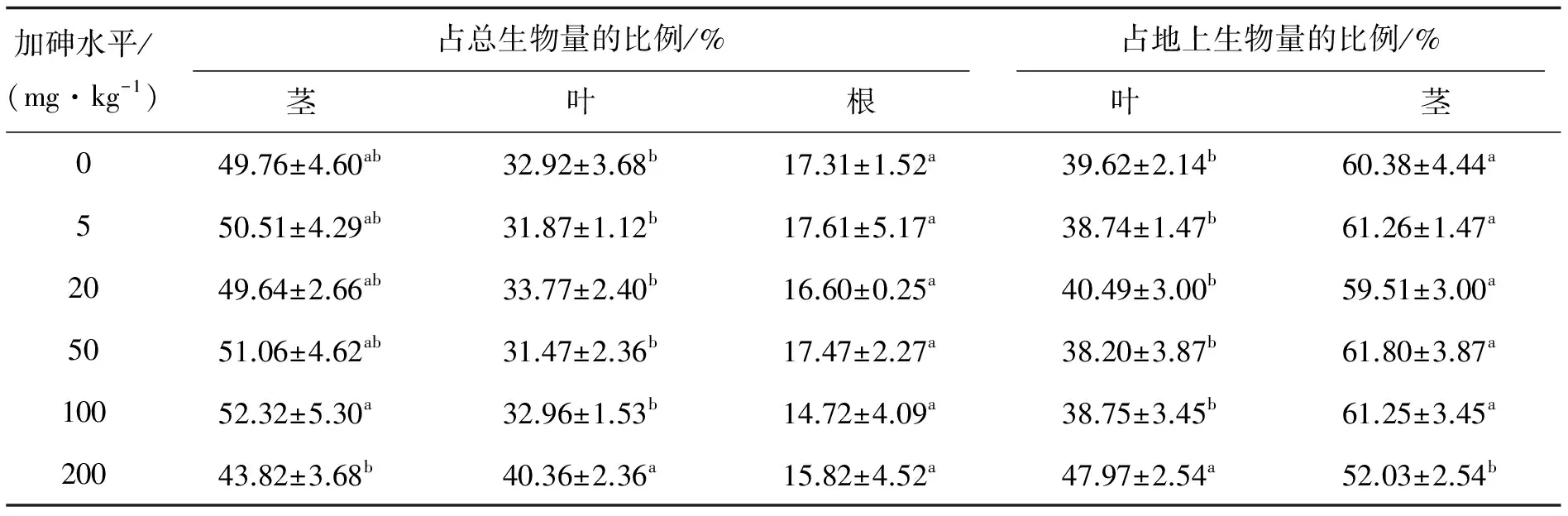
表2 一枝黄花根、茎、叶生物量的分配
2.5土壤加砷水平与一枝黄花生物量的关系回归分析表明,加拿大一枝黄花根、茎、叶的生物量和总生物量均与土壤加砷水平之间存在显著的指数函数关系.以生物量为因变量(y),土壤加砷水平为自变量 (x),可以建立指数回归方程.根据对照生物量,结合回归方程,可以计算出生物量降低到对照生物量一半的土壤砷浓度,称为生物量半衰减浓度.如果回归方程为y=aebx,对照生物量为y0,则半衰减浓度的计算公式为
x1/2=(1/b)×ln[y0/(2a)]
根据此公式算出的一枝黄花根、茎、叶及总生物量的半衰减浓度分别为119.24、110.35、125.33和126.22 mg·kg-1(表3),不同部位的半衰减浓度以叶最大,茎最低.总生物量的半衰减浓度与叶相近.
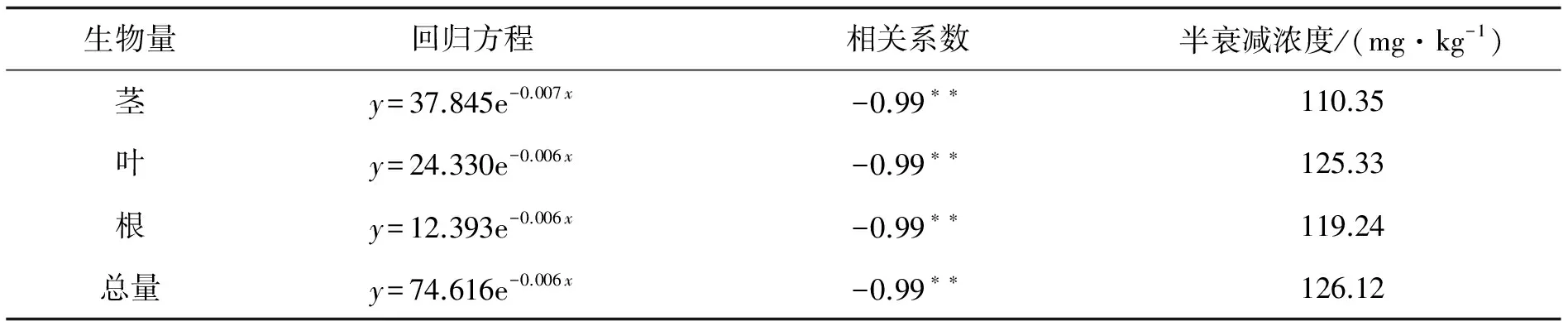
表3 一枝黄花生物量与土壤砷水平之间的回归分析统计
**表示显著水平超过0.01.
3 讨论
砷是一种对动物和植物都有毒的元素,植物在砷污染环境中一般都会表现出一定的中毒症状,并严重影响生长和产量.李海波等[21]发现当土壤加砷达50 mg·kg-1时,大豆出现植株矮化,叶片皱缩,成熟延迟等症状,而加砷水平达到100 mg·kg-1时,大豆株高、茎叶生物量、地上生物量和总生物量分别下降45.0%、36.6%、44.6%和43.4%.本实验中,土壤加砷水平为50 mg·kg-1时,同对照相比一枝黄花生长正常.土壤加砷水平为100 mg·kg-1时, 株高和茎粗无显著变化,但根、茎、叶和总生物量分别下降了46.9%、29.7%、34.2%、34.1%.加砷水平达到200 mg·kg-1时,株高和茎粗显著降低.上述结果说明一枝黄花的耐砷污染能力比大豆强. 这一方面是由于植物的适应能力的差异而导致的. 比如,在土壤加亚砷酸盐态砷100 mg·kg-1时,烟草、空心菜略有增产,辣椒、水花生、水稻、花生略有减产,而生姜和苋菜减产较严重;在500 mg·kg-1时,空心菜、水花生减产42%-45%,苋菜、雀稗减产85%-90%,水稻则颗粒无收,而甘薯却没有减产[22].另一方面也可能是由于土壤类型和土壤环境的差异导致的. 本实验土壤为潮土,偏碱性,而上述大豆实验土壤为红壤,呈酸性. 酸性以及还原土壤条件下砷以As3+为主, 而碱性或强氧化土壤条件下砷以As5+为主[23-24],而As3+的毒性比 As5+毒性更大[25]. 土壤加亚砷酸盐种植小麦的实验表明,砷明显降低小麦株高和产量,而当土壤砷含量达到625 mg·kg-1时小麦颗粒无收[26],这与本实验土壤加砷500 mg·kg-1,植物根系腐烂无生物量相近,说明砷对植物的毒性比较普遍. 本实验下,加砷50 mg·kg-1的株高和茎粗的平均值均最大,而且茎粗显著高于对照,高出35.3%,说明一定的低砷水平可以促进一枝黄花的生长,而高砷水平则抑制其生长,这与某些其他植物的研究结果一致. 如土壤喷洒低浓度砷酸盐能促进药用植物黄岑的生长和根系发育,而高砷水平则降低其生物量[27]; 日本小菘菜的水培实验也证明低浓度的亚砷酸钠能促进生长, 高浓度砷则抑制生长[28].
本实验中显示土壤砷会改变植物生物量的分配. 目前有关砷对植物生物量分配影响方面报道不多.已有的土壤加砷种植大豆的盆栽实验表明,高砷条件下, 根系生物量与地上部分生物量的比值、茎叶生物量与地上生物量的比值显著高于对照组[21].其中茎叶生物量与地上生物量的比值高于对照的结果与本实验中叶生物量占地上生物量的比例显著高于对照的结果相似,说明在高砷土壤环境下,植物通过生物量分配的改变来适应砷的毒害,或者植物不同部位对土壤砷污染的敏感性不同.本实验中,高砷条件下,叶生物量占总生物量和地上生物量的比例均高于对照和其他低砷处理,而茎生物量占地上生物量的比例显著低于对照和其他低砷处理,说明高砷污染对一枝黄花叶损伤相对较小,而茎比叶更容易受到砷的毒害.
在本实验条件下, 由于一枝黄花的各部位生物量和总生物量均与土壤加砷水平存在显著的指数函数关系,根据指数回归方程可以计算出同对照相比,生物量下降一半时的土壤砷水平,将其称之为生物量的半衰减浓度.该浓度可以反映出植物的耐砷能力,浓度越高,耐砷能力越强. 本次实验条件下,根、茎、叶生物量的半衰减浓度均在110 mg·kg-1以上,以叶生物量的半衰减浓度最高,表明一枝黄花叶的耐砷能力最强,这与生物量分配的结果相一致.一枝黄花叶的耐砷能力比根和茎强的原因主要有三个方面,一是土壤砷需要经过根系和茎秆才能到达叶片,根和茎对砷的阻截对叶也起到了保护作用,二是砷可能影响了一枝黄花合成的光合产物向茎和根系输送,从而使光合产物更多在叶中积累,相对就减少了光合产物在茎和根系中分配. 虽然本实验中,在加砷0-200 mg·kg-1的范围内,根系生物量占总数的比例没有显著差异,但是加砷200 mg·kg-1处理的根系生物量占总生物量比例平均值还是低于对照的,三是高砷水平抑制植物光合作用,叶片光合产物首先要供应叶片自身需要,多余的才会向其他部位转移,光合作用受影响时,就不利于光合产物在其他部位的分配.土壤加砷种植烤烟[29]和大豆[30, 21]的试验都表明,土壤砷污染影响叶绿素含量与构成,从而影响光合作用.
4 结论
1) 加拿大一枝黄花在土壤加砷500 mg·kg-1下呈现出新叶发黄,叶尖干枯,根系腐烂的中毒症状.
2) 与对照相比,当土壤加砷不大于100 mg·kg-1时,一枝黄花的株高无显著变化;土壤加砷200 和500 mg·kg-1时株高和茎粗显著下降.
3) 与对照相比,当土壤加砷不大于50 mg·kg-1时,一枝黄花各部位及总的生物量均无显著变化;当加砷达到100 mg·kg-1时,根重、茎重、叶重和总生物量均显著降低,并随土壤加砷水平的增加而进一步下降.
4) 与对照相比,土壤加砷200 mg·kg-1时,叶生物量占总生物量和地上生物量的比例增加,但茎生物量占地上生物量的比例降低,表明高砷水平改变一枝黄花生物量的分配.
5) 一枝黄花的根、茎、叶生物量与土壤加砷水平之间存在显著的指数函数关系. 根据生物量与加砷水平之间的指数回归方程,得到一枝黄花根、茎、叶生物量的半衰减浓度分别为119.24、110.35和125.33 mg·kg-1.
6) 本实验条件下,一枝黄花对土壤砷的耐受水平在100 mg·kg-1左右,根、茎、叶三者之中叶的抗砷污染能力最强.
[1] 王新,贾永锋.土壤砷污染及修复技术[J].环境科学与技术,2007,30(2):107-110.
[2] Chaney R L, Minnie M, Li Y M, et al. Phytoremediation of soil metals[J]. Current Opinion in Biotechnolony, 1997, 8(3): 279-284.
[3] 刘小梅,吴启堂,李秉涛.超富集植物治理重金属污染土壤研究进展[J].农业环境科学报,2003,22(5):636-640.
[4] 查红平,肖维林,雷晓林,等.砷的植物修复研究进展[J].地质灾害与环境保护,2007,18(2):55-60.
[5] 陈同斌,韦朝阳,黄泽春,等.砷超富集植物蜈蚣草及其对砷的富集特征[J].科学通报,2002,47(3):207-210.
[6] 韦朝阳,陈同斌,黄泽春,等.大叶井口边草——一种新发现的富集砷的植物[J].生态学报,2002,22(5):777-778.
[7] Visoottiviseth P, Fancesconi K, Sridokchan W. The potential of Thai indigenous plant species for the phytoremediation of arsenic contaminanted land[J]. Environmental Pollution,2002, 118(3):453-461.
[8] Cai Y, Su J, Ma L Q. Low molecular weight thiols in arsenic hyperaccumulator pteris vittata upon exposure to arsenic and other trace elements[J]. Environmental Pollution,2004,129(1): 61-78.
[9] Zhao F J, Dunham S J, McGrath S P. Arsenichyperaccumulation by different fern species[J].New Phytologist, 2002,156(1): 27-31.
[10] Mrittunjai S, Ma L Q, Jorge S, et al. Three new arsenic hyperaccumulating ferns[J]. Science of the Total Environment,2006,364(1): 24-31.
[11] 王凤永,郭朝晖,苗旭峰,等.东方香蒲(Typha orientalis Presl)对重度污染土壤中As, Cd, Pb的耐性与累积特征[J].农业环境科学学报,2011,30(10):1966-1971.
[12] 段桂兰,王利红,陈玉,等.植物超富集砷机制研究的最新进展[J].环境科学学报,2007,27(5):714-720.
[13] 蒋汉明,邓天龙,赖冬梅,等.砷对植物生长的影响及植物耐砷机理研究进展[J].广东微量元素科学,2009,16(11):1-5.
[14] 陈同斌,黄泽春,黄宇营,等.砷超富集植物中元素的微区分布及其与砷富集的关系[J].科学通报,2003,48(11):1163-1168.
[15] Liu J, Liang S C, Liu F H,et al. Invasive alien species in China:regional distribution patterns[J].Diversity & Distributions, 2005,11(4):341-347.
[16] 黄华,郭水良.外来入侵植物加拿大一枝黄花繁殖生物学研究[J].生态学报,2005, 25(11):2795-2799.
[17] 董梅,陆建忠,张文驹,等.加拿大一枝黄花——一种正在迅速扩张的外来入侵植物[J].植物分类学报,2006, 44 (1): 72-85.
[18] 杨如意,唐建军,陈欣,等.加拿大一枝黄花的入侵机理研究进展[J].生态学报,2011,31(4):1185-1194.
[19] Lu J Z, Weng E S, Wu X W,et al. Potential distribution of Solidago canadensis in China[J]. Acta Phytotaxonomica Sinica, 2007,45 (5):670-74.
[20] 向言词,冯涛,刘炳荣,等.加拿大一枝黄花在改良锰尾渣中的生长与重金属富集特性[J].矿业工程研究,2010,25(1):63-68.
[21] 李海波,杨兰芳,李亚东.土壤砷对大豆主要性状及叶绿素含量的影响[J].作物学报,2013, 39(7): 1303-1308.
[22] 刘更另, 陈福兴, 高素端, 等. 土壤砷对植物生长的影响——南方“砷毒田”的研究[J]. 中国农业科学, 1985, 18(4): 9-16.
[23] Garg N, Singla P. Arsenic toxicity in crop plants: physiological effects and tolerance mechanisms[J]. Environmental Chemistry Letters, 2011,9(3):303-321.
[24] Smith S E, Christophersen H M, Pope S, et al. Arsenic uptake and toxicity in plants: integrating mycorrhizal influences[J]. Plant Soil,2010, 327(1-2): 1-2.
[25] Aposhian H V, Zakharyan R A, Avram M D,et al. A view of the enzymology of arsenic metabolism and a mew potential role of hydrogen peroxide in the detoxication of the trivalent arsenic species[J]. Toxicology & Applied Pharmacology, 2004,198(3): 327-335.
[26] 杨清. 砷对小麦生长的影响[J].土壤肥料,1992, (3): 23-24.
[27] Cao H, Jiang Y, Chen J, et al. Arsenic accumulation in Scutellaria baicalensis Georgi and its effects on plant growth and pharmaceutical components[J]. J Hazardous Materials, 2009,171: 508-513.
[28] Shaibur M R, Kawai S. Effect of arsenic on visible symptom and arsenic concentration in hydroponic Japanese mustard spinach[J]. Environ Exp Bot,2009, 67(1): 65-70.
[29] 常思敏, 马新明, 张贵龙, 等. 砷对烤烟碳氮代谢及其产量和品质的影响[J]. 植物生态学报, 2006, 30(4): 682-688.
[30] 牛昌美, 杨兰芳, 彭小兰, 等. 土壤加砷对大豆叶绿素、脯氨酸和过氧化氢酶活性的影响[J]. 湖北大学学报(自然科学版), 2013, 35(30): 283-287.
ThegrowthresponseofinvasiveSolidagocanadensisL.toarsenicpollutioninsoil
LIAN Jiapan, CHEN Ningning, ZHAO Yan, YANG Lanfang, HUANG Yunxin, LI Haibo
(Faculty of Resource and Environmental Science, Hubei University, Wuhan 430062, China)
Invasive plants have strong adaptability to environment, but their adaptabilities to the contaminated soil environment are rarely reported. In order to understand the response of invasive plants to arsenic polluted soil, a pot experiment cultivatingSolidagoCanadensisL.(SCL) in arsenic addition soil was conducted, in which the growth of SCL was observed, and the plant height, stem diameter and biomass of SCL was measured. The results showed that high soil arsenic addition caused toxicity to SCL, and the toxic symptoms included dwarfed plants, yellow new leaves, withered leaf tips and root rot. Compared to control, arsenic additions had no significant effects on the plant height and stem diameter of SCL when arsenic concentration was no more than 100 mg·kg-1, but 200 and 500 mg·kg-1of soil arsenic addition caused 49.9% and 89.1% decrease in plant height, and 48.4% and 58.5% decrease in stem diameter, respectively. When arsenic concentration was no more than 50 mg·kg-1, arsenic addition did not influence the biomass of SCL significantly, but caused significant decrease in the root, stem and leaf biomass of SCL at 100 mg·kg-1, and the root, stem and leaf biomass were decreased by more than 95% at 500 mg·kg-1. The correlation analysis showed that there was a significant exponential relationship between soil arsenic additions and the root, stem and leaf biomass of SCL. Based on the exponential regression equation, the half decay arsenic concentration of the root, stem and leaf biomass of SCL was 119.2, 110.3, 125.3 and 126.1 mg·kg-1, respectively. In conclusion, SCL would grow normally at no more than 100 mg·kg-1of soil arsenic addition, but a higher concentration significantly inhibited SCL’s growth and changed the allocation of its biomass among different parts of the plants.
SolidagocanadensisL.(SCL); soil arsenic additions; response of growth; biomass; half decay concentration
2017-02-20
国家自然科学基金(31670543)、湖北省自然科学基金重点项目(2014CFA113)资助
连加攀(1994-),男,本科生, E-mail:ljiapan@163.com;杨兰芳,通信作者,教授,E-mail:lfyang@hubu.edu.cn;黄运新,通信作者,教授,E-mail:y.huang@hubu.edu.cn
1000-2375(2017)06-0609-07
X53;S154.1
A
10.3969/j.issn.1000-2375.2017.06.009
(责任编辑 游俊)

