外周血与肿瘤组织膜联蛋白A3表达对卵巢上皮癌铂类耐药的预测价值
谢祥红,刘 芳
(武警四川总队医院:1.检验科;2.妇产科,四川乐山 614000)
论著·临床研究doi:10.3969/j.issn.1671-8348.2017.30.012
外周血与肿瘤组织膜联蛋白A3表达对卵巢上皮癌铂类耐药的预测价值
谢祥红1,刘 芳2
(武警四川总队医院:1.检验科;2.妇产科,四川乐山 614000)
目的比较外周血与肿瘤组织膜联蛋白A3(Annexin A3)表达对卵巢上皮癌铂类耐药的预测价值。方法选择2010年2月至2012年2月该院术后行以铂类为基础化疗,且完成随访的72例初治卵巢上皮癌患者,按照铂类耐药评价标准分为铂类化疗敏感组54例和铂类化疗耐药组18例,采用化学发光免疫分析法检测外周血Annexin A3水平;采用免疫组织化学染色检测肿瘤组织Annexin A3水平;通过绘制受试者工作特征(ROC)曲线分析外周血与肿瘤组织Annexin A3对铂类耐药的预测价值。结果铂类敏感组外周血Annexin A3水平显著低于铂类耐药组,差异有统计学意义(P<0.05),铂类敏感组肿瘤组织Annexin A3表达阳性率显著低于铂类耐药组(P<0.05)。外周血Annexin A3低浓度组中位生存期(31.2个月)显著高于高浓度组(23.1个月),差异有统计学意义(P<0.05);组织Annexin A3低表达组中位生存期(35.2 个月)显著高于高表达组(20.4个月),差异有统计学意义(P<0.05)。多因素分析显示,血清与肿瘤组织Annexin A3表达水平是影响铂类耐药的独立危险因素(均P<0.05)。外周血Annexin A3预测铂类耐药的ROC曲线下面积(AUC)为0.821;组织Annexin A3预测铂类耐药的AUC为0.763;外周血Annexin A3预测铂类耐药的AUC显著高于组织Annexin A3。结论铂类耐药的卵巢上皮癌患者外周血与肿瘤组织Annexin A3表达水平均显著升高,外周血Annexin A3对铂类耐药的预测价值优于组织Annexin A3。
膜联蛋白A3;卵巢肿瘤;药物疗法,联合;化疗敏感;化疗耐药;卵巢上皮癌;生存预后
肿瘤化疗耐药分为原发性耐药和获得性耐药,其中80%以上对铂类耐药属于获得性耐药[1-2]。若能在化疗前或化疗初期预测肿瘤的耐药性,对调整化疗方案、提高肿瘤缓解率具有重要意义。人膜联蛋白A3(Annexin A3)蛋白属于Annexin家族成员之一,主要参与细胞骨架的形成、调节磷酸化、细胞信号转导等生物学功能。Yin等[3]报道称卵巢癌组织Annexin A3表达上调,且高表达Annexin A3患者无病生存期显著缩短;该研究进一步发现高表达Annexin A3对铂类耐药明显,对紫杉醇、阿霉素等化疗药物无明显耐药性,提示Annexin A3可能是铂类耐药的特异性蛋白。然而组织取样操作繁琐,对患者伤害大,甚至存在感染的风险。有报道称Annexin A3在细胞外也有表达,且随着Annexin A3表达增加,外周血Annexin A3水平也逐渐升高,这为外周血Annexin A3检测提供了可能[4]。鉴于此,本研究分别对卵巢上皮癌患者外周血和组织Annexin A3表达进行检测,评估外周血和组织Annexin A3检测对铂类耐药的预测价值,现将研究结果报道如下。
1 资料与方法
1.1一般资料 本研究经本院伦理委员会批准,前瞻性地选择2010年2月至2012年2月医院收治的81例初治卵巢上皮癌患者作为研究对象,年龄22~75岁,平均(58.1±7.4)岁;按照美国癌症联合委员会[5](American Joint Committee on Cancer,AJCC)乳腺癌TNM分级标准分为Ⅰ期5例,Ⅱ期14例,Ⅲ期56例,Ⅳ期6例;组织学类型:浆液性腺癌68例,黏液性腺癌4例,透明细胞癌6例,子宫内膜样癌3例;组织学分级:高分化11例,中分化26例,低分化44例。纳入标准:(1)所有患者均拟行手术治疗,包括肿瘤细胞减灭术和全面分期手术;(2)术后接受以铂类为基础的化疗;(3)术中取组织标本,病理诊断经病理科证实;(4)患者出院后规律随访;(5)治疗方案取得患者及家属同意,并签署知情同意书。排除标准:(1)自愿放弃手术或无手术指征者;(2)既往接受过抗癌治疗者;(3)患者入组前已经接受化疗;(4)对铂类等药物过敏者。
1.2方法
1.2.1治疗方案 患者行肿瘤细胞减灭术或全面分期手术,术前抽取患者外周肘静脉血3 mL,静置10~20 min,12 000 r/min离心15 min,吸取上清液置于-80 ℃冰箱保存待检。术中收集癌组织标本,常规石蜡包埋,制成厚度约为4 μm的切片,置于-20 ℃冰箱保存待检。术后行紫杉醇+卡铂的化疗方案:静脉滴注紫杉醇:80 mg/m2,持续输注1 h,第1、8、15天;静脉滴注卡铂5.0~6.0 mg·mL-1·min-1,持续输注1 h,第1天;化疗3周为1个周期,共计化疗6个周期。每个周期结束后2周行盆腹腔超声检查。
1.2.2外周血、组织Annexin A3检测 采用化学发光免疫分析法检测外周血Annexin A3水平:取出血清标本,室温溶解,向包被孔中加入50 μL标准品和样品,均设复孔,再向每孔中加入50 μL酶标检测抗体,室温孵育2 h。采用化学发光仪检测每孔的发光值,根据拟合方程计算样品Annexin A3水平。参考文献[4],以Annexin A3≥2.05 mg/L为高浓度,<2.05 mg/L为低浓度。采用免疫组织化学染色检测肿瘤组织Annexin A3水平:二甲苯脱蜡、乙醇梯度洗脱,磷酸盐缓冲液(PBS)冲洗3次;加入0.01 mol/L枸橼酸缓冲液,煮沸进行抗原修复,再加入3%H2O2孵育3 min消除内源性过氧化酶。加入3%山羊血清封闭液体,37 ℃孵育10 min弃去封闭液;分别滴加1∶500的鼠抗人Annexin A3单克隆抗体(购自北京同立海源生物科技有限公司),4 ℃孵育过夜。PBS冲洗3次,再加入辣根过氧化物酶标记的羊抗兔IgG二抗,37 ℃孵育30 min,PBS冲洗3次,加入新配置的二氨基联苯胺(DAB)显色液显色,自来水充分冲洗,复染,封片。结果判定:由两位病理科医师采用盲法阅片,显微镜下随机选择10个视野,采用半定量法对细胞染色程度进行评分[6];染色强度:无染色为0分,浅棕色后淡红色为1分,棕黄色为2分,棕褐色为3分。着色细胞所占百分比:染色细胞小于5%为0分,染色细胞5%~25%为1分,染色细胞>26%~50%为2分,染色细胞>51%~75%为3分,染色细胞大于75%为4分;以染色强度×染色细胞百分比作为总分,其中总分0分代表阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)。以染色程度为依据,分为弱阳性组即低表达组,++以上为强阳性组即高表达组。
1.2.3铂类耐药评价标准 参考文献[7],铂类化疗敏感:化疗结束后患者达到完全缓解,后期复发时间距最后一次化疗间隔6个月及以上;铂类化疗耐药:化疗结束后患者达到完全缓解,后期复发时间距最后一次化疗间隔小于6个月;铂类化疗难治:化疗结束后患者症状未缓解;其中铂类化疗耐药、铂类化疗难治均归于铂类耐药。
1.2.4随访 化疗结束后对患者进行随访,随访从化疗结束第2天开始,化疗结束后第1年每月随访1次,第1~2年每3个月随访1次,2年以上每半年随访1次,随访时检查血常规、尿常规、肝肾功能及盆腹腔超声;截止日期为随访结束或患者死亡或失访之日。由于本研究随访时间较短,因此以无进展生存期(PFS)作为主要观察终点,随访截止日期为2015年3月1日。

2 结 果
2.1随访情况与治疗结局 本研究纳入的81例初治卵巢上皮癌患者,最终完成随访72例,失访9例,随访时间7~43个月,中位随访时间24.5个月。失访原因:患者搬迁至外地无法随访4例,中途转院3例,其他未知原因放弃随访2例。72例患者中,按照铂类耐药评价标准,铂类化疗敏感54例,铂类化疗耐药13例,铂类化疗难治5例。
2.2铂类敏感与铂类耐药患者Annexin A3表达比较 铂类敏感组外周血Annexin A3水平显著低于铂类耐药组(P<0.05);免疫组织化学染色显示,肿瘤组织Annexin A3主要定位于细胞质和细胞核,铂类敏感组肿瘤组织Annexin A3表达阳性率显著低于铂类耐药组(P<0.05),见表1、图1。
2.3外周血Annexin A3对患者PFS的影响 高浓度患者23例,低浓度患者49例。高浓度患者中位PFS为20.4个月,低浓度患者中位PFS为31.2个月,高浓度患者中位PFS显著低于低浓度患者(P<0.05),见图2。
2.4组织Annexin A3对患者PFS的影响 高表达患者中位PFS为23.1个月,低表达患者中位PFS为35.2个月,高表达患者中位PFS显著低于低表达患者(P<0.05),见图3。
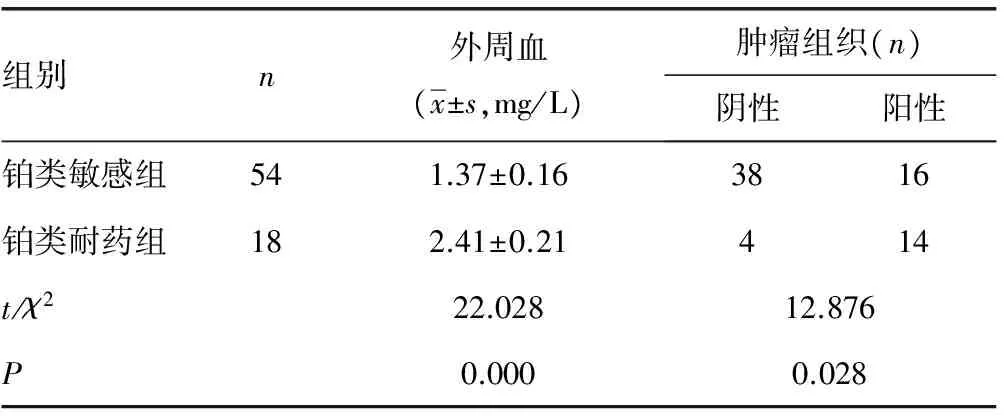
表1 铂类敏感与铂类耐药患者Annexin A3表达比较

A:阴性;B:弱阳性;C:阳性;D:强阳性
图1肿瘤组织Annexin A3染色结果(免疫组织化学,×200)
2.5铂类耐药影响因素单因素分析 单因素分析显示,血清Annexin A3高浓度患者铂类耐药发生率显著高于血清Annexin A3低浓度患者,组织Annexin A3高表达患者铂类耐药发生率显著高于组织Annexin A3低表达患者(P<0.05),见表2。
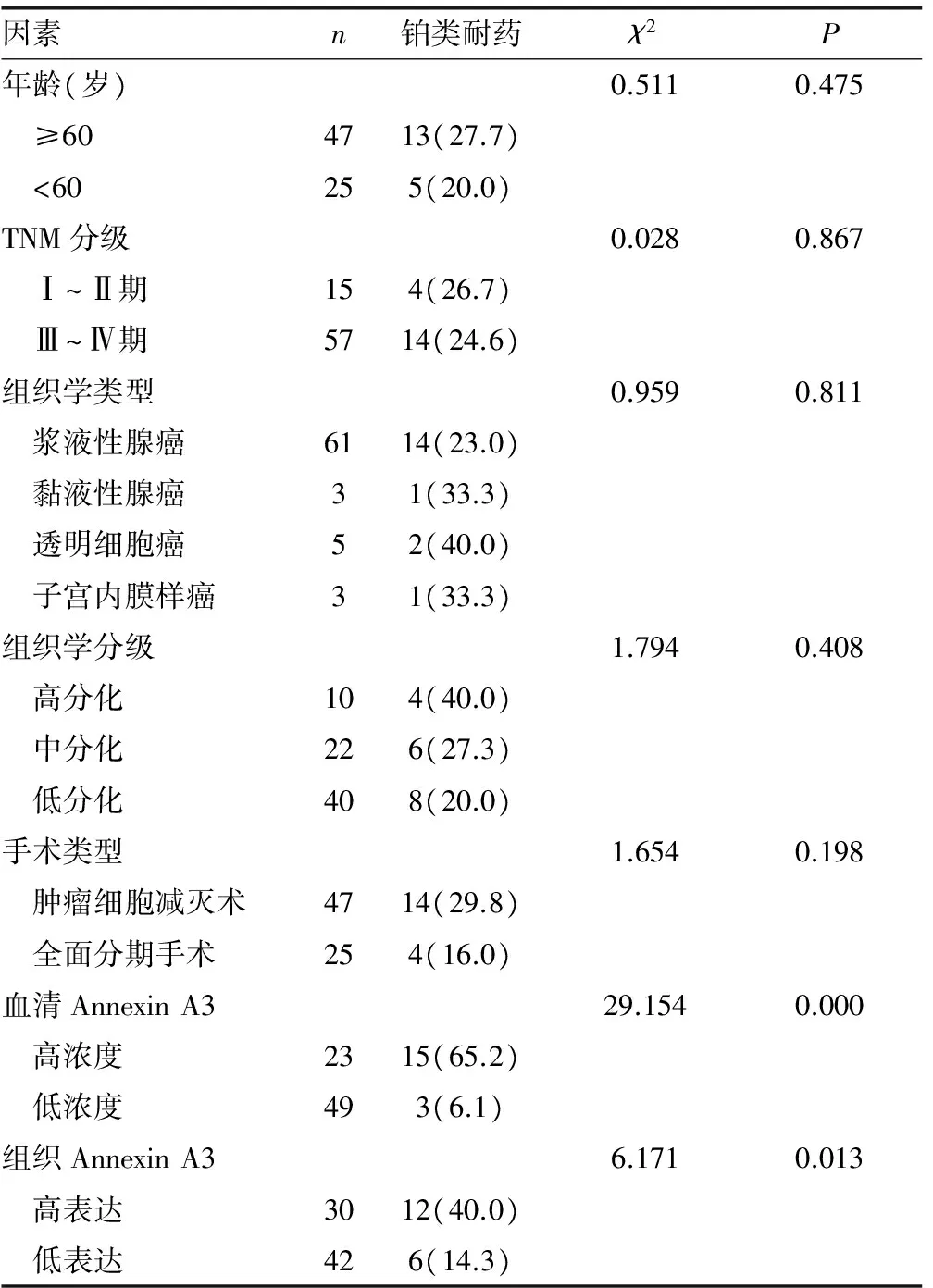
表2 铂类耐药影响因素单因素分析(%)

图2 高浓度与低浓度Annexin A3患者生存曲线
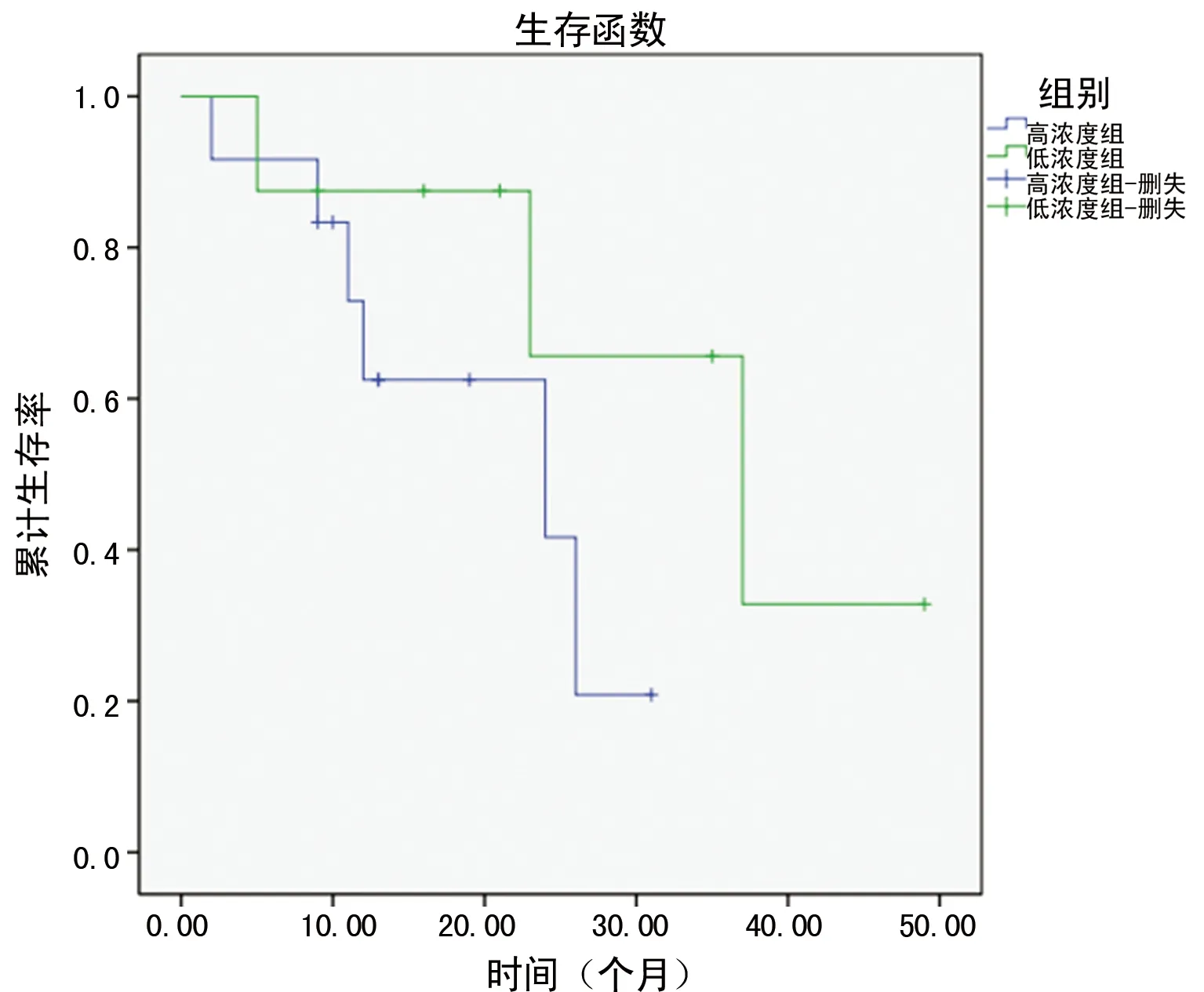
图3 高表达与低表达Annexin A3患者生存曲线
2.6铂类耐药影响因素多因素分析 多因素分析显示,血清与肿瘤组织Annexin A3蛋白表达水平是影响铂类耐药的独立危险因素(P<0.05),见表3。
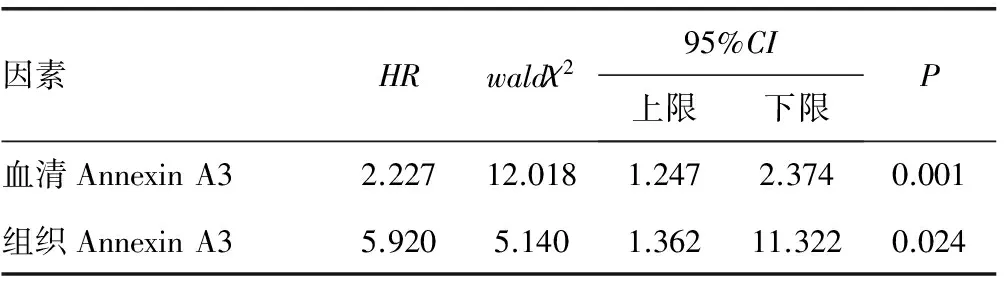
表3 铂类耐药影响因素多因素分析
2.7外周血、组织Annexin A3对铂类耐药的预测价值 外周血Annexin A3预测铂类耐药的AUC为0.821(95%CI:0.692~0.951,P<0.05),最佳临界值为2.05 mg/L,此临界值的特异度为85.37%,敏感度为53.27%,阳性预测值为45.82%,阴性预测值为88.74%;组织Annexin A3预测铂类耐药的AUC为0.763(95%CI:0.614~0.911,P<0.05),最佳临界值为阳性(++),此临界值的特异度为82.45%,敏感度为43.91%,阳性预测值为49.73%,阴性预测值为86.59%;外周血Annexin A3预测铂类耐药的AUC高于组织Annexin A3,见图4。

A:外周血Annexin A3;B:组织Annexin A3
图4外周血、组织Annexin A3预测铂类耐药的ROC曲线
3 讨 论
卵巢上皮癌病死率居女性生殖恶性肿瘤的首位,是威胁女性健康安全的重大疾病之一。随着医疗水平的发展,肿瘤细胞减灭术联合铂类为主的化疗方案成为卵巢癌治疗的主要手段,并成功挽救无数女性患者的生命。然而晚期卵巢癌患者远期生存期低于30%,其中对化疗药物耐药是造成晚期卵巢癌生存率偏低的主要原因[8]。目前对铂类耐药的临床评价主要包括化疗期间肿瘤进展、化疗结束后6个月内复发、对标准化疗方案的最佳反应仅为肿瘤无变化等,然而这些评价标准存在缺陷,只能等到化疗到一定阶段,才能判断出化疗药物是否敏感,可能延误部分患者的最佳治疗时机。因此,寻找到预测铂类耐药的敏感指标,并及时调整化疗方案,对改善患者的治疗结局具有重要意义。
Annexin A3是一种Ca2+依赖磷脂结合蛋白,与细胞内多种生物功能密切相关。国外有研究显示,膀胱癌、肺癌等组织中Annexin A3表达显著升高,提示Annexin A3可能参与了肿瘤的发病[9]。Watanabe等[10]采用Annexin A3基因RNA干扰表达载体转染胆囊癌细胞株,结果显示胆囊癌细胞生长受限,并随着时间延长胆囊癌细胞逐渐发生凋亡,提示Annexin A3可能是治疗胆囊癌的一个潜在的分子靶点。傅燕萍等[11]证实Annexin A3能够显著降低肿瘤细胞内铂与DNA结合的水平,导致细胞对铂类耐药。动物成瘤实验也证实,顺铂作用后的肿瘤细胞,Annexin A3高表达的细胞成瘤率显著高于Annexin A3低表达的细胞[12];但是对于紫杉醇、表阿霉素等药物作用的细胞成瘤率无明显差异,提示Annexin A3可能是特异性铂类耐药的分子标记蛋白。
本研究对外周血和组织Annexin A3水平进行检测,结果显示铂类敏感组肿瘤组织Annexin A3水平显著低于铂类耐药组,提示Annexin A3水平与铂类耐药密切相关。免疫组织化学染色证实,Annexin A3主要定位于细胞质和细胞核;而根据吴志明等[13]的报道,Annexin A3没有跨膜区域和信号肽,因此Annexin A3能否成为铂类耐药的标志蛋白取决于其能否被分泌至细胞外。Hamelin-Peyron等[14]采用免疫印迹法检测铂类耐药的细胞培养上清液,结果证实细胞外依然可以检测出Annexin A3表达,且细胞外Annexin A3表达与细胞内Annexin A3分泌量呈正相关。本研究同样证实,铂类敏感组外周血Annexin A3水平显著低于铂类耐药组,这亦为Annexin A3作为铂类耐药的分子标记物提供了理论基础。本研究还证实外周血Annexin A3低浓度患者中位PFS显著高于高浓度患者,组织Annexin A3高表达患者中位PFS显著高于低表达患者,说明Annexin A3与卵巢上皮癌患者生存预后有关。
本研究多因素分析显示,血清与肿瘤组织Annexin A3表达水平是影响铂类耐药的独立危险因素,ROC曲线分析显示外周血Annexin A3预测铂类耐药的AUC为0.821,组织Annexin A3预测铂类耐药的AUC为0.763,两者均可作为铂类耐药的预测指标。从生物学取样、操作便捷性和结果稳定性方面,外周血检测均有无可比拟的优势。组织标本仅在手术时可获取,而血清标本理论上可在任何时段取样,因此,血清学标本取样优于组织学标本。本研究进一步对比外周血和组织Annexin A3对铂类耐药的预测价值,结果显示,外周血Annexin A3预测铂类耐药的AUC、特异度、敏感度、阴性预测值均高于组织Annexin A3。因此外周血Annexin A3检测对铂类耐药预测的价值优于组织Annexin A3检测。
[1]Koshkin PA,Chistiakov DA,Chekhonin VP.Role of microRNAs in mechanisms of glioblastoma resistance to radio- and chemotherapy[J].Biochemistry (Mosc),2013,78(4):325-334.
[2]Luque-Ortega JR,de la Torre BG,Hornillos V,et al.Defeating leishmania resistance to miltefosine (hexadecylphosphocholine) by peptide-mediated drug smuggling:a proof of mechanism for trypanosomatid chemotherapy[J].J Control Release,2012,161(3):835-842.
[3]Yin J,Yan XE,Yao X,et al.Secretion of annexin A3 from ovarian cancer cells and its association with Platinum resistance in ovarian cancer patients[J].J Cell Mol Med,2012,16(2):337-348.
[4]Ito Y,Watanabe T,Nagatomo S,et al.Annexin a3-Expressing cellular phenotypes emerge from necrotic lesion in the pericentral area in 2-Acetylaminofluoren/Carbon Tetrachloride-Treated rat livers[J].Biosci Biotechnol Biochem,2007,71(12):3082-3089.
[5]Edge SB,Compton CC.The American joint committee on cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM[J].Ann Surg Oncol,2010,17(6):1471-1474.
[6]姜洋,金晓明,屠康.平均阳性染色面积百分比法分析免疫组化结果初探[J].生物医学工程学杂志,2007,24(3):650-653.
[7]Raffaghello L,Lee C,Safdie FM,et al.Starvation-dependent differential stress resistance protects normal but not cancer COS against high-dose chemotherapy[J].Proc Natl Acad Sci U S A,2008,105(24):8215-8220.
[8]吴若冰,程通,张雅丽,等.米非司酮对人耐药卵巢癌细胞增殖、凋亡及其对紫杉醇敏感性的影响[J].中国癌症杂志,2012,22(2):114-119.
[9]Schostak M,Schwall GP,Poznanovic S,et al.Annexin a3 in urine:a highly specific noninvasive marker for prostate cancer early detection[J].J Urol,2009,181(1):343-353.
[10]Watanabe T,Ito Y,Sato A,et al.Annexin a3 as a negative regulator of adipocyte differentiation[J].J Biochem,2012,152(4):355-363.
[11]傅燕萍,吴志明,范乘龙,等.Annexin A3在乳腺癌中的表达及临床意义[J].实用肿瘤杂志,2015,30(6):567-570.
[12]Nishiura H,Yamanegi K,Kawabe M,et al.Annexin a3 plays a role in cytoplasmic Calcium oscillation by extracellular Calcium in the human promyelocytic leukemia HL-60 cells differentiated by phorbol-12-myristate-13-acetate[J].Exp Mol Pathol,2014,97(2):241-246.
[13]吴志明,邱海江,方孙阳,等.Annexin A3在乳腺癌中的表达及意义[J].肿瘤学杂志,2014,20(9):705-709.
[14]Hamelin-Peyron C,Vlaeminck-Guillem V,Haidous H,et al.Prostate cancer biomarker annexin A3 detected in urines obtained following digital rectal examination presents antigenic variability[J].Clin Biochem,2014,47(10/11):901-908.
PredictivevalueofAnnexinA3proteinexpressioninperipheralbloodandtumortissueforplatinumresistanceinovarianepithelialcancer
XieXianghong1,LiuFang2
(1.DepartmentofClinicalLaboratory;2.DepartmentofObstetricsandGynecology,ArmedPoliceSichuanCorpsHospital,Leshan,Sichuan614000,China)
ObjectiveTo compare the values of peripheral blood and tumor tissue Annexin A3 protein expressions for predictinge platinum resistance in ovarian epithelial cancer.MethodsA total of 72 cases of newly treated ovarian epithelial cancer and undergoing platinum based chemotherapy after surgery,and completely followed up in this hospital from February 2010 to February 2012 were selected and divided into the platinum-sensitive group(54 cases) and platinum-resistant group(18 cases) according to the platinum resistance evaluation criteria.Peripheral blood Annexin A3 level was detected by chemiluminescence immunoassay.Tumor tissue Annexin A3 level was detected by adopting the immunohistochemical staining.The predictive value of peripheral blood and tumor tissue Annexin A3 for predicting platinum resistance was analyzed by drawing the ROC curve.ResultsThe peripheral blood Annexin A3 level in the platinum-sensitive group was significantly lower than that in the platinum-resistant group,the difference was statistically significant(P<0.05),the positive rate of tumor tissue Annexin A3 expression in the platinum sensitivity group was significantly lower than that of platinum-resistant group(P<0.05).The median survival time in peripheral blood Annexin A3 low concentration group was significantly higher than that of high concentration group(31.2 monthsvs. 20.4 months,P<0.05).The median survival time in tissue Annexin A3 low expression group was significantly higher than that in the high expression group (35.2 monthsvs. 23.1 monthsP<0.05).The multivariate analysis showed that the level of Annexin A3 expression in serum and tumor tissue were the independent risk factor for affecting platinum resistance (allP<0.05).The area of curve (AUC) of peripheral blood Annexin A3 in predicting platinum resistance was 0.821,which of tissue Annexin A3 in predicting platinum was 0.763,peripheral blood Annexin A3 for predicting platinum resistance was significantly higher than tissue Annexin A3(P<0.05).ConclusionThe expression levels of Annexin A3 protein in peripheral blood and tumor tissue are significantly increased in the patients with platinum resistant ovarian cancer,the predictive value of Annexin A3 protein in peripheral blood for platinum resistance is better than that of tissue Annexin A3 protein.
Annexin A3;ovarian neoplasms;drug therapy,combination;chemotherapy sensitivity;chemotherapy resistance;ovarian epithelial cancer;survival prognosis
谢祥红(1966-),副主任技师,本科,主要从事临床医学检验专业研究。
R737.3
A
1671-8348(2017)30-4214-04
2017-01-24
2017-04-12)

