不同强度运动对肥胖大鼠肝脏氧化应激和脂联素及其受体的影响
曹姣 肖国强 陈晓光
1 广东第二师范学院体育学院(广州 510303)
2 华南师范大学体育科学学院 3广东医学院
不同强度运动对肥胖大鼠肝脏氧化应激和脂联素及其受体的影响
曹姣1肖国强2陈晓光3
1 广东第二师范学院体育学院(广州 510303)
2 华南师范大学体育科学学院 3广东医学院
目的:探讨三种不同强度运动对肥胖大鼠肝脏氧化应激及脂联素/脂联素受体等相关指标的影响。方法:经16周高脂饲料喂养构建肥胖大鼠模型,32只模型鼠分为高脂安静组(HF,8只)、小强度运动组(HS组,8只)、中等强度运动组(HM组,8只)和递增负荷运动组(HI组,8只),另外选取正常对照组(NC组)大鼠8只。运动方式采用跑台运动,小强度运动跑速为10 m/min,中等强度跑速为15 m/min,递增负荷强度为10 m/min的速度运动20min、20 m/min的速度运动20min、28~30 m/min的速度运动20min。运动组每周运动5天,每次1小时。干预持续6周后检测各组大鼠体重,肝脏超氧化物歧化酶(SOD)活性、丙二醛(MDA)、肿瘤坏死因子α(TNF-α)、白介素6(IL-6)、脂联素受体I(AR1)、AR2,血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、脂联素、甘油三酯(TG)、胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、自由脂肪酸(FFA)等指标。结果:与NC组比较,HF组大鼠体重、TG、TC、LDLC、FFA含量、ALT活性、AST活性以及MDA、TNF-α和IL-6表达均显著性升高(P<0.05或P<0.01),HDL-C含量、SOD活性、血清脂联素水平及AR1、AR2表达均显著性降低(P<0.05或P<0.01);与HF组比较,HS、HM和HI组体重、血清TG、LDL-C、FFA含量及肝脏ALT含量、MDA、TNF-α、IL-6表达均显著性降低(P<0.05或P<0.01),SOD活性、脂联素水平及AR1、AR2表达均显著性升高(P<0.05或P<0.01),仅HM组HDL-C含量显著升高(P<0.05);与HS组和HI组比较,HM组FFA含量、MDA表达进一步降低(P<0.05),脂联素水平、AR2进一步增加(P<0.05)。结论:有氧运动能有效改善高脂饮食所致的肥胖大鼠脂代谢异常,提高肝脏抗氧化酶活性,增强自由基清除能力,预防肝细胞炎症损伤,改善肝脏代谢功能紊乱,其中中等强度运动优于小强度或递增负荷强度运动,其机制可能是通过增加血清脂联素进一步激活肝脏脂联素受体2有关。
不同强度运动;氧化应激;脂联素;脂联素受体2;肥胖大鼠
肥胖已经成为一种严重危害人类健康的疾病,常继发性引起脂肪肝、心脏病、糖尿病、癌症、炎症和代谢综合征等的发生[1,2]。研究显示,多种因素可导致肥胖,其中作用最为显著的是膳食结构与生活方式因素的改变。既往研究显示,长期的高脂饮食可通过激活脂肪细胞NADPH酶,加速活性氧过量产生[3]。活性氧(reactive oxygen species,ROS)的产生增加可促使肝脏肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、白介素6(interleukin-6,IL-6)等脂肪细胞因子表达升高,造成肝细胞功能异常,进一步引起肝脏脂代谢系统功能紊乱[4]。脂联素为一种分子量为30 kDa的蛋白质,其结构包含一个C-末端的球状结构域和一个类似胶原的N-末端结构域。经显示,脂联素能抑制单核细胞粘附到内皮细胞,同时可将巨噬细胞转化为泡沫细胞,激活内皮细胞功能,抑制TNF-α表达,具有高抗炎和抗动脉粥样硬化作用[5],此外,它与肥胖、胰岛素抵抗(insulin resistance,IR)也存在相关[6]。
有氧运动具有多种有益于健康的效应,如维持体重正常、抗炎症[7],此外,还能加强机体清除过量自由基,提高抗氧化酶活性,增强抗氧化能力,维持机体自由基的产生与清除间的平衡,减少氧化应激对肝脏脂代谢造成的损伤[8,9]。然而在众多不同形式的运动中,何种强度对肥胖机体产生的影响的效应最佳?不同强度运动对其肝脏脂代谢和细胞因子表达影响程度如何?其具体作用机制怎样?尚不清楚。因此,本实验通过采取不同强度的运动干预方式,探讨其对高脂饮食所致的肥胖大鼠脂代谢紊乱、肝脏脂肪细胞分泌因子的影响及相关机制,旨在为高脂饮食所致肝脏脂代谢紊乱相关疾病的防治提供实验参考。
1 材料与方法
1.1 实验动物分组和肥胖模型构建
2月龄SPF级雄性SD大鼠46只均选自广州中医药大学动物实验中心,许可证号:SCXK(粤)2011-0020,体重178±14 g。大鼠适应性喂养2周后随机分为正常饮食对照组(NC组,8只)和高脂组(H组,38只)。适应性喂养期间所有大鼠喂以普通饲料,实验期间动物房进行自然光照,室内温度保持25℃左右,湿度为50%。实验期间大鼠自由饮食饮水,正常饮食对照组进行固体普通饲料喂养,高脂组大鼠进行高脂饲料喂养。高脂饲料由广东省动物实验中心提供,配方成分为:蔗糖5%、猪油18%,蛋黄粉15%,胆酸钠0.5%,胆固醇1%,基础饲料60.5%,其中脂肪供能占58.3%。
高脂组大鼠经16周高脂饲料喂养,体重超过普通饲料喂养大鼠平均体重的1.4倍标准差的大鼠即为肥胖模型大鼠[10]。之后将造模成功的32只肥胖大鼠随机分成高脂安静组(HF组,8只),高脂小强度运动组(HS组,8只),高脂中等强度运动组(HM组,8只)和高脂递增负荷强度运动组(HI组,8只)。造模成功后的所有高脂组大鼠均采用普通饲料喂养。
1.2 运动方案
运动组大鼠采取无坡度跑台运动的方式,经适应性运动1周后开始正式运动训练,小强度跑台运动控制跑台速度为10 m/min,相当30%VO2max强度;中等强度控制跑台速度为15 m/min,相当50%VO2max强度;递增负荷强度运动方式为10 m/min运动20min,20 m/min运动20min,28~30 m/min运动20min。运动共持续6周,每周5次,每次1 h[11]。NC组和HF组大鼠均不进行运动干预。
1.3 Lee’ s指数及血清各指标的测定
由专人测量大鼠的体质量与体长(鼻至肛门的长度),每只大鼠测3次,取较为相近的两次值,计算平均值,依公式Lee’s指数 = 体质量(g)1/3×103/ 体长(cm),计算Lee’s指数[12]。
大鼠取材前禁食12 h,经10%水合氯醛(0.35~0.40 mL/kg)腹腔注射麻醉后,打开腹腔进行腹主动脉取血,将血液置于抗凝管中静置10min左右,于高速离心机内,4℃、3500 rpm离心15min,制备血清,-80℃冰箱保存,待测血清各指标。其中谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)、血清甘油三酯(triglyceride,TG)、胆固醇(cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoproteincholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoproteincholesterol,LDL-C)、自由脂肪酸(free fatty acid,FFA)采用比色法,按照试剂盒说明书在全自动生化分析仪上测试。
血清脂联素的测定采用双抗体夹心ABC-ELISA法。测定过程为:每孔各加入标准品和血清100 μl,将反应板充分混匀后置 37℃120min;洗板,每孔中加入一抗100 μl;将反应板充分混匀后置 37℃ 60min;洗板,每孔加酶标抗体工作液 100 μl。将反应板置37℃ 30min;洗板,每孔加入底物100 μl,置 37 ℃暗处反应15min;每孔加入100 μl终止液混匀;30min内用酶标仪在 450 nm处测吸光值。
1.4 肝指数、肝脏TNF- α和IL- 6的测定
打开大鼠胸腔取肝组织,称取肝湿重,肝指数(%)=(肝湿重/体重)×100%;之后取每只大鼠肝中叶相同部位的肝脏组织切成1.0cm×1.0cm×1.0cm,经0.9%的生理盐水中清洗干净,置于10%中性甲醛溶液固定24~48 h,用于制备肝脏组织病理学切片,待测TNF-α和IL-6。
TNF-α、IL-6指标用免疫组织化学法测试。测试过程为:肝脏组织固定、脱水、浸蜡、包埋、切片;脱蜡,水化;PBS冲洗3次×5min;3%H2O2封闭,室温10min;PBS冲洗,抗原微波修复;10%山羊血清(0.1 Mpbs配制,加0.1%的Triton-100液)孵育,室温20min~1 h;滴加一抗(0.1 Mpbs配制,加浓度为0.1%的Triton-100液,4℃过夜;加二抗,室温孵育3 h;DAB显色;苏木精复染,盐酸酒精分化;自来水冲洗10~15min;脱水,透明,封片。应用CK40-F2000型显微镜观察肝脏切片,每张切片随机选取5个视野,400倍光镜下观察记录5组大鼠肝脏TNF-α、肝脏IL-6阳性细胞染色情况,使用Image-ProPlus图像处理软件进行图像采集与分析,分析结果以染色平均光密度值表示。
1.5 肝组织超氧化物岐化酶(SOD)、丙二醛(MDA)和脂联素受体的测定
取部分肝中叶用锡箔纸分块包裹,液氮(-80℃)保存,待测肝组织超氧化物岐化酶(SOD)、丙二醛(MDA)和肝脏脂联素受体。将肝组织加入适量生理盐水捣碎,用电动搅拌器带动的玻璃匀浆器制成10%组织匀浆,以上操作均在0~4℃水浴中进行。离心10分钟,取上清液。SOD采用黄嘌呤氧化酶法测试。先设定对照管(两管)和测试管,测试管中加入上清液,取样量均为30 μl,加入样品和试剂的顺序依试剂盒说明,混匀后37℃水浴40min,再加显色剂Znil,混匀,10min置入722分光光度计550 nm下比色测定吸光度值。MDA采用硫代巴比妥酸法。先将等量的标准品、无水乙醇、肝组织上清液分别加入试管中。按试剂盒要求分别加入试剂和样品。混匀后95℃水浴40min,取出后冷却,4000 rpm离心10min,取上清532 nm处比色测定吸光度值。
肝脏脂联素受体Ⅰ(AR1)和脂联素受体Ⅱ(AR2)蛋白表达采用western blot法测定。先取1.5 ml离心管,按每称取 100 mg组织,加入 1 mL RIPA、10 μl 100 mM 的PMSF和10 μl磷酸酶抑制剂,匀浆;4℃12000 r/min离心30min;BCA试剂盒总蛋白定量;取100 μL的组织裂解液,加25 μl 5×电泳上样缓冲液;沸水浴5min,12000 r/min离心3min,上样;电泳约30min;转膜;洗涤,用5%脱脂奶粉室温封闭30min,4℃过夜;加已稀释好的兔抗体AR1和AR2(1:200)(稀释液含2%的BSA),4℃过夜;洗膜;加5 ml 1:5000稀释(稀释液含2%的脱脂奶粉)的羊抗兔二抗,37℃反应1 h;加入ECL化学发光试剂,放入X射线暗盒,置于暗房;浸透晃洗胶片;自来水浸泡,晾干。
1.6 统计学处理
所得数据应用SPSS 16.0和Excel 2003统计软件进行处理,采用单因素方差分析和配对样本T检验进行统计学分析,结果以平均数±标准差(±s)来表示,显著性水平为P<0.05,非常显著性水平为P<0.01。
2 结果
2.1 各组大鼠体重和血清脂代谢相关指标变化
如表1所示,造模前,大鼠的体重表现为:NC组和高脂组两组之间无显著性差异(P>0.05),经16周造模后,与NC组比较,高脂组大鼠体重、Lee’指数非常显著性升高(P<0.01),且体重超过普通饲料喂养大鼠(NC组)平均体重的1.4倍标准差。

表1 造模前后正常对照组(NC组)和高脂组大鼠体重和Lee’指数比较
如表2所示,与NC组比较,HF组体重、TG、TC、LDL-C和FFA均非常显著升高(P<0.01),HDL-C显著降低(P<0.05)。与HF组比较,HS组、HM组、HI组大鼠的体重、TG、LDL-C和FFA显著性降低(P<0.05或P<0.01),HM组HDL-C显著性升高(P<0.05);与HS组、HI组比较,HM组大鼠血清FFA显著性降低(P<0.05)。

表2 干预后各组大鼠体重和血清脂代谢相关指标比较
2.2 各组大鼠肝重指数及血清ALT、AST的变化
如表3所示,与NC组比较,HF组肝重指数、ALT、AST显著性升高(P<0.05或P<0.01)。与HF组比较,HS、HM和HI组肝重指数、ALT含量显著性降低(P<0.05或P<0.01),除HS组外,HM和HI三组大鼠AST含量均呈显著降低(P<0.05)。

表3 各组大鼠肝重指数及ALT、AST指标比较
2.3 各组大鼠肝脏氧自由基代谢的变化
如表4所示,与NC组比较,HF组SOD活性非常显著性下降(P<0.01),MDA含量非常显著性升高(P<0.01)。与HF组比较,HS组、HM组和HI组大鼠肝脏SOD活性显著升高(P<0.01),MDA含量呈非常显著降低(P<0.01),其中,与HS组、HI组比较,HM组大鼠肝脏MDA含量均呈显著性下降(P<0.05)。

表4 各组大鼠肝脏SOD活性和MDA含量比较
2.4 各组大鼠肝脏TNF- α表达的变化
如图1所示,各组大鼠肝脏TNF-α蛋白阳性产物呈棕褐色细颗粒状,主要定位于细胞质,其中NC组未见棕色颗粒,表达呈阴性,HF组中存在明显的棕色颗粒状区域,呈强阳性。如表5所示,与NC组比较,HF组TNF-α表达非常显著性升高(P<0.01)。与HF组比较,HS组和HI组TNF-α表达显著性降低(P<0.05),HM组表达非常显著性降低(P<0.01)。
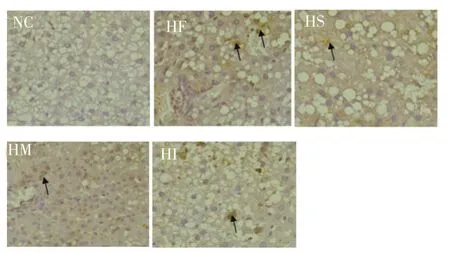
图1 各组大鼠肝组织TNF-α免疫组化染色结果(DAB显色,×400)

表5 各组大鼠肝脏TNF-α表达的比较
2.5 各组大鼠肝组织IL- 6表达的变化
如图2所示,各组大鼠肝脏IL-6蛋白阳性产物呈棕褐色细颗粒状,主要定位于细胞质,其中NC组中未见棕色颗粒,表达呈阴性,HF组中存在明显的棕色颗粒状区域,呈强阳性。如表6所示,与NC组比较,HF组IL-6表达非常显著性升高(P<0.01)。与HF组比较,HS、HM和HI组IL-6表达显著性降低(P<0.05或P<0.01)。

图2 各组大鼠肝组织IL-6免疫组化染色结果(DAB显色,×400)

表6 各组大鼠肝脏IL-6表达的比较
2.6 各组大鼠血清脂联素及肝脏脂联受体水平
2.6.1 各组大鼠血清脂联素水平
如表7所示,与NC组比较,HF组大鼠血清脂联素水平非常显著下降(P<0.01)。与HF组比较,HS组、HM组和HI组大鼠血清脂联素水平显著升高(P<0.05或P<0.01);与HS组比较,HM组大鼠血清脂联素水平显著升高(P<0.05)。

表7 各组大鼠血清脂联素水平比较
2.6.2 各组大鼠肝脂联素受体 I(AR 1)和受体 II(AR 2)蛋白表达的变化
如图3、图4所示,与NC组比较,HF组大鼠肝脏AR1蛋白显著性降低(P<0.05),AR2非常显著性降低(P<0.01);与HF组比较,HS、HM、HI组大鼠肝脏AR1蛋白显著性增加(P<0.05),HI组大鼠肝脏AR2蛋白表达显著性增加(P<0.05),而HS、HM组大鼠肝脏AR2蛋白表达非常显著性增加(P<0.01);与HS组、HI组比较,HM组大鼠肝脏AR2蛋白表达显著性增加(P<0.05)。
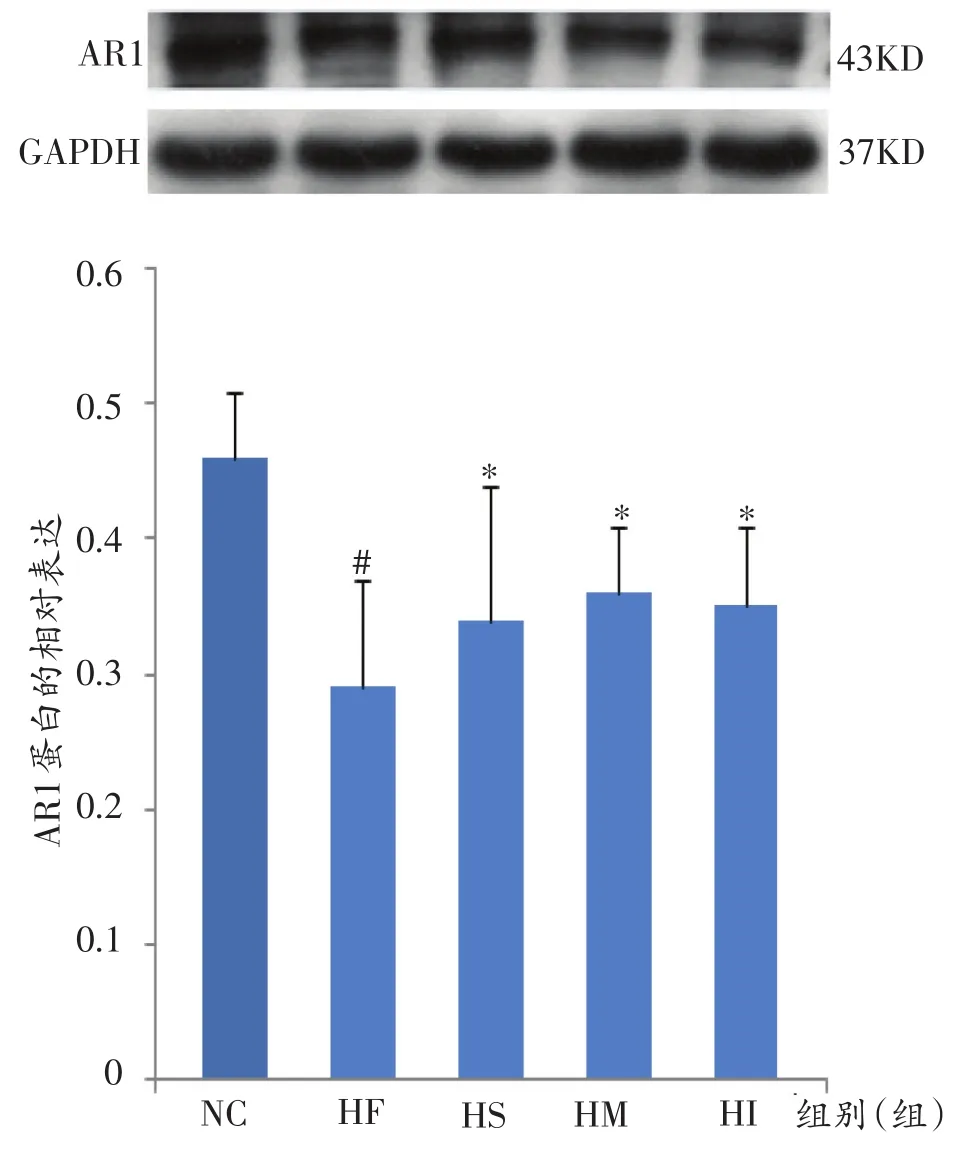
图3 各组大鼠肝脏AR1蛋白的相对表达量
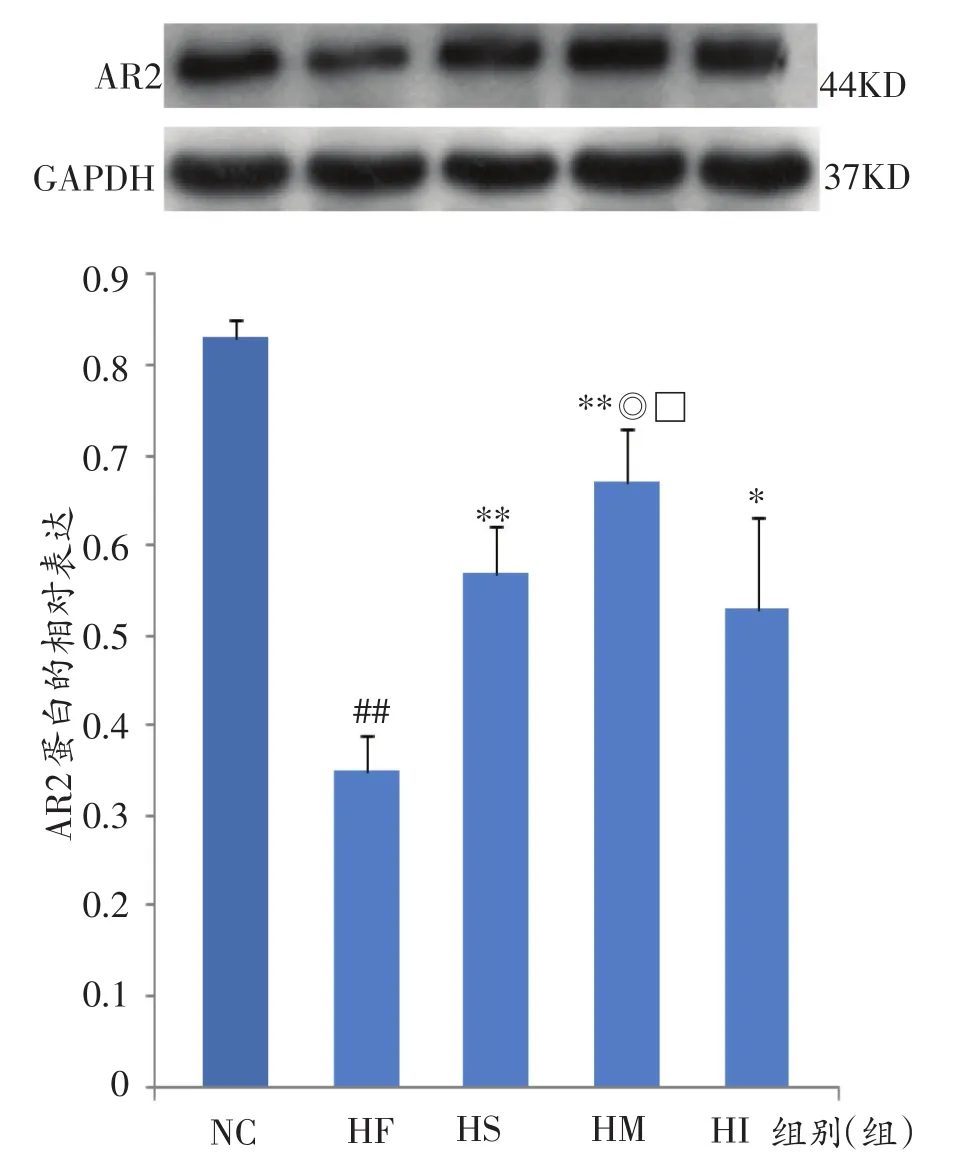
图4 各组大鼠肝脏AR2蛋白的相对表达量
3 讨论
3.1 三种不同强度运动对肥胖大鼠体重、血脂的影响
有研究显示,规律的有氧运动具有增加能量消耗,增强机体降脂[8]、抗氧化[9]、抗炎能力[7]等功能,因而在减少肥胖相关疾病患病风险中起着关键作用。本研究通过16周的高脂饮食成功构建营养型肥胖大鼠模型,表现为体重非常显著增加,且超过普通饲料喂养大鼠平均体重的1.4倍标准差。经过6周的干预后,本实验结果显示,与HF组比较,三种不同运动干预组的体重、TG、LDL-C和FFA显著性降低(P<0.05或P<0.01),仅有HM组的HDL-C显著性增加(P<0.05);与其他两组比较,HM组的FFA进一步降低(P<0.05)。表明中等强度干预降低肥胖大鼠体重和改善肥胖大鼠脂代谢紊乱优于小强度和递增负荷强度运动,其原因可能是后两种强度运动对脂肪动员能力较弱有关。HS组运动强度较低,只能在运动开始之初对体重造成一定的影响,至机体适应该运动强度时便会出现该强度对机体产生刺激不足,糖原供能可满足机体运动时的能量需求,而脂肪动员较少[13];HI组在有氧运动前期,由于运动强度小、运动时间短,不足以动用机体脂肪供能[14],而后期由于运动强度较大,可能主要以无氧供能系统中的糖酵解供能为主,仍未动用脂肪供能[15]。
3.2 三种不同强度运动对肥胖大鼠肝功能及肝脏氧自由基代谢的影响
MDA是判定脂质过氧化水平和氧化损伤程度的重要指标,SOD是机体消除自由基的一种抗氧化酶,在对抗自由基过程中起着第一道防线的作用。本实验结果显示,高脂安静组(HF组)大鼠肝脏的肝重指数、MDA、血清AST、ALT水平显著升高,SOD活性降低(P<0.05或P<0.01),表明高脂饮食所致肥胖大鼠肝脏脂质过氧化产物生成增加,体内自由基含量升高,氧化-抗氧化系统代谢失衡而出现氧化应激,引起肝功能损害,这与国外某些研究结果相一致[16]。经6周不同强度运动干预后,研究显示,HS、HM、HI组大鼠肝重指数、MDA、血清TG、ALT含量均呈现显著下降(P<0.05),SOD活性非常显著性增加,表明不同强度运动均能改善肥胖大鼠肝脏的脂质过氧化,其中HM组MDA含量下降幅度最大,而HI组幅度最小。其原因可能是小强度有氧运动可以增强机体的防御能力,并且运动时机体氧运输能力提高,组织血供增多,自由基生成减少,但不足以达到使机体抗氧化系统产生适应性变化的阈值,长期以此强度进行运动训练,无法提高机体各组织器官的兴奋性,虽然抗氧化酶活性提高幅度较大,但MDA的消除效果不明显[17]。中等强度运动可以提高机体抗氧化能力、自由基消除的能力,使脂质过氧化产物含量下降,调节氧化-抗氧化系统的动态平衡,降低机体脂毒性[18]。然而,递增负荷运动相比其他的强度运动,机体耗氧量相对增加,机体处于缺氧状态反而增加了自由基的产生量,过量的自由基攻击膜不饱和脂肪酸,MDA产生增加进入组织器官使蛋白质、核酸等物质出现氧化损伤,为抵制自由基,抗氧化酶过度消耗,不利于肥胖大鼠肝脏氧化应激的较好改善[18,19]。值得一提的是,递增负荷强度组大鼠与肥胖组相比,体重显著性降低,分析其原因可能与食欲激素的平衡调节变化有关,递增负荷运动一方面通过血液重新分配,抑制胃饥饿素的分泌;另一方面,通过促进细胞因子的释放、改善交感神经系统活性以及骨骼肌代谢,介导酪酪肽(peptide YY,PYY)和胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)等厌食信号激素的分泌,减少进食,最终出现能量负平衡,体重减轻[19]。
3.3 三种不同强度运动对肥胖大鼠肝脏脂肪细胞分泌因子及脂联素/脂联素受体的影响
TNF-α是肿瘤坏死因子之一,它是肿瘤坏死因子家族中的重要一员,可促进T细胞产生各种炎症因子。它的主要功能是:激活其他细胞因子,并且调节细胞的分化、增殖、坏死或凋亡,这对于脂代谢有着积极的作用[20]。IL-6是脂肪细胞分泌因子中的一种多效能细胞因子,是能量代谢平衡中重要的调节因子,不仅是促炎症的细胞因子参与炎症的发生,而且在肝脏中,还能通过引起运动急性反应,造成肝细胞损伤[21]。Jung S[22]、Nepal S[23]等研究发现,高脂引起的血脂异常包括高胆固醇血症、脂蛋白-α分泌异常,以及TNF-α、IL-6等炎性因子增加,可通过激发Kupffer细胞的活性,分泌出更多的细胞因子,引起肝脏功能损伤。本实验结果显示(如表5、表6),与NC组比较,HF组TNF-α、IL-6表达非常显著性升高(P<0.01)。适度运动可降低肥胖大鼠肝脏TNF-α、IL-6含量,减轻肝脏损伤[19],本实验结果显示,三种不同强度运动组中,HS和HI组大鼠TNF-α、IL-6表达较HF组明显降低(P<0.05或P<0.01),而HM组具有进一步降低的趋势(P>0.05),表明中等强度的运动可能较好地降低肥胖大鼠体脂含量,提高肝脏抗氧化能力,减轻肝细胞炎症损伤程度,最终改善肝脏功能,可能与TNF-α、IL-6水平降低有关。
脂联素结构上与补体系统蛋白和TNF-α相关,这是一组蛋白质家族中的亚型成员,又名为CTRP(C1q/TNF结合物)。脂联素是APM1基因的产物,由244个氨基酸组成,又称为GBP-28、ADOPOQ和ACRP30。这一蛋白主要由脂肪细胞分泌,起着调节能量稳态[24]、糖脂代谢[24]和抗炎效应[25]。相比其他的脂肪细胞分泌因子,在胰岛素抵抗和肥胖疾病中,脂联素表达和在血浆中的浓度减少。脂联素能抑制单核细胞粘附到内皮细胞,同时可将巨噬细胞转化为泡沫细胞,激活内皮细胞功能,抑制TNF-α表达,具有高抗炎和抗动脉粥样硬化作用[5]。脂联素水平和肥胖、胰岛素抵抗(IR)相关[6],研究报道[26],高脂喂养大鼠的血清脂联素降低,而其注射脂联素则出现脂肪变性改善,减轻炎症的严重程度。脂联素可能通过抑制脂肪合成的两个关键酶:乙酰辅酶A和脂肪酸合酶[27],抑制TNF-α在肝脏合成,促进肝脏内脂肪氧化[28]。本实验结果显示,HF组大鼠血清脂联素水平非常显著性降低(P<0.01),而HS组、HM组或HI组大鼠血清脂联素水平出现不同程度的增加(P<0.05或P<0.01),提示有氧运动干预后,高脂饮食所致肥胖大鼠肝脏炎症状态减轻可能与脂联素的水平有关。
脂联素发挥作用需通过受体的介导,机体内的脂联素的受体主要包括两种,分别为AR1和AR2。这些受体有7个跨膜部分,但功能上不同于G蛋白偶联受体。不同组织器官中AR1和AR2表达不一,如在骨骼肌中,主要表达的受体是AR1,而在肝脏中,AR2为主要表达受体[29]。Bullen等[30]研究显示,随龄增加或高脂肪饮食都可引起脂联素减少,AR1和AR2的水平增加。Oliveira等研究显示,高脂饮食大鼠的肝脏的AR2 mRNA表达呈现了2倍的增加,而AR1 mRNA以及AR1、AR2蛋白表达均无显著性变化[31]。Li等[32]、Ma等[33]研究显示,非酒精性脂肪肝大鼠肝脏AR1和AR2蛋白表达均显著性降低,而AR2下降更为明显。本实验采用高脂饮食成功构建肥胖大鼠,结果显示,肥胖大鼠肝脏中AR1和AR2均非常显著性降低,其中AR2降低更加明显。经6周的不同强度运动干预后,测得大鼠血清脂联素及其肝脏内受体的表达,研究发现,有氧运动可对肥胖大鼠的脂联素及其受体进行正向调节作用,其中各运动组AR1、AR2表达均增加(P<0.05或P<0.01),AR2增加更加显著(P<0.05),三种不同强度运动中,中等强度运动组增加最为显著。
由此可见,肥胖机体脂质代谢紊乱,可引起肝脏氧化应激加强和肝脏炎症增加,两者之间相互影响,共同参与肝脏功能损害过程,有氧运动特别是中等强度的有氧运动作为一种非药理学的干预方法,对肥胖所致的脂质代谢紊乱引起的肝功能损害起保护作用,其中脂联素作为一种对机体内环境稳定性起防御保护作用的细胞因子,其与受体结合特别是AR2的结合可能发挥重要作用。Alba等研究发现[34],巨噬细胞上的AR数量受到PPARγ调控作用。Jian等研究显示,脂联素与其相应的受体结合后,可激活AMP活化的蛋白激酶(adenosine monophosphate activated protein inase,AMPK)及有丝分裂原活化蛋白激酶P38两个途径,引起下游一系列信号分子的改变,使乙酰辅酶A羧化酶(acetyl-coA carboxylase,ACC)和过氧化酶体增殖物激活受体α(peroxidase proliferate activated receptor α,PPARα)磷酸化,介导线粒体生物合成和脂肪酸氧化加强,改善胰岛素抵抗等多种生物学功能[35]。据此推测,有氧运动改善肝脏脂质代谢紊乱引起的肝功能损害过程中,脂联素受体表达的调控以及脂联素与其相应受体结合后的信号通路可能与这些因子相关,对此还有待于进一步研究。
4 结论
有氧运动能增强高脂饮食所致的肥胖大鼠肝脏抗氧化酶活性,增强自由基清除能力,预防肝细胞炎症损伤,改善脂代谢异常及功能紊乱,其中中等强度运动优于小强度或递增负荷强度运动,其机制可能与血清脂联素含量增加激活肝脏AR2介导下游信号通路有关。
[1]Jodayree S,Patterson ZR,MacKay H,et al.Blood and liver antioxidant capacity of mice fed high fat diet supplemented with digested oatbran proteins[J].IntJFood Sci Nutr Eng,2014,4(1):9-14.
[2]Ansari JA,Bhandari U,Pillai K,et al.Effect of rosuvastatin on obesity-induced cardiac oxidative stress in Wistar rats-A preliminary study[J].Indian J Exper Biol,2012(50):216-222.
[3]ZuoX,Tian C,ZhaoN,etal.Teapolyphenolsalleviate high fat and high glucose-induced endothelial hyperpermeability by attenuating ROS production via NADPH oxidase pathway[J].BMC Res Notes,2014,7:120.
[4]Evans CC,LePard KJ,Kwak JW,et al.Exercise prevents weight gain and alters the gut microbiota in a mouse model of high fat diet-induced obesity[J].PLoS One,2014,9(3):e92193-e92214.
[5]Recasens M,Ricart W,Fernández-Real JM.Obesity and inflammation[J].Rev Med Univ Navarra,2004,48(2):49-54.
[6]Balsan GA,Vieira JL,Oliveira AM,et al.Relationship between adiponectin,obesity and insulin resistance[J].Rev Assoc Med Bras,2015,61(1):72-80.
[7]孙婧瑜,漆正堂,丁树哲.FAT/CD36、AMPK和PGC-1α在运动干预高脂饮食性肥胖中的作用机制[J].中国运动医学杂志,2013,32(2):174-177.
[8]Promrat K,Kleiner DE,Niemeier HM,et al.Randomized controlled trial testing the effects of weight loss on nonalcoholic steatohepatitis[J].Hepatology,2010,51(1):121-129.
[9]Jinhee W,Sunghwun K.Diet change and exercise enhance protein expression of CREB,CRTC 2 and lipolitic enzymes in adipocytes of obese mice[J].Lipids Health Dis,2016,15(1):147.
[10]汪军,姚珂,王瑞元.8周跑台运动对肥胖大鼠血浆和下丘脑神经肽Y蛋白及其基因表达的影响[J].中国运动医学杂志,2008,27(6):707-710.
[11]Bedford TG,Tipton CM,Wilson NC,et al.Maxium oxyen consumption of rats nd its changes with various experitmentalprocedures[J].ApplPhysiol,1979,47(6):1278-1283.
[12]董乃相,张书义,梁玉磊,等.针刺对不同性别单纯性肥胖大鼠 Lee's指数与Leptin含量的影响[J].中医学报,2015,205(30):846-848.
[13]Venables MC,Achten J,Jeukendrup A.Determinants of fat oxidation during exercise in healthy men and women:a cross-sectional study[J].J Appl Physiol,2005,98(1):160-167.
[14]Hyeon KK,Karina A,Hiroki T,et al.Effects of Different Intensities of Endurance Exercise in Morning and Evening on the Lipid Metabolism Response[J].J Sports Sci Med,2016,15(3):467-476.
[15]肖国强,曹姣.运动与能量代谢[D].北京:人民体育出版社,2014.
[16]Ozata M,Mergen M,Oktenli C,et al.Increased oxidative stressand hypozincemia in male obesity[J].Clin Biochem,2002,35(8):627-631.
[17]Choi EY,Cho YO.The influence of different durations of aerobic exercise on fuel utilization,lactate level and antioxidant defense system in trained rats[J].Nutr Res Pract,2014,8(1):27-32.
[18]Guo R,Liong EC,So KF,et al.Beneficial mechanisms of aerobic exercise on hepatic lipid metabolism in non-alcoholic fatty liverdisease[J].Hepatobiliary PancreatDis Int,2015,14(2):139-144.
[19]Hazell TJ,Islam H,Townsend LK,et al.Effects of exercise intensity on plasma concentrations of appetite-regulating hormones:Potential mechanisms[J].Appetite,2016,98(1):80-88.
[20]Jamaluddin M ,Wang S,Boldogh I,et al.TNF-α-induced NF- κB/RelA Ser(276) phosphorylation and enhanceosome formation is mediated by an ROS-dependent PKAc pathway[J].Cell Signal,2007,19(7):1419-1433.
[21]Lee S,Lee TA,Song SJ,et al.Hyperproduction of IL-6 caused by aberrant TDP-43 overexpression in high-fat diet-induced obese mice[J].FEBS Lett,2015 ,589(15):1825-1831.
[22]Jung S ,Lee MS,Shin Y,et al.High hydrostatic pressure extract of red ginseng attenuates inflammation in ratswith high-fatdietinduced obesity[J].Prev Nutr Food Sci,2015 ,20(4):253-259.
[23]Nepal S,Malik S,Sharma AK,et al.Abresham ameliorates dyslipidemia,hepatic steatosis and hypertension in high-fat diet fed rats by repressing oxidative stress,TNF-a and normalizing NO production[J].Exp Toxicol Pathol,2012,64(7-8):705-712.
[24]Turer AT,Scherer PE.Adiponectin:mechanistic insights and clinicalimplications[J].Diabetologia,2012,55(9):2319-2326.
[25]OuchiN,Kihara S,Arita Y,et al.Adiponectin an adipocyte derived plasma protein,inhibites endothelial NF-kappa B signaling through ac-AMPK dependent pathway[J].Circulation,2000,102(11):1296-1301.
[26]Tomita K,Oike Y,Teratani T,et al.Hepatic AdipoR2 signaling plays a protective role against progression of nonalcoholic steatohepatitis in mice[J].Hepatology,2008,48:458-473.
[27]Coletta DK,Sriwijitkamol E,Wajcberg,et al.Pioglitazone stimulates AMP-activated protein kinase signalling and increases the expression of genes involved in adiponectin signalling,mitochondrial function and fat oxidation in human skeletal muscle in vivo:a randomised trial[J].Diabetologia,2009,52(4):723-732.
[28]Harada K,Shen WJ,Patel S,et al.Resistance to high-fat diet-induced obesity and altered expression of adiposespecific genes in HSL-deficient mice[J].Am J Physiol Endocrinol Metab,2003,285(6):E1182-E1195.
[29]Yamauchi T,Nio Y,Maki T,et al.Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin binding and metabolic actions[J].Nat Med,2007,13(3):332-339.
[30]Bullen JW,Bluher S,Kelesidis T,et al.Regulation of adiponectin and its receptors in response to development of diet-induced obesity in mice[J].Am J Physiol Endocrinol Metab,2007,292(4):E1079-E1086.
[31]Oliveira C ,Mattos AB ,Biz C ,et al.High-fat diet and glucocorticoid treatment cause hyperglycemia associated with adiponectin receptor alterations[J].Lipids Health Dis,2011,10:11.
[32]Li ZP,Xu JY,Zheng PY,et al.Hawthorn leaf flavonoids alleviate nonalcoholic fatty liverdisease by enhancing the adiponectin/AMPK pathway[J].Int J Clin Exp Med,2015,8(10):17295-17307.
[33]Ma H,You GP,Cui F,et al.Effects of a low-fat diet on the hepatic expression of adiponectin and its receptors in rats with NAFLD[J].Ann Hepatol,2015,14(1):108-117.
[34]Alba FS,Eduardo MS,Mirandeli B,et al.Inflammation,Oxidative Stress,and Obesity[J].Int J Mol Sci,2011,12(5):3117-3132.
[35]Jian H,Yimin J,Shifeng P,et al.Butyrate alleviates high fat diet-induced obesity through activation of adiponectinmediated pathway and stimulation of mitochondrial function in the skeletal muscle of mice[J].Oncotarget,2016,30,7(35):56071-56082.
Effects of Exercises of Different Intensity on Oxidative Stress and Adiponectin/Adiponectin Receptors of Livers in Obese Rats
Cao Jiao1,Xiao Guoqiang2,Chen Xiaoguang3
1 School of Physical Education,South China Normal University,Guangzhou 510303,China
2 School of Physical Education,Guangdong University of education,Guangzhou 510006,China
3 Guangdong Medical University,Zhanjiang 524023,China
Xiao Guoqiang,Email:xgqde_100@qq.com
ObjectiveTo discuss effects of three different-intensity exercise on oxidative stress and adiponectin/adiponectin receptor1/2 ofthe liverin obese rats.MethodsThirty-two Sprague-Dawley rats were fed high-lipid fodder and became the obesity model after 16 weeks.Then they were randomly divided into a high-lipid control group(HF),a low-intensity exercise group(HS),a moderate-inten-sity exercise group(HM)and an exercise group with progressive intensity(HI),each of 8.Another 8 rats were chosen into a normal control group(NC).The speed of treadmill running of group HS and HM was 10m/min and 15m/min respectively,while that of group HI was10m/min for 20min,followed by another 20min at and still another 20min at 28~30m/min,five days a week for 6 weeks.Six weeks later,theweight,alaninetransaminase (ALT),aspartatetransaminase (AST),superoxidedismutase(SOD),malondialdehyde(MDA),tumor necrosis factor alpha(TNF-α),interleukin-6(IL-6),adiponectin receptors1/2,adiponectin,triglyceride (TG),cholesterol(TC),high-density lipoproteincholesterol(HDL-C),low-density lipoproteincholesterol(LDL-C)and free fatty acid(FFA)were tested.ResultsCompared with group NC,significant increase was observed in the average weight,TG,TC,LDL-C,FFA,ALT,AST,MDA,TNF-α and IL-6(P<0.05 orP<0.01),while significant decrease was found in the average HDL-C,SOD,adiponectin and adiponectin receptors1/2 of group HF (P<0.05 orP<0.01).Compared with group HF,there was significant decrease in the average weight,TG,LDL-C,FFA,ALT,MDA,TNF-α and IL-6(P<0.05 orP<0.01),but significant increase in the average SOD,adiponectin,AR1 and AR2 of group HS,HM and HI(P<0.05 orP<0.01),and only HDL-C of group HM increased significantly(P<0.05).Compared with group HS and HI,significant decrease was found in the average FFA and MDA (P<0.05),while significant increase was found in the average adiponectin and AR2 of group HM (P<0.05).ConclusionAerobic exercise can improve abnormal hepatic lipid metabolism and oxidative stress,strengthen free radical scavenging capacity,prevent liver cell inflammation injury and ameliorate liver metabolism disorder of obese rats induced by high-lipid fodder.Moreover,the effect of moderate-intensity exercise is superior to low-intensity exercise or exercise with progressive intensity,whose mechanism may be related to further activating liver adiponectin receptor 2 through increasing serum adiponectin.
different intensity exercise,oxidative stress,adiponectin,adiponectin receptor 2,obese rats
2016.10.15
广东省科学事业计划项目(2011B031600010);广东省体育局科研项目(GDSS2016115)
第1作者:曹姣,Email:caojiao218@163.com;
肖国强,Email:xgqde_100@qq.com

