腹腔镜下肝切除术的临床疗效及对细胞免疫功能的影响①
唐 彪,欧阳正晟
(永州市中心医院,湖南 永州,425000)
·论 著·
腹腔镜下肝切除术的临床疗效及对细胞免疫功能的影响①
唐 彪,欧阳正晟
(永州市中心医院,湖南 永州,425000)
目的分析腹腔镜下肝切除术的临床疗效及对细胞免疫功能的影响。方法回顾分析97例行肝切除术肝癌患者的临床资料,分为观察组(n=48,行腹腔镜下肝切除术)与对照组(n=49,行开腹肝切除术)。对比两组术中指标、术后近期疗效、远期疗效、并发症发生情况及手术前后不同时间点的外周血淋巴细胞亚群、血清白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)表达水平。结果两组转移率、复发率、死亡率、并发症发生率差异均无统计学意义(P>0.05);术后72 h,观察组CD3、CD4、CD8、IL-6、TNF-α表达水平基本恢复至术前水平,对照组CD3、CD4、CD8仍低于术前水平,IL-6、TNF-α仍高于术前水平,差异有统计学意义(P<0.05)。结论腹腔镜下肝切除术治疗肝癌的临床疗效确切,创伤小,安全性较高,近期疗效优于开腹肝切除术,且对患者的细胞免疫功能影响小,术后康复快。
肝肿瘤;肝切除术;腹腔镜检查;剖腹术;治疗结果;免疫,细胞
肝切除术作为根治原发性肝癌的首选治疗方法之一,由于肝脏结构功能较复杂,肝切除术必然对机体造成不同程度的创伤,引发强烈的应激反应,抑制细胞免疫功能。研究表明[1-2],手术患者的细胞免疫功能与创伤程度呈负相关。此外,在保证临床疗效的基础上,最大限度地减小手术创伤,抑制细胞免疫功能受影响,是现代外科手术领域的重要课题。相较开腹肝切除术而言,腹腔镜下肝切除术的创伤性及触发的应激反应显著降低,对于维持患者的细胞免疫功能具有重要作用[3]。近年,腹腔镜下肝切除术逐渐替代开腹肝切除术,广泛用于治疗肝癌,临床疗效得到广泛认可;但腹腔镜下肝切除术对肝脏恶性肿瘤切除的充分性仍存有争议,近期、远期疗效优于开腹肝切除术尚缺少大样本临床资料证实[4-5]。此外,腹腔镜肝切除术治疗肝癌的细胞免疫功能变化情况尚不清晰。对此,本研究旨在分析腹腔镜下肝切除术的临床疗效及对细胞免疫功能的影响。
1 资料与方法
1.1 临床资料 回顾分析行肝切除术治疗的97例肝癌患者的临床资料,根据手术方式分为两组,观察组(n=48,行腹腔镜下肝切除术)与对照组(n=49,行开腹肝切除术)。两组患者一般资料,包括性别、年龄、身高、体重等差异均无统计学意义(P>0.05);见表1。
1.2 手术方法 观察组行腹腔镜肝切除术,脐环上缘做10 mm左右的纵行切口,置入腹腔镜探头及超声刀等手术器械,分为局部或规则性肝切除。局部肝切除:超声刀距游离肝脏病灶2 cm处直接离断肝实质,并结合电凝止血、引流等术后处理,将切除部分的肝实质置于腹腔镜标本袋内,从延长的表皮切口中快速取出。规则性肝切除:游离病灶周围韧带,离断后充分暴露肝叶,预控制处理肝门血流,于肝段、肝叶解剖结构处作标志,并根据标志用超声刀直接切除肝实质。解剖第一肝门,对于左半肝切除者,需游离出肝左动脉、门静脉左支,在其分出尾状叶支后夹闭切断(图1A)。左外叶切除者,需游离门静脉向左肝外的各分支,用钛夹夹闭后离断(图1B)。解剖第二肝门,贴近肝脏离断肝胃韧带,解剖肝静脉韧带并于近左肝静脉处用钛夹夹闭后离断(图1C),对于左半肝切除者夹闭并离断肝左静脉(图1D),显露肝左静脉(图1E、图1F),夹闭后离断,电凝止血及放置引流管后取出切除部分。对照组行开腹肝切除术,严格按操作规程行局部或规则性肝切除,并及时取出,电凝止血,放置引流管,以预防胆漏等并发症发生。

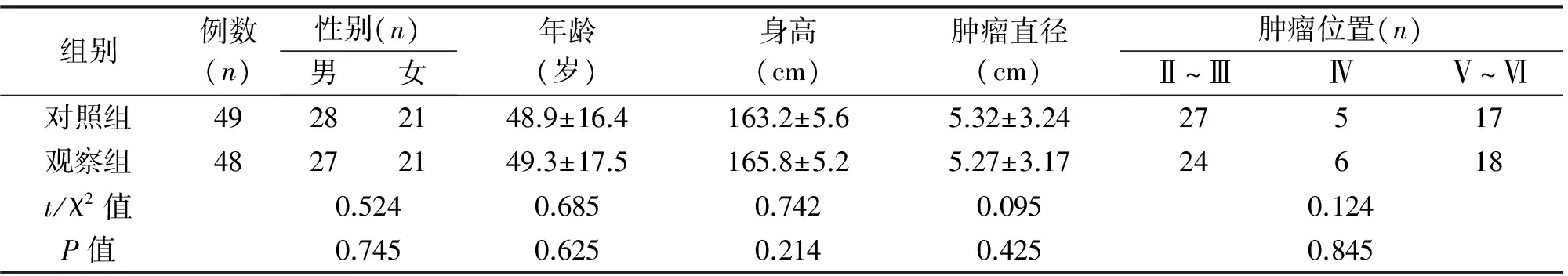
组别例数(n)性别(n)男女年龄(岁)身高(cm)肿瘤直径(cm)肿瘤位置(n)Ⅱ~ⅢⅣⅤ~Ⅵ对照组49282148.9±16.4163.2±5.65.32±3.2427517观察组48272149.3±17.5165.8±5.25.27±3.1724618t/χ2值0.5240.6850.7420.0950.124P值0.7450.6250.2140.4250.845

图1 腹腔镜肝切除术。A:夹闭切断肝左动脉、门静脉左支;B:夹闭后离断门静脉向左肝外的各分支;C:解剖第二肝门;D:离断肝左静脉;E、F:显露肝左静脉
1.3 观察指标
1.3.1 临床指标 术中指标:手术时间、总出血量、切口长度、血流阻断情况;术后近期疗效:引流管留置时间、开始进食时间、术后住院时间、镇痛药使用总量;术后随访12个月的远期疗效:转移率、复发率、死亡率;并发症发生情况:出血、肝周胸腔积液、腹水、肺部感染、胆漏、肠粘连等[6]。
1.3.2 细胞免疫功能指标 外周血淋巴细胞亚群:CD4、CD3、CD8;使用流式细胞仪进行CD3、CD4、CD8计数;使用酶标仪以酶联免疫吸附法测定血清白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平[7]。

2 结 果
2.1 术中指标 观察组手术时间长于对照组,总出血量少于对照组,切口长度短于对照组,血流阻断率低于对照组,差异有统计学意义(P<0.05);见表2。
2.2 近期疗效 观察组引流管留置时间、开始进食时间、术后住院时间均短于对照组,镇痛药使用总量少于对照组,差异有统计学意义(P<0.05);见表2。
2.3 远期疗效及并发症 两组转移率、复发率、死亡率、并发症发生率差异均无统计学意义(P>0.05),见表2。
2.4 手术前后不同时间点细胞免疫功能 术后24 h,两组CD3、CD4、CD8表达水平均较术前明显降低(P<0.05),IL-6、TNF-α表达水平均较术前明显升高(P<0.05);两组间差异均无统计学意义(P>0.05)。术后72 h,观察组CD3、CD4、CD8、IL-6、TNF-α表达水平基本恢复至术前水平,与术前相比,差异均无统计学意义(P>0.05);而对照组CD3、CD4、CD8仍低于术前水平,IL-6、TNF-α仍高于术前水平,差异有统计学意义(P<0.05);见表3。流式细胞仪检测两组患者T淋巴细胞亚群的变化见图2、图3。


组别手术时间(min)出血量(ml)切口长度(cm)血流阻断[n(%)]引流管留置时间(d)开始进食时间(d)对照组156.3±64.7351.6±217.226.3±9.5823(46.94)7.63±3.314.58±0.62观察组191.6±82.5203.2±169.44.36±1.245(10.42)3.45±2.231.38±0.74t/χ2值3.7483.9654.23869.8454.4253.923P值0.0110.0160.0070.0420.0140.006
续表2
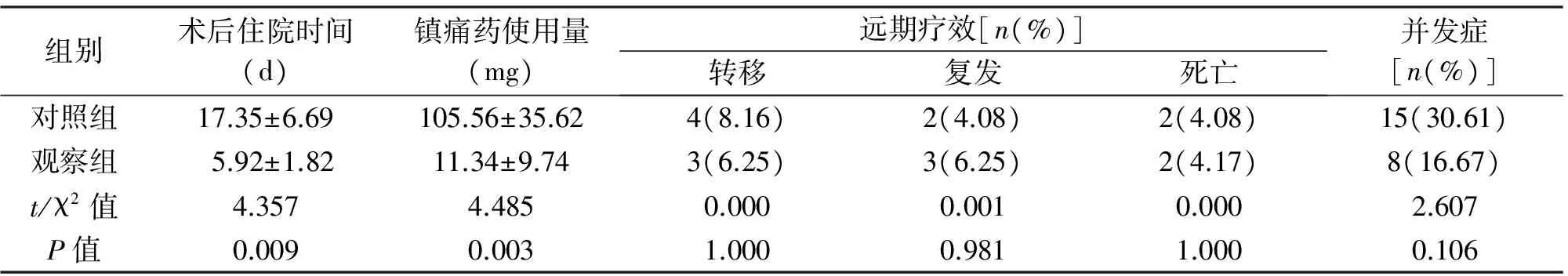
组别术后住院时间(d)镇痛药使用量(mg)远期疗效[n(%)]转移复发死亡并发症[n(%)]对照组17.35±6.69105.56±35.624(8.16)2(4.08)2(4.08)15(30.61)观察组5.92±1.8211.34±9.743(6.25)3(6.25)2(4.17)8(16.67)t/χ2值4.3574.4850.0000.0010.0002.607P值0.0090.0031.0000.9811.0000.106
表3 两组患者手术前后不同时间点细胞免疫功能对比
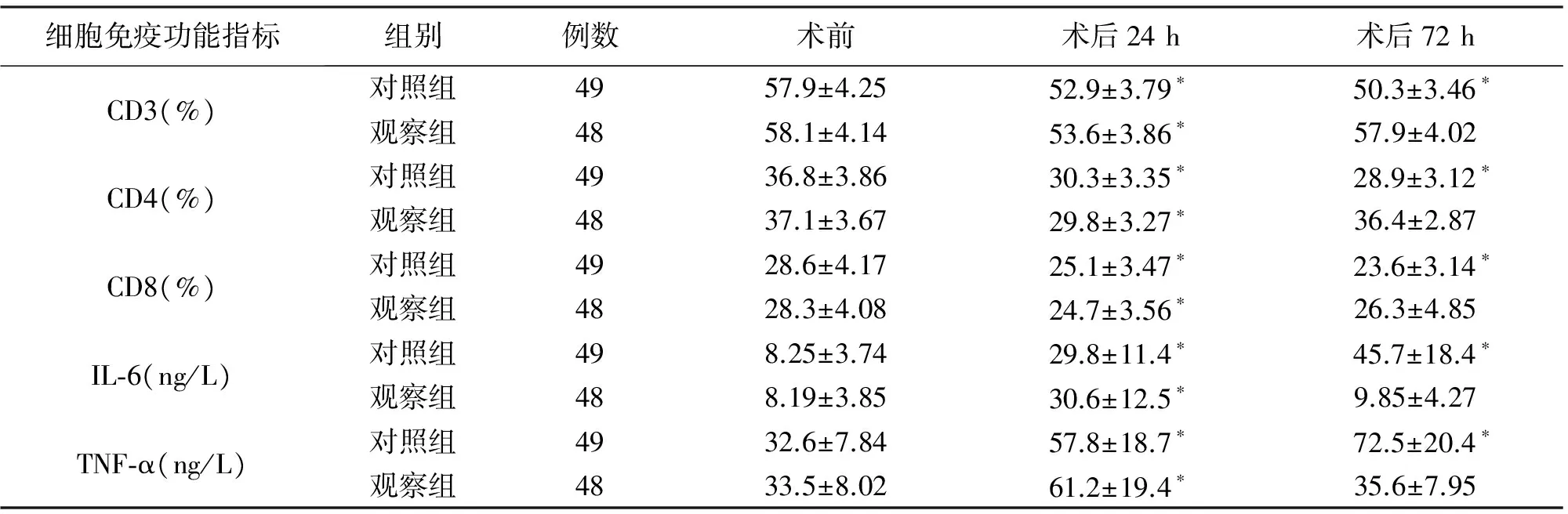
细胞免疫功能指标组别例数术前术后24h术后72hCD3(%)对照组4957.9±4.2552.9±3.79∗50.3±3.46∗观察组4858.1±4.1453.6±3.86∗57.9±4.02CD4(%)对照组4936.8±3.8630.3±3.35∗28.9±3.12∗观察组4837.1±3.6729.8±3.27∗36.4±2.87CD8(%)对照组4928.6±4.1725.1±3.47∗23.6±3.14∗观察组4828.3±4.0824.7±3.56∗26.3±4.85IL⁃6(ng/L)对照组498.25±3.7429.8±11.4∗45.7±18.4∗观察组488.19±3.8530.6±12.5∗9.85±4.27TNF⁃α(ng/L)对照组4932.6±7.8457.8±18.7∗72.5±20.4∗观察组4833.5±8.0261.2±19.4∗35.6±7.95
*P<0.05 vs. 术前
3 讨 论
肝切除术作为治疗肝癌的首选,与开腹肝切除术相比,腹腔镜下肝切除术治疗肝癌具有明显优势,可在直视下完成各项手术操作,结合超声刀切割,可充分切除肿瘤组织,操作准确性高,显著减少了对周围组织器官的损伤。国内外研究发现,腹腔镜下肝切除术治疗肝癌的关键在于能否充分切除肝癌组织,避免了胆漏、出血等并发症的发生,且保证已切除的肝癌组织能完整顺利取出[8-9]。随着腹腔镜技术的发展、成熟,腹腔镜下肝切除术适应证进一步明确,可用于治疗肝脏表面的肝癌、肝脏顶部肝癌、多发性肝癌等,手术禁忌证随之减少。本研究中,观察组总出血量少于对照组,切口长度短于对照组,血流阻断率小于对照组;这与大多数回顾性研究文献相一致[10-12]。表明腹腔镜下肝切除术的创伤性显著小于开腹肝切除术,提示前者具有良好的应用前景。这正是因为腹腔镜下肝切除术具有微创性,以超声刀作为操作器械,操作灵活,切割位置精确,对健康组织损伤小。同时,腹腔镜下肝切除术的切口较小,但需保证良好的手术视野,且尽量避免血流阻断,手术难度较大,需规范精细操作,导致手术时间延长,这也是本研究中观察组手术时间长于对照组的原因。
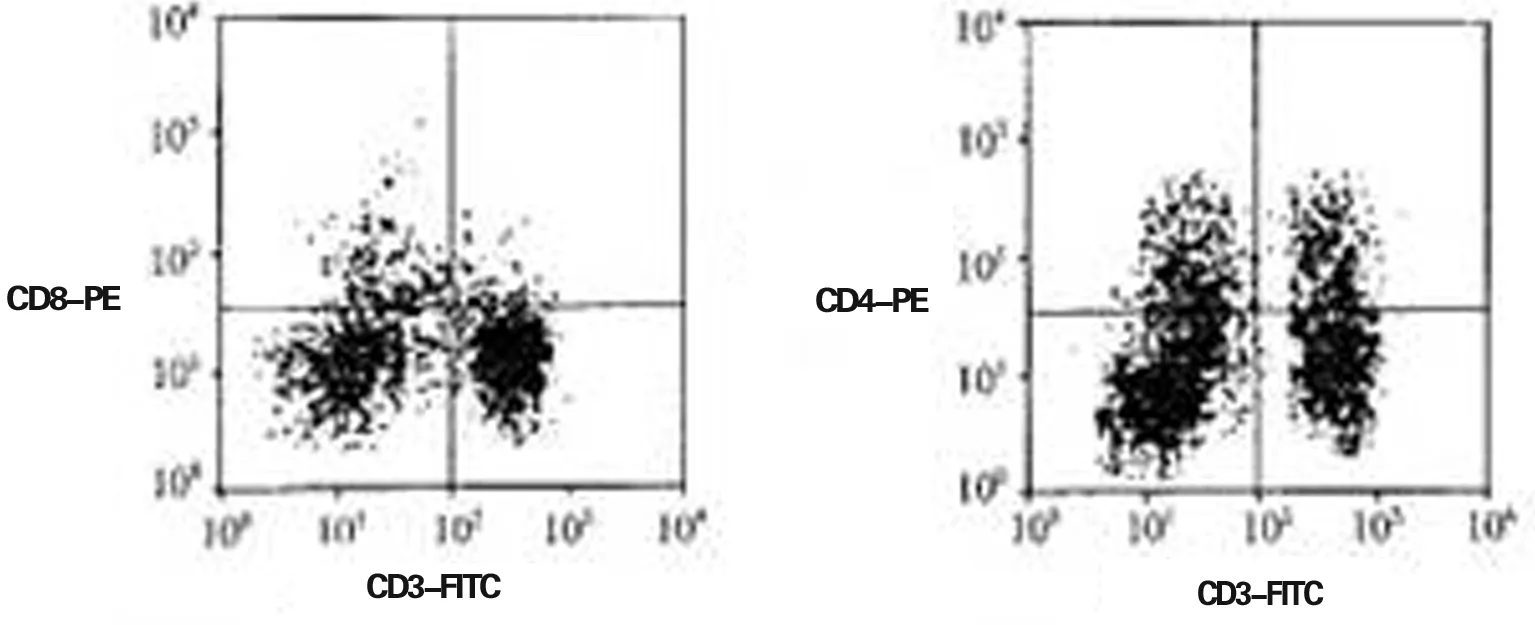
图2 流式细胞仪检测观察组中术后T淋巴细胞亚群的变化。A:CD3CD8抗体标记,左下限CD3-CD8-细胞群30.6%,左上限CD3-CD8+细胞群25.4%,右下限CD3+CD8-细胞群47.2%,右上限CD3+CD8+细胞群4.3%;B:CD3CD4抗体标记,左下限CD3-CD4-细胞群33.7%,左上限CD3-CD4+细胞群18.7%,右下限CD3+CD4-细胞群32.8%,右上限CD3+CD4+细胞群15.9%

图3 流式细胞仪检测对照组中术后T淋巴细胞亚群的变化。A:CD3CD8抗体标记,左下限CD3-CD8-细胞群35.7%,左上限CD3-CD8+细胞群14.5%,右下限CD3+CD8-细胞群37.8%,右上限CD3+CD8+细胞群7.8%;B:CD3CD4抗体标记,左下限CD3-CD4-细胞群35.1%,左上限CD3-CD4+细胞群11.6%,右下限CD3+CD4-细胞群29.1%,右上限CD3+CD4+细胞群17.2%
在术后近期疗效方面,通过本研究可知,观察组引流管留置时间、开始进食时间、术后住院时间均短于对照组,镇痛药使用总量少于对照组。与顾海涛等[13]的研究相一致;提示腹腔镜下肝切除术具有明显的微创性,术后疼痛程度较轻,康复较快,从而表现出良好预后。此外,相关研究认为,腹腔镜下肝切除术对患者的腹壁损伤轻,表现为切口较短,有效减少内脏器官的暴露范围、缓解水分挥发;同时,对腹壁门、体静脉的损伤小,表现在术中出血量少,有效减少术后输液量[14]。此外,腹腔镜下肝切除术治疗肝癌的安全性、远期疗效尤为引起相关专家的关注;腹腔镜下肝切除术的推广初期,由于对肿瘤边界的认定不准确,结合腹腔高压,不能清扫淋巴结等,均限制了此术式的广泛应用,甚至有研究认为,此术式可导致肿瘤播散。本研究表明,腹腔镜下肝切除术治疗肝癌的并发症发生率为16.67%。此外,两组转移率、复发率、死亡率差异无统计学意义;这与之前的大量研究一致,进一步表明腹腔镜下肝切除术治疗肝癌的远期疗效、安全性均具有临床可行性。
临床上,CD3、CD4、CD8、IL-6、TNF-α表达水平可直接反映患者的免疫应答水平,均为细胞免疫功能指标。Hu等[15]研究认为,腹腔镜下肝切除术无法将肝癌细胞彻底清除,仍停留在减轻肿瘤负荷的治疗阶段,而术后转移或复发完全取决于机体的细胞免疫功能。如果肝切除术后患者的细胞免疫功能正常,对于抑制或杀灭肿瘤细胞具有一定作用;反之,会导致肿瘤细胞失去细胞免疫监控,从而迅速转移或复发。由于肝切除术可触发强烈的应激反应,启动机体的免疫保护机制,随着手术创伤性的增加,呈现不同程度的免疫抑制,表现为免疫应答缓慢、免疫因子释放量减少、对抗原的识别能力降低等。此外,腹腔镜下肝切除术的创伤性较小,表现在手术切口小,皮肤、黏膜屏障较为完整,可抑制外源性病原体进入体内,且应激性反应较轻,因此即使存在一定程度的免疫抑制,但术后康复快,可促进免疫功能的恢复[16]。本研究中,术后72 h,观察组CD3、CD4、CD8、IL-6、TNF-α表达水平基本恢复至术前水平,对照组CD3、CD4、CD8仍低于术前水平,IL-6、TNF-α仍高于术前水平,差异有统计学意义(P<0.05),亦提示腹腔镜下肝切除术治疗肝癌过程中对患者的细胞免疫功能影响小,这也进一步体现了腹腔镜下肝切除术的微创性。
综上所述,腹腔镜下肝切除术治疗肝癌的临床疗效确切,创伤小,安全性高,近期疗效优于开腹肝切除术,且对患者的细胞免疫功能影响小,术后康复快。
[1] 牛坚,汪海军,邵华,等.腹腔镜肝癌切除术对术后机体康复和免疫的影响研究[J/CD].中华腔镜外科杂志(电子版),2014,7(3):199-204.
[2] Lee KF,Chong CN,Wong J,et al.Long-term results of laparoscopic hepatectomy versus open hepatectomy for hepatocellular carcinoma:a case-matched analysis[J].World J Surg,2011,35(10):2268-2274.
[3] Zhou YM,Shao WY,Zhao YF,et al.Meta-analysis of laparoscopic versus open resection for hepatocellular carcinoma[J].Dig Dis Sci,2011,56(7):1937-1943.
[4] 黄河,陈新桂,黄品助,等.超声引导下微波消融在腹腔镜肝切除术中的应用研究[J/CD].中华肝脏外科手术学电子杂志,2013,2(2):86-89.
[5] Rao A,Rao G,Ahmed I.Laparoscopic vs. open liver resection for malignant liver disease.A systematic review[J].Surgeon,2012,10(4):194-201.
[6] 武金才,李灼日,周开伦,等.完全腹腔镜肝切除术在肝肿瘤治疗中的应用和评价[J].肝胆胰外科杂志,2014,26(3):192-194.
[7] 马洪波,黄涛,韩风,等.DC-CIK细胞联合手术治疗原发性肝癌的临床研究[J].重庆医科大学学报,2012,37(11):980-983.
[8] 吴志翀,沈柏用,邓侠兴,等.腹腔镜肝切除术的疗效评价[J].上海医学,2010,33(3):223-227.
[9] Kim HH,Park EK,Seoung JS,et al.Liver resection for hepatocellular carcinoma:case-matched analysis of laparoscopic versus open resection[J].J Korean Surg Soc,2011,80(6):412-419.
[10] 温敏杰,徐波,夏金堂,等.腹腔镜技术在肝脏外科中的临床应用体会[J].中山大学学报(医学科学版),2007,28(z1):132-133.
[11] 易永祥,王建,王翔,等.腹腔镜与开腹肝癌左外叶切除术对患者临床康复和机体免疫功能的影响[J].中国老年学杂志,2015,35(23):6844-6846.
[12] Yin Z,Fan X,Ye H,et al.Short- and long-term outcomes after laparoscopic and open hepatectomy for hepatocellular carcinoma:a global systematic review and meta-analysis[J].Ann Surg Oncol,2013,20(4):1203-1215.
[13] 顾海涛,石欣.腹腔镜肝切除术在肝癌治疗中的应用与评价[J].中国微创外科杂志,2010,10(2):176-180.
[14] 张建军,武金才.完全腹腔镜与开腹肝切除治疗肝肿瘤临床疗效比较[J].海南医学,2015,26(9):1349-1351.
[15] Hu BS,Chen K,Tan HM,et al.Comparison of laparoscopic vs open liver lobectomy (segmentectomy) for hepatocellular carcinoma[J].World J Gastroenterol,2011,17(42):4725-4728.
[16] 薛平,郑超,曹良启,等.超声联合腹腔镜射频消融术对肝癌患者免疫功能的影响[J].临床医学工程,2012,19(10):1637-1640.
Clinicalefficacyoflaparoscopichepatectomyanditsinfluenceoncellularimmunefunction
TANGBiao,OUYANGZheng-sheng.
DepartmentofHepatobiliarySurgery,YongzhouCentralHospital,Yongzhou425000,China
Objective:To investigate the clinical effect of laparoscopic hepatectomy and its influence on cellular immune function.MethodsThe clinical data of 97 patients with liver cancer receiving hepatic resection were retrospectively analyzed.The patients were divided into two groups,48 patients in the observation group
laparoscopic liver resection;49 patients in the control group received open liver resection.The intraoperative indicators,the short-term and long-term postoperative effect,complication incidence and peripheral blood lymphocyte subsets,serum interleukin-6 (IL-6),tumor necrosis factor-α(TNF-α) at different time points before and after surgery were compared between the two groups.ResultsThere was no significant difference in metastasis rate,recurrence rate,mortality rate and the complication incidence between two groups (P>0.05).At 72 h after the operation,the expression of CD3,CD4,CD8,IL-6 and TNF-α in the observation group returned to pre-operative level.The CD3,CD4,CD8 in the control group were still less than the preoperative level,and the level of IL-6,TNF-α was still higher than the preoperative level,and the differences were statistically significant (P<0.05).ConclusionsLaparoscopic hepatectomy for liver cancer has the advantage of definite therapeutic effect,mini-invasion,high safety and rapid recovery.The short-term therapeutic effect and the influence on cellular immune function of laparoscopic hepatectomy are better than open hepatectomy.
Liver neoplasms;Hepatectomy;Laparoscopy;Laparotomy;Treatment outcome;Immunity,cellular
唐 彪(1980—)男,湖南省永州市中心医院肝胆外科副主任医师,主要从事肝胆外科的研究。
1009-6612(2017)09-0648-05
10.13499/j.cnki.fqjwkzz.2017.09.648
R657.3
A
2016-09-13)
(英文编辑:柳悄然)

