siRNA沉默表皮生长因子受体蛋白表达对肾癌细胞生物学行为的影响
汪 峰, 张斌斌, 郭 巍, 高继学, 强亚勇, 贾军琪
(延安大学附属医院, 陕西 延安, 716000)
siRNA沉默表皮生长因子受体蛋白表达对肾癌细胞生物学行为的影响
汪 峰, 张斌斌, 郭 巍, 高继学, 强亚勇, 贾军琪
(延安大学附属医院, 陕西 延安, 716000)
目的观察在siRNA沉默EGFR基因处理后肾癌细胞的生物学行为情况。方法将肾癌细胞株ACHN分为3组,对照组不进行任何干预,阴性对照转染组使用加入非特异性转染试剂及siRNA干预,观察组使用加入特性性转染试剂及siRNA干预,分别检测3组细胞的EGFR表达量、增殖活性、生长曲线、迁移及侵袭活性。结果经siRNA处理72 h后,观察组细胞EGFR表达水平明显低于阴性对照转染组和对照组; 观察组细胞生长活跃能力显著低于对照组和阴性对照转染组,且在处理48 h后RNAi组细胞数显著低于对照组和阴性对照转染组(P<0.05); 较空白组和阴性对照转染组,观察组细胞生长受到显著抑制(P<0.05); 12 h时及24 h时观察组细胞划痕距离显著高于对照组和阴性对照转染组(P<0.05); 12 h时对照组、阴性对照转染组穿膜细胞数差异无统计学意义(P>0.05), 观察组穿膜细胞数显著低于对照组和阴性对照转染组(P<0.05)。结论 采用siRNA沉默EGFR蛋白后,可有效改善肾癌细胞的增殖、生长、迁移及侵袭等生物学活性。
siRNA; EGFR蛋白; 肾癌细胞; 生物学行为
有研究[1-2]结果表明,在肾癌细胞中表皮生长因子受体(EGFR)多过度表达,且其与肿瘤细胞的凋亡、增殖、血管生成、转移等诸多过程密切相关,可作为肾癌患者的重要的治疗靶点。RNA干扰(RNAi)可有效控制基因表达,也在肿瘤治疗的基础研究中广泛应用[3]。作者采用RNA干扰技术沉默EGFR基因表达,观察在RNA沉默EGFR基因处理后肾癌细胞的生物学行为,现报告如下。
1 材料与方法
1.1 材料
本研究中人肾细胞癌细胞株(ACHN)购自国家典型培养保藏中心(武汉)。RPMI 1640培养基、胰蛋白酶购自Gibco公司(美国),胎牛血清购自BI公司(以色列), β-actin抗体、兔抗二抗、二氨基联苯胺(DAB)、噻唑蓝(MTT)购买自Sigma公司(美国), EGFR抗体购买自CST公司(美国),转染试剂盒购买自Life公司(美国), RIPA裂解液购买自碧云天公司(上海), Transwell小室购买自Millipore公司(美国), Matrigel胶购买自BD公司(美国)。
1.2 SiRNA的设计及合成
使用OptiRNAi设计可特异性沉默EGFR的SiRNA序列,并由上海吉玛制药公司合成,其序列表为正义链5′-gaaggugagaaaguuaaaauucctt-3′, 阴性对照组5′-uucuccgaacgugucacgutt-3′。
1.3 细胞培养与处理
使用含10%胎牛血清的RPMI 1640完全培养基培养ACHN细胞,将细胞置于37 ℃, 含5%CO2的培养箱中培养。本研究将细胞分为3组,即空白对照组、阴性对照转染组(加入非特异性转染试剂及siRNA)、观察组(加入特异性转染试剂及siRNA)。取对数生长期细胞,使用胰酶消化后将细胞接种于35 mm细胞培养皿中。待细胞密度生长致70%左右时,参照转染试剂盒说明书进行siRNA转染,后继续培养4 h后换液,并收集细胞。
1.4 EGFR Western Blot检测结果
使用RNA干扰72 h后,使用磷酸盐缓冲溶液漂洗细胞2遍,后收集细胞使用RIPA裂解液处理细胞,置于冰上振摇30 min, 后使用Thermo离心机以12 000 r/min离心10 min, 收集上清,使用二喹啉甲酸测定总蛋白后,调整蛋白浓度至等体积,后加入等体积的上样缓冲液(2×)沸水浴5 min。后使用SDS-PAGE凝胶电泳分离蛋白,采用280 mA恒流转膜1 h, 将蛋白转移至PVDF膜上,使用5%脱脂奶粉封闭2 h, 使用TBST清洗3次,加入EGFR抗体, 4 ℃孵育过夜,使用TBST清洗3次,加入二抗室温孵育1 h, 使用TBST细胞曝光显色。
1.5 生长曲线检测方法
依照分组对细胞进行处理并接种于24孔板中,每组3复孔。放入37 ℃, 含5%CO2的培养箱中培养,每24 h取3复孔,进行计数并绘制细胞生长曲线。
1.6 细胞增殖检测方法
将细胞依照分组处理,调整细胞浓度至5×107/L接种于96孔板中,每孔200 mL, 每组6个复孔。使用无血清培养基培养24 h、48 h、72 h及96 h,每孔加入10 μL MTT溶液(5 μg/L), 急性培养4 h, 后加入10 μL二甲基亚砜震荡10 min, 后再572 nm波长下检测各孔吸光度值(A), 并计算细胞增殖抑制率(IR)。
IR(%)=[A对照组-A实验组]/A对照组×100%。
1.7 迁移能力检测
将细胞依照分组处理并接种于24孔板中,培养24后使用10 μL枪头在细胞皿中划1道横线,每12 h观察并拍照1次,后使用NIS-ELEMENTS软件分析各组细胞迁移差异。
1.8 Transwell实验检测
由金斯瑞公司构建H2 BmCherry稳转细胞系,使用无血清1640培养基培养细胞10 h, 并使用无血清1640培养基稀释Matrigel胶(1∶8), 每小室铺胶60 μL, 后将细胞以5×104/μL的浓度置于小室中,上室加入无血清培养基,下室加入1 mL含血清1640培养基培养12 h, 后取出Transwell小室并使用棉棒擦净上室细胞,使用显微镜去5个视野,计算视野中穿膜的细胞数。
1.9 统计学方法
本研究中使用SPSS 19.0存储并处理原始数据,使用均值±标准差表示计量资料,并行方差分析组间差异,P<0.05为差异有统计学意义。
2 结 果
2.1 Western Blot检测结果
本研究结果显示,经siRNA处理72 h后,观察组细胞EGFR表达水平明显低于阴性对照转染组和对照组,见图1。
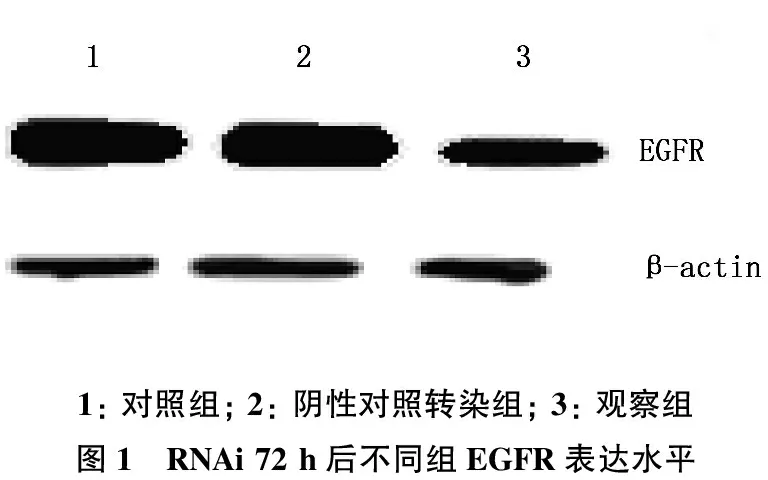
1:对照组;2:阴性对照转染组;3:观察组图1 RNAi72h后不同组EGFR表达水平
2.2 生长曲线
本研究结果显示,观察组细胞生长活跃能力显著低于对照组和阴性对照转染组,且在处理48 h后RNAi组细胞数明显低于对照组和阴性对照转染组(P<0.05),见图2。

图2 生长曲线
2.3 MTT检测结果
较空白组和阴性对照转染组,观察组细胞生长受到显著抑制(P<0.01), 且随着作用时间增长,抑制作用也逐渐增加,见表1。

表1 细胞生长抑制率 %
与观察组相比, **P<0.01。
2.4 细胞迁移能力检测结果
12、24 h时,观察组细胞划痕距离显著高于对照组和阴性对照转染组(P<0.05), 但对照组与阴性对照转染组间差异无统计学意义(P>0.05), 见表2。

表2 细胞迁移能力检测结果 μm
与观察组相比, *P<0.05, **P<0.01。
2.5 细胞侵袭能力检测结果
本研究结果显示, 12 h时对照组、阴性对照转染组穿膜细胞数分别为(322.5±20.0)个和(300.0±16.5)个,差异无统计学意义(P>0.05), 观察组穿膜细胞数为(154.5±13.0)个,显著低于对照组和阴性对照转染组(P<0.05)。
3 讨 论
有大量研究[4-5]指出,在多种肿瘤组织中EGFR常处于高表达状态,如肾癌、直肠癌、肺癌、卵巢癌等,其中在肾癌中50%以上为EGFR高表达。有学者研究[6]指出,肾癌细胞膜中EGFR是重要生物标志物,其异常高表达可作为患者预后不良的重要评价指标。此外,EGFR的高表达也使其可作为重要的指标靶点,进行靶向治疗[7]。RNA干扰具有高效性、特异性、稳定性等诸多优点,且目前RNA干扰技术在卵巢癌、肺癌等诸多肿瘤中的应用十分广泛[8]。采用siRNA技术干预肿瘤细胞后,可有效敲减细胞EGFR表达水平改善化疗药物的不敏感效应。
免疫治疗是现阶段临床中的研究热点,但肾癌患者采用免疫疗法进行治疗时其临床有效率偏低,因而其仍无法成为临床中治疗肾癌的有效手段[9]。此外,采用传统的放疗及化疗手段进行治疗,仍存在明显的敏感性低等现象[10]。有研究[11-12]指出,若肾癌患者不进行及时干预,则有可能向脑部及肺部转移,进而导致患者完全丧失最佳的治疗时机。目前靶向治疗仍是治疗晚期肾癌的首选方案,因而寻求有效的靶点也是现阶段临床研究的热点所在。有研究[13]指出,采用siRNA可有效沉默肾癌细胞VEGF的表达,并可显著降低肾癌细胞的迁移及侵袭能力。
EGFR通路与转化生长因子(TGF)、血管生长因子(VEGF)等通路密切相关的细胞转导通路。在肿瘤细胞中EGFR常异常高表达,使EGFR持续活化,进而增强下游信号转导能力,打破正常细胞的地生理平衡,增强细胞的侵袭和转移能力[14-16]。此外,其还可以增强VEGF、血管形成素-1(Ang-1)等血管生成相关因子的表达水平,增强肿瘤组织的血管新生能力[17-18]。
本研究结果显示,采用siRNA沉默EGFR蛋白后,可有效降低ACHN细胞的EGFR蛋白水平。MMT和生长曲线结果显示,特异性沉默EGFR蛋白后,可有效降低ACHN的细胞活力。通过迁移和侵袭实验证明, siRNA沉默EGFR蛋白后可有效降低肾癌细胞的迁移和侵袭能力。分析[19-20]认为,采用siRNA特异性沉默ACHN细胞的EGFR蛋白后,可有效抑制EGFR相关信号转导通路的激活,降低肿瘤细胞的VEGF、TGF、Ang-1的表达水平,进而显著改善ACHN细胞的生物学行为。
综上所述,本研究通过划痕、侵袭等实验发现,采用siRNA沉默EGFR蛋白后,可有效改善肾癌细胞的增殖、生长、迁移及侵袭等生物学活性。
[1] Noga Kozer, Dipak Barua, Christine Henderson, et al. Recruitment of the Adaptor Protein Grb2 to EGFR Tetramers[J]. Biochemistry, 2014, 53(16): 2594-2604.
[2] 谢勉, 何朝生, 魏慎海, 等. Notch信号通路体外介导肺癌细胞表皮生长因子受体酪氨酸激酶抑制剂获得性耐药的分子机制研究[J]. 肿瘤研究与临床, 2015, 27(5): 298-304.
[3] Azzouz M, Ramsing J, Thomsen H S, et al. Fluctuations in eGFR in relation to unenhanced and enhanced MRI and CT outpatients[J]. European Journal of Radiology, 2014, 83(6): 886-892.
[4] Tingting Zhang, Long Zhang, Tao Zhang, et al. Metformin Sensitizes Prostate Cancer Cells to Radiation Through EGFR/p-DNA-PK_(CS) In Vitro and In Vivo[J]. Radiation Research: Official Organ of the Radiation Research Society, 2014, 181(6): 641-649.
[5] 李建成, 邱子丹, 潘丁龙, 等. siRNA干扰EGFR表达对食管鳞癌和腺癌细胞放射敏感性影响[J]. 中华放射肿瘤学杂志, 2016, 25(1): 76-80.
[6] Gerber N K, Yamada Y, Rimner A, et al. Erlotinib versus radiation therapy for brain metastases in patients with EGFR-mutant lung adenocarcinoma[J]. International Journal of Radiation Oncology, Biology, Physics, 2014, 89(2): 322-329.
[7] Wang Y, Zhou J, Qiu L, et al. Cisplatin-alginate conjugate liposomes for targeted delivery to EGFR-positive ovarian cancer cells[J]. Biomaterials, 2014, 35(14): 4297-4309.
[8] 寇哲文, 林水苗, 张兴梅, 等. 靶向notch1的siRNA对U87-EGFRv Ⅲ胶质瘤细胞株凋亡和放射敏感度的影响[J]. 肿瘤防治研究, 2016, 43(4): 245-248.
[9] Marya Ahmed, Kazuhiko Ishihara, Ravin Narain, et al. Calcium mediated formation of phosphorylcholinebased polyplexes for efficient knockdown of epidermal growth factor receptors (EGFR) in HeLa cells[J]. Chemical communications, 2014, 50(22): 2943-2946.
[10] D Fatehi, T N Baral, A Abulrob, et al. In Vivo Imaging of Brain Cancer Using Epidermal Growth Factor Single Domain Antibody Bioconjugated to Near-Infrared Quantum Dots[J]. Journal of nanoscience and nanotechnology, 2014, 14(7): 5355-5362.
[11] 胡洋, 张龙, 李旺, 等. TTA1-Tat-PEG-GS NPs结合siRNA-EGFR转染C6细胞抑制EGFR基因表达的研究[J]. 中国医药导报, 2016, 13(6): 4-8.
[12] Nataly Kravchenko-Balasha, Jun Wang, Francoise Remacle, et al. Glioblastoma cellular architectures are predicted through the characterization of two-cell interactions[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(17): 6521-6526.
[13] Gao L Y, Liu X Y, Chen C J, et al. Core-Shell type lipid/rPAA-Chol polymer hybrid nanoparticles for invivo siRNA delivery[J]. Biomaterials, 2014, 35(6): 2066-2078.
[14] 白璇, 唐慧, 郭强, 等. 大肠癌细胞FoxQ1与EGFR基因表达的相关性[J]. 肿瘤防治研究, 2016, 43(1): 20-24.
[15] Chandra A, Lan S, Zhu J, et al. Epidermal growth factor receptor (EGFR) signaling promotes proliferation and survival in osteoprogenitors by increasing early growth response 2 (EGR2) expression[J]. The Journal of biological chemistry, 2013, 288(28): 20488-20498.
[16] 褚晗, 于德新, 张志强, 等. siRNA沉默肾癌细胞EGFR基因对放疗敏感性影响的研究[J]. 临床泌尿外科杂志, 2013, 232(4): 246-250.
[17] 许洪礼, 胡萍, 张振, 等. siRNA干扰FLOT2基因表达对肾细胞癌细胞增殖的影响[J]. 现代肿瘤医学, 2015(23): 3376-3379.
[18] 印重任, 李远伟, 吴万瑞, 等. 靶向siRNA干扰hIAP-2联合姜黄素抑制肾癌GRC-1细胞增殖的实验研究[J]. 肿瘤药学, 2017, 7(1): 33-37.
[19] 韩庆杰. siRNA沉默DAD1基因表达对肾癌细胞A498增殖与侵袭能力的影响[D]. 南华大学, 2015.
[20] 陈俊明, 吴登爽, 王志向, 等. RNA干扰p38基因对肾癌786-O细胞生物学特性的影响及对舒尼替尼的增敏作用[J]. 第二军医大学学报, 2016, 37(7): 799-804.
EffectofsiRNAsilencingepidermalgrowthfactorreceptorproteinexpressiononbiologicalbehaviorofrenalcellcarcinomacells
WANGFeng,ZHANGBinbin,GUOWei,GAOJixue,QIANGYayong,JIAJunqi
(AffiliatedHospitalofYan′anUniversity,Yan′an,Shaanxi, 716000)
ObjectiveTo explore the biological behavior of renal cell carcinoma cases after treatment with siRNA silencing epidermal growth factor receptor (EGFR) gene.MethodsRenal cell carcinoma cell line ACHN were divided into three groups, the control group without any intervention, negative control transfection group by adding the nonspecific transfection reagent and siRNA interference, and the observation group adding transfection reagent and siRNA interference. Cells with EGFR expression and proliferation activity, growth curve, migration and invasion activity were detected in three groups.ResultsAfter 72 h of siRNA treatment, the observation group had significantly lower EGFR expression levels, and cell growth activity ability, and cell number of RNAi group after 48 h than negative control transfection group and control group (P<0.05). Compared with the blank control group and negative control transfection group, the observation group was significantly inhibited (P<0.05), and cell scratch distance after 12 h and 24 h was significantly higher than that of the control group and negative control transfection group(P<0.05). The control group and negative control transfection group showed no significant difference in the cell membrane at 12 h (P>0.05). The observation group had significantly lower transmembrane cell number than the control group and negative control transfection group(P<0.05).ConclusionThe proliferation, growth, migration and invasion of renal carcinoma cells can be effectively improved by using siRNA EGFR protein.
siRNA; EGFR protein; renal cell carcinoma; biological behavior
R 736.6
A
1672-2353(2017)19-103-04
10.7619/jcmp.201719029
2017-05-19
贾军琪

