人乳头状瘤病毒核酸检测试剂盒用于宫颈癌及癌前病变筛查的临床价值
尚乐乐, 胡杰锋, 王月清, 朱茵茵, 蒯守刚
(1. 江苏省无锡市惠山区人民医院, 江苏 无锡, 214000;2. 杭州德同生物技术有限公司, 浙江 杭州, 310053)
人乳头状瘤病毒核酸检测试剂盒用于宫颈癌及癌前病变筛查的临床价值
尚乐乐1, 胡杰锋2, 王月清1, 朱茵茵1, 蒯守刚1
(1. 江苏省无锡市惠山区人民医院, 江苏 无锡, 214000;2. 杭州德同生物技术有限公司, 浙江 杭州, 310053)
目的分析人乳头状瘤病毒(HPV)杂交捕获-化学发光法核酸检测试剂盒(DH3)用于宫颈癌及癌前病变筛查的临床价值。方法收集480例妇科门诊妇女宫颈脱落细胞样本,分别采用DH3、TCT和HPV-PCR检测,对TCT≥ASC-US者行阴道镜下病理检测,以病理学结果为金标准,分析DH3诊断价值。结果病理学结果显示,正常者370例(77.08%), 良性病变者(≤CINⅠ)59例(12.29%), 高危者(≥CINⅡ)51例(10.63%); TCT、HPV-PCR和DH3诊断阳性率分别为26.04%、32.08%和27.08%; DH3与TCT检测一致率为94.79%(P<0.01), 与HPV-PCR检测一致率为93.13%(P<0.01); DH3灵敏度98.18%, 特异度87.57%, 阳性预测值70.13%, 阴性预测值99.39%, 准确率为90%, 检出高危型(≥CINⅡ)的ROC曲线面积Z=0.887(95%CI为0.785~0.918,P<0.01)。结论DH3试剂盒与TCT、HPV-PCR在检出HPV宫颈癌及癌前病变具有高度一致性,灵敏度、特异度和准确率高,操作便捷,临床筛查意义显著。
人乳头状瘤病毒; 癌前病变; 宫颈癌; 筛查
人乳头瘤状病毒(HPV)持续感染是诱发宫颈癌和癌前病变的关键致病因素,几乎全部宫颈癌切除标本均检测出HPV感染[1-3]。薄层液基细胞学(TCT)、HPV-PCR检测等为筛查宫颈癌及癌前病变的常用技术[4-5], 但TCT检测以细胞学为基础,对检验人员和医疗设备要求严格, HPV-PCR需要PCR检测专用实验室,对于卫生资源相对匮乏的地区,不适于进行大规模普及和筛查[6-7]。DH3为HPV核酸检测试剂盒,采用杂交捕获-化学发光法可对HPV-16、18、31、33、35、39、45、51、52、56、58、59、66、68共14种亚型进行筛查,具有操作简便、无需PCR实验室、对操作人员无特殊资质要求的特点,适于各级医疗机构广泛展开筛查工作[8]。本研究针对本院获得的480份妇女宫颈脱落细胞样本,分析DH3试剂盒在宫颈癌及癌前病变中的筛查价值,报告如下。
1 资料与方法
1.1 一般资料
收集2013年11月—2016年11月本院妇科门诊480例妇女宫颈脱落细胞样本。纳入标准: 年龄25~60岁,有性生活史3年以上者; 无宫颈、子宫手术史,无急性生殖道炎症者; 未接受过盆腔放疗治疗者; 自愿参加本筛查研究者。排除标准: 处于月经期者; 近1周内使用抗生素类药物治疗者; 不配合诊断者; 重要资料不全者; 合并其他器质性疾病者; 合并其他恶性肿瘤者; 妊娠及哺乳期者。480例妇女年龄30~59岁,平均年龄(38.53±7.51)岁。本研究符合伦理学考量,经本院伦理委员会特批,所有患者均签订知情同意书。
1.2 方法
1.2.1 样本收集: 所有受检者处于非月经期,检查前3 d不行阴道冲洗或阴道内用药,检查前1 d无性生活,采用专用宫颈细胞采集毛刷采集宫颈脱落细胞标本待检。
1.2.2 宫颈组织病理学检测: 于阴道镜下对可疑部位进行宫颈管骚刮术或多点取宫颈活检组织,所取标本需达一定深度,用1%甲醛固定后送去病理科检测。依据WHO子宫颈肿瘤病理诊断和分类标准[9], 将检测结果分为阴性结果、慢性炎症、轻度不典型增生(CIN Ⅰ)、中度不典型增生(CINⅡ)、重度典型增生(CIN Ⅲ)和宫颈磷状细胞癌(SCC); 活检结果为慢性炎症、CINⅠ者归为良性病变者, ≥CINⅡ归为高危型病变。
1.2.3 TCT检测: 将预先处理好的宫颈脱落细胞标本采用全自动制片机(美国新柏氏公司,型号ThinPrep 2000)制片,染色采取人工巴氏染色,于光学显微镜下观察结果,依据细胞学癌症检测TBS分析系统[10], 对检测结果进行分类,包括阴性、意义不明显的非典型鳞状细胞(ASC-US)、低度鳞状上皮内病变(LSIL)、高度鳞状上皮内病变(HSIL)和宫颈磷状细胞癌(SCC),TCT结果≥LSIL者为高危型病变。
1.2.4 HPV-PCR检测: 将处理好的宫颈脱落细胞标本经分离、沉淀、萃取等步骤提取DNA后,采用荧光定量PCR技术,对HPV-16、18、31、33、35、39、45、51、52、56、58、59、66、68共14种亚型进行筛查,试剂盒购自中山大学达安基因,每次扩增均设置空白对照和阳性对照,诊断结果以相对光单位(RLU)/最小阳性对照RLU均值(RLU/CO)表示,当RLU/CO≥1.0, 则对应检出结果为阳性, <1.0结果则为阴性。
1.2.5 DH3检测: DH3为快速HPV-DNA检出试剂盒,宫颈脱落细胞标本收集后,经细胞裂解液裂解细胞后,暴露HPV-DNA,将其解链,单链DNA与HPV-16、18、31、33、35、39、45、51、52、56、58、59、66、68共14种亚型HPV全长互补RNA杂交,形成HPV-DNA/RNA杂交物,使用含有单克隆抗体的磁珠与杂交物混合,再依次加入碱性磷酸酶和相应显色第五,依据底物光强度反应HPV-DNA数量,当RLU/CO≥1.0, 则对应检出结果为阳性, <1.0结果则为阴性,检测过程进行严格质量控制。
1.3 观察指标
① 病理学诊断结果与DH3、TCT、HPV-PCR诊断结果对比; ② 分析DH3与TCT检测一致性; ③ 分析DH3与HPV-PCR检测一致性; ④ 分析DH3的灵敏度、特异度、阳性预测值和阴性预测值; ⑤ 分析DH3检出高危型(≥CINⅡ)的ROC曲线。
1.4 统计学分析
采用SPSS 19.0软件,计数资料以例(n)或百分比率(%)表示,组间比较采用χ2检验, DH3与TCT和HPV-PCR采用Kappa一致性检验, DH3诊断高危型HPV感染特异度采用ROC曲线分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 DH3、TCT、HPV-PCR检测结果与病理学结果比较
病理学结果显示,正常者370例(77.08%), 良性病变者(≤CINⅠ)59例(12.29%), 高危者(≥CINⅡ)51例(10.63%), 阳性率为22.92%; TCT诊断阳性率为26.04%(125/480), HVP-DNA诊断阳性率为32.08%(154/480), DH3诊断阳性率为27.08%(130/480)。见表1。

表1 DH3、TCT、HPV-PCR检测结果与病理学结果比较
2.2 DH3与TCT检测一致性分析
Kappa=86.65%(P<0.001), DH3与TCT检测一致率为94.79%(455/480)。见表2。
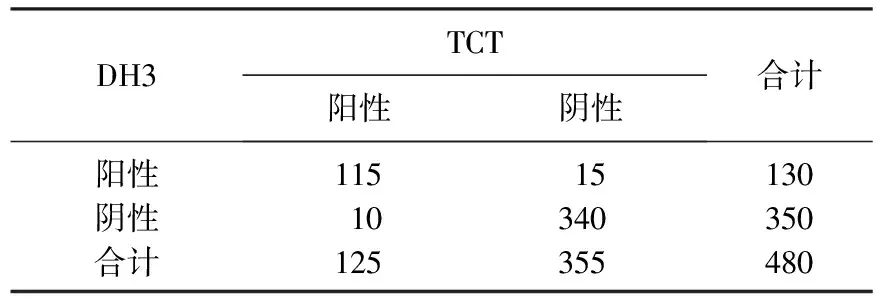
表2 DH3与TCT检测一致性分析
2.3 DH3与HPV-PCR检测一致性分析
Kappa=0.8314(P<0.001), DH3与HPV-PCR检测一致率为93.13%(447/480)。见表3。
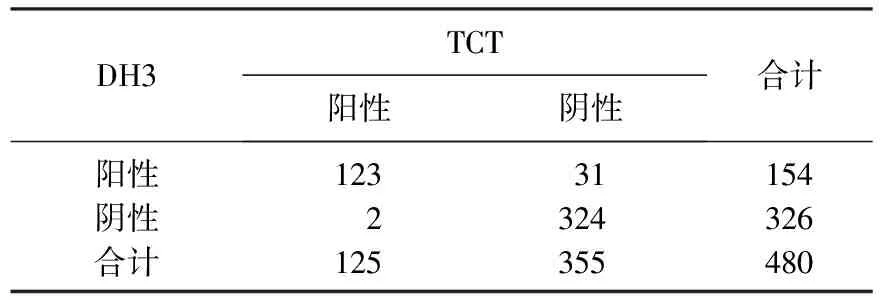
表3 DH3与HPV-PCR检测一致性分析
2.4 DH3的灵敏度、特异度、阳性预测值和阴性预测值分析
DH3的灵敏度为98.18%(108/110), 特异度为87.57%(324/370), 阳性预测值为70.13%, 阴性预测值为99.39%, 准确率为90%。见表4。
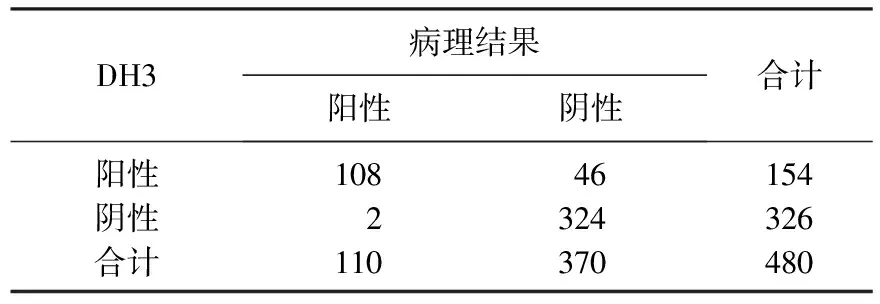
表4 DH3的灵敏度、特异度、阳性预测值和阴性预测值分析
2.5 DH3检出高危型(≥CINⅡ)的ROC曲线分析
DH3检出高危型(≥CINⅡ)的ROC曲线分析面积Z=0.887(95%CI为0.785~0.918,P<0.001)。
3 讨 论
宫颈轻度-中度-重度不典型增生是发生宫颈癌必经癌前病变阶段,对癌前病变和早期宫颈癌进行有效筛查和诊断,及早开展手术、放化疗等方式治疗,可有效预防宫颈癌发生发展[11]。HPV持续感染是宫颈癌诱发原因,传统巴氏涂片细胞学检测假阴性率高,存在一定局限性,目前TCT和HPV-DNA检测应用较为广泛[12]。TCT作为一种新兴技术,其制作的单层细胞涂片具有阅片容易、高质、高效、清晰等特点,结果更加可靠[13]。HPV-DNA检测为WHO最新宫颈癌前病变指南推荐初筛方法, 2015年《美国宫颈癌筛查过渡期指南》指出, HPV-DNA初筛高危型HPV感染与细胞学方法比较,可保证更低罹患宫颈癌概率,提示以HPV-DNA为基础的宫颈癌筛查具有更加广阔应用前景[14-15]。
HPV-PCR和二代杂交捕获法(HC2)为HPV核酸检测常用方法,但HPV-PCR检测需专用实验室检测,对检测人员要求较高,而HC2也需先进设备,费用昂贵,不易开展广泛普查[16-17]。DH3核酸检测试剂盒,采用杂交捕获-化学发光法,在65 ℃环境下,其特异性RNA探针可与HPV-16、18、31、33、35、39、45、51、52、56、58、59、66、68共14种亚型分别结合为DNA-RNA杂合体,可有效避免假阴性和假阳性,并可将HPV-16/18型与其他12种高危型HPV型区别开来,可用于宫颈疾病初筛和处理后定性监测,与HPV-PCR和HC2比较,具有操作简便、无需PCR实验室、对操作人员无特殊资质要求、价格相对低廉的特点,适于各级医疗机构广泛开展研究,便于医院风险分层管理,临床指导意义重大。
本研究中, 480例妇科门诊患者经病理学诊断后,宫颈良性病变率12.29%, 高危型病变率10.63%, 总病变率22.92%, 与方婧等[18]的22.77%接近,而高于谢珊艳等[19]的10.7%和宛丽梅[20]的3.71%, 说明本地区宫颈癌及癌前病变患者比率略高,需加以重视。本研究中, DH3诊断宫颈癌及癌前病变阳性率为27.08%, TCT为26.04%, HPV-PCR为32.08%, DH3与TCT检测一致率为94.79%, 与HPV-PCR检测一致率为93.13%, 说明DH3具有与TCT和HPV-PCR诊断宫颈癌及癌前病变具有高度一致性。但无论是DH3、TCT还是HPV-PCR, 其诊断阳性率均高于病理学诊断,说明三种检测方法均存在一定假阳性率,后期还需进一步优化。本研究中, DH3检测灵敏度为98.18%, 特异度为87.57%, 阳性预测值为70.13%, 阴性预测值为99.39%, 准确率为90%, 说明DH3诊断价值较高。通过绘制DH3检测高危型(≥CINⅡ)宫颈病变的ROC曲线,发现ROC曲线下面积为0.887(95%CI为0.785~0.918,P<0.001), 说明DH3对高危型(≥CINⅡ)宫颈病变具有较高诊断价值。
综上所述, DH3试剂盒与TCT、HPV-PCR在检出HPV宫颈癌及癌前病变具有高度一致性,灵敏度、特异度和准确率高,操作便捷,对高危型宫颈病变有较高诊断价值。
[1] 戴伟, 冯锋. MRI多序列对宫颈癌的临床应用价值分析[J]. 中国CT和MRI杂志, 2016, 14(12): 96-98.
[2] 李乐赛, 李梅花, 张弦, 等. HPV16 E6对宫颈癌E-cadherin表达水平和基因甲基化的影响[J]. 湖南师范大学学报: 医学版, 2016, 13(4): 1-4.
[3] 桂定清, 李静蓉, 张力忆, 等. 术前新辅助化疗对宫颈癌细胞超微结构动态改变的观察[J]. 解放军医药杂志, 2016, 28(12): 65-68.
[4] 张宗莲, 郭云, 赵维新. 高危型HPV感染基因型分布及其高危因素分析[J]. 临床误诊误治, 2015, 28(7): 95-98.
[5] 常晓晗, 张淑兰. HCCR-1、P53在宫颈癌及其癌前病变中的表达及其临床意义[J]. 医学临床研究, 2014, 31(1): 133-136.
[6] 林桥凤. 薄层液基细胞学与阴道镜检查对宫颈病变的检查结果对比分析[J]. 国际医药卫生导报, 2014, 20(23): 3622-3625.
[7] 洪威阳, 胡敏. HPV、TCT、阴道镜诊断宫颈上皮瘤变及宫颈癌的价值[J]. 中国妇幼健康研究, 2015, 26(6): 1272-1274.
[8] 杨丽华, 冷天艳, 张琴, 等. 杂交捕获定量分型技术检测高危型人乳瘤病毒在子宫颈癌筛查中的应用[J]. 中国妇产科临床杂志, 2016, 17(6): 542-543.
[9] 孔令非. WHO(2014)女性生殖道肿瘤分类中子宫内膜增生性病变的新变化[J]. 临床与实验病理学杂志, 2015, 31(1): 1-3.
[10] 王新玲, 金华, 王艳琴, 等. 新疆维吾尔族妇女宫颈病变与HPV载量及TCT检查结果的相关性研究[J]. 中国妇幼保健, 2016, 31(16): 3323-3325.
[11] 李丽梅, 魏丽江, 张莉萍, 等. 基层不同年龄段已婚妇女妇科病普查结果分析[J]. 西部医学, 2014, 26(11): 1475-1476.
[12] 高田方. 高危型HPV检测及TCT检查在宫颈癌筛查中的应用效果[J]. 实用临床医药杂志, 2016, 20(21): 213-214.
[13] 张淼, 周秀春, 张冠群. 人乳头瘤病毒检测及TCT检查在宫颈癌筛查中的临床价值研究[J]. 现代预防医学, 2016, 43(5): 836-838.
[14] Huh W K, Ault K A, Chelmow D, et al. Use of primary high-risk human papillomavirus testing for cervical cancer screening: Interim clinical guidance[J]. Gynecologic Oncology, 2015, 136(2): 178-182.
[15] 李雨聪, 张莉, 胡尚英, 等. 高危型人乳头瘤病毒检测初筛宫颈癌后几种分流方法的效果评价[J]. 肿瘤, 2015, 35(5): 536-543.
[16] 喻垚, 郭变琴, 罗光丽, 等. 液基细胞学与高危型HPV-DNA联合检测在宫颈病变筛查中的意义[J]. 检验医学与临床, 2015, 12(11): 1550-1551.
[17] 温旺荣, 李莉. HPV 基因检测技术新进展[J]. 中华检验医学杂志, 2015, 38(8): 514-516.
[18] 方婧, 洪颖. 高危型人乳头瘤病毒核酸检测试剂盒-Care HPV用于宫颈癌及癌前病变筛查的临床价值[J]. 中国妇幼健康研究, 2016, 27(4): 457-459.
[19] 谢珊艳, 任鹏, 吕晨君. TCT, HC2-HPV-DNA检测和阴道镜检查在宫颈癌及癌前病变筛查中的联合应用[J]. 中国性科学, 2014, 23(3): 82-84.
[20] 宛利梅. 第二代基因杂交捕获法检测高危型HPV-DNA在宫颈癌前病变筛查中的应用研究[J]. 中国医药导报, 2013, 10(18): 101-102.
Clinicalvalueofhumanpapillomavirusnucleicaciddetectionkitinscreeningcervicalcancerandprecancerouslesions
SHANGLele1,HUJiefeng2,WANGYueqing1,ZHUYinyin1,KUAIShougang1
(1.WuxiHuishanDistrictHospital,Wuxi,Jiangsu, 214000; 2.HangzhouDeTongBiologicalTechnologyCorporationLimited,Hangzhou,Zhejiang, 310053)
ObjectiveTo analyze the clinical value of the second generation hybrid capture nucleic acid detection kit (DH3) of human papillomavirus (HPV) in screening cervical cancer and precancerous lesions.MethodsThe cervical exfoliated cell samples of 480 women in gynecologic clinic were collected and detected by DH3, TCT and HPV-PCR. Colposcopic pathological examination was performed in women with TCT≥ASC-US. With the pathological results as the golden standard, the diagnostic value of DH3 was analyzed.ResultsThe pathological results showed that 370 cases were normal (77.08%), 59 cases had benign lesions (≤CIN Ⅰ) (12.29%) and 51 were high-risk cases (≥CIN Ⅱ) (10.63%). The positive diagnostic rates of TCT, HPV-PCR and DH3 were 26.04%, 32.08% and 27.08%, respectively. The concordancerate of DH3 and TCT was 94.79% (P<0.01), and the concordance rate with HPV-PCR was 93.13% (P<0.01). The sensitivity, specificity, positive predictive value, negative predictive value and accuracy rate of DH3 were 98.18%, 87.57%, 70.13%, 99.39% and 90%, respectively. The ROC area of detection of high-risk (CIN Ⅱ) wasZ=0.887 (95%CI 0.785~0.918,P<0.01).ConclusionDH3 kit has a high degree of consistency with TCT and HPV-PCR in the detection of HPV cervical cancer and precancerous lesions. The sensitivity, specificity and accuracy are high, and it is easy to operate.
human papillomavirus; human papillomavirus; cervical cancer; screening
R 737.33
A
1672-2353(2017)19-099-04
10.7619/jcmp.201719028
2017-03-21
江苏省自然科学基金项目(BK2012564)
蒯守刚

